Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
InVet
On-line version ISSN 1668-3498
InVet vol.14 no.1 Ciudad Autónoma de Buenos Aires June 2012
ARTÍCULO DE INVESTIGACIÓN
Características biológicas de cepas de Herpesvirus bovino 1 y 5 utilizando el modelo experimental conejo
Pidone, C.L.1; Riganti, J.G.1; Valera, A.R.2; Poli, G.L.1; Ridley, A.I.1; Fuentealba, N.A.2, 3; Anthony, L.M.1; Brion, C.1; Pereyra, N.B.1; Galosi, C.M.2, 4.
1Facultad de Ciencias Veterinarias (Universidad Nacional de Rosario), Av. Ovidio Lagos y Ruta 33, (2170) Casilda, Santa Fe.
2Facultad de Ciencias Veterinarias (Universidad Nacional de La Plata), Calle 60 y 118, (1900) La Plata, Buenos Aires.
3CCT - CONICET - Calle 8 Nº 1467 (1900) La Plata.
4Comisión de Investigaciones Científicas de la Provincia de Buenos Aires, Calle 10 y 526, (1900) La Plata, Buenos Aires.
Correspondencia e-mail: Claudio Pidone cpidone@fveter.unr.edu.ar
Recibido: 16/05/2012
Aceptado: 20/12/2012
Resumen
Los Herpesvirus bovinos (BoHV) pueden infectar tanto a mustélidos como a conejos y esta última especie ha sido utilizada como modelo de laboratorio para la infección por BoHV-1 y 5. El objetivo de este trabajo fue estudiar la patogenicidad de diferentes cepas argentinas de BoHV-1 y BoHV-5 utilizando el modelo experimental conejo. Se utilizaron conejos de raza neozelandesa que se inocularon por vía intranasal e intravaginal. Los animales inoculados por vía intranasal con cepas de BoHV-5 desarrollaron signos nerviosos en el 83% de los casos, mientras que BoHV-1.1 causó signos nerviosos en el 57% de los animales y BoHV-1.2 no provocó signos clínicos evidentes. El BoHV-5 causó síntomas nerviosos solo en los animales jóvenes mientras que BoHV-1 solo lo hizo ocasionalmente y también en individuos jóvenes. Los conejos inoculados por vía intravaginal no mostraron signos clínicos ni lesiones aparentes en los órganos estudiados; la infección se demostró por seroconversión serológica. El conejo resultó adecuado para estudiar la sintomatología y las lesiones producidas en los distintos órganos, fundamentalmente en el sistema nervioso central. El modelo resultó de utilidad por ser económico, de muy fácil manejo y permitió reconocer diferencias en el comportamiento biológico de las cepas de BoHV-1 y BoHV-5 estudiadas.
Palabras claves: Caracterización de cepas; Herpesvirus bovino; Modelo conejo.
Biological characteristics of Bovine Herpesvirus 1 and 5 strains using the rabbit experimental model
Summary
Bovine Herpesvirus (BoHV) can infect both rabbits and mustelids. Rabbit has been used as a laboratory model for infection with BoHV-1 and 5. The objective of this research was to study the pathogenicity of different Argentinian BoHV-1 and BoHV-5 strains by using the rabbit experimental model. New Zealand rabbits were inoculated by intranasal and intravaginal ways. The animals inoculated intranasally with strains of BoHV-5 developed neurological signs in 83% of the cases. BoHV-1.1 caused neurological signs in 57% of the animals and BoHV-1.2 did not cause clear clinical signs. BoHV-5 caused nervous signs in young animals while BoHV-1 did so occasionally in young rabbits. Animales inoculated intravaginally showed no apparent clinical signs or apparent lesions in the studied organs. The infection was demonstrated by serological seroconversion. The rabbit was appropriate to study the clinical signs and the lesions produced in the different organs, primarily in the central nervous system. The model was useful for being inexpensive and very easy to use, and it enabled to identify differences in the biological behavior of the studied BoHV-1 and BoHV-5 strains.
Key words: Bovine Herpesvirus; Characterisation of strains; Rabbit model.
Introducción
Los Herpesvirus bovino tipo 1 (BoHV- 1) y 5 (BoHV-5), integrantes de la familia Herpesviridae, subfamilia Alphaherpesvirinae, género Varicellovirus, afectan naturalmente al bovino, especie en la que provocan un amplio espectro de manifestaciones clínicas. BoHV-1.1 se asocia generalmente a rinotraqueítis infecciosa bovina, conjuntivitis, aborto y ocasionalmente a encefalitis; BoHV-1.2 frecuentemente causa vulvovaginitis pustular infecciosa o balanopostitis y BoHV-5 es el mayor causante de meningoencefalitis en terneros15.
Cuando el virus ingresa por vía oronasal, puede llegar al cerebro a través de las ramas maxilar y mandibular del nervio trigémino20 y producir enfermedad neurológica caracterizada por depresión, anorexia, ptialismo, amaurosis, rechinamiento de dientes, incoordinación, tremor muscular, reclinación, ceguera y, eventualmente, la muerte del animal3.
Las infecciones por BoHV-1.1 y BoHV- 5 son frecuentes en Argentina. BoHV-1 es endémico y la respuesta inmune inducida por la infección o por la vacunación explicaría la protección cruzada con BoHV-5 y, por lo tanto, la menor frecuencia de brotes de enfermedad neurológica5.
El primer brote por BoHV-5 en Argentina fue descripto en 1983 y se aisló la cepa denominada A663. Desde ese momento han sido aisladas varias cepas virales tanto de BoHV-1 como de BoHV-5 y, algunas de ellas, tipificadas con endonucleasas de restricción (RP )15. Las cepas de BoHV-5 fueron además subtipificadas por sus RP y por multiplex PCR10. De este último estudio surge que en Argentina se encuentran los subtipos BoHV-5 "a" y BoHV- 5 "b", a diferencia de Brasil en donde sólo se reporta la circulación de BoHV-5 "a" y BoHV-5 no "a" no "b". Sin embargo, las cepas argentinas actualmente subtipificadas como BoHV-5 "b" fueron aisladas en la década del 80 y ningún otro aislamiento posterior a éstos fue encontrado con este subtipo genómico, sugiriendo que el mismo podría haber desaparecido o solo haberse aislado en territorio argentino10.
Experimentalmente, los BoHV pueden infectar tanto a mustélidos como a conejos y desde 1979 se empleó a esta última especie como modelo de laboratorio para la infección con BoHV-120. El conejo ha sido utilizado con relativo éxito como modelo para estudiar la infección latente de cepas respiratorias de BoHV-1 y para estudiar las características neuropatógenas del BoHV-5. Además, demostró ser de valor como herramienta para el estudio comparativo de la neuropatogenicidad de los BoHV-1 y BoHV-54, 6,12,13,17,18.
Las lesiones que estos virus provocan en el sistema nervioso central (SNC) de los conejos son similares a las que se producen en el cerebro de los bovinos, aunque Spilki y colaboradores18 afirman que en conejos que presentaron signos nerviosos como consecuencia de la infección con la cepa Los Angeles (BoHV-1) se observó, por histopatología, vasculitis y trombosis en pulmones y cerebro, sin ninguna lesión que indicara encefalitis, lo que les sugiere que el daño nervioso fue, probablemente, consecuencia de la anoxia del tejido.
El BoHV-5, por características aún no debidamente definidas y que no estarían vinculadas a la existencia de receptores celulares específicos, es un virus netamente neurotrópico, que provoca solo sintomatología nerviosa en animales jóvenes. Por el contrario, el BoHV-1 sólo ocasionalmente provoca signos nerviosos, y también en animales jóvenes18.
En función de los antecedentes expuestos, el objetivo de este trabajo fue estudiar la patogenicidad de diferentes cepas argentinas de BoHV-1 y BoHV-5 utilizando el modelo experimental conejo.
Materiales y métodos
Animales de experimentación: se emplearon conejos neozelandeses, machos y hembras, de 22-33 días de vida (n=33) y hembras de igual raza de 60 días de vida (n=16) provistos por una empresa familiar de Casilda, Santa Fe, y por la empresa Conecar S.A. Los animales se mantuvieron en ambientes de temperatura controlada y alimentados ad libitum con productos balanceados comerciales. Los procedimientos experimentales se hicieron de acuerdo con las normativas internacionales8. Las experiencias fueron realizadas secuencialmente de acuerdo a la disponibilidad de animales y a la capacidad de las instalaciones utilizadas.
Células y virus: para todo el desarrollo del trabajo se utilizaron células Madin-Darby Bovine Kidney (MDBK) crecidas en Medio Esencial Mínimo (MEM) suplementado con 10% de suero fetal bovino -SFB- (MEM-C) y se cultivaron a 37ºC en una atmósfera húmeda con 5% de C02. Para la multiplicación de las cepas virales se utilizó MEM suplementado con 2% de SFB (MEM-M).
Se estudiaron 3 cepas argentinas de BoHV-5: A663 (subtipo "b"), A178 (subtipo "a") (dato no publicado) y A54 (subtipo "a")10, la cepa A67 de BoHV-1.215 y la cepa de referencia Los Angeles (prototipo BoHV-1.1).
Todas las cepas se titularon por el método de Reed y Muench, y se conservaron en pequeños volúmenes a -70ºC.
Inoculación de los animales y seguimiento clínico: los conejos de 22-33 días de vida (n=33) se inocularon por vía intranasal (IN ) previa anestesia local con lidocaína al 10% aplicada por aspersión sobre cada una de las narinas. Comprobada la insensibilidad de la zona, se introdujeron 500 μl de una suspensión viral de ~106,5 DICT50%/50μl, utilizando el método descripto por Valera y colaboradores19.
Las hembras de aproximadamente 60 días de vida (n=16), se infectaron por vía intravaginal (IV) con 500 μl del mismo inóculo.
Luego de la infección experimental se controló diariamente la temperatura de los animales y la aparición de signos clínicos.
Toma de muestras: los animales fueron sacrificados in extremis, o a los 14-20 días pos infección (pi) cuando no presentaron signos clínicos evidentes. Se tomaron muestras de pulmón, cerebro y aparato genital. Parte de las muestras se procesaron convenientemente para estudios histopatológicos, se fijaron en formol neutro al 10%, se procesaron para cortes embebidos en parafina (de 5µ de espesor) y se colorearon con hematoxilina-eosina (HE). Otra parte fue preparada como homogenato al 10% en MEM -C para estudios virológicos. Para corroborar la presencia de anticuerpos (Ac) se obtuvo sangre por vía intracardíaca, se separó el suero y se conservó a -20ºC hasta su utilización.
Los pulmones y la mucosa vaginal de algunos de los animales sacrificados, que no presentaron signos clínicos respiratorios ni genitales, fueron conservados a -70ºC y posteriormente procesados para aislamiento viral y detección de ADN.
Reacción en cadena de la Polimerasa (PCR): se eligieron cuatro muestras de órganos a partir de los cuales no se pudo lograr el aislamiento de BoHV, a los fines de determinar si era posible demostrar la presencia de ADN viral por PCR.
Para la extracción de ADN se utilizaron dos métodos: a) un equipo comercial (Promega Lab., Madison, WI, USA), b) digestión con 0.2 mg /ml de Proteinasa K (PK) en buffer PK (1 M Tris, 0.05 M de EDTA , 0.3 M de ClNa y 10% de SDS), extracción con solución 6 M de NaCl y precipitación con etanol frío8. Como control positivo se utilizó un trozo de cerebro de bovino infectado por BoHV-5.
La técnica de PCR se realizó de acuerdo a la metodología descripta por Alegre y colaboradores1, utilizando dos pares de cebadores que amplifican una porción genómica de 183 pb del gen TK de BoHV-1 (TK1:5´-AGA CCC CAG TTG TGA TGA ATG C-3´y TK2:5´- ACA CGT CCA GCA CGA ACA CC-3´) y de 564 pb del gen de la glicoproteína D del BoHV-5 (gD1:5´-CCC GCA GTT TCC CCT ACC- 3´ y gD2:5´-CGC ACC CGC TCT CAA TCT T-3´). La amplificación consistió en: a) calentamiento inicial a 99°C durante 10 min, b) 35 ciclos de 95°C 1 min, 61,4°C 1 min, 72°C 1 min y c) extensión final de 72°C 5 min. Las muestras se corrieron en geles de agarosa al 1,5% durante 30 min a 100V, se tiñeron con bromuro de etidio y se visualizaron bajo luz UV.
Detección de los anticuerpos: se realizó un ELISA indirecto previamente estandarizado19. Se utilizó un antígeno soluble elaborado a partir de células MDBK infectadas con la cepa Los Angeles de BoHV-1.1 y diluciones en base dos de los sueros problemas desde la dilución 1:25. Como segundo Ac se utilizó un suero anti conejo conjugado con peroxidasa (Sigma). El título de los sueros fue expresado como la mayor dilución de los mismos cuyo valor de densidad óptica (DO) superó al valor de corte establecido por dos valores de DO correspondiente al suero negativo de referencia.
Resultados
Las cepas A54 y A178 (ambas BoHV-5 subtipo "a") inoculadas por vía IN provocaron signos nerviosos en el 100 % de los animales entre los 7-12 días pi, mientras que la cepa A663 (BoHV-5 subtipo "b") lo hizo en el 83% de los casos; la cepa A67 (BoHV-1.2) no produjo signos clínicos y la cepa Los Angeles (BoHV- 1.1) provocó signos nerviosos en el 57% de los casos en el mismo período de tiempo. Se observó incoordinación, movimientos masticatorios y rechinamiento de dientes, movimiento en círculos, posturas anormales, elevación sobre el tren posterior y caída hacia atrás, depresión, temblores y ataxia (Fig. 1).

Figura 1. Conejo inoculado por vía intranasal con la cepa argentina A54 de BoHV-5. Signos neurológicos observados a los 8 días pos infección.
El aislamiento viral fue posible en 22 de los 25 animales que manifestaron signos clínicos, los que siempre fueron de tipo nervioso.
Las lesiones histopatológicas observadas en los cerebros de los animales que enfermaron consistieron en meningitis no supurativa, presencia de manguitos perivasculares y marcada infiltración mononuclear, necrosis focal y gliosis difusa (Fig. 2).
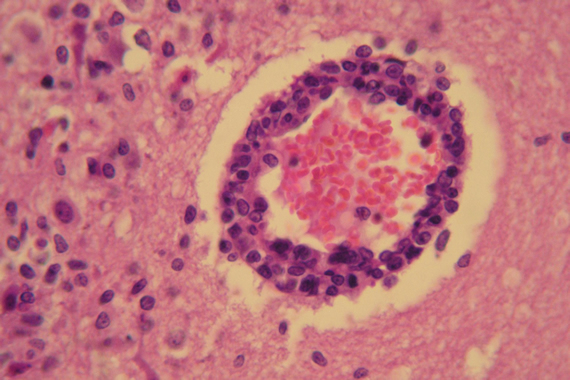
Fig. 2. Cerebro de conejo con signos neurológicos. Se observa un corte de corteza cerebral con encefalitis no supurativa, hiperemia, leve aumento del espacio de Virchow-Robin con infiltración de células mononucleares formando un manguito perivascular (40X).
Los pulmones de algunos de los animales infectados presentaron neumonía intersticial y enfisema, lesiones características de este tipo de infección (Fig. 3).
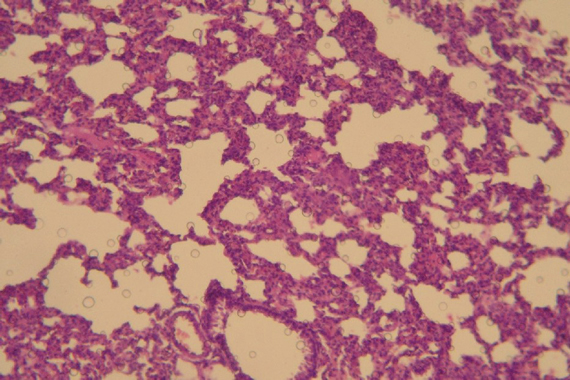
Fig. 3. Pulmón de conejo inoculado con la cepa argentina A54 de BoHV-5. Se observa neumonía intersticial y aumento del espesor de las paredes alveolares por infiltración y proliferación de células mononucleares (20X).
En los otros órganos estudiados no se encontraron lesiones de relevancia.
Las cepas inoculadas por vía IV en hembras de 60 días de edad no provocaron signos clínicos evidentes ni lesiones observables. La infección se demostró por seroconversión serológica.
Los resultados individuales con cada una de las cepas estudiadas se detallan en la Tabla 1.
Tabla 1. Resultados obtenidos de la inoculación de distintas cepas de BoHV (~106.5 DICT 50%/ 50 ul) en conejos neozelandeses utilizando diferentes vías.
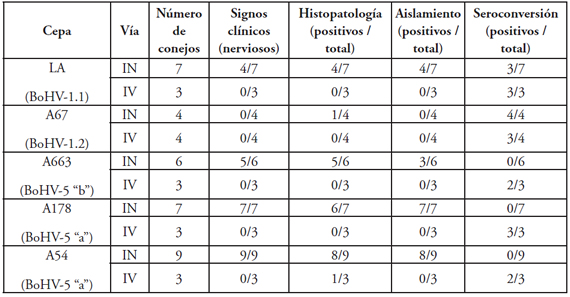
Referencias: IN: intranasal (utilizada en animales de 22-30 días de edad)
IV: intravaginal (utilizada en animales de 60 días de edad)
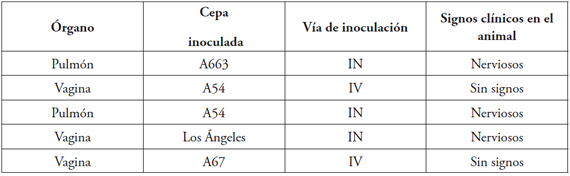
Las cuatro muestras elegidas de órganos de los cuales no fue posible aislar virus, conservadas a -70ºC y analizadas por PCR, resultaron negativas (Tabla 2). El control de cerebro bovino infectado por BoHV-5 resultó positivo por PCR.
Tabla 2. Órganos de conejos neozelandeses inoculados con distintas cepas de BoHV (~106.5 DICT 50%/ 50 ul) y analizados por PCR.
No se detectaron Ac en ninguno de los animales que murieron con signos clínicos y se detectaron Ac títulos variables entre 1/400-1/800 en 20 de los 24 animales que no presentaron signos clínicos y que fueron sacrificados a los 14-20 días pi.
Discusión
Experiencias previas14 demostraron que factores tales como la dosis infecciosa, la vía de inoculación y la edad de los animales resultaron fundamentales para lograr la infección. Con relación a la dosis, se observó la necesidad de asegurar una dosis de ~106.5 DICT50%/ 50 ml. La vía de inoculación fue previamente estandarizada19. La edad de los animales fue un factor determinante, ya que para asegurarse de que se manifestaran signos nerviosos los conejos a emplear no debían tener más de 30 días de vida. La cepa A663, a diferencia de los resultados encontrados por Beltrao y colaboradores2, quienes utilizaron conejos de mayor edad, provocó signos nerviosos en 5 de los 6 animales inoculados. Las razones por las cuales la edad es un factor determinante no están del todo claras, pero se supone que tienen relación con el desarrollo del sistema inmune.
Los signos clínicos neurológicos desarrollados en los animales, cuando éstos se manifestaron, y las lesiones consecuentes encontradas en los cerebros, fueron similares a los obtenidos en trabajos previos que para la infección experimental utilizaron otras cepas de BoHV, como TX894 o EVI-882. La principal diferencia en el comportamiento de las distintas cepas radicó, entonces, en el porcentaje de animales que finalmente desarrollaron la enfermedad nerviosa.
En el conejo, se demostró la capacidad de BoHV-5 de inducir signos nerviosos, tal cual ocurre también en el bovino. Las cepas A54 y A178 de BoHV-5 fueron altamente neuropatógenas en el conejo cuando se tuvieron en cuenta los factores mencionados y se las inoculó por vía IN (100 % de los casos).
BoHV-1, en cambio, tal como lo demuestra éste y otros trabajos7,11, provocó signos neurológicos sólo en forma ocasional, y esto fue dependiente de la cepa, siendo muy difícil discernir, hasta el momento, las causas de tal comportamiento.
Por otro lado, cuando BoHV originó signos nerviosos en el conejo, el virus se aisló de cerebro y, a veces, también de pulmón. No se detectaron Ac en ninguno de estos animales, lo cual probablemente se haya debido a que los animales se sacrificaron cuando manifestaron los signos nerviosos en etapa temprana de la infección, antes de los 14 días pi. La detección de Ac en los animales sacrificados luego de los 14-20 días pi corroboró la infección.
Los resultados obtenidos tras la inoculación IV demuestran la viabilidad de la técnica estandarizada para lograr la infección. Sin embargo, la ausencia de signos clínicos y de aislamiento viral sugiere que la puerta de entrada, al menos en esta especie, no deriva en enfermedad manifiesta.
Con los resultados negativos por PCR a partir de las zonas de tejidos estudiadas, se infiere que el virus, al menos a los días pi estudiados, sólo llegó al cerebro de los conejos que fueron inoculados por vía IN con las cepas A54, A663 y Los Ángeles, cepas que tienen la capacidad de producir cuadros nerviosos, dando origen a los signos clínicos característicos de este tipo de infección.
De acuerdo a lo observado en este trabajo, sobre el estudio de las propiedades biológicas de los BoHV-1 y BoHV-5, el modelo conejo resultó de utilidad como fue descripto en trabajos previos4,6,18, ya que es un modelo económico, de muy fácil manejo, permitió reconocer diferencias en el comportamiento biológico de las cepas de BoHV-1 y BoHV-5 y resultó adecuado para estudiar la sintomatología y las lesiones producidas en los distintos órganos, fundamentalmente en el SNC.
Se concluye que las cepas estudiadas presentaron diferentes características, y que el modelo conejo demostró ser un modelo predecible en sus resultados cuando se inocularon las cepas de BoHV-5 subtipo "a" A178 y A54, siempre que se lo hiciera antes de los 22 días de vida del animal de experimentación. Por eso, es presumible pensar que pudiera ser de utilidad para evaluar el efecto de diversas drogas antivirales, como ya fuera estudiado en trabajos parciales previos16. Posteriores ensayos permitirán confirmar o no esta hipótesis.
Agradecimientos
Se agradece a la Universidad Nacional de Rosario, que a través de su Secretaría de Ciencia y Tecnología ha financiado parte de este trabajo, a la Comisión de Investigaciones Científicas de la Provincia de Buenos Aires, a la Universidad de Buenos Aires, ya que parte de esta investigación corresponde a una tesis doctoral de esta Universidad, y al Instituto de Virología del CICV-INTA -Castelar, por la tipificación de una de las cepas.
1. Alegre, M.; Nanni, M.; Fondevila, N. Development of Multiplex Polymerase Chain Reaction for the Differentiation of Bovine Herpesvirus-1 and -5. J. Vet. Med. B. 2001, 48: 613-621. [ Links ]
2. Beltrao, N.; Flores, E.F.; Weiblen, R.; Silva, A.M.; Roehe, P.M.; Irigoyen, L.F. Infecção e enfermidade neurológica pelo herpesvírus bovino tipo 5 (BHV-5): coelhos como modelo experimental. Pesq. Vet. Bras. 2000, 20 (4): 144-150. [ Links ]
3. Bulach, D.M.; Studdert, M.J. Comparative genome mapping of bovine encephalitis herpesvirus, bovine herpesvirus 1, and buffalo herpesvirus. Arch. Virol. 1990, 113:17-34. [ Links ]
4. Chowdury, S.I.; Lee, B.J.; Mosier, D.; Sur, J. H.; Osorio, F.A.; Kennedy, G..; Weiss, M.L. Neuropathology of Bovine Herpesvirus Type 5 (BHV-5) Meningoencephalitis in Rabbit Seizure Model. Journal of Comparative Pathology. 1997, Vol. 117, Nº 4. [ Links ]
5. Del Medico Zajac, M.P.; Puntel, M.; Zamorano, P.I.; Sadir, A.M.; Romera, S.A. BHV-1 vaccine induces crossprotection against BHV-5 disease in cattle. Research in veterinary science, 2006, 81(3):327-334. [ Links ]
6. Flores, E.F.; Silva, A.M.; Weiblen, R. Neuropatogenicidade do Herpesvirus Bovino tipo 5 (HBV-5) (Avaliaçao de ovinos e coelhos como modelos experimentais). Simpósio Internacional sobre Herpesvirus Bovino (tipo 1 y 5) e virus da Diarréia Viral Bovina (BVDV). 1998. [ Links ]
7. Furuoka, H.; Izumida, N.; Horiuchi, M.; Osame, S.; Matsui, T. Bovine herpesvirus meningoencephalitis association with infectious bovine rhinotracheitis (IBR) vaccine. Acta Neuropathol. 1995, 90:565-571. [ Links ]
8. Galosi, C.M.; Vila Roza, M.V.; Oliva, G.A.; et al. A Polymerase Chain Reaction for Detection of Equine Herpesvirus-1 in Routine diagnostic Submissions of Tissues from Aborted Foetuses. J. Vet. Med. B. 2001, 48, 341±346. [ Links ]
9. Guide for the Care and Use of Laboratory Animals. Academy Press, 2008, Washington, USA. [ Links ]
10. Maidana, S.S.; Ladelfa, M.F.; Pérez, S.E.; Lomónaco, P.M.; Del Médico Zajac1, M.P.; Odeón, A.; Blanco Viera, J.; Combessies, G.; Fondevila, N.; Palacios, M.; Thiry, J. Muylkens, B.; Thiry, E.; Romera, S.A. Characterization of BoHV-5 field strains circulation and report of transient specific subtype of bovine herpesvirus 5 in Argentina. BMC Veterinary Research. 2011, Vol. 7:1-8. [ Links ]
11. Maisonnave, J.; del Campo, R.; Alonzo, P.; et al. Caracterización de Herpesvirus Bovino, Aislado en Uruguay de un Ternero con Sintomatología Nerviosa. Veterinaria (Montevideo). 2002, 37 (147-148):15-22. [ Links ]
12. Meyer, G.; Lemaire, N.; Lyaku, J.; Pastoret, P.P.; Thiry, E. Establishment of a rabbit model for bovine herpesvirus type 5 neurological acute infection. Veterinary Microbiology. 1996, 51: 27-40. [ Links ]
13. Nilzane, B.; Silva, A.M.; Brum, M.C.S.; et al.Neuropatogenicida de Herpesvirus Bovino 1 tipo 5 (BHV-5): Avaliaçao de Ovinos e Coelhos como Modelos Experimentais. VI Jornadas de Jóvenes Investigadores Grupo Montevideo - Santa Fe (Argentina). 1998. [ Links ]
14. Pidone, C.L. Estudio comparativo en el modelo conejo de las propiedades biológicas de cepas de Virus Herpes Bovino 1 y 5 aisladas en Argentina. (Tesis: Doctorado de la Universidad de Buenos Aires). 2007. [ Links ]
15. Pidone, C.L.; Galosi, C.M.; Etcheverrigaray, M.E.. "Herpesvirus Bovinos 1 y 5". Analecta Veterinaria. 1999, 19, 1/2: 40-50. [ Links ]
16. Pidone, C.L.; Riganti, J.G.; Galosi, C.M.; Pereyra, N.B.; Ridley, A.I.; Maure, P.F. Uso de interferón para evitar la enfermedad neurológica en conejos inoculados con cepas de Herpesvirus bovino 1 y 5. Revista de Medicina Veterinaria. 2010, Vol. 91, Nº 1/2: 26. [ Links ]
17. Silva, A.M.; Brum, M.C.S.; Canto, M.C.; Weiblen, R.; Roehe, P.M.; Flores, E.F. Pathogenesis of Meningoencephalitis in Weanling Rabbits by Bovine Herpesvirus type-5 (BHV-5). Simpósio Internacional sobre Herpesvirus Bovino (tipo 1 y 5) e virus da Diarréia Viral Bovina (BVDV). 1998. [ Links ]
18. Spilki, F.; Esteves, P.; Franco, A.; et al. Neurovirulence and Neuroinvasiveness of Bovine Herpesvirus Type 1 and 5 in Rabbits. Pesq. Vet. Bras. 2002, Apr./June, vol.22, no.2:58-63. [ Links ]
19. Valera, A.R.; Galosi, C.M.; Echeverría, M.G.; Silvestrini, M.P.; Romero Jorge; Nosetto, E.O. Desarrollo y estandarizacion de un ELISA indirecto para la detección de anticuerpos contra el herpesvirus bovino tipo 1 (BHV-1). Avances en Ciencias Veterinarias. 2008,.13(1):21-24. [ Links ]
20. Wyler, R.; Engels, M.; Schwyzer, M. Infectious bovine rhinotracheitis/vulvovaginitis (BHV1). En: G. Wittman and Y. Becker (ed.), Herpesvirus diseases of cattle, horses, and pigs. Developments in veterinary virology ser. Kluwer Academics Publishers, Boston: 1989, 1-72. [ Links ]














