Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
InVet
versión On-line ISSN 1668-3498
InVet vol.14 no.1 Ciudad Autónoma de Buenos Aires jun. 2012
ARTÍCULO DE INVESTIGACIÓN
Estudio de la interferencia serológica en el diagnóstico de la brucelosis bovina en el modelo murino
Díaz, A.G.1,3; Soto, P.2, Estein, S.M.1,4
1Laboratorio de Inmunología, Depto SAMP, Centro de Investigaciones Veterinarias Tandil (CIVETAN ), CONICET, Facultad de Ciencias Veterinarias, Universidad Nacional del Centro de la Provincia de Buenos Aires. Pinto 399 (7000) Tandil, Buenos Aires, Argentina.
2Laboratorio de Microbiología Clínica y Experimental, Departamento SAMP, FCV - UNCPBA. Pinto 399 (7000) Tandil, Bs. As., Argentina.
3Becaria CONICET.
4Investigador Adjunto CONICET
Correspondencia e-mail: Silvia M. Estein silmares@vet.unicen.edu.ar
Recibido: 06/03/2012
Aceptado: 31/08/2012
Resumen
En Argentina, el control de la brucelosis bovina se apoya en la vacunación obligatoria de las terneras con la cepa 19 de Brucella abortus y en la eliminación de los animales seropositivos con destino a faena. Las pruebas serológicas que se emplean más frecuentemente son el BPA (Buffered Plate Antigen) (prueba tamiz) y el FPA (Fluorescence Polarization Assay) (prueba confirmatoria). Ambas detectan anticuerpos anti-cadena O del polisacárido inducidos por la vacunación o por la infección con brucelas de campo. En ocasiones se han encontrado, en un contexto de ausencia de enfermedad clínica, reacciones serológicas atípicas en bovinos adultos. Las mismas han sido atribuidas a la presencia de anticuerpos de reacción cruzada inducidos por vacunas que contienen bacterias Gram negativas. Los objetivos del presente trabajo desarrollado en el modelo murino fueron: estudiar la interferencia en el diagnóstico de la brucelosis bovina generada por la administración de vacunas comerciales que contienen bacterias Gram negativas e identificar las cepas vacunales responsables de la reacción cruzada. En un primer ensayo se vacunaron ratones BALB/c hembras con 9 biológicos de aplicación en bovinos. En un segundo ensayo se inmunizaron ratones con las bacterias Gram negativas (bacterinas) contenidas en las vacunas. Se incluyeron como grupos control, animales vacunados con la cepa 19 de B. abortus y animales inoculados con B. abortus 544. Se realizaron sangrías periódicas y los sueros fueron analizados en las pruebas de BPA modificada y FPA. Los resultados obtenidos indican que 6/9 vacunas empleadas indujeron una respuesta serológica de corta duración que sólo fue detectada por la prueba de BPA en un porcentaje variable de animales por grupo. Por otro lado, las bacterinas que indujeron la serología más persistente en ambas pruebas fueron: Pasteurella multocida y Mannheimia haemolytica. Por lo anteriormente expuesto, los anticuerpos generados por las vacunas empleadas en este trabajo no tendrían un impacto significativo en el diagnóstico de la brucelosis bovina en el modelo murino.
Palabras claves: Brucella abortus; Bacterias Gram negativas; Interferencia serológica.
Serological crossreactivity in the diagnosis of bovine brucellosis in the mouse model
Summary
The National Programme of Control and Eradication of Bovine Brucellosis in Argentina involves the vaccination of female calves between 3 and 8 months of age with B. abortus S19, and elimination of seropositives reactors. Commonly used serological tests are BPA (Buffered Plate Antigen) and FPA (Fluorescence Polarization Assay) as screening and confirmatory tests, respectively. Both detect antibodies to the O-chain (OPS) induced by vaccination or by field strains. Occasionally, false positive reactions were found in healthy adult bovine induced by cross reaction antibodies stimulated by the administration of vaccines composed of Gram negative bacteria. The aims of this work were to study in the mouse model: a) the crossreactivity in diagnosis of bovine brucellosis induced by administration of commercial vaccines that contain Gram negative bacterins and b) the identification of vaccinal strains that induced crossreactivity. In the Experiment I, female Balb/c mice were vaccinated with 9 bovine commercial vaccines. In the second experiment, groups of mice were immunized with Gram negative bacterias (bacterins) contained in vaccines used in this study. As positive control groups, mice vaccinated with 19 strain and other inoculated with B. abortus 544 were included. Periodic bleedings were performed and sera were analized in modified BPA and FPA tests. The results showed that 6/9 vaccines induced a short-term serological response detected only by BPA in a variable percentage of animals per group. On the other hand, the bacteria that induced most persistent serology in both tests were Pasteurella multocida y Mannheimia haemolytica. According to our results, the antibodies induced by vaccines used in this work would not have a significant impact on the diagnosis of bovine brucellosis in the murine model.
Key words: Brucella abortus; Gram negative bacteria; Serological crossreactivity.
Introducción
En Argentina, el control de la brucelosis bovina se apoya en la vacunación obligatoria de las terneras con Brucella abortus cepa 19 entre los tres y ocho meses de edad y en la detección y eliminación de los reactores positivos con destino a faena8.
El diagnóstico serológico se basa en la determinación de anticuerpos (Ac) específicos anti-Brucella. Las técnicas oficialmente aceptadas son la prueba de aglutinación rápida en placa (BPA), la prueba de aglutinación lenta en tubo con agregado de 2 mercaptoetanol (SAT - 2 ME), la fijación de complemento (FC), la polarización de la fluorescencia (FPA) y las técnicas de ELISA indirecto y competitivo8. Estas pruebas detectan Ac contra el polisacárido O (PSO), porción más expuesta del lipopolisacárido S (LPS-S), y antígeno inmunodominante de la membrana externa frente al cual aparecen los primeros Ac séricos en los animales infectados con brucelas de campo o tras la vacunación con B. abortus cepa 1911.
En ocasiones se han encontrado reacciones serológicas atípicas, caracterizadas por reacciones anti-Brucella en bovinos adultos, en un contexto de ausencia de enfermedad clínica5,7,12. Las causas probables son: la presencia de Ac residuales post-vacunación (dosis-excesiva, revacunación accidental, infección persistente localizada, familias de bovinos genéticamente condicionados para respuestas altas, reactivación por inmunoestimulación inespecífica)14 o Ac de reacción cruzada o heteroespecíficos6. En este último caso, se observan reacciones serológicas en individuos que no están infectados con Brucella. Las reacciones cruzadas pueden atribuirse a infecciones con otras bacterias Gram negativas como: Escherichia coli, Pasteurella spp., Haemophilus, Francisella spp., Salmonella spp. Campylobacter o por el empleo de vacunas que contienen bacterinas elaboradas con estos microrganismos5. Las reacciones cruzadas se deben a la similitud que existe entre el PSO de estas bacterias y el de Brucella y constituyen un importante objeto de estudio, particularmente en zonas libres de brucelosis en Europa, donde provocan serias interferencias en el diagnóstico que obligan al descarte de animales falsos positivos9,15. En una situación similar se encontraría la producción lechera en nuestro país dado que existen 6.247 tambos libres sobre un total de 8.858 tambos muestreados13. En este contexto es recomendable el empleo de técnicas serológicas más específicas tales como el FPA o el ELISA competitivo.
Los objetivos de este trabajo desarrollado en el modelo murino fueron: a) estudiar la interferencia en el diagnóstico de la brucelosis bovina generada por la administración de diferentes vacunas comerciales que contienen bacterias Gram negativas, b) identificar dichas cepas y detectar la inducción de Ac de reacción cruzada y la persistencia serológica de los mismos.
Materiales y métodos
Animales
Se emplearon ratones BALB/c hembras de 8-10 semanas de edad provenientes del Bioterio de la Universidad de Buenos Aires. Los animales se distribuyeron al azar en los distintos grupos de experimentación una semana antes de la vacunación o inoculación y permanecieron alojados en una unidad ventilada con aire filtrado y presión negativa aislada del exterior, bajo condiciones de luz y temperatura controladas recibiendo agua y alimentación ad libitum (Bioterio, Facultad de Ciencias Veterinarias, Universidad Nacional del Centro de la Provincia de Buenos Aires). Todos los protocolos experimentales se realizaron bajo las normas de cuidado y bienestar animal establecidas por la Comisión de Bioética y Bioseguridad de la FCV, UNCPBA (Acta 087/02, FCV, UNCPBA, Tandil, Argentina; http://www.vet.unicen.edu.ar).
Vacunas
Se utilizó una vacuna comercial (vacuna inactivada) por grupo cuya composición se presenta en la Tabla 1. Además, se incluyeron dos grupos control inmunizados con B. abortus cepa 19 (vacuna comercial) (Grupo J) o inoculados con Brucella abortus 544 (Grupo K).
Tabla 1. Grupos de inmunización y componentes de cada vacuna empleada

Bacterias, bacterinas y adyuvante
Las cepas bacterianas componentes de las vacunas comerciales que indujeron Ac de reacción cruzada fueron solicitadas a los laboratorios elaboradores y sembradas en medios de cultivo adecuados. Mannheimia haemolytica (Pasteurella haemolytica), P. multocida y Moraxella bovis fueron sembradas en Agar Nutritivo (Oxoid) con adición de sangre desfibrinada al 10% y cultivadas a 37ºC. Histophilus somni (Haemophilus somnus) y Campylobacter fetus fetus se sembraron en los mismos medios en atmósfera con microaerofilia. Los cultivos de cada bacteria fueron cosechados con solución salina estéril (SSE) e inactivados con tratamiento térmico (70ºC, 20 min). Las suspensiones fueron ajustadas espectrofotométricamente a una concentración de 106 teniendo en cuenta que una absorbancia de 0,165 a l=600 nm equivale aproximadamente a 109 unidades formadoras de colonias (UFC)/ml (Pharmacia LKB, Ultrospec III).
Cada bacterina fue emulsificada en partes iguales con Marcol 52 (gentilmente cedido por Biogénesis, Argentina) mediante el empleo de vórtex.
Las suspensiones de la cepa 19 de B. abortus y B. abortus 544 fueron ajustadas a una concentración entre 104-105 UFC/ml. La dosis exacta fue determinada a los 4 días de la siembra por recuento retrospectivo de las colonias mediante diluciones y diseminación en medio de cultivo adecuado3.
Muestras
Los animales fueron anestesiados y se extrajeron muestras de sangre mediante punción del plexo retrorbital en los tiempos indicados en el diseño experimental. Los sueros obtenidos se conservaron a -20ºC hasta su procesamiento.
Pruebas serológicas
BPA modificado
Se empleó el protocolo oficial con una modificación de los volúmenes de los reactivos empleados. Se utilizaron 16 μl de suero y 6 μl of BPA (Laboratorio Biológico Tandil®, Argentina). La lectura se efectuó a simple vista y la presencia de grumos se interpretó como una reacción positiva.
FPA
Las muestras de suero fueron diluidas en el tampón provisto por el kit en tubos de borosilicato. Posteriormente se agregaron 10 μl del Ag brucélico a cada tubo (PSO conjugado a isotiocianato de fluoresceína) (Laboratorio Biológico Tandil®, Argentina) y se mezclaron mediante agitación con vórtex. La lectura se realizó en un polarímetro (FPM1). Los datos fueron expresados en unidades de milipolarización (mP). La interpretación se realizó de acuerdo a la normativa del SENASA: negativo: menor de 94 mP, sospechoso: igual o mayor a 94 y menor a 105 mP y positivo: mayor o igual a 105 mP8.
Enzimoinmunoensayo (Dot Blot)
El Dot Blot se realizó con 2 μl de las suspensiones de las cepas de C. fetus fetus, M. haemolytica, P. multocida, M. bovis y H. somni (DO=2, l=600 nm) fijadas sobre tiras de nitrocelulosa. El bloqueo se realizó con leche descremada al 3% en tampón fosfato (PBS) pH 7,2 durante 30 minutos. Las mezclas de sueros por grupo de vacunación (Grupos B, E y H) o inoculación fueron diluidas 1:50 en leche descremada (San Regim) al 0,3 % y se incubaron durante 2 h. a temperatura ambiente. Además, se incluyó como control positivo el anticuerpo monoclonal (AcM) anti-OPS (04/ F09) y como control negativo el suero de un ratón no inmunizado. Posteriormente, las tiras se incubaron con el anticuerpo secundario anti-ratón conjugado a peroxidasa obtenido en conejo (SIGMA) diluido 1:250 durante 1h. El revelado de la reacción se realizó con 3,3´-diaminobencidina tetrahidroclorada (DAB) (Pierce), al 0,02% en PBS y agua oxigenada al 0,1%. La reacción se detuvo a los 3 minutos mediante el lavado con agua destilada.
Diseño experimental
Ensayo I
Se distribuyeron 57 ratones en 11 grupos y se inmunizaron por la vía subcutánea (s.c.) con 0,2 ml de las vacunas de la Tabla 1. Estos ratones recibieron un refuerzo a los 25 días con las mismas vacunas. Se incluyeron dos grupos control: el Grupo J, vacunado vía s.c. con 1 x 104 UFC/ratón de B. abortus cepa 19 (n=6) y el Grupo K, inoculado por la vía intraperitoneal (i.p) con 6,97 x 104 UFC/ratón de B. abortus 544 (n=5). Se obtuvieron muestras de sangre el día 0 y a los 7, 15, 40, 50 y 60 días post-vacunación/ inoculación. Los sueros se analizaron con la técnica de BPA modificada y sobre los sueros positivos se realizó la prueba de FPA.
Ensayo II
Los ratones (n= 27) fueron distribuidos en 5 grupos inmunizados con 0,2 ml de las suspensiones inactivadas (106 UFC/ratón) y emulsificadas en Marcol 52 de las siguientes bacterias: G1) C. fetus fetus (n=4), G2) H. somni (n=4), G3) M. bovis (n=4), G4) M. haemolytica (n=4) y G5) P. multocida (n=5). Veinticinco días después se efectuó un refuerzo. Se incluyó un grupo control positivo inoculado (n=5) con B. abortus 544 (G6) (1,0 x 105 UFC/ratón). Se obtuvieron muestras de sangre el día 0 y a los 15, 32, 40, 50, 60, 70, 80, 95, 110, 130 y 150 días post-inmunización. Los sueros fueron analizados mediante la técnica de BPA modificada, FPA y Dot Blot.
Resultados
Ensayo I
Seis de las 9 vacunas comerciales empleadas indujeron Ac de reacción cruzada detectados por la técnica de BPA modificada en un número variable de animales por grupo. Los animales reactores se negativizaron a esta técnica a los 50 días post-inmunización (Tabla 2). Por el contrario, la prueba de FPA no detectó animales positivos en los distintos grupos y tiempos evaluados (Tabla 2). Por otro lado, todos los animales vacunados con la cepa 19 permanecieron positivos a la prueba de BPA mientras que los mismos sueros ensayados en FPA dieron resultado negativo en todos los tiempos estudiados. En el caso de los animales inoculados, el FPA detectó el 100% de los animales infectados con B. abortus 544.
Tabla 2. Número y porcentaje de sueros positivos a las técnicas de BPA modificada y FPA en los diferentes tiempos post-vacunación

*presencia de animales con resultados sospechosos a la técnica de FPA.
Ensayo II
Los sueros de los ratones inmunizados con las suspensiones de las distintas bacterias Gram negativas componentes de la vacunas comerciales dieron resultado positivo a la prueba de BPA modificada en un porcentaje variable por grupo (Figura 1). El porcentaje de reactores de cada grupo disminuyó a lo largo del tiempo del estudio excepto en el grupo inmunizado con P. multocida, en el cual el 100% de los animales mostraron reacciones serológicas persistentes hasta el final del ensayo (150 días). Por el contrario, en la prueba de FPA solamente se registraron resultados positivos en los grupos de ratones inmunizados con M. haemolytica y P. multocida (Figura 2). Los ratones del grupo control G6, inoculado con B. abortus 544 permanecieron positivos a ambas pruebas durante todo el experimento.
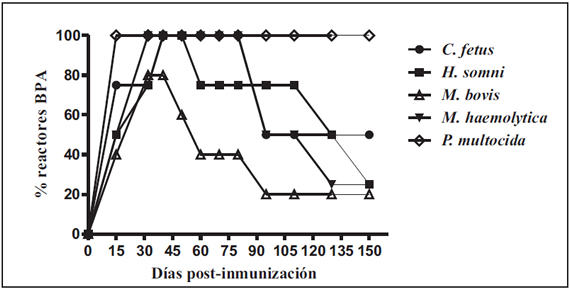
Figura 1.Porcentaje de ratones inmunizados con distintas especies de bacterias Gram negativas que reaccionaron a la técnica de BPA en los diferentes tiempos post-inmunización.
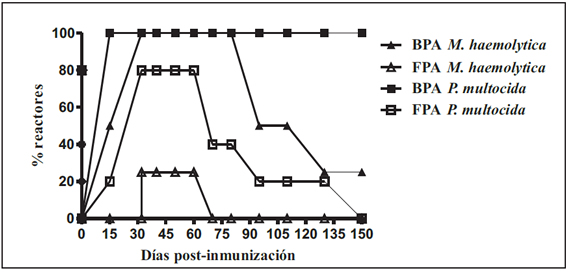
Figura 2. Comparación entre el porcentaje de ratones inmunizados con distintas especies de bacterias Gram negativas que reaccionaron a BPA y FPA en los diferentes tiempos post-inmunización.
Por otro lado, los sueros de los ratones positivos a BPA del Ensayo I se analizaron en Dot Blot con las suspensiones de las bacterias Gram negativas (bacterinas). Los sueros de los animales vacunados con la cepa 19 o inoculados con B. abortus 544 reaccionaron con M. haemolytica, P. multocida y H. somni (Figura 3). Del mismo modo, el AcM anti-OPS reconoció este antígeno en estas bacterias. Por otro lado, los sueros de los animales vacunados con las vacunas compuestos por estos microorganismos, no sólo reconocieron las cepas homólogas sino también a B. abortus.
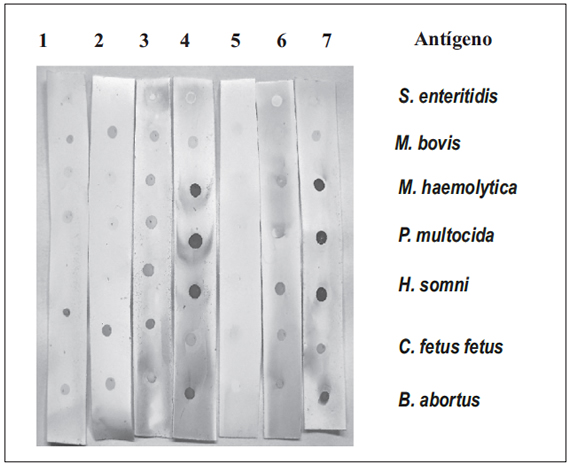
Figura 3. Sueros de animales de los grupos: 1 Grupo B, 2 Grupo E, 3 Grupo H, 4 AcM anti-OPS (04F09), 5 Suero control negativo, 6 B. abortus cepa 19, 7 B. abortus 544.
Discusión
Los resultados obtenidos en este trabajo indican que la vacunación con ciertos biológicos que incluyen en su composición microorganismos Gram negativos inducen la producción de Ac de reacción cruzada con B. abortus en el modelo murino. Estos Ac fueron detectados mediante la técnica de BPA modificada en un número variable de animales por grupo y por un periodo breve. Por el contrario, la prueba de FPA mostró una mayor especificidad y 0 15 30 45 60 75 90 105 120 135 150 0 20 40 60 80 100 BPA M. haemolytica BPA P. multocida FPA M. haemolytica FPA P. multocida Días post-inmunización % reactores Figura 2. Comparación entre el porcentaje de ratones inmunizados con distintas especies de bacterias Gram negativas que reaccionaron a BPA y FPA en los diferentes tiempos post-inmunización. por lo tanto su uso sería recomendable a los efectos de disminuir el número de reacciones falsas positivas. Sin embargo, recientemente, Samartino y colaboradores12 reportaron la presencia de títulos no específicos en hembras bovinas adultas seronegativas que recibieron una vacuna formulada en adyuvante oleoso contra el complejo respiratorio (IBR, DVB, PI3, M. haemolytica, P. multocida y H. somni). En este trabajo, las pruebas de BPA y FPA no discriminaron las reacciones atípicas.
Existen reportes de reacciones serológicas no específicas en bovinos no infectados con Brucella atribuidas a infecciones con E. coli O:157, Vibrio cholerae, Pasteurella spp., Francisella spp. y Salmonella spp. o por vacunas que contienen estos u otros microorganismos Gram negativos en su composición2,4. La semejanza que existe entre la estructura química del OPS de estas bacterias y Brucella, es responsable de la mayoría de las reacciones cruzadas observadas. En nuestro estudio, en concordancia con otros reportes, M. haemolytica y P. multocida fueron los principales microorganismos implicados en estas reacciones y los que generaron las respuestas serológicas más persistentes1,12. Estas bacterinas podrían ser las responsables de ciertas reacciones atípicas reportadas en establecimientos certificados como libres. Si bien el modelo empleado no es el adecuado por no tratarse del huésped natural, son datos que deberían considerarse en un análisis de este tipo.
Conclusión
Los anticuerpos generados por el vacunas comerciales empleadas en nuestro trabajo no tendrían un impacto significativo en el diagnóstico de la brucelosis bovina en el modelo murino.
Agradecimientos
Al Médico Veterinario S. Islas (C.I.C, Bs. As., Argentina) y F. Amaya (U.N.C.P.B.A, Argentina) por el cuidado de los animales. A Sanidad Ganadera y Biogénesis-Bagó por el suministro de las vacunas y cepas bacterianas.
1. Bakos, E.; Citroni, D. ;Galassi J. Títulos anti-Brucella abortus de origen inusual en toros de raza índica. Vet. Arg. 1992; 9(83):177-81. [ Links ]
2. Benett, J.J.; Massard, C.; Garin-Bastuji, B. Réactions sérologiques atypiques dans le dépistage de la brucellose bovine. Epidemiol Sante Anim. 1991;19:97-130. [ Links ]
3. Bowden R.A., Cloeckaert A., Zygmunt M.S., Dubray G. Evaluation of immunogenicity and protective activity of the major 25 kDa outer membrane protein of Brucella melitensis expressed in Escherichia coli, J Med Microbiol 1998: 4739-48. [ Links ]
4. Corbel, M.J.; Stuart, F.A.; Brewer R.A. Observations on serological cross-reactions between smooth Brucella species and organisms of other genera. Dev Biol Stand 1984; 56: 341-8. [ Links ]
5. Garin-Bastuji, B. Le dépistage de la brucellose des ruminants et ses difficultés. Le cas des sérologies atypiques en brucellose bovine. Point Vét. 1993; 152: 23-31. [ Links ]
6. Garin-Bastuji, B.; Hummel, N.; Gerbier, G.; Cau, C.; Pouillot, R.; Da Costa, M.; Fontaine, J.J. Non specific serological reactions in the diagnosis of bovine brucellosis: experimental oral infection of cattle with repeated doses of Yersinia enterocolitica O:9. Vet. Microbiol.1999; 66:223-33. [ Links ]
7. Hilbink, F.; Fenwick, S. G.; Thompson, E. J.; Kittelberger, R.; Penrose, M.; Ross G. P. Non-specific seroreactions against Brucella abortus in ruminants in New Zealand and the presence of Yersinia enterocolitica 0:9. N Z Vet J.1995; 43:175-8. [ Links ]
8. Nicola, A.; Elena, S. Manual de diagnóstico serológico de la brucelosis bovina. 2009. SENASA.p14 y p46. [ Links ]
9. Nielsen, K.; Smith, P.; Yu, W.L.; Halbert, G. Salmonella enterica serotype Urbana interference with brucellosis serology. J Immunoassay Immunochem 2007; 28:289. [ Links ]
10. Nielsen, K.; Smith, P.;Widdison,J., Gall, J.; Kelly, L.; Kelly W., Nicoletti P. Serological relationship between cattle exposed to Brucella abortus, Yersinia enterocolitica O:9 and Escherichia coli O157:H7. Vet Microbiol 2004; 100:25-30. [ Links ]
11. Pennimpede E. F. , Di Lorenzo C. L. Inmunoserología en brucelosis bovina. Therios 1991; 87:78-87. [ Links ]
12. Samartino, L.; Aristizábal, M.T; Céspedes, N.J. Unspecific titles in a bovine brucelosis free herd induced by a commercial vaccine against respiratory complex. Brucellosis 2011. International Research Conference 2011. Buenos Aires, Argentina. [ Links ]
13. Sistema Integrado de Gestion de Sanidad Animal (SIGSA).2011.Fuente: Sistema de Gestion Sanitaria (SGS). 2011 [ Links ]
14. Torioni de Echaide, S.;Hábich, G. E. Efecto de la vacunación antiaftosa sobre la evolución de los anticuerpos brucélicos post-vacunales en bovinos. Rev Med Vet. 1989; 3:146-51. [ Links ]
15. Weynants,V.; Tibor, A.; Denoel P.A.; Saegerman, C.; Godfroid, J.; Thiange, P.; Letesson J. Infection of cattle with Yersinia enterocolitica 0:9 a cause of the false positive serological reactions in bovine brucellosis diagnostic test. Vet Microbiol. 1996; 48:101-12. [ Links ]














