Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
InVet
versión On-line ISSN 1668-3498
InVet vol.15 no.1 Ciudad Autónoma de Buenos Aires jun. 2013
ARTÍCULO DE INVESTIGACIÓN
Aparato reproductor y parámetros seminales de vicuña (Vicugna vicugna vicugna)
Giuliano, S.M.1,3; Spirito, S.E.1; Miragaya, M.H.2,3; Rutter, B.2; Agüero, A.2,3; Capdevielle, E.F.2,3; Boquet, M.D.1; Ferrari M.R.1,3
Cátedra de
1Física Biológica,
2Teriogenología: Facultad de Ciencias Veterinarias, Universidad de Buenos Aires, CABA, Argentina.
3Instituto de Investigación y Tecnología en Reproducción Animal (INITRA), Facultad de Ciencias Veterinarias, Universidad de Buenos Aires, CABA, Argentina.a.
Correspondencia e-mail: Susana Giuliano smgiulia@fvet.uba.ar
Recibido: 20/11/2012
Aceptado: 16/12/2013
Resumen
Este estudio tuvo como objetivos determinar el tamaño y forma testicular, evaluar ultrasonográficamente las glándulas anexas del aparato reproductor macho, obtener semen mediante electroeyaculación y determinar parámetros seminales de la vicuña (Vicugna, vicugna vicugna). Debido a que son escasos los reportes sobre los parámetros reproductivos de los machos de esta especie, los objetivos planteados son importantes para contribuir al conocimiento de la fisiología reproductiva de estos camélidos. Los testículos derecho e izquierdo presentaron respectivamente, un largo de 3,91±0,64 cm y 3,91±0,60 cm y un ancho de 1,92±0,31 cm y 1,93±0,37 cm (n=19 machos). En tres machos (n=3, r=1) se determinó por ultrasonografía, que la próstata tenía 1,69 cm de largo y 1,76 cm de ancho. Las glándulas bulbouretrales presentaron un largo y ancho promedio de 1,08 cm y 1,60 cm respectivamente. Se comprobó la ausencia de vesículas seminales y la distancia ano-próstata promedio fue de 11,5 cm. El semen presentó las siguientes características (rango): color blancuzco, filancia, pH (7,0-7,7), volumen (1,0-2,5 ml), concentración espermática (10-140x106 espermatozoides/ml), movilidad (0 a 10%), morfología espermática normal (66-75%) (n=3; 7 eyaculados). El 89% de los núcleos espermáticos, teñidos con la reacción de Feulgen, eran morfológicamente normales y a partir de imágenes digitalizadas del núcleo se determinaron valores morfométricos (n=1; 3 eyaculados). La coloración del núcleo con Azul de Toluidina permitió observar 3 patrones de coloración asociados con distintos grados de maduración de la cromatina. Este estudio confirmó la posibilidad de extraer semen de vicuña mediante electroeyaculación y de evaluar los eyaculados.
Palabras clave: Vicuña; Semen; Electroeyaculación; Ultrasonografía; Núcleo espermático.
Anatomy of the reproductive tract and seminal parameters in vicugna (Vicugna vicugna vicugna)
Summary
The aims of this study were: 1) to determine testicle size and shape, 2) ultrasonographically evaluate the accessory sex glands associated to the male reproductive tract, 3) collect semen by electroejaculation and determine semen parameters in vicuna. Knowledge on vicuna male reproductive system is scarce, thus the objectives of this study are important for estimating the reproductive fitness of males in the future. Measurements for the right and left testes were 3.91±0.64 cm and 3.91±0.60 cm long and 1.92±0.31 cm and 1.93±0.37 cm wide respectively (n=19). Ultrasonographically, the average length and width of the prostate was 1.69 cm and 1.76 cm respectively and the average length and width of the bulbourethral glands was 1.08 cm and 1.60 cm respectively. No seminal vesicles were observed and the average distance between anus and prostate was obtained (11.5 cm) (n=3). Semen presented the following characteristics (range): whitish color, thread formation, pH (7.0-7.7), volume (1.0-2.5 ml), concentration (10-140x106 sperm/ml), sperm motility (0 to 10%) and morphology (normal sperm 66-75%) (n=3; 7 ejaculates). Eighty nine percent of the sperm nuclei stained with Feulgen were morphologically normal and the morphometric characteristics were obtained using digital microphotographs (n=1; 3 ejaculates). Nuclei stained with Toluidine Blue showed three distinct staining patterns, which are associated with different degrees of chromatin maturation. These results confirmed that it is feasible to collect vicuna semen using electroejaculation and to evaluate the ejaculates thus obtained.
Key words: Vicuna; Semen; Electroejaculation; Ultrasonography; Sperm nucleus.
Introducción
La vicuña (Vicugna vicugna) es un mamífero silvestre, que pertenece al grupo de los camélidos sudamericanos (CSA). Habita a gran altura, entre los 3.200 y 4.600 metros sobre el nivel de mar donde la tensión de oxígeno es baja, en zonas desérticas e inhóspitas con gran amplitud térmica entre el día y la noche, y vientos fuertes. La subespecie geográfica austral, Vicugna vicugna vicugna, habita en Argentina y se localiza en la región noroeste del país, desde los 22° hasta los 29°10´ de latitud sur. La otra subespecie, de la zona norte (Vicugna vicugna mensalis), habita en cambio en regiones del norte de Chile y en Perú.
La vicuña presenta la fibra natural de mayor finura, con un diámetro promedio de 13,5µm. Esta fibra tiene gran valor como producto de exportación y constituye un ingreso potencialmente importante para las comunidades andinas agropastoriles. Por ser una especie silvestre, la producción de vicuñas en la Argentina está regulada por un marco legal. El Apéndice I del CITES (Convention on Internacional Trade in Endangered Species) incluye las especies en peligro de extinción que pueden estar afectadas por el comercio. El Apéndice II incluye aquellas especies que aunque no están necesariamente en peligro de extinción, podrían llegar a estarlo a menos que su comercio estuviera sujeto a una reglamentación estricta con el fin de evitar la utilización incompatible con su supervivencia. Desde 1977 las vicuñas de la provincia de Jujuy - y desde 2002 las vicuñas de la provincia de Catamarca, Argentina - están incluidas en el Apéndice II del CITES, permaneciendo los ejemplares de las restantes provincias en el Apéndice I. Este cambio ha permitido la venta internacional de fibra esquilada de vicuñas vivas, de telas y de productos manufacturados.
Como el estudio de esta especie de camélidos sudamericanos quedó condicionado a su lugar de origen, la información con que se cuenta acerca de la fisiología reproductiva del macho Vicugna vicugna, es escasa. La implementación de biotecnologías reproductivas permitiría conservar semen en bancos genéticos, incrementar la fertilidad de los rebaños y lograr el mejoramiento genético de la especie. Además contribuiría a generar una importante fuente de recursos alternativos para impulsar las economías alto-andinas.
El presente estudio tuvo como objetivos determinar el tamaño y la forma testicular, evaluar ultrasonográficamente las glándulas anexas del aparato reproductor del macho de la vicuña, obtener semen mediante electroeyaculación y determinar parámetros seminales macro y microscópicos.
Materiales y métodos
Animales y locación
Los estudios se realizaron en dos grupos de machos de vicuñas argentinas (V. v. vicugna), durante dos meses de verano.
Grupo 1: constituido por 16 machos de 3 a 10 años de edad, con un peso promedio de 44,9±6,2 Kg localizados en la provincia de Salta, Argentina (localidad de Los Molinos, a 2.020 msnm).
Grupo 2: formado por tres animales, con 60 Kg de peso promedio, localizados en la provincia de Catamarca, Argentina (Reserva de la Biósfera de Laguna Blanca, a 3.222 msnm).
Determinación del tamaño testicular
Se midieron el largo y el ancho testicular en todos los animales de ambos grupos utilizando un calibre tipo Vernier con precisión de 0,05mm.
Evaluación de las glándulas anexas, de la uretra pelviana y la distancia ano-próstata
Las ultrasonografías se realizaron por vía transrectal, utilizando un ecógrafo Berger LC- 2010 con un transductor lineal, de 5,0 Mhz, con vástago anexado y otro transductor, convexo, de 6,5 Mhz. Las evaluaciones con este último se llevaron a cabo sólo en el Grupo 2 (n=3).
Extracción de semen
Se recolectaron y procesaron 13 eyaculados de los animales del Grupo 2 (n=3; 13 eyaculados). Las extracciones, bajo anestesia general, se realizaron mediante electroeyaculación (EE), cada 72 hs. Para anestesiar a los animales se aplicó xilacina (Rompun®, Bayer) en dosis de 0,2 mg/Kg + hidrocloruro de ketamina (Ketamina®, Holliday, Argentina) a razón de 1,5 mg/Kg, por vía endovenosa (EV).
Una vez anestesiado cada macho se colocó en decúbito lateral y se le lavó la cavidad prepucial con solución fisiológica a 37°C.
Para la colecta se utilizó un electroeyaculador P-T Electronics®, modelo 304 (220 V) y un vástago con tres electrodos lineales # 4. Antes de colocar el vástago en el recto, se retiraron las heces y luego fue introducido cuidadosamente, ubicando los electrodos sobre la mitad caudal de la próstata. El vástago se localizó según la distancia ano-próstata medida con ultrasonografía en cada uno de los casos.
La estimulación eléctrica fue incrementándose (paulatinamente de a 0,2 V) partiendo de 2 V, hasta llegar a 10 V. Cada estimulación sucesiva tuvo una duración 3 segundos con un intervalo de 1 segundo entre cada estímulo eléctrico. La electroestimulación se realizó hasta obtener respuesta o por un máximo de 20 minutos. El protocolo de electroeyaculación empleado se basó en el descripto por Director et al 6.
Al producirse la erección, el pene se exteriorizó retirando el prepucio hacia atrás. El semen se recolectó en tubos de vidrio protegidos con una camisa externa que contenía agua a 37ºC, lo que permitió mantener constante la temperatura el eyaculado durante toda la maniobra. Mientras tenía lugar la estimulación, el tubo de vidrio se cambiaba cada 5 minutos para evitar una posible contaminación con orina.
La técnica de electroeyaculación bajo anestesia general empleada en este estudio fue aprobada por el Comité Institucional de Cuidado y Uso de Animales de Experimentación (CICUAL) de la Facultad de Ciencias Veterinarias de la UBA.
Determinación de características macroscópicas y microscópicas del semen
Las características macro y microscópicas estudiadas en cada eyaculado fueron: color, volumen, filancia, pH, concentración, movilidad, viabilidad y morfología de los espermatozoides. Además se evaluaron las siguientes características del núcleo espermático: morfología, morfometría y maduración de la cromatina.
Color: se evaluó subjetivamente por observación.
Volumen: se determinó en tubo graduado.
Filancia: se determinó si los eyaculados formaban hilo o no al ser tomados con pipeta Pasteur.
pH: se midió con cinta de pH (Meutralit, Merck®) de rango entre 5,5 y 9.
Concentración espermática: mediante una cámara hemocitométrica de Neubauer.
Movilidad espermática: a partir de la observación de semen sin diluir, entre porta y cubreobjeto, sobre platina térmica a 37 °C, en microscopio de contraste de fase (400x) se determinó el porcentaje de espermatozoides con movilidad progresiva.
Morfología espermática: se estudió colocando una gota de semen puro entre porta y cubreobjeto, utilizando microscopía de contraste de fases (1000x). Se consideraron espermatozoides morfológicamente normales a aquellos que no tenían ninguna de las siguientes características: cabeza con morfología anormal, cabeza suelta, cola enrollada o gota citoplasmática. Se determinaron como cabezas morfológicamente normales aquellas que presentaban la morfología más numerosa y homogénea en la población. A partir de la observación de un pool de 200 espermatozoides se determinó el porcentaje de espermatozoides normales y con diferentes anormalidades de cabeza, cola y gota citoplasmática. Se obtuvieron fotomicrografías de espermatozoides coloreados con eosina que presentaban distintas morfologías. La coloración se hizo según Giuliano et al14.
Morfología del núcleo: se evaluó un pool de 170 núcleos provenientes de 3 eyaculados de un único macho. Sobre extendidos coloreados con la reacción de Feulgen según la técnica descripta por Ferrari y col.9, se determinó el porcentaje de núcleos morfológicamente normales y anormales (piriformes, pequeños, grandes, alargados, globosos, vacuolados y amorfos). Los núcleos considerados morfológicamente normales fueron aquellos que presentaban la morfología más numerosa y homogénea en la población.
Morfometría del núcleo: se determinaron, según la técnica descripta por Spirito y col.21, seis caracteres morfométricos: área (µ2), perímetro (µ), diagonal máxima (µ), diagonal mínima (µ), largo/ancho y forma dada por la relación 4.Ï.área/perímetro2 mediante un analizador de imágenes (Kontron Bildanalyse, MiniMOP). Las determinaciones se hicieron sobre microfotografías del plano principal de 156 núcleos espermáticos morfológicamente normales coloreados con la reacción de Feulgen y los resultados de las mediciones se expresan como media±desvío estandar.
Maduración de la cromatina: sobre extendidos de semen fresco secados al aire se hizo la coloración con Azul de Toluidina (AT) de acuerdo a Carretero y col.2. Los núcleos se clasificaron en tres grupos (positivos, negativos e intermedios) de acuerdo a la intensidad de la coloración de la cromatina espermática2. Los núcleos violeta oscuro son positivos, los celestes muy tenues negativos y los violeta claro intermedios. La coloración más intensa, violeta oscuro, se da en los núcleos que tienen un grado bajo de condensación y por lo tanto la entrada de colorante es mayor. Estos núcleos intensamente coloreados están asociados con falta de maduración y posiblemente otras anormalidades nucleares. En los núcleos negativos, celestes muy tenues, la entrada de colorante sería escasa debido a la alta compactación de la cromatina que es característica de los núcleos que completaron el proceso de maduración. Un mismo operador observó un pool de 421 núcleos provenientes de 3 eyaculados de un mismo animal. Los resultados se expresan como porcentaje de los tres tipos de núcleos observados.
Resultados
Determinación del tamaño testicular
Los testículos de la vicuña se encuentran dentro del escroto no pendular, en la región perineal. La forma es ovoide y la consistencia es tenso-elástica. Las medidas testiculares promedio y desvío estándar figuran en el Cuadro 1.

Cuadro 1. Largo y ancho (media ± desvío estándar) de los testículos de 19 vicuñas.
Evaluación de las glándulas anexas, de la uretra pelviana y la distancia ano-próstata
Mediante ultrasonografía transrectal se observó que la próstata presentaba forma ovoide con un largo y ancho promedio de 1,69 cm y 1,76 cm respectivamente.
Las glándulas bulbouretrales presentaban forma redondeada y estaban situadas en posición dorso lateral respecto a la uretra pelviana. Tenían un largo y ancho promedio de 1,08 cm y 1,60 cm respectivamente. Se determinó la ausencia de vesículas seminales.
La distancia ano-próstata promedio fue de 11,5 cm.
Extracción de semen
Se hicieron 13 colectas a partir de 3 machos. Se descartaron cuatro eyaculados con azoospermia y dos por contaminación con orina (6/13).
Determinación de características macroscópicas y microscópicas del semen
Se determinaron las características de las siguientes parámetros seminales: color (blancuzco), volumen (1,0-2,5 ml), filancia (todos los eyaculados formaron hilo al ser pipeteados), pH (7,0-7,7), concentración espermática (10-140x106 espermatozoides/ml), movilidad progresiva (0 a 10%), morfología espermática: espermatozoides normales (66- 75%), cabezas anormales (4-6%), cabezas sueltas (0-6%), colas enrolladas (6-14%), gota citoplasmática (7-13%) (Figura 1).
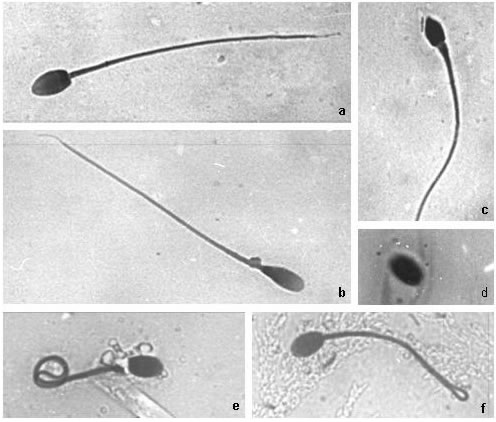
Figura 1. Características morfológicas de espermatozoides de vicuña coloreados con eosina. a, normal; b, gota citoplasmática proximal y cabeza piriforme-alargada; c, cabeza amorfa; d, cabeza suelta; e y f, colas enrolladas. Todas las fotos fueron tomadas con aumento 1000x e impresas en la misma escala.
En 170 espermatozoides con núcleos teñidos con la reacción de Feulgen, provenientes de un animal del Grupo 2; se determinó la proporción de las siguientes morfologías: normales 89,0%; piriformes 1,8%; pequeños 3,5%; grandes 1,2%; alargados 2,3%; globosos 1,8%; vacuolados 0,6% y amorfos 0,6%. En la Figura 2 se observan núcleos con morfologías normales y anormales.

Figura 2. Núcleos espermáticos de vicuña coloreados con la reacción de Feulgen. a-c Normales, d Piriforme, e Grande, f Globoso, g Vacuolado (la flecha señala la vacuola), h Pequeño, i Alargado, j Amorfo (flecha). Todas las fotos fueron tomadas con aumento 1000x e impresas en la misma escala.
A partir de las imágenes digitalizadas de 156 núcleos coloreados con la reacción de Feulgen se obtuvieron las siguientes medidas morfométricas (media±desvío estándar): área nuclear 11,10±1,49 µm2; perímetro 12,80±0,87 µm; diagonal máxima 4,96±0,37 µm; diagonal mínima 2,83±0,37 mm y dos caracteres indirectos (media±desvío estándar): diagonal máxima/ diagonal mínima 1,78±0,17 y forma 4 π área / perímetro2 (0,83±0,05). Todos los parámetros mencionados corresponden a la sección máxima del núcleo.
Los núcleos espermáticos de vicuña teñidos con Azul de Toluidina presentaron tres patrones de coloración: celeste muy tenue (negativos, sin alteración en la condensación de la cromatina), violeta claro (intermedios, algún grado de decondensación), violeta oscuro (positivos, alto grado de condensación). En los 421 núcleos así coloreados se observó que el 96% eran negativos, un 2% intermedios y otro 2% positivos (Figura 3).

Figura 3. Núcleos espermáticos de vicuña coloreados con Azul de Toluidina. Los colores violeta oscuro, violeta claro y
celeste muy claro observados microscópicamente se muestran en las fotos como diferentes tonalidades de gris. a Positivo,
b y c Intermedio, d Negativo. Todas las fotos fueron tomadas con aumento 1000x e impresas en la misma escala.
Discusión
En este estudio se obtuvieron medidas del largo y ancho de testículos de 19 adultos. Las medidas promedio obtenidas (largo: 3,9 cm y ancho: 1,92 cm) son similares a las presentadas en otros estudios7, 12, 24. Tanto en el largo como en el ancho las medidas fueron menores a las reportadas en llamas (7 cm y 5 cm)12; alpacas (4-5 cm y 2,5-3,0 cm)12 y guanacos (4,06 cm y 2,05 cm)16.
Por ultrasonografía transrectal se observó la presencia de la próstata y glándulas bulbouretrales así como la ausencia de vesículas seminales, concordando con lo descrito en la literatura para los machos de llama, alpaca y guanaco1, 12, 16.
En este estudio se obtuvo por primera vez semen de vicuñas argentinas mediante electroeyaculación y se estudiaron sus características seminales.
Para evaluar los parámetros seminales de los machos de Vicugna vicugna, especie silvestre de camélidos sudamericanos (CSA), fue necesario implementar una técnica de recolección de semen mediante EE, ya que estos machos no responden a la extracción con vagina artificial (VA). Con EE se obtuvieron eyaculados de todos los machos utilizados ya que este método no necesita de la cooperación del animal y permite obtener eyaculados de calidad de manera repetible. Esto coincide con los resultados obtenidos en vicuña7, 8, 19 y en nuestro laboratorio en otras especies de CSA: llama6, 15, guanaco16 y alpaca4.
El eyaculado de vicuña es blanquecino, filante y viscoso, coincidiendo con lo descrito en la especie7, 19 y en los demás CSA3, 5, 16, 17, 24. Los rangos de las características seminales obtenidas en este estudio mediante EE están comprendidos en general dentro de lo reportado, no sólo en vicuñas, sino también en otros CSA 6, 15, 16, 17,. Además están comprendidos dentro de los rangos reportados por diferentes autores con semen de CSA obtenido mediante VA11, 15, 18, 23,26. La concentración es el parámetro que mostró mayor variabilidad entre los resultados presentados para vicuñas por distintos autores7,19, lo que podría deberse tanto al uso de diferentes metodologías de recuento espermático, como a las variaciones de las maniobras y rutinas en la extracción de semen.
Entre los parámetros seminales que se utilizan para evaluar los eyaculados de distintas especies se encuentra la morfología del núcleo. Si bien las observaciones del núcleo espermático hechas en el presente estudio se realizaron sólo en un individuo, tienen el valor de contribuir en esta área de un modo especial ya que prácticamente no hay datos publicados al respecto. La coloración que se utilizó para evaluar la morfología de los núcleos espermáticos en vicuñas fue la reacción de Feulgen, específica para identificar ADN. El núcleo de los espermatozoides de vicuñas mostró anormalidades semejantes a las observadas en otras especies: piriformes, pequeños, grandes, alargados, globosos, con vacuolas, amorfos10, 27. Los valores morfométricos del núcleo espermático, obtenidos en el presente estudio, son similares a los determinados en llama13, 14 y levemente inferiores a los presentados por Enciso para la cabeza espermática7.
El Azul de Toluidina es un colorante nuclear básico que tiñe la cromatina en forma orto y metacromática22. Tiene la capacidad de unirse a los residuos fosfato de la cromatina espermática de acuerdo al estado de compactación de la misma y a la integridad del ADN25. Las alteraciones de la cromatina espermática posibilitan una mayor entrada de colorante que genera una reacción positiva en los núcleos (violeta oscuro). En este estudio se observaron tres poblaciones de núcleos de espermatozoides de vicuña con distinta intensidad de coloración. Los patrones observados coincidieron con los reportados en vicuña19 llama2, guanaco3, alpaca4 y equino20.
Conclusiones
Este trabajo permitió confirmar y complementar los datos obtenidos por otros autores para V. v. mensalis, respecto de las características de los órganos genitales masculinos en V. v. vicugna.
Fue posible implementar una metodología y un protocolo de recolección de semen de vicuñas argentinas mediante electro-eyaculación.
Y también evaluar los eyaculados así obtenidos, aportando por primera vez datos de las características macro y microscópicas del semen de vicuñas argentinas, y logrando reconocer las anormalidades más frecuentes de los espermatozoides, así como los valores morfométricos del núcleo.
La información obtenida es relevante e invita a continuar y profundizar estudios de la fisiología reproductiva del macho de vicuña.
1. Agüero, A.; Zanzottera, E.; Egey, J.; et al. Anatomía ultrasonográfica del aparato genital macho de Lama glama. Actas del Segundo Seminario Internacional de Camélidos Sudamericanos Domésticos 1997; Ciudad de Córdoba, Argentina: 111-3. [ Links ]
2. Carretero, MI.; Giuliano, SM.; Casaretto, C.; Gambarotta MC.; Neild, DM. Evaluación del ADN espermático de llamas utilizando azul de toluidina. InVet 2009a; 11(1): 55-63. [ Links ]
3. Carretero, MI.; Giuliano, S.; Agüero, A.; et al. Guanaco sperm chromatin evaluation using toluidine blue. Reprod Fertil Dev. 2009b; 22 (1) 310. [ Links ]
4. Carretero, MI.; Arraztoa, CC.; Casaretto, CI.; Huanca, W.; Neild, DM.; Giuliano SM. Alpaca Sperm Chromatin Evaluation Using Toluidine Blue. In Fibre production in South American camelids and other fibre animals. Lieke Boersma Editor, Wageningen Academic Publishers, 2010: 141-144. [ Links ]
5. Casaretto, C.; Martínez Sarrasague, M.; Giuliano, S.; et al. Evaluation of Lama glama semen viscosity with a coneplate rotational viscometer. Andrologia 2012 44: 335-41 [ Links ]
6. Director, A.; Giuliano, S.; Trasorras, V.; Carretero, MI.; Pinto, M.; Miragaya, M. Electroejaculation in llama (Lama glama). Journal of Camel P & R. 2007; 14(2): 203-6. [ Links ]
7. Enciso Hoyos, MA.. Reproducción en la vicuña macho Vicugna vicugna: evaluación del método de contención química, colección de semen, análisis del eyaculado y biometría testicular, (2009) Tesis de Maestría. Unidad de Post Grado. Universidad Nacional Mayor de San Marcos, Lima , Perú [ Links ]
8. Enciso Hoyos, MA., Rodríguez, C.; Huanca, W.; Valdivia, M. Semen collection, testicular volume, and preliminary assay of cooled semen of captive peruvian vicunas (Vicugna vicugna mensalis) Reprod Fert Develop. 22(1) 257-7. [ Links ]
9. Ferrari, MR.; Spirito, SE.; Giuliano, SM.; Cristini, EA. Feulgen reaction: its microspectrophotometric analysis in bovine spermatozoa. Com Biol. 1996; 14: 19-32. [ Links ]
10. Ferrari, MR.; Giuliano, SM.; Spirito, SE.; Fernández, HA. Chromatin citophotometric analysis of abnormal bovine spermatozoa. Andrologia 1998; 30: 85-9. [ Links ]
11. Flores P.; García-Huidobro J.; Muñoz, C.; Bustos- Obregón, E.; Urquieta, B. Alpaca semen previous to a mating period. Ani Reprod Sci. 2002; 72 (3-4), 259-266. [ Links ]
12. Fowler, M. Medicine and Surgery of South American Camelids. Second Edition. Iowa State University Press/ Amer: 391-429. [ Links ]
13. Giuliano, S.; Ferrari, M.; Spirito, S.; Estudios morfométricos y de distribución de la cromatina de espermatozoides de Lama glama. 3er. Seminario Internacional de Camélidos Sudamericanos Domésticos 1998a. Córdoba, Argentina. Resúmenes pág 26. [ Links ]
14. Giuliano, S.; Ferrari, M.; Spirito, S.; Roldán, J.; Fernández, H.; Aguero, A. Análisis morfométrico de los espermatozoides de Lama glama mediante el uso de tres coloraciones. XVI PANVET, Congreso Panamericano de Ciencias Veterinarias 1998b. Santa Cruz de la Sierra, Bolivia. Resúmenes pág. 138. [ Links ]
15. Giuliano, S.; Director, A.; Gambarotta, M. Collection method, season and individual variation on seminal characteristics in the llama (Lama glama). Anim Reprod Sci. 2008; 104, 359-369. [ Links ]
16. Giuliano, S.; Carretero, I.; Pinto, M.; et al. Electroeyaculación y características seminales de guanaco. Resúmenes en Actas V Congreso Mundial de Camélidos 2009; Riobamba, Ecuador. [ Links ]
17. Giuliano, S.; Carretero. M.; Gambarotta, M.; et al. Improvement of llama (Lama glama) seminal characteristics using collagenase. Anim Reprod Sci. 2010; 118 (1): 98-102. [ Links ]
18. Morton, KM.; Thomson, PC.; Bailey, K.; Quality parameters for alpaca (Vicugna pacos) Semen are affected by semen collection procedure. Reprod Domest Anim. 2010; 45: 637-43. [ Links ]
19. Pacheco JI.; Mamani RH.; Deza HW. Colección de semen mediante electroeyaculacion de vicuñas mantenidas encautiverio. Spermova 2011; 1(1): 131-3. [ Links ]
20. Sardoy, MC.; Carretero, MI.; Neild, D. Evaluation of stallion sperm DNA alterations during cryopreservation using toluidine blue. Anim Reprod Sci. 2008; 107: 349-350. [ Links ]
21. Spirito, S.; Boquet, M.; Giuliano, S.; et al. Distribución de la cromatina y morfología nuclear en espermatozoides equinos normales. INVET 2001; 3: 19-28. [ Links ]
22. Stockert, JC.; Gosálvez. J.; Del Castillo. P.; Pelling, C; Mezzanotte, R. X-ray microanalysis of toluidine blue stained chromosomes: a quantitative study of the metachromatic reaction of chromatin. Histochemistry 1991; 95: 289-295. [ Links ]
23. Sumar, J. Fisiología de la reproducción del macho y manejo reproductivo. En: Fernández-Baca, S. (Ed.). Avances y perspectivas del conocimiento de los Camélidos Sudamericanos. Editorial FAO. Santiago, Chile, 1991:111-147. [ Links ]
24. Tibary, A.; Vaughan, J. Reproductive physiology and infertility in Male South American Camelids: A review and clinical observations. Small Rumin Res. 2006; (61): 283-298. [ Links ]
25. Tsarev, I.; Bungum, M.; Giwercman, A.; et al. Evaluation of male fertility potential by Toluidine Blue test for sperm chromatin structure assessment. Hum Reprod 2009; 24: 1569-1574. [ Links ]
26. Urquieta, B.; Flores, P.; Muñoz, C.; Bustos-Obregón, E.;García-Huidobro J. Alpaca semen characteristics under free and directed mounts during a mating period. An Reprod Sci. 2005; 90 (3-4): 329-339. [ Links ]
27. WHO; Laboratory manual for the examination and processing of human semen. 5th Edition. WHO Press, World Health Organization. Geneva, 2010. [ Links ]














