Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
InVet
versión On-line ISSN 1668-3498
InVet vol.15 no.2 Ciudad Autónoma de Buenos Aires dic. 2013
ARTÍCULO DE INVESTIGACIÓN
Caracterización de las inmunoglobulinas del ñandú (Rhea americana)
Montagna, D.R.1; Rigo, V.1; Ramayo, L.G.1; Goldman, L.H.1; Huguet, M.J.2; Maceira, N.3; Jar, A.M.1
1Cátedra de Inmunología y
2Cátedra de Genética, Facultad de Ciencias Veterinarias, UBA.
3Grupo Recursos Naturales y Gestión Ambiental, EEA INTA-Balcarce. Autor Corresponsal: Ana M. Jar. Cátedra de Inmunología. Facultad de Ciencias Veterinarias. Chorroarín 280. C1427CWO, Buenos Aires. Argentina. * Premio Estímulo a la Investigación Científica de la convocatoria 2012. Categoría Alumnos de FCV - UBA
Correspondencia e-mail: Ana María Jar amjar@fvet.uba.ar
Recibido: 29/10/2013
Aceptado: 16/12/2013
Resumen
El objetivo de este trabajo fue caracterizar las inmunoglobulinas séricas y la IgY de la yema de huevo de ñandú, a través de las técnicas de electroforesis en acetato de celulosa, electroforesis en gel de poliacrilamida y Western-blot. Se estudiaron 19 ñandúes clínicamente sanos de 14 a 15 meses de edad, provenientes un criadero de Balcarce, Argentina. La electroforesis en acetato de celulosa de los sueros mostró la presencia de cuatro fracciones proteicas: albúmina, alfa, beta y gamma globulinas. La concentración de las gamma globulinas fue de 0,69 ± 0,18 g/dl, con un rango de 0,42-1,05 g/dl. La corrida electroforética de la IgY muestró que esta se ubica en la fracción gammaglobulínica. La electroforesis en gel de poliacrilamida evidenció, tanto en suero como en IgY purificada, dos bandas proteicas con un peso molecular de aproximadamente 65 y 25 kD, compatibles con cadena pesada y liviana de la IgY. Se produjo un anti-IgY en cabra, que reconoció la banda de aproximadamente 65 kD en el Western-blot, tanto en el suero como en la IgY purificada. Este suero anti-IgY podría utilizase como herramienta diagnóstica para estudiar la circulación de agentes causantes de enfermedades infecciosas.
Palabras clave: Ãandú; Electroforesis; SDS-PAGE ; Western-blot; LgY.
Characterization of Rhea americana immunoglobulins
Summary
The aim of this work was to characterize the serum immunoglobulins and egg-yolk IgY from ñandú (Rhea americana), by cellulose acetate electrophoresis, polyacrylamide gel electrophoresis and Westernblot. Nineteen clinically-healthy birds, 14 to 15 month-old were studied, belonging to a farm placed in Balcarce, Buenos Aires province, Argentina. Cellulose acetate electrophoresis showed that four protein fractions were present in serum: albumin, alpha, beta and gammaglobulins. Gammaglobulin concentration was 0.69 ± 0.18 g/dl, with a range of 0.42-1.05 g/dl. Electrophoresis of IgY showed that this immunoglobulin runs together with gammaglobulins. Polyacrylamide gel electrophoresis showed two protein bands with an approximate molecular weight of 65 and 25 kD, compatible with IgY heavy and light chain, that could be seen in serum as well as in purified IgY. A goat anti-ñandú IgY was produced and utilized in a Western-blot, in which it recognized a 65 kD-protein band, both in serum and in purified IgY. This anti-IgY could allow the development of diagnostic tools to study the presence of the causative agents of infectious diseases in Rhea populations.
Key words: Rhea americana; Electrophoresis; SDS-PAGE; Western-blot; LgY.
Introducción
El ñandú común (Rhea americana) es un ave no voladora (ratite) autóctona de Sudamérica. En Argentina es una especie amenazada según la categorización del apéndice II de la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (CITES II; accesible on-line en http:// www.cites.org). Durante los años ´80 y ´90, comenzó a desarrollarse su cría en cautiverio, y en la actualidad se explota en diferentes regiones de Argentina, Brasil, Chile y Uruguay22. En la Argentina se están haciendo esfuerzos por valorizar a esta especie como un recurso sostenible, ya que sus productos (carne, aceite, cuero y plumas) tienen demanda en mercados en crecimiento como el de la Comunidad Europea y Asia, tal como lo ha informado la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO ) en 199918. La cría en cautiverio del ñandú no sólo generaría un beneficio económico sostenido basado en un recurso natural, sino también la ventaja adicional de fomentar su conservación22. Para poder realizar una cría racional de esta especie, se hace necesario conocer sus órganos y sistemas fisiológicos, dentro de los cuales está el sistema inmune.
Las inmunoglobulinas constituyen uno de los principales mecanismos de defensa inmunológica. En las aves se sintetizan Inmunoglobulina M (IgM) e Inmunoglobulina A (IgA) al igual que en los mamíferos y una tercera inmunoglobulina llamada Inmunoglobulina Y (IgY), que se asemeja a la Inmunoglobulina G (IgG) de los mamíferos en su distribución, concentración e importancia funcional: es el anticuerpo más abundante en el suero de todas las aves estudiadas hasta el momento, y se lo considera el principal anticuerpo de defensa contra las infecciones sistémicas. La IgY, a su vez, es la inmunoglobulina presente en la yema de huevo y constituye la fuente de anticuerpos que protege al pichón en los primeros días de vida5. Se transfiere al huevo a través del epitelio folicular por un mecanismo activo que probablemente esté mediado por un receptor para la porción Fc10. A excepción del pollo y del pato, se conoce muy poco sobre las inmunoglobulinas de las aves. En las ratites existen escasos y parciales trabajos sobre el tema. Cadman et al.2,3 separaron por cromatografía dos fracciones del suero de cinco avestruces homologables con la IgG e IgM de los mamíferos y produjeron un suero específico contra lo que definieron como "IgG" del avestruz sin que se haya podido encontrar menciones bibliográficas de su utilización. Ramayo et al.15 encontraron que no había reactividad cruzada entre anticuerpos comerciales anti-IgM, anti- IgA y anti-IgY de pollo y las Igs del suero de ñandú. Conrado et al.4 y Esteves Almeida et al.6, publicaron datos sobre el perfil electroforético de ñandúes estudiados en Brasil, mientras que Uhart et al.22 informaron las concentraciones de globulinas totales halladas en el contexto de un relevamiento sanitario realizado en la zona de Entre Ríos, Argentina.
El conocimiento de las inmunoglobulinas de los mamíferos y de las especies domésticas en general, ha permitido el desarrollo de técnicas serológicas de diagnóstico que permiten monitorear la presencia de enfermedades inmunológicas en una población. Esta es una deuda con especies de menor impacto económico como el ñandú. Esto dificulta la evaluación de la funcionalidad de la rama humoral del sistema inmune. Además, determina que los relevamientos epidemiológicos que se puedan llevar a cabo, sean hechos mediante pruebas de seroneutralización, inhibición de la hemoaglutinación o ELISA competitivo, que son costosas y de aplicación limitada solo a algunos patógenos.12,17,20,21
El objetivo del presente trabajo fue caracterizar las inmunoglobulinas del suero y de la yema de huevo del ñandú, que incluyó la producción de un antisuero específico para la IgY. Esta anti-IgY de ñandú podría utilizarse para desarrollar técnicas más sencillas y económicas para el diagnóstico de enfermedades infecciosas y parasitarias a través de la identificación de la respuesta inmune al patógeno.
Materiales y métodos
Animales
Se estudiaron diecinueve ñandúes clínicamente sanos de 14 a 15 meses de edad, que aun no habían alcanzado la madurez sexual, provenientes del criadero de ñandúes Pampa Cuyén (Balcarce, provincia de Buenos Aires). En ese establecimiento los animales se mantienen sobre pasturas de gramíneas y leguminosas y se les suministra un complemento diario de maíz molido y extrusado-prensado de soja, mezclados en una proporción 4:1.
Muestras
Se obtuvieron muestras de suero a partir de sangre sin anticoagulante, extraída por punción de la vena braquial del ala. Se obtuvo además la yema de huevos de reciente postura.
Determinación de la concentración de proteínas totales
El nivel de proteínas de cada suero se determinó mediante el sistema Proti 2® (Wiener Laboratorios S.A.I.C., Rosario, Argentina), siguiendo las instrucciones del fabricante. Este es un método colorimétrico para la determinación de proteínas totales basado en la reactividad de los puentes peptídicos proteicos con el ion cúprico en un medio alcalino.
Purificación de la IgY a partir de la yema de huevo
La purificación se realizó por precipitación con polietilenglicol 6000 (PEG 6000) siguiendo la técnica descrita previamente14. El pellet obtenido se resuspendió en PBS y se dializó durante tres días frente a PBS, a 4ºC.
Caracterización de los sueros y de la IgY de yema de huevo por electroforesis
Electroforesis en acetato de celulosa. Se realizó según la técnica descrita previamente,1 aplicando una corriente de 150 Volt durante 45 minutos. Las tiras se colorearon con una solución de negro amido B; los proteinogramas, con los valores relativos (%) de cada fracción proteica, se obtuvieron por lectura densitométrica; los valores absolutos (g/dl) se calcularon relacionando el porcentaje de cada fracción con el dato de proteínas totales obtenido por colorimetría.
Electroforesis en gel de poliacrilamida (SDSPAGE). Los sueros y la IgY se corrieron en geles de poliacrilamida al 12% en condiciones reductoras, siguiendo la técnica ya descrita.9
Producción y evaluación de anti-IgY
Producción. A fin de obtener un antisuero específico, se inmunizó una cabra con la IgY purificada por precipitación con PEG 6000. El inóculo consistió en 1 ml de suspensión compuesto por partes iguales de IgY (150 μg de proteína en PBS) y adyuvante (hidróxido de aluminio y magnesio, Imject Alum®, Pierce Protein Biology Products, Thermo Scientific, Rockford, EEUU). Se realizaron tres inoculaciones por vía subcutánea los días 0, 14 y 28 y se efectuaron extracciones periódicas para titular los anticuerpos. Se extrajo sangre para la preparación del antisuero a los quince días de la última inoculación (semana 6 del esquema de inmunización), momento en el que se obtuvo un título satisfactorio. Todo el procedimiento contó con la aprobación del Comité Institucional de Cuidado y Uso de Animales de Laboratorio (CICUAL) de la Facultad de Ciencias Veterinarias de la UBA.
A partir del suero obtenido la semana 6, se purificaron las inmunoglobulinas totales mediante dos precipitaciones consecutivas con 33% de sulfato de amonio, de acuerdo a la técnica descrita previamente9. El precipitado se resuspendió en PBS y se centrifugó en columnas Amicon® Ultra, con membranas de un umbral de filtración de 100 kD (Ultracel® 100K, Millipore Ltd., Cork, Irlanda). El concentrado obtenido se sometió al proceso de diafiltración, que consiste en volver a resuspender y centrifugar para extraer los residuos salinos de la preparación proteica. El grado de purificación se determinó por electroforesis en acetato de celulosa, siguiendo el procedimiento ya descrito.
Evaluación. El título de anticuerpos específicos se determinó por enzimoinmunoensayo (ELISA). Brevemente, las placas de poliestireno (Microlon Plate, Greiner Bio-One, Neuburg, Alemania) se sensibilizaron con un pool de suero de ñandúes en dilución 1:100 en buffer carbonato-bicarbonato pH 9,2 durante 1 h a 37 ºC y se bloquearon con 10 % de leche en polvo en PBS pH 7,2 durante 16 h a 4 ºC. El anti-IgY se probó en dilución seriada en base 2; como segundo anticuerpo se utilizó un anti-Igs de cabra producido en conejo, conjugado con peroxidasa (Dako A/S, Glostrup, Dinamarca) en dilución 1:1000. La reacción se reveló con o-fenilendiamina (OPD; Sigma- Aldrich, St. Louis, EEUU), se frenó con ácido sulfúrico 1 M y se leyó en espectrofotómetro a 490 nm. El suero del día 0, extraído previo a la inmunización, se utilizó como control negativo. El título se expresó como la inversa de la dilución del anti-IgY que arrojó una densidad óptica 6 veces mayor a la del control negativo.
Caracterización de los sueros y de la IgY de yema de huevo por Western-blot
La técnica de inmunoblot (Westernblot) se efectuó de acuerdo a lo descrito en la bibliografía.9 Brevemente, los sueros de ñandúes y la IgY purificada se corrieron en un gel de poliacrilamida al 8 % en condiciones reductoras. La transferencia se efectuó a una membrana de nitrocelulosa con un poro de 0,45 μm (Trans- Blot® Transfer Medium, Bio-Rad Laboratories, Hercules, EEUU) durante 16 h a 65 Volt y a 4 ºC. La membrana se bloqueó con leche en polvo al 10 % en PBS. Como primer anticuerpo se utilizó el anti-IgY diluido 1:500 y como segundo anticuerpo, un anti-Igs de cabra producido en conejo, conjugado con peroxidasa (Dako A/S) a dilución 1:1000, durante 1 h a 37 ºC. La reacción se reveló con tetrahidroxicloruro de 3,3-diamino bencidina (DAB; Bio-Rad).
Resultados
Electroforesis en acetato de celulosa
Las corridas electroforéticas de los sueros mostraron la presencia de cuatro fracciones proteicas: albúmina, alfa, beta y gamma globulinas. Las corridas electroforéticas de dos sueros y sus respectivos proteinogramas se muestran en la Figura 1. Los valores relativos y absolutos de cada fracción se presentan en la Tabla 1, expresados como media aritmética y desviación estándar, y rango. La corrida electroforética de la IgY purificada muestró que esta se ubica en la fracción gamma globulínica (Figura 2).

Figura 1. Corrida electroforética y proteinograma de dos sueros normales de ñandú. En la tabla inferior se indican los valores obtenidos (%) y calculados (g/dl) para cada fracción.

Figura 2. Corridas electroforéticas de suero y de IgY precipitada con PEG 6000. 1, 3: Suero normal de ñandú; 2: IgY de ñandú purificada por precipitación con PEG 6000. A: albúmina; a: alfaglobulinas; Ã: betaglobulinas; γ: gammaglobulinas.
Tabla 1. Valores de proteínas totales y de cada fracción proteica obtenidos en 19 ñandúes adultos.
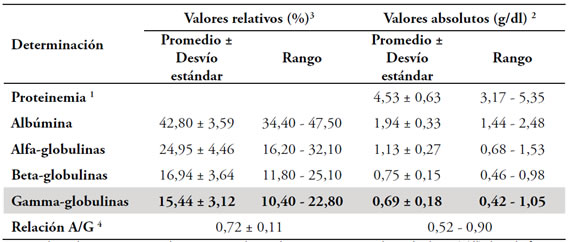
1. Los valores de proteinemia se obtuvieron por el método Proti-2®; 2. Los valores absolutos (g/dl) de cada fracción se obtuvieron por cálculo aritmético a partir del valor de proteinemia y del porcentaje de cada fracción proteica; 3. Los porcentajes de cada fracción se determinaron a través de la lectura densitométrica de las corridas electroforéticas (proteinograma); 4. Relación A/G: Relación Albúmina/Globulina.
Electroforesis en gel de poliacrilamida (SDSPAGE)
La corrida en condiciones reductoras permitió separar dos bandas proteicas que se ubicaron en las regiones de peso molecular de aproximadamente 65 y 25 kD, compatibles con la cadena pesada y liviana de la IgY, respectivamente. Esta imagen se evidenció tanto en el caso del suero como de la IgY purificada. La Figura 3 muestra la imagen de un SDSPAGE correspondiente a seis sueros y a la IgY purificada.
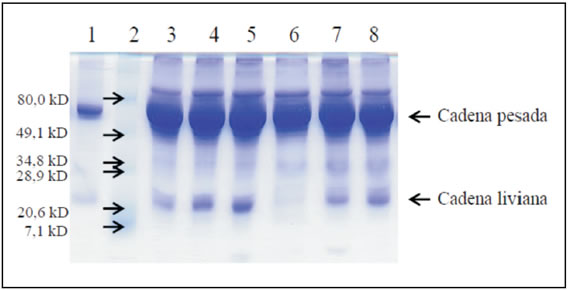
Figura 3. Electroforesis en gel de poliacrilamida (SDS-PAGE ) del suero de ñandú y de la IgY purificada de yema de huevo. Calle 1: IgY de yema de huevo precipitada con PEG 6000; calle 2: Marcador de peso molecular (Pre-stained broad range SDS-PAGE standards, Bio-Rad); calles 3-8: Sueros de ñandú.
ELISA y Western-blot
El anti-IgY elaborado a partir del suero de la cabra inmunizada, correspondiente a la semana 6 del plan de inmunización, arrojó un título por ELISA de 6400.
Se pudo determinar que este anti-IgY reconoce una banda de proteína que se ubica en las región de peso molecular de aproximadamente 65 kD. Esta banda, compatible con la cadena pesada de la IgY, se observó tanto en la muestra de IgY purificada como de suero (Figura 4).

Figura 4. Western-blot del suero de ñandú y de la IgY purificada de yema de huevo. a: SDS-PAGE ; b: Western-blot. Línea 1: IgY purificada a partir de yema de huevo; línea 2: suero de ñandú; línea 3: marcador de peso molecular (Pre-stained broad range SDS-PAGE standards, Bio-Rad).
Discusión
La electroforesis de los sueros en acetato de celulosa permitió separar las proteínas séricas en las cuatro fracciones características: albúmina, y alfa, beta y gamma globulinas. Estos resultados coinciden con estudios similares llevados a cabo en pollos parrilleros8 y en gallinas ponedoras7.
Cuando comparamos las concentraciones de las proteínas séricas obtenidas en nuestro estudio con las informadas por otros investigadores, y nos concentramos en las gammaglobulinas, podemos advertir algunas diferencias. Así, por ejemplo, en Brasil, Estevez Almeida et al.6 muestran valores más dispersos de gammaglobulinemia, con un rango (0,25 a 1,91 g/dl) mayor al hallado en nuestro trabajo, pero dentro del cual están incluidos todos nuestros valores. Por el contrario, el trabajo de Conrado et al.4 informa valores de concentración de gammaglobulinas en sangre (0,35 ± 0,07) inferiores a los nuestros y a los del grupo de Estevez Almeida.6 En Argentina, Uhart et al.22, en la Universidad Nacional de Córdoba, efectuó diversas determinaciones en un grupo de ñandúes silvestres, que no incluyeron la concentración de gammaglobulinas pero sí del nivel de globulinas totales. La concentración que se informa (1,5 a 2,6 g/dl) es menor a la hallada en nuestro trabajo (1,56 a 3,56 g/dl). Las diferencias encontradas podrían tener relación con las características propias de la población estudiada, como ser aquellas que dependen de la genética, el ambiente o el manejo productivo, pero también podrían deberse a diferencias en el método de cuantificación proteica.
La IgY se considera el equivalente en las aves de la IgG de los mamíferos, en cuanto a su concentración en suero, su distribución y su función en la protección del huésped y de su cría.5 En nuestro trabajo se observó que la IgY del ñandú migra en la región gammaglobulínica, al igual que la IgY del pollo (datos no mostrados) y la IgG de los mamíferos. La electroforesis en geles de poliacrilamida (SDS-PAGE ) de la IgY purificada mostró dos bandas características a la altura de 65 y 25 kDa que corresponderían a la cadena pesada (ípsilon) y a la cadena liviana de la IgY. El SDS-PAGE de los sueros muestró el mismo patrón de bandas: En las aves, la albúmina sérica tiene igual peso molecular que la cadena pesada ípsilon (65 KDa),13 y por lo tanto ambas moléculas se ubican a la misma altura en el gel. Aunque la albúmina sérica también está presente en pequeñas cantidades en la yema de huevo,13 el control de pureza de la IgY mostró una única banda en la región de las gammaglobulinas al realizar la electroforesis en acetato de celulosa, aun cuando se utilizó la tinción argéntica, cuya mayor sensibilidad permite identificar entre 1 y 10 ng de proteína9 (dato no mostrado). De este modo se pudo confirmar la ausencia de albúmina en la IgY purificada, que a su vez se utilizó como inóculo para la obtención del suero anti-IgY en cabra. Así, se puede inferir que la banda observada a la altura de 65 KDa en el PAGE y reconocida por el anti-IgY en el Western-blot es la cadena pesada ípsilon. En el caso de los sueros, la albúmina posiblemente forme parte de la banda gruesa que se observa a esta misma altura en el SDSPAGE (Figura 3).
En los mamíferos, las cadenas pesadas de las dos inmunoglobulinas principales del suero, IgM (cadena μ) e IgG (cadena γ) tienen pesos moleculares (PM) muy distintos, porque la cadena μ posee cuatro dominios constantes mientras que la cadena γ solo posee tres. En el pollo, la cadena pesada Ï
de la IgY tiene también cuatro dominios constantes, por lo que las cadenas pesadas de la IgM (70 kDa) y la IgY (67 kDa) tienen PM similares, indistinguibles por SDS-PAGE.16 En el pato, la cadena μ tiene un PM de 86 kDa, mientras que el PM de la cadena Ï
es similar a la del pollo. En esta especie, en el ganso, y en el cisne (ánades) existe además una forma de IgY truncada (ÎIgY) de aproximadamente 30 kDa11. La situación en el ñandú era desconocida hasta el momento. En un trabajo llevado a cabo en nuestro laboratorio19. se pudo determinar que el ñandú está filogenéticamente más cerca del pato que del pollo. En el presente estudio, se intentó determinar si en el ñandú existen, como en las ánades, diferencias entre las cadenas pesadas de las inmunoglobulinas séricas. Cuando se realizó el SDS-PAGE con acrilamida al 12 % (Figura 3) no se identificó una cadena truncada de IgY, la que sí pudo verse en sueros de gansos (dato no mostrado). Se concluye entonces que el ñandú carece de la forma ÎIgY. El SDS-PAGE con 8% de acrilamida y el subsiguiente Western blot se realizaron con el objetivo de separar en el gel, las cadenas pesadas de la IgM y la IgY, si existieran diferencias moleculares evidentes. El Western-blot mostró una banda a la altura de los 65 kDa, que se debe al reconocimiento de la cadena pesada de la IgY por parte del anti-IgY (Figura 4).Las imágenes obtenidas no permiten sacar resultados concluyentes, por lo que es necesario continuar la evaluación con diferentes condiciones de corrida.
El manejo sanitario de una población requiere conocer los valores normales de parámetros que son indicadores del estado de salud. En el caso que nos ocupa, por ejemplo, una modificación en los niveles de gammaglobulinas puede alertar sobre la posibilidad de enfermedad. Esto es particularmente importante en la conservación de las aves silvestres, tanto de aves criadas en cautiverio para ser reintroducidas en su hábitat natural con fines de repoblamiento, como de aves que han sido recientemente capturadas para ser criadas en cautiverio. Por esto, es nuestro objetivo continuar los estudios en los ñandúes, sobre las características del sistema inmune en general, y de sus inmunogobulinas en particular.
Conclusiones
Los resultados informados en este trabajo no sólo constituyen un conocimiento científico, sino que aportarían herramientas aplicables al diagnóstico de enfermedades infecciosas y parasitarias y a la evaluación del estado sanitario de esta especie aviar. Asimismo, ayudaría a evidenciar la presencia de otro tipo de enfermedades, tales como procesos tumorales, autoinmunes y genéticos, capaces de producir alteraciones en los valores inmunológicos normales, como por ejemplo los niveles séricos de las gammaglobulinas. Además, facilitaría la evaluación de la funcionalidad de la rama humoral del sistema inmune.
Agradecimientos: Agradecemos el asesoramiento del Dr. Juan Claver, Profesor de la Cátedra de Histología de la FCV, UBA; agradecemos también al Dr. Juan Claver, al Sr. Marcelo Santo, al Ing. Agr. Maceira (h) y a la Srta. Alejandra Feld, por la colaboración prestada en la sujeción de los ñandúes y la extracción de sangre. Este trabajo fue subsidiado por la Facultad de Ciencias Veterinarias a través de la Fundación FUNDAVET (Nov 2011- Ago 2012) y por la Universidad de Buenos Aires (Subsidio UBACyT 20020110200169 - Programación Científica 2012-2014).
1. Barta, O.; Arnold, DF.; Electrophoresis. En: Barta, O. (ed). Monographs in Animal Immunology, Veterinary Clinical Immunology Laboratory. Bar-Lab, Inc. 1993; Chapter C1, pp C1-1 - C1-17 [ Links ]
2. Cadman, HF.; Kelly, PJ.; Dikanifura, M.; Carter, SD.; Azwai, SM.; Wright, EP. Isolation and characterization of serum immunoglobulin classes of the ostrich (Struthio camelus). Avian Dis 1994a; 38: 616-20. [ Links ]
3. Cadman, HF.; Kelly, PJ.; Zhou, R.; Davelaar, F.; Mason, PR. A serosurvey using enzyme-linked immunosorbent assay for antibodies against poultry pathogens in ostriches (Struthio camelus) from Zimbabwe. Avian Dis 1994b; 38: 621-5. [ Links ]
4. Conrado, AC.; Lopes, STA.; Martins, DB.; et al. Electroforese das proteínas plasmáticas em emas (Rhea americana) de diferentes faixas etárias. Ciencia Rural, Santa María. 2007; 37: 1033-8. [ Links ]
5. Davison, F.; Magor, KE.; Kaspers, B. Structure and Evolution of Avian Immunoglobulins. In: Avian Immunology. Fred Davison, Bernd Kaspers and Karel A. Schat, Editors. Academic Press. London, UK. 2008; 107-27. [ Links ]
6. Esteves Almeida, C.; Bach, BC.; Lovato Flores, M.; Pereira Fontoura, R.; Dickel Segabinazi, S.; Carlesso Aita, MH. Evaluation of serum protein electrophoresis in greater rhea (Rhea americana Linnaeus, 1758). Eur J Wildl Res 2010; 56: 101-4. [ Links ]
7. FilipoviÄ, N.; StojeviÄ, Z.; MilinkoviÄ-Tur, S.; Beer LjubiÄ, B.; Zdelar-Tuk, M. Changes in concentration and fractions of blood serum proteins of chickens during fattening. Veterinarski Arhiv. 2007; 77: 319-26, [ Links ]
8. Hasegawa, MY.; Fonteque, JH.; Kohayagawa, A.; Boretti, LP. Avaliação do perfil eletroforético das proteínas séricas em matrizes pesadas (Gallus Gallus domesticus) da Linhagem Avian Farm. Revista Brasileira de Ciência Avícola. 2002; 4: 203-7. [ Links ]
9. Harlow, E.; Lane, D. Cap12: Immunoblotting. En: Antibodies. Ed Cold Spring Harbor Laboratory: a laboratory manual, New York, EEUU. 1988; 485-92. [ Links ]
10. Liu, SS.; Higgins, DA. Yolk-sac transmission and post-hatching ontogeny of serum immunoglobulins in the duck (Anas platyrhynchos). Comp. Biochem. Physiol. 1990; 97B: 637-44. [ Links ]
11. Magor, KE. Immunoglobulin genetics and antibody responses to infuenza in ducks (Review). Dev Compe Immunol. 2011; 35: 1008-17 [ Links ]
12. Moro De Sousa RL, Montassier HJ, Pinto AA. Detection and quantification of antibodies to Newcastle disease virus in ostrich and rhea sera using a liquid phase blocking Enzyme-Linked Immunosorbent Assay. Clin Diagn Lab Immunol 2000; 7: 940-4. [ Links ]
13. Nilsson, L.; Osmark, P.; Fernandez, CL.; Bergenstahl, BR. Competitive Adsorption of Proteins from Total Hen Egg Yolk during Emulsification. J. Agric. Food Chem. 2007; 55: 6746-53. [ Links ]
14. Pauly, D.; Chacana, PA.; Calzado, EG.; Brembs, B.; Schade, R. IgY Technology: Extraction of Chicken Antibodies from Egg Yolk by Polyethylene Glycol (PEG) Precipitation. JoVE. 2011; 51. http://www.jove.com/ details.php?id=3084, doi: 10.3791/3084. [ Links ]
15. Ramayo, LG.; Huguet, MJ.; Silvestro, C.; Jar, AM. Estudio de la reactividad cruzada entre los anticuerpos anti-IgA, anti-IgM y anti-IgY de pollo y las inmunoglobulinas del suero de ñandú (Rhea americana). IV Jornadas y Reunión Anual de la Asociación Argentina de Inmunología Veterinaria, 2011, Resumen PII9, p. 90, Río Cuarto, Córdoba. [ Links ]
16. Ratcliffe, MJH. Antibodies, immunoglobulin genes and the bursa of Fabricius in chicken B-cell development. Dev Comp Immunol. 2006: 30: 101-18. [ Links ]
17. Sakai, K.; Sakabe, G.; Tani, O.; Nakamura, M.; Takehara, K. Antibodies responses in ostriches (Struthio camelus) vaccinated with commercial live and killed Newcastle disease vaccines. J Vet Med Sci 2006; 68: 627-9. [ Links ]
18. Sarasqueta, DV. Cría Experimental de Ãandúes en Cautividad (Rhea pennata). En: Iriarte A, Tala C, Gonzalez B, Zapata B, Gonzalez G, editors. Cría en Cautividad de Fauna Chilena. Santiago, Chile, 2004, p. 147-71. [ Links ]
19. Silvestro, CA.; Huguet, MJ.; Miño, OS.; et al. Primeras secuencias genómicas de Apolipoproteínas en Ãandú y Choique. Invet Investigación Veterinaria 2011: 13 (1): 63-9. [ Links ]
20. Thompson, PN.; Sinclair, M.; Ganzevoort, B. Risk factors for seropositivity to H5 avian influenza virus in ostrich farms in the Western Cape Province, South Africa. Prev Vet Med. 2008; 86: 139-52. [ Links ]
21. Toffan, A.; Olivier, A.; Mancin, M.; et al. Evaluation of different serological tests for the detection of antibodies against highly pathogenic avian influenza in experimentally infected ostriches (Struthio camelus). 2010; 39:11-5. [ Links ]
22. Uhart, M.; Aprile, G.; Beldomenico, P.; et al. Evaluation of the health of free-ranging greater rheas (Rhea americana) in Argentina. Vet Rec 2006; 158: 297-303C. [ Links ]














