Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
InVet
On-line version ISSN 1668-3498
InVet vol.15 no.2 Ciudad Autónoma de Buenos Aires Dec. 2013
ARTÍCULO DE INVESTIGACIÓN
Eficacia de la combinación de dos nucleósidos inhibidores de la transcriptasa inversa con un no-nucleósido, en gatos infectados por el Virus de la Inmunodeficiencia felina
Gómez, N.1; Fontanals, A.2; Castillo, V.3; Mira, G.3; Gisbert, M.A.1; Suraniti, A.1; Passeri, C.1
1Cátedra Clínica Médica de Animales Pequeños.
2Cátedra de Inmunología.
3Cátedra de Patología Clínica. Facultad de Ciencias Veterinarias. Universidad de Buenos Aires. Chorroarín 280 (1427) C.A.B.A.
Correspondencia e-mail: Nélida Gómez ngomez@fvet.uba.ar
Recibido: 10/04/2013
Aceptado: 07/05/2014
Resumen
El principal objetivo de este trabajo consiste en poner en evidencia los beneficios del tratamiento de gatos infectados por el Virus de la Inmunodeficiencia Felina, con combinaciones de drogas anti-retrovirales Zidovudina (ZDV) + Lamivudina (3TC) + Nevirapina (Nevi), comparados con la administración de una mono-droga Zidovudina (ZDV). Se confrontaron dichos tratamientos en la etapa asintomática y en la fase final de la enfermedad. Los gatos fueron evaluados durante un año por medio del examen clínico, hemograma, pruebas bioquímicas, carga viral, relación de linfocitos T CD4+/CD8+ y los potenciales visuales y auditivos evocados. Según los resultados presentados, la combinación ZDV+3TC+Nevi es más eficaz que la ZDV sola, para reducir la carga viral, aumentar la relación CD4+/CD8+ y hacer remitir los signos clínicos de los gatos cursando la etapa de portador asintomático. En la etapa de SIDA la diferencia entre ambas terapias no fue tan marcada; sin embargo, la combinación fue más eficiente respecto de la ZDV sola para mejorar el cuadro y los parámetros evaluados. Los potenciales visuales y auditivos evocados pusieron en evidencia la enfermedad neurológica aún en gatos sin signos neurológicos y resultaron útiles para evaluar la evolución de los pacientes con los dos protocolos confrontados.
Palabras clave: VIF; Antirretrovirales; Etapa asintomática; Etapa de SIDA felino; Zidovudina; Lamivudina; Nevirapina.
Efficacy of a combination of two nucleoside and one non-nucleoside reverse transcriptase inhibitors in Feline Immunodeficiency Virus-naturally infected cats, during the last stages of the disease
Summary
The aim of this study was to report the comparative results using combined antiviral drugs on naturally-infected FIV cats in the asymptomatic and AIDS stages of the disease. The drug combinations evaluated were zidovudine (ZDV) alone and ZDV + lamivudine (3TC) +Nevirapine. Plasma viral load was measured at the beginning of treatment and at one year. Total leucocytes, neutrophils and lymphocyte counts, CD4+/CD8+ ratios and biochemical profile values were also analyzed. Neurological disease was evaluated by evoked potentials determinations. The results showed a better efficacy of the combined therapy vs. ZDV alone, reducing the viral load, increasing the CD4+/CD8+ ratio and improving the clinical signs in the asymptomatic stage. In the AIDS stage the differences between both protocols were not so marked, but the combined therapy produced better results compared with ZDV alone. The auditory and visual evoked potentials put on evidence the neurological disease, even in cats without neurologic signs and were useful to evaluate the evolution of the patients with both protocols contrasted.
Key words: FIV; Antiretrovirals; Asymptomatic stage; AIDS stage; Zidovudine; Lamivudine; Nevirapine.
Introducción
El virus de la inmunodeficiencia felina (VIF) es un virus T-linfotrópico que pertenece a la familia Retroviridae, género Lentivirus1,2,9. Se replica en los linfocitos T CD4+ y CD8+, linfocitos B, monocitos, macrófagos y otras células de esta estirpe como son los astrocitos y las células de la microglia4,12,21. En los gatos VIF+ las anomalías inmunológicas primordiales son la reducción del número de linfocitos T CD4+ circulantes y de la relación CD4+/CD8+, los que juegan un importante papel en la respuesta inmune para identificar y destruir las bacterias, hongos y virus4,7,16,19,21. Esta enfermedad viral, caracterizada por su cronicidad puede subdividirse en tres etapas:
1- Fase aguda: dura 4 a 6 semanas hasta algunos meses, puede pasar desapercibida o presentarse con signos inespecíficos, hay disminución de neutrófilos y aumento de los linfocitos T CD8+7,8, 9.
2- Fase de portador asintomático: dura de meses a años. No se detectan signos clínicos severos, la relación de linfocitos T CD4+/CD8+, si bien se encuentra en valores normales (> a 0,9) tiende a descender paulatinamente y se detecta hipergamaglobulinemia. Los signos clínicos son: fiebre recurrente, gingivitis, leucopenia, linfoadenopatía, anorexia, pérdida de peso intermitente, etc. La carga viral oscila en valores de 105 a 106 copias/ml7,8,9,14,16,24.
3- Fase de SIDA: la depleción de linfocitos es mucho mayor, CD4+/CD8+ < 0,9, a expensas de la disminución marcada de los linfocitos T CD4+ y la carga viral se encuentra a razón de 107 a 1011 copias por ml. Se manifiestan infecciones crónicas no-oportunistas tales como gingivitis, enfermedades respiratorias, infecciones crónicas de piel, neurológicas, renales, oftalmológicas, etc.7,8,9. Al descender más la relación CD4+/CD8+ (<0,6) se produce el Síndrome de Inmunodeficiencia Adquirida (SIDA) en el que se detectan infecciones oportunistas: Toxoplasmosis, Hemobartonellosis, Calicivirosis, Leucemia Felina, Sarna, Criptococosis, Tuberculosis, etc.14,15. También los tumores son considerados como oportunistas, especialmente los que se manifiestan en la cabeza7,8.
Desde la aparición del Virus de la Inmunodeficiencia Humana (VIH) se han detectado mejores resultados al combinar drogas, que actúan a nivel de los puntos críticos del ciclo de replicación viral: la entrada del virus a la célula, la transcripción inversa de su genoma, la integración del genoma viral al genoma celular y el ensamble de las proteínas virales2,7,8.9,22. Estas combinaciones son conocidas como "terapia antirretroviral de elevada eficiencia" o HAART (Highly Active Antiretroviral Therapy) 2,3,5,7,10,22.
El grupo de drogas que actúan inhibiendo a la transcriptasa reversa (inhibidores nucleósidos y no-nucleósidos) evitan la conversión de ARN viral a ADN viral. Estos grupos de drogas han sido evaluadas en el tratamiento de VIF2,13,14,23. La Zidovudina (ZDV) es un análogo nucleósido muy estudiado en el gato, con buena tolerancia en esta especie. Con este tratamiento se reduce el número de copias virales y mejora el estado clínico del paciente7,8,9. La droga Lamivudina (3TC) es otro análogo nucleósido con capacidad de revertir las mutaciones virales indeseadas causadas por el ZDV y combinada con ella, permite que la actividad antiviral se mantenga por más tiempo, actuando en forma sinérgica3,7. Otro inhibidor de la transcriptasa inversa, pero del grupo de los no-nucleósidos, es la Nevirapina (Nevi) que es efectiva para disminuir la carga viral y mejorar los signos neurológicos, pues atraviesa la barrera hematoencefálica3,20.
La combinación de drogas: ZDV+3TC+Nevi es empleada en la mujer embarazada e infectada por HIV y en los bebés infectados debido a la capacidad de dicha combinación de disminuir la carga viral con más eficiencia que las drogas separadamente, con baja toxicidad y buena llegada al SNC20. Esta combinación, hasta el presente proyecto, no había sido probada en gatos infectados espontáneamente.
El SNC actúa como un reservorio de VIF, pues queda protegido de las drogas anti-retrovirales y porque allí se replica más fácilmente, debido a que el SNC tiene una baja eficiencia en la respuesta frente a la infección, por ello resulta una fuente de re-infección para los tejidos periféricos6. El uso de compuestos con pobre penetración de la barrera hematoencefálica favorece no solo a la producción de virus en el SNC, sino que contribuye también a crear un medio adecuado para el desarrollo de resistencia a las drogas6. Las alteraciones neurológicas, si bien son frecuentes, en muchas ocasiones son asintomáticas6,9,17,18. Este hecho podría deberse a que las lesiones que produce VIF, a diferencia de HIV, son más leves y afectan a los macrófagos, astrocitos, microglia, pero no a las neuronas6. Por ello, la evaluación de los pacientes por medio de las técnicas para la determinación de los potenciales visuales y auditivos evocados y los electroencefalogramas pueden resultar útiles para predecir la enfermedad neurológica18.
El principal objetivo de este estudio consiste en reportar los resultados de la respuesta a la terapia con la combinación ZDV+3TC+Nevi comparados con los obtenidos con ZDV usada sola, en las etapas asintomática y de SIDA de gatos infectados en forma natural por el Virus de la Inmunodeficiencia Felina.
Materiales y métodos
1. Población en estudio:
Los gatos estudiados son pacientes del Hospital Escuela de la Facultad de Ciencias Veterinarias (FCV) de la Universidad de Buenos Aires. Se evaluaron 32 gatos, entre 6 y 10 años, con infección natural por VIF. Un 46% eran hembras y 54% machos, 80% de gatos mestizos y 20% de variadas razas puras y se integraron cuatro grupos:
Grupo ZDV: 8 gatos en la etapa asintomática, tratados con ZDV sola a razón de 5 mg/kg/12 h, oral, durante 1 año. Cabe aclarar que para este grupo y el siguiente se seleccionaron pacientes en la etapa final de la fase asintomática (Relación CD4+/CD8+ entre 0.7 y 1, signos clínicos inespecíficos y carga viral en ascenso).
Grupo ZDV+3TC+Nevi: 8 gatos en la etapa asintomática tratados con ZDV asociada con 3TC cada una a una dosis de 25 mg/kg/12 h y con Nevirapina (12 mg/ kg/12 h), oral, por 1 año.
Grupo ZDV: 8 gatos en la etapa final (SIDA), tratados con ZDV sola a razón de 5 mg/kg/12 h, oral, durante 1 año. En este grupo y siguiente se seleccionaron pacientes con cargas virales muy elevadas, relación CD4+/CD8+ < 0,6 y aparición de signos compatibles con la etapa.
Grupo ZDV+3TC+Nevi: 8 gatos en la etapa final (SIDA) tratados con ZDV asociada con 3TC cada una a una dosis de 25 mg/kg/12 h y con Nevirapina 12 mg/ kg/12 h, oral, por 1 año.
Todos los pacientes fueron evaluados por medio del examen físico y de laboratorio de rutina (hemograma, determinaciones bioquímicas), se examinaron para localizar infecciones oportunistas y en los casos necesarios, se recurrió a los estudios por imágenes. Se determinaron, además, la carga viral y la relación CD4+/CD8+ para estadificar9 a los pacientes y conformar los grupos. A los 6 meses y al año se evaluaron mediante hemogramas, pruebas bioquímicas, relación CD4+/CD8+ y la carga viral fue determinada nuevamente al año.
Además en todos los pacientes se llevaron a cabo las determinaciones de los potenciales visuales y auditivos evocados al inicio y al final del estudio.
2. Diagnóstico de la enfermedad:
El diagnóstico inicial se realizó usando un test comercial basado en la inmunocromatografía (SpeedDUO-Medicatec®). Una vez que los pacientes fueron recibidos para el estudio, la enfermedad fue confirmada por medio de una PCR, desarrollada previamente en nuestra institución8,9.
3. Pruebas complementarias de rutina:
Es importante hacer un hemograma completo pues en los pacientes VIF+ se encuentran con mucha frecuencia alteraciones de la serie roja y de la blanca. El método usado fue el de rutina del Laboratorio del Hospital Escuela. Se examinaron minuciosamente con el objeto de detectar la presencia de hemoparásitos, los que podrían afectar más severamente a estos pacientes. Las pruebas bioquímicas evaluadas fueron: proteínas totales, albúmina, urea, creatinina, hepatograma, etc. También se recurrió a los métodos de rutina del Servicio de Enfermedades Infecciosas de la FCV para descartar o confirmar la presencia de enfermedades oportunistas. En los casos necesarios se indicaron estudios de diagnóstico por imágenes e histopatología. Todos estos estudios se emplearon con el objeto de tener una idea completa del estado clínico de los pacientes y colaborar en la estadificación de los mismos.
4. Determinación de la relación CD4+/CD8+, por medio de citometría de flujo2,8,916,23,25:
Las muestras de sangre se recolectaron usando EDTA como anticoagulante. La capa de células mononucleares fue separada por medio de Histopaque (Sigma Diagnostics) y se marcaron las células con anticuerpos monoclonales: anti CD4+ antigen fluorescein-conjugated (Mouse anti cat CD4+-FI-, Serotec) y CD8+ antigen phycoerithrin-conjugated (Mouse anti Feline CD8+-ALPHA/BETA, RPE). Se evaluaron en un citómetro de flujo Becton Dickinson FAC-Scalibur, Becton Dickinson Biosciences en el Laboratorio Cassará (Buenos Aires, Argentina). Las muestras de sangre de 2cc con anticoagulante (EDTA) permitieron obtener una buena capa de células mononucleares. La sangre debe mantenerse en refrigeración (pero no congelación para que no se alteren las células) durante un máximo de 8-12 horas. La relación fue considerada anormal cuando resultó menor a 0,9 y se la midió en los pacientes de los cuatro grupos: al inicio, a los 6 meses y luego al año del inicio del tratamiento. Cuando este valor resultó menor de 0,6 se consideró al paciente en la etapa de SIDA.
5. Determinación de la Carga Viral (CV)9,10,11:
Para evaluar la CV se usó una técnica previamente descripta8,9. El ARN viral se detectó por medio de una PCR cuantitativa-competitiva. Se utilizaron 140 μl de plasma para extraer el ARN mediante el kit comercial QIAamp® Viral RNA (Qiagen) según las indicaciones de manufactura. La PCR cuantitativa competitiva se realizó mediante el uso del preparado comercial SuperScript⢠One-Step RT-PCR with Platinum Taq (Invitrogen). La región blanco amplificada consistió en una porción de 312 pb (gen gag de VIF). Para la construcción del templado competidor se eliminó la región central de la misma, aplicando PCR y ligación in vitro de los extremos, obteniéndose un nuevo fragmento de 98 pb. La PCR se llevó a cabo con 5 μl de templado competidor en diluciones seriadas, 40 pmoles de cada primer (771-f-AGAACCTGGTGATATACCAGAGAC y 1081-r- TTGGGTCAAGTGCTACATATT), 2 mM MgCl2, 100 UI de Recombinant RNA sin Ribonuclease Inhibitor (Promega) y 2 U de Taq DNA polimerasa. Se analizaron las bandas obtenidas del gel de agarosa (bromuro etídico) mediante la utilización de Image J 1.38x software (National Institute of Health, USA).
6. Evaluación de los Potenciales Visuales (PVE) y Auditivos Evocados (PAE):
Los potenciales evocados constituyen una respuesta a la estimulación visual o auditiva. Pueden usarse para verificar lesiones en el SNC. En los PAE de los gatos infectados por VIF, se puede observar la presencia de ondas de amplitud disminuida y latencias aumentadas. Este último hallazgo indica un defecto en el tiempo de conducción central (TCC). Por su parte, en los PVE la alteración más frecuente es la disminución de la onda P100. Estos parámetros fueron evaluados en el Servicio de Electrofisiología del Hospital Escuela de la Facultad de Ciencias Veterinarias (UBA) con un equipo ATI Nautilus17,18. Los PAE y PVE fueron medidos al comienzo y al final de este estudio en los cuatro grupos.
7. Evaluación ética:
El proyecto UBACyT 20020100100002, en el que está inscripto este trabajo fue aprobado por el Comité de Ãtica de la Facultad de Ciencias Veterinarias de la Universidad de Buenos Aires (CICUAL). Los propietarios dieron su consentimiento firmado.
8. Evaluación estadística:
Las variables fueron contrastadas por medio de test no paramétricos. La comparación intragrupo en cada fase se realizó por medio del test de Wilcoxon para muestras pareadas. La comparación entre grupos y entre los tiempos de ambas fases para un mismo tipo de tratamiento se llevó a cabo por medio del test de Mann- Whitney. El estudio de correlación fue realizado por medio del test de Spearman. Los datos se expresan como mediana y rangos con nivel de significación de p<0.05.
Resultados
1. Cuadro clínico de los pacientes:
En el grupo de pacientes en fase asintomática y de SIDA se observaron diversas alteraciones menores. La gingivitis, con grados de severidad variable, se diagnosticó en 14/16 gatos, en fase asintomática y 16/16 en la fase de SIDA. Como consecuencia de ésta lesión, algunos gatos presentaron dificultades para comer y pérdida de peso (pseudoanorexia). En 12/16 gatos asintomáticos y 14/16 en etapa de SIDA se presentaron linfoadenopatías. Cabe aclarar que las mismas no se traducían en el aumento de tamaño de todos los linfonódulos palpables, sino solo de algunos de ellos. Las superficies de los linfonódulos, a la palpación, se encontraban lobuladas e histopatológicamente se detectó hiperplasia de los mismos.
En la etapa asintomática, algunos gatos (5/16) evidenciaron cuadros de rinitis y sinusitis, 2/16 con cuadros leves de insuficiencia renal, 3/16 con diarrea crónica y 2/16 con conjuntivitis. Los resultados de laboratorio de rutina mostraron en todos los gatos hiper-globulinemia, en 3/12 anemia causada por Mycoplasma haemofelis, linfopenia en 11/16 y el resto de los parámetros bioquímicos se hallaron alterados en aquellos gatos con enfermedades concurrentes.
Se efectuó una clasificación de los pacientes con el siguiente score:

Todas estas manifestaciones remitieron con el inicio del tratamiento antiviral y en muy pocos casos fue necesario agregar otro tipo de terapia, con la excepción de los casos graves de gingivitis y con el objeto de que los pacientes se encontraran en mejores condiciones físicas al empezar a administrar los antivirales.
A modo de síntesis en la etapa asintomática, una gran proporción de gatos evidenciaron linfoadenopatías, gingivitis, hiperglobulinemia y linfopenia, estos signos deberían ser tenidos muy en cuenta para sospechar la enfermedad y recurrir al diagnóstico serológico. En menor medida se detectaron gatos con anemia por Mycoplasma haemofelis, la cual fue tratada antes del inicio del tratamiento. También se encontraron casos de rinitis-sinusitis, insuficiencia renal, diarrea crónica y conjuntivitis.
En los gatos cursando la etapa de SIDA, a lo largo del año de observación se detectaron cuadros de neumonía en 2/16 gatos, piodermias superficiales en 3/16, uveítis en 2/16 y anemia no regenerativa en 1/16. Desde el inicio, además se detectaron los signos neurológicos que se describen en el apartado 4.
En este estudio se diagnosticaron oportunistas en la fase de SIDA, en el grupo tratado con ZDV, en un caso durante el tratamiento y en la mayoría a posteriori de la terapia (Tabla 1).
Tabla 1. Oportunistas detectados en el grupo de pacientes en fase de SIDA tratados con ZDV.

Por su parte en el grupo de pacientes con SIDA, tratados con ZDV+3TC+Nevi, hasta 2 años después de iniciado el tratamiento no se han presentado oportunistas ni decesos.
2. Evolución de la relación CD4+/ CD8+
En la fase asintomática se observó incremento significativo de la relación CD4+/ CD8+ con el tratamiento combinado (p<0,01). En cambio, en los tratados con ZDV sola no se detectó significación (Fig. 1).

Figura1. Relación CD4/CD8 (b) en los grupos con combinación terapéutica y con ZDV sólo, en fase asintomática (símbolos llenos) y sintomática (símbolos blancos).Terapia combinada: círculos; ZDV sólo: cuadrados. Las diferencias entre la fase asintomática vs sintomática (SIDA) entre cada tiempo se expresan con símbolos. ***P<0,001 tiempo 0 asintomáticos vs 0 sintomático (SIDA) y tiempo 1 año asintomático vs 1 año sintomático (SIDA) para la terapia combinada δ δ P<0,01 tiempo 0 asintomático vs 0 sintomático (SIDA). δ δ δ P<0.001 tiempo 1 año asintomáticos vs 1 año sintomático para la terapia con ZDV sólo. Valores expresados como mediana y rangos. Test de Wilcoxon (intr-grupo) y test de Mann-Whitney (inter-grupo).
Al compararse la terapia combinada y la terapia con ZDV se aprecia una eficacia mucho más significativa de la primera (p<0,001).
En cambio en la etapa de SIDA, en ambas terapias, la relación disminuyó (p<0,01), pero en la etapa de SIDA lo hizo por debajo de valores de 0,6 (Fig. 1).
No se encontró correlación entre la disminución de linfocitos y la disminución de la relación CD4+/CD8+ (r: 0,23).
3. Evolución de la carga viral:
En la fase asintomática la carga viral descendió significativamente (p< 0,01) con la terapia combinada y con ZDV, pero la respuesta fue significativamente mayor con la combinación de drogas comparada con la monodroga. Al comparase los resultados de la terapia combinada en ambas fases se detecta una respuesta significativamente mayor (p 0,001) en la fase asintomática.
En la etapa de SIDA se observaron diferencias significativas con la terapia combinada (p< 0,01) pero no con la ZDV sola. Estos resultados se presentan en la figura 2.

Figura 2. Carga viral en los grupos con combinación terapéutica y con ZDV sóla, en fase asintomática (símbolos llenos) y de SIDA (símbolos blancos).Terapia combinada: círculos; ZDV sólo: cuadrados. Valores expresados como mediana y rangos. Test de Wilcoxon (intra-grupo) y test de Mann-Whitney (inter-grupo). **P<0.01 tiempo 1 año asintomáticos vs 1 año sintomático con tratamiento combinado. No hubo diferencias significativas en los gatos tratados con ZDV sólo entre los tiempos de la fase asintomática vs sintomática.Valores expresados como mediana y rangos. Test de Wilcoxon (intra-grupo) y test de Mann-Whitney (inter-grupo).
4. Signos neurológicos y potenciales visuales y auditivos evocados:
En los gatos infectados por VIF en fase asintomática, previo al inicio del tratamiento, se observaron signos neurológicos consistentes en cambios de comportamiento, convulsiones parciales y tics. Esto se detectó tanto en el grupo ZDV (2/8 gatos) como en el grupo ZDV/3TC/ Nevi (3/8 gatos). Al efectuarse los PVE y PAE, resultaron anormales 6/8 gatos del grupo ZDV y 7/8 gatos del grupo con la terapia combinada (Tabla 2).
Tabla 2. Proporción de pacientes asintomáticos con Potenciales evocados anormales al inicio y al finalizar el tratamiento con ambos protocolos.

Luego de efectuado el tratamiento en el grupo ZDV+3TC+Nevi, se observó una marcada mejoría clínica de los signos neurológicos. Por su parte, el grupo ZDV evidenció una leve mejoría de los signos neurológicos. En dicho grupo, los potenciales evocados no presentaron mejoría, mientras que sí la hubo en el grupo ZDV+3TC+Nevi (Tabla 3).
Tabla 3: Resultados, según el score de los potenciales visuales y auditivos, en los pacientes de ambos grupos, asintomáticos, antes y después del tratamiento.

PVE: potencial visual evocado, PVEC: PVE conservado, PVE SC: PVE sub-conservado, PVE NC: PVE no conservado. PAE: potencial auditivo evocado, PAE Conservado, PAE SC: PAE sub-conservado, PAE NC: PAE no conservado. PVE y PAE N: potenciales visual y auditivo normales.
En los PVE se detectó disminución de la amplitud y aumento de la latencia en la onda p 100 (Figura 3). Por su parte, los PAE revelaron el aumento del tiempo de conducción central (TCC) y disminución de las amplitudes (Figura 3).
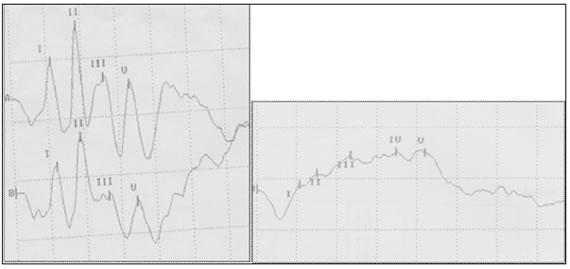
Figura 3. PAE conservado y sub-conservado en un paciente del estudio, mostrando el TCC. PAE conservado. Intensidad de clicks: 90db. Cada oído es evaluado en respuesta a1000 clicks División horizontal 1msec; división vertical : 0.73 μV. TCC (onda I-onda V): 2,19 PAE subconservado: nótese la disminución generalizada de las amplitudes de las ondas y el aumento del TCC (ondas I-V): 4,13. Intensidad de clicks: 90 db. Cada oído es evaluado en respuesta a 1000 clicks. División horizontal 1msec; división vertical : 0.73 μV.
Los pacientes que cursaban la fase final (SIDA) evidenciaron signos neurológicos en una elevada proporción de: 5/8 en el grupo ZDV y 6/8 en el grupo ZDV+3TC+Nevi. Todos los afectados presentaron anormalidades en los potenciales evocados y mostraron mejoría en el grupo ZDV+3TC+Nevi (4/8), no ocurrió lo mismo en el grupo ZDV.
5- Efectos adversos de ambos protocolos.
Durante el año de observación de los pacientes no se detectaron efectos colaterales relacionados con la terapéutica empleada. Cabe señalar que no se trataron pacientes que al inicio estuvieran anémicos debido a la probabilidad de que la Zidovudina empeore el cuadro. La ZDV es empleada como tratamiento por este grupo de trabajo desde hace varios años y nuestra experiencia es que raramente produce anemia salvo que el paciente la tenga por causas preexistentes9. El hecho de haber tomado dicha decisión, antes de iniciar el estudio, evitó que se observaran anemias atribuibles al tratamiento.
Discusión
El gato infectado por VIF ha sido y es un excelente modelo experimental para el estudio de la enfermedad homónima humana y esto ha permitido, entre otras cosas, investigar el efecto de los antirretrovirales en el gato infectado experimentalmente, para luego aplicarlos en el hombre infectado por VIH. Recientemente, se han comenzado a comunicar resultados de estudios clínicos investigando el posible uso de las terapias combinadas en el gato con infección espontánea1,7,8,9,14,22. Antes de iniciar el tratamiento se debe estadificar al paciente, pues lo ideal es comenzarlo cuando los gatos infectados están cursando los momentos previos a la etapa final. Esto se debe a que los gatos en la fase asintomática tienen un sistema inmune todavía funcional y sus órganos no están dañados severamente9, de este modo toleran mejor la terapia y no tienen enfermedades debidas a agentes oportunistas tales como Mycoplasma haemofelis, Toxoplasma gondii, Mycobacterium bovis, Cryptococcus neoformans, etc.7,9. Por otra parte, elegir el inicio del tratamiento en dicho momento acorta el tiempo de terapéutica, disminuye la posibilidad de resistencias, efectos colaterales y posterga la aparición del SIDA. También podrían darse situaciones en que sea necesario aplicar el tratamiento a gatos que han contactado con un animal infectado a fin de evitar la infección o bien tratar a un animal en la etapa final (SIDA) de la infección7,14.
Un problema importante para generalizar el uso de esta terapéutica es la necesidad de contar con técnicas como carga viral y la relación CD4+/CD8+, con personal entrenado en su ejecución e interpretación y con propietarios dispuestos a hacerse cargo de estos tratamientos. No se han encontrado aún parámetros que correlacionen fuertemente la relación CD4+/ CD8+ con los linfocitos totales por ejemplo. Si la correlación presentara una mayor significación, el clínico podría hacer un control de los pacientes sin necesidad de derivarlos a centros especializados. Hay investigadores3,20 que señalan que la correlación mencionada es moderada y que es suficiente para el seguimiento de los pacientes. Según nuestros actuales resultados y otros previos9 la correlación entre CD4+/CD8+ y los linfocitos es baja o poco significativa. Esto reafirma el hecho que resulta esencial el control, por medio de la relación CD4+/CD8+ de los gatos en tratamiento.
Cabe destacar que la combinación (ZDV+3TC+Nevi) que se ha puesto a prueba en este trabajo no ha sido usada previamente en gatos con infección espontánea. Hay antecedentes de su aplicación en medicina humana y se considera una de las combinaciones preferidas, en especial en niños y en mujeres embarazadas2,3,13. Lo aportado en este artículo pone en evidencia la eficacia e importancia del empleo de terapias combinadas por encima de las mono-drogas, tal como puede observarse en los cambios que se producen en la carga viral (Fig. 2) y en la relación CD4+/CD8+ (Fig.1), con mejorías de ambos parámetros en los pacientes, mucho más notorias en la fase asintomática resultados observados en el paciente infectados por VIH3,13,20 y no se encuentran antecedentes para comparar el uso en el gato infectados espontáneamente. Sería necesario continuar con el seguimiento y tratamiento de este grupo ZDV+3TC+Nevi con el objeto de verificar su eficacia en un plazo mayor.
Con respecto al tratamiento de pacientes en fase de SIDA, es sabido que las posibilidades de éxito terapéutico es mucho menor, especialmente cuando presentan infecciones oportunistas. Esto se debe a que la mayoría de los agentes oportunistas producen anemia y esta es una limitación importante. Por otro lado, debe tratarse al paciente con anti-retrovirales y paralelamente indicar el tratamiento específico del oportunista y esto es muy desgastante para el organismo. Además, generalmente los pacientes que cursan esta etapa responden parcialmente o no responden a la terapia específica del oportunista. Si el oportunista es una enfermedad infecciosa la terapia se prescribe por un tiempo mucho más prolongado y la respuesta observada es variable. Con más razón en esta etapa debería usarse la terapia combinada pues hay mayores probabilidades de disminuir la carga viral y aumentar la relación CD4+/ CD8+, dándole al paciente una mejor calidad de vida y la posibilidad de obtener una mejor respuesta al tratamiento de los oportunistas. En nuestros pacientes no se produjeron muertes ni manifestación de oportunistas en el grupo tratado con la combinación de drogas. Sin embargo esto debería estudiarse a más largo plazo.
En síntesis, la mejoría de los pacientes con VIF, tratados con la combinación y en fase asintomática, fue significativamente mayor que la observada con la ZDV. Del mismo modo, en la etapa de SIDA se detectó una mejoría variable en algunos pacientes.
En cuanto a la evolución de los signos neurológicos y de las pruebas electro-fisiológicas, el tratamiento resultó más efectivo en los pacientes en fase asintomática. Sin embargo, en el grupo ZDV+3TC+Nevi en los pacientes en fase de SIDA se observó también mejoría en un 50% de los pacientes. Estos resultados probablemente se deban a la acción de la Nevirapina, por su buena penetración de la barrera hematoencefálica. Es crucial el empleo de una droga, dentro de la combinación, que acceda al SNC con el objeto de combatir el virus a dicho nivel y minimizar los daños neurológicos6,18. Al actuar el SNC como reservorio del virus, la droga que atraviesa la barrera hematoencefálica produce también una disminución de la carga viral sistémica, mucho más marcada que cuando se emplean drogas sin dicho efecto6,9. Con respecto al menor efecto observado en los pacientes en fase de SIDA, quizás esto se deba a que los gatos ya se encontraban con un mayor desequilibrio del sistema inmune 7,9.
La evaluación de los PVE y PAE evidencian el deterioro neurológico aún cuando los signos no sean evidentes. En nuestros pacientes, los signos neurológicos registrados fueron de baja prevalencia y leves. Sin embargo, las pruebas electro-fisiológicas mostraron anormalidades en un elevado número de gatos. Este hecho es probable que se deba al tipo de lesiones producidas por VIF, pues afecta a macrófagos y astrocitos, pero no a las neuronas6. Nuestros resultados en relación con las manifestaciones neurológicas coinciden con los obtenidos por algunos investigadores 6,7,18 y contradicen el hallazgo de otros 7,18 quienes reportan signos neurológicos graves (demencia, agresividad extrema, formación de granulomas, etc). Estos últimos signos neurológicos se observan en pacientes en fase de SIDA como efecto de los oportunistas (Toxoplasma gondii, Mycbacterium bovis Cryptococcus neoformans, etc), los cuales son responsables de cuadros granulomatosos severos en el SNC17,18.
Cabe destacar que los resultados presentados, en relación a la respuesta a la terapia combinada, incluyen las observaciones a lo largo de un año y serían necesarias evaluaciones más prolongadas a fin de confirmarlas, por ejemplo por medio del estudio de cohortes, pues demuestran mejor la efectividad terapéutica. Esto por ahora es poco factible pues para ello el tratamiento debería estar más difundido en los pacientes con la enfermedad natural.
Conclusiones
A la luz de los presentes resultados, la combinación ZDV+3TC+Nevi es más eficaz que la ZDV administrada sola para reducir la carga viral, aumentar la relación CD4+/CD8+ y hacer remitir los signos clínicos de los gatos cursando la etapa de portador asintomático. En la etapa de SIDA la diferencia entre ambas terapias no es tan marcada; sin embargo, la combinación es más eficiente respecto de la ZDV sola para mejorar el cuadro y los parámetros evaluados.
La combinación ZDV+3TC+Nevi también resulta efectiva para mejorar los signos neurológicos de estos pacientes en la fase asintomática de la enfermedad.
La combinación de antivirales estudiada es una terapia eficaz, accesible económicamente, de poca toxicidad y aplicable al tratamiento de los pacientes preferencialmente cuando están muy cerca etapa de SIDA pero aún con una relación CD4+/CD8+ mayor a 0,6 y en ausencia de infecciones oportunistas y de anemia. En cambio, en la fase de SIDA también puede emplearse con resultados variables y que deberían corroborarse con estudios a más largo plazo.
1. Arai, M.; Earl, D.D.; Yamamoto, J.K. Is AZT/3TC therapy effective against FIV infection or immunopathogenesis. Vet. Immunol. Immunopathol. 2002; 85: 189-204. [ Links ]
2. Bisset, L.R.; Lutz, H.; Boni, J.; Hofmann-Lehmann, R.; Luthy, R.; Schupbach, J. Combined effect of zidovudine (ZDV), lamivudine (3TC) and abacavir (ABC) antiretroviral therapy in suppressing in vitro FIV replication. Antivir. Res. 2002; 53: 35-45. [ Links ]
3. Chokephaibulkit1, K.; Cressey,T.; Capparelli, E.; et al. Pharmacokinetics and safety of a new paediatric fixed-dose combination of zidovudine/lamivudine/ nevirapine in HIV-infected Children. AntivirTher. 2011; 16(8): 1287-1295. [ Links ]
4. de Parseval, A.; Chatterji, U.; Sun, P.; Elder, J.H. Feline immunodeficiency virus targets activated CD4+T cells by using CD134 as a binding receptor. ProcNatlAcadSci .U S A. 2004; 101(35): 13044-49. [ Links ]
5. Dunn, D.; Goodall, R.; Munderi, P.; et al. Residual Activity of Two HIV Antiretroviral Regimens Prescribed without Virological Monitoring. Antimicrob. Agents Chemother. 2011; 55(10): 4575-80. [ Links ]
6. Fletcher, N.; Meeker, R.B.; Hudson, L.C.; Callanan, J.J. The neuropathogenesis of feline immunodeficiency virus infection: Barriers to overcome. Vet. J. 2011; 188(3): 260-269. [ Links ]
7. Hartmann, K. Clinical aspects of feline immunodeficiency and feline leukemia virus infection. Vet. Immunol. Immunopathol. 2011; 143: 190-201. [ Links ]
8. Gómez, N.; Castillo, V..; Gisbert, M.A.; Pisano, P.; Mira, G.; Fontanals, A.; Cabrera Blatter, M.F. Immune-endocrine interactions in naturally FIVinfected cats, with and without antiviral treatment. Vet. Immunol. Immunopathol. 2011; 143: 332-337. [ Links ]
9. Gómez, N.V.; Fontanals, A.; Castillo, V.; Gisbert, M.A.; Suraniti, A.; Mira, G.; Pisano,P. Evaluation of different antiretroviral drug protocols on naturally infected Feline Immunodeficiency Virus (FIV) cats in the late phase of the asymptomatic stage of infection. Viruses.2012; 4: 924-939. [ Links ]
10. González-Alba, J.; Rodríguez-Domínguez, M.; Mateos Lindemann, M. Determinación de la carga viral del VIH-1. EnfermInfeccMicrobiol Clin.2011; 29(Supl.3):47-50. [ Links ]
11. Goto, Y.; Nishimura, Y.; Mizuno, T.; et al. Quantification of viral ribonucleic acid in plasma of cats naturally infected with feline immunodeficiency virus. Am. J. Vet. Res. 2000; 61: 1609-13. [ Links ]
12. Grant, C. K.; Fink, E. A.; Sundstrom, M; Torbett, B E; Elder, J. H. Improved health and survival of FIV-infected cats is associated with the presence of autoantibodies to the primary receptor, CD134. Proc. Natl. Acad. Sci. U.S.A. 2009; 106(47):19980-5. [ Links ]
13. http://aids.gov/hiv-aids-basics/just-diagnosed-withhiv-aids/understand-your-test-results/cd4-count/index.html. consultado el 31 de Enero de 2013. [ Links ]
14. Mi l l e r, M.; Fogle, J. Administration of Fozivudinetidoxil as a single-agent therapeutic during acute feline immunodeficiency virus infection does not alter chronic infection.Viruses, 2012; 4(6): 954-62, [ Links ]
15. Murphy, B.; Vapniarsky, N; Hillman, C; et al. FIV establishes a latent infection in feline peripheral blood CD4+ T lymphocytes in vivo during the asymptomatic phase of infection. Retrovirology. 2012; 9:12. [ Links ]
16. Paillot, R; Richard, S.; Bloas, F.; et al. Toward a detailed characterization of feline immunodeficiency virus-specific T cell immune responses and mediated immune disorders. Vet ImmunolImmunopathol. 2005; 106(1-2):1-14. [ Links ]
17. Phillips, T.R.; Prospéro-García, O.; Puaoi, D.L.;et al. Neurological abnormalities associated with feline inmunedeficiency virus infection. J. Gen. Virol. 1994; 75: 979-987. [ Links ]
18. Prospéro-García, O.; Herold, N.; Phillips, T.R.; Elder, J.H.; Bloom, F.E.; Henriksen, S.J. Sleep patterns are disturbed in cats infected with feline immunodeficiency virus. Proc. Natl. Acad. Sci. USA. 1994; 91: 12947-51. [ Links ]
19. Simões, R. D; Howard, K .E; Dean, G. A.; In Vivo Assessment of Natural Killer Cell Responses during Chronic Feline Immunodeficiency Virus Infection. PLoS One. 2012. 7(5):e37606: 3-13. [ Links ]
20. Srasuebkul, P.; Ungsedhapand , C.; Ruxrungtham, K.; et al. Predictive factors for immunological and virological endpoints in Thai patients receiving combination antiretroviral treatment. HIV Med. 2007; 8(1):46-54. [ Links ]
21. Tompkins, M.B.; Tompkins, W.A. Lentivirus-induced immune dysregulation. Vet ImmunolImmunopathol. 2008; 123(1-2):45-55. [ Links ]
22. Uckun, F.M.; Lin-Chen, C.; Samuel, P.; et al. In vivo antiretroviral activity of stampidine in chronically feline immunodeficiency virus-infected cats. Antimicrob. Agents Chemother. 2003; 47(4): 1233-1240. [ Links ]
23. VandeWoude, S.; Apetrei, C. Going wild: lessons from naturally occurring T-lymphotropic lentiviruses. ClinMicrobiol Rev. 2006; 19(4): 728-62. [ Links ]
24. Willett, B.J.; McMonagle, E.L.; Ridha, S.; Hosie, M.J. Differential utilization of CD134 as a functional receptor by diverse strains of feline immunodeficiency virus. J Virol. 2006; 80(7): 3386-94. [ Links ] 25.
25.Wood, E.; Hogg, R.; Yip, B.; Harrigan, P.; O'Shaughnessy, M.; Montaner, J. Is there a baseline CD4 cell count that precludes a survival response to modern antiretroviral therapy? AIDS. 2003; 17(5):711-20 [ Links ]














