Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
InVet
versión On-line ISSN 1668-3498
InVet vol.15 no.2 Ciudad Autónoma de Buenos Aires dic. 2013
ARTÍCULO DE INVESTIGACIÓN
Inocuidad de carne molida y presencia de cepas Escherichia coli causantes de lesiones de adherencia y esfacelación*
Srednik, M.E.T1; Rumi M.V. 1, Bentancor, A.1
1Cátedra de Microbiología. Facultad de Ciencias Veterinarias. Universidad de Buenos Aires. Chorroarín 280 (C1427 CWO).
* Premio Estímulo a la Investigación Científica de la convocatoria 2012. Categoría Graduados de FCV - UBA
Correspondencia e-mail: aben@fvet.uba.ar
Recibido: 29/10/2013
Aceptado: 16/12/2013
Resumen
Escherichia coli es un marcador de contaminación fecal en alimentos. Dentro de la especie se encuentran patotipos de riesgo para la salud. Entre ellos, E. coli enteropatógeno y enterohemorrágico tienen la habilidad de causar la lesión de adherencia y esfacelación (A/E) en células intestinales. El estudio de ambos patotipos engloba aquellos más frecuentemente relacionados a diarrea infantil. El objetivo del presente trabajo fue evaluar la presencia de cepas A/E, particularmente las enteropatógenas que serían consideradas inocuas bajo la normativa de control actual. Se analizaron 98 muestras de carne molida compradas en carnicerías de Buenos Aires. La presencia de los patotipos se analizó mediante PCR de los genes (a) eae que codifica la proteína intimina, necesario para causar A/E en la mucosa intestinal y (b) stx1/stx2 que codifican las toxinas Shiga. Ocho muestras resultaron positivas al gen eae. A su vez, dos fueron positivas a los genes stx1/stx2. Bajo la normativa actual, 8% de las muestras pueden ser categorizadas como portadoras de cepas de E. coli genérica y ser comercializada sin estimar el impacto de las mismas para la salud. La revisión de los criterios de calidad e inocuidad deberían ser analizados.
Palabras clave: AEEC; Escherichia coli; Carne molida; Calidad; Inocuidad.
Safety ground beef under the regulatory framework of The Argentine Food Code and the presence of Escherichia coli strains causing attaching and effacing lesions
Summary
Escherichia coli is a marker of fecal contamination in food. Within the specie there are health risk pathotypes. Among them, enteropathogenic E. coli and enterohemorrhagic E. coli share the ability to introduce attaching and effacing (A/E) lesions on intestinal cells. The study of both pathotypes includes those most frequently related to childhood diarrhea. The aim of this study was to evaluate the presence of strains A/E, particulary the enteropathogenic that would be considered safe under current control regulations. 98 ground beef samples from butchers located in Buenos Aires were tested. The presence of the pathotypes was analyzed by PCR of the genes a) eae, encoding intimin protein, necessary to cause A/E in the intestinal mucosa and b) stx1/stx2, encoding Shiga toxin. Eight samples were positive to eae gene. Also, two samples were positive to stx1/stx2 genes. Under current regulations, 8% of samples can be categorized as carriers of generic E. coli strains and can be marketed without estimating their impact on health. Review of quality and safety criteria should be analized.
Key words: AEEC; Escherichia coli; Ground beef ; Quality; Safety.
Introducción
Escherichia coli es un habitante universal del tracto intestinal de humanos y animales. Como integrante de la microbiota del hombre y de muchos animales, se lo considera un microorganismo indicador de contaminación fecal cuando está presente en el ambiente, agua y alimentos. Debido a su amplia diseminación en el medio ambiente, las bacterias pueden estar presentes en áreas que se utilizan para la producción de alimentos21.
A nivel mundial, las enfermedades diarreicas agudas (EDA), son un problema importante de salud de la población infantil, principalmente en los países en desarrollo, donde se producen anualmente 4,9 millones de muertes y constituyen la segunda causa global de mortalidad infantil21. En Argentina durante el 2012 se registraron más de 10 millones de casos de diarrea; con un detalle de 1200 casos de diarreas agudas sanguinolentas y 256 casos de síndrome urémico hemolítico (SUH)17. Entre las bacterias productoras de las EDA, se describen al menos 6 categorías patogénicas bien definidas que se distinguen de los simbiontes de la microbiota, por la presencia de factores de virulencia11.
E. coli enteropatógeno (EPEC) y E. coli enterohemorrágico (EHEC) comparten algunos atributos de virulencia y poseen características diferenciales que explican su patogenia particular. Poseen un sistema de secreción tipo III mediado por la proteína intimina (gen eae) ubicado en el Locus of Enterocyte Effacement (LEE) y producen una lesión histopatológica caracterizada por adherencia y esfacelación (A/E) en la mucosa intestinal, necesario para causar enfermedad severa en el hombre19,28. EPEC es uno de los patógenos bacterianos más importantes asociado a la gastroenteritis infecciosa y diarrea esporádica en niños menores a un año15. Los pacientes afectados por estos microorganismos son habitualmente niños con necesidades básicas insatisfechas (NBI). Así mismo, en niños mayores, una dosis infectante superior puede causar diarrea5,28. EPEC es una causa de diarrea infantil en países en desarrollo y también una importante causa de diarrea en países desarrollados27. EHEC se caracteriza por producir las toxinas Shiga (Stx1, Stx2 y variantes) causando una amplia gama de cuadros clínicos desde diarreas leves a sanguinolenta, colitis hemorrágica, síndrome urémico hemolítico (SUH) hasta la muerte8,12. Es una enfermedad de mayor gravedad en niños y preadolescentes, y es endémica en Argentina6,7,20. Los alimentos o subproductos animales son los vehículos de transmisión al ser humano más frecuentes4. La contaminación de la carne se produce usualmente en el momento de la faena26. La dosis infectante de EHEC es reducida (<100 UFC/g)23. El prototipo de EHEC es el serotipo O157:H7, el mismo puede ser identificado mediante el marcador rfbO15714,23.
Quedan de esta forma definidas las siguientes categorías posibles, cepas de E. coli de adherencia y esfacelación (AEEC) que incluyen los patotipos EPEC (eae+) y EHEC (eae+, stx1/stx2+), caracterizadas por la producción de la intimina. Por otro lado, independientemente de la producción de intimina, se describe al patotipo STEC que incluye cepas productoras de toxina Shiga (stx1/stx2+).
La Comisión Internacional para la Especificación Microbiológica de los Alimentos permite regular el comercio internacional de los mismos estableciendo límites microbiológicos, métodos de análisis y de muestreo incluyendo la determinación de E. coli genérica en carne molida fresca16,18,24. Para diferenciar correctamente cepas de E. coli diarreogénicas de E. coli genéricas podrían realizarse, entre otros, métodos genotípicos rápidos25. En la actualidad, el Código Alimentario Argentino (CAA), establece la ausencia de O157:H7 en carne molida18. Este prototipo es uno de las posibles serotipos EHEC, por lo cual quedan sin especificar el control para más de 200 serotipos de riesgo en salud pública.
El objetivo del presente trabajo fue estudiar la prevalencia de cepas AEEC causantes de la lesión de adherencia y esfacelación a partir de carne molida proveniente de carnicerías del Partido de San Martín, provincia de Buenos Aires mediante la Reacción en Cadena de la Polimerasa (PCR). A su vez, evaluar la proporción de patotipos dentro de las AEEC que bajo la normativa higiénica en vigencia serían consideradas inocuas.
Materiales y métodos
Se evaluaron tres áreas del Partido de San Martín, provincia de Buenos Aires que representan diferentes porcentajes de NBI10 (1) ≥ 75%, (2) entre <75% y ≥ 25% y (3) < 25%.
Se analizaron un total de 98 muestras de carne molida, obtenidas por compra directa en bocas de expendio minorista. Las muestras fueron congeladas hasta su procesamiento. Para el estudio de E. coli AEEC se inocularon 65 g de carne molida en 585 ml de caldo tripteína soja (CTS) y se homogeneizaron con Stomacher durante 2 minutos en bolsa estéril. Cada suspensión se incubó a 35°C durante 24 hs y luego se sembró en Agar Mac Conkey (AMC).
A partir del cultivo en AMC se obtuvo con ansa una muestra de la zona de crecimiento bacteriano confluente que fue suspendido en 150 μl de agua bidestilada. La suspensión hervida en baño de agua durante 10 minutos fue centrifugada 5 minutos a 13.000g. El sobrenadante fue utilizado como templado para rastrillaje por PCR. Los templados se conservaron a 4°C.
El perfil patogénico de AEEC se realizó mediante el análisis por PCR del g e n eae . Se u t i l i z a ron los primers propuestos por Blanco y col.1 (eae1 5'-GGAACGGCAGAGGTTAATCTGCAG-3' y eae2 5'-GGCGCTCATCATAGTCTTTC-3') dando un producto de 346 pares de bases. Se utilizó una mezcla de reacción con 2,5 ml de buffer de PCR, 2 mM de Cl2Mg, 200 mM de desoxinucleótidos trifosfato (dNTP), 0,12 pM de cada primer, 1U de Taq DNA polimerasa (Invitrogen) y 4 ml de templado, llegando a un volumen final de 25 ml. Se amplificó el ADN en un termociclador Eppendorf (modelo Mastercycler gradient) bajo las siguientes condiciones: 94ºC por 5 min; 30 ciclos a 94ºC por 45 seg, 60ºC por 30 seg y 72ºC por 1 min; y extensión final 72ºC por 7 min. Se utilizó la cepa 2348 y ATCC 25922 como control positivo y negativo de reacción respectivamente.
El perfil patogénico de EPEC y EHEC se discriminó mediante PCR del gen stx1 y/o stx2 a partir del mismo templado. A su vez, se identificó la presencia de EHEC O157:H7 mediante la amplificación del gen rfbO157. En adición quedó definida la contaminación por STEC no EHEC. Se utilizaron los primers propuestos por Leotta y col.14 (stx1a 5'- GAAGAGTCCGTCCGTGGGATTACG-3' y stx1b 5'-AGCGATGCAGCTATTAATAA-3'; rfbO157f 5'-CGGACATCCATGTGATATGG-3' y r f b O 1 5 7 r 5'-TTGCCTATGTACAGCTAATCC; stx2a 5'-TTAACCACACCCCACCGGGCAGT-3' y stx2b 5'-GCTCTGGATGCATCTCTGGT-3';) dando tres productos de 130, 249 y 346 pares de bases respectivamente. Se utilizó una mezcla de reacción con 5 ml de buffer de PCR, 200 mM de dNTP, 0,6 pM de cada primer sxt1 y rfbO157, 0,12 pM de cada primer stx2, 1U de Taq DNA polimerasa (Invitrogen) y 3 ml de templado, llegando a un volumen final de 25 ml. Se amplificó el ADN bajo las siguientes condiciones: 94ºC por 5 min; 30 ciclos a 94ºC por 30 seg, 56ºC por 30 seg y 72ºC por 30 seg y extensión final 72ºC por 7 min. Se utilizaron las cepas EDL 933 y ATCC 25922 como controles positivo y negativo respectivamente.
Criterio de clasificación por muestra: [AEEC=eae+], [EPEC=eae+, stx-], [EHEC =eae+, stx+], [STEC=eae-, stx+].
Análisis estadístico: Se realizó Ï2 y análisis de diferencia de proporciones de contaminación por AEEC y EPEC en carne molida. Se analizaron las proporciones de contaminación de cada patotipo en cada estrato de NBI.
Resultados
El total de los locales identificados para el muestreo fueron 31, 32 y 35 para cada área de NBI: <25%, ≥25-<75% y ≥75% respectivamente. La contaminación con AEEC fue identificada en 8,16% (8/98) de las muestras evaluadas (Tabla 1). Dentro del grupo AEEC se diferenciaron 2 EHEC (eae+, stx1/stx2 +, rfbO157-). No se detectó en este muestreo la presencia de EHEC O157. La distribución por nivel socioeconómico de cada patotipo se detalla en la Tabla 2. No se observaron diferencias significativas en la contaminación por AEEC entre los grupos de diferente %NBI mediante test de diferencia de dos proporciones. Sin embargo, al considerar la contaminación del conjunto de AEEC y STEC se observaron diferencias entre los grupos de NBI opuestos (≥75% vs <25%.) (P: 0,04).
Tabla 1. Muestras de carne molida testeadas por PCR para el gen eae y stx1/stx2 provenientes de áreas con diferentes porcentajes de necesidades básicas insatisfechas.
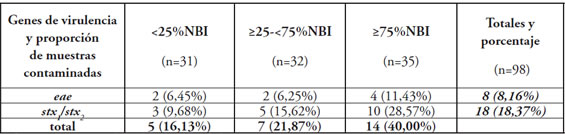
Referencia: NBI: necesidades básicas insatisfechas.
Tabla 2. Muestras de carne molida provenientes de áreas con diferentes porcentajes de necesidades básicas insatisfechas y contaminación según patotipo identificado.
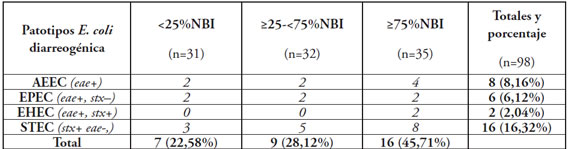
Referencia: NBI: necesidades básicas insatisfechas.
Discusión
En el marco del presente estudio se detectó que ocho muestras estaban contaminadas por cepas AEEC. Teniendo en cuenta las especificaciones de calidad que debe cumplir la carne molida18, dentro de un recuento admitido de E. coli/g, existe la probabilidad de que el contaminante sea un patotipo de impacto en salud, tal las cepas AEEC.
La Comisión Internacional de Especificaciones Microbiológicas en Alimentos (ICMSF) agrupa a los microorganismos y parásitos de acuerdo al tipo de severidad del riesgo13,24. EHEC se agrupa dentro de "riesgo severo" y otras cepas diarreogénicas de E. coli dentro de "riesgo moderado de extensión potencialmente amplia".
La carne molida fresca debe responder a ciertas especificaciones microbiológicas (recuento de E. coli/g: aceptable<100, marginalmente aceptable=100-500, defectuosa>500 y E. coli O157:H7: ausencia/65g)18. Dentro de este estudio se encontraron 8,16% de muestras con presencia de cepas AEEC de riesgo moderado, dentro de las cuales 2,04% eran EHEC, de riesgo severo. Por tal motivo se propone medidas tendientes a su determinación como criterio microbiológico y la necesidad de modificar las especificaciones higiénicas en vigencia determinadas por el CAA. Nuestros resultados confirman que cepas de riesgo severo EHEC no O157:H7 dentro del grupo AEEC pueden detectarse en muestras de carne molida de expendio minorista y no son evaluadas con criterios microbiológicos específicos. La distribución de estos contaminantes es homogénea y abarca todos los estratos, independientemente del NBI del área.
En Estados Unidos, la detección por PCR de E. coli patogénico en lotes de carne molida de varias plantas comerciales determinó que 9,1% de las muestras fueron positivas para el gen eae y 15% fueron positivas para los genes stx1 y/o stx29. Estos resultados son similares a los nuestros respecto a las cepas AEEC (8,16%). En nuestro análisis detectamos 2 (2,04%) de EHEC y 16 (16,33%) de STEC en las muestras estudiadas.
Existen numerosas referencias que señalan la presencia de E. coli genérico y STEC en particular en carne molida3,4,13,29. También abundan los trabajos de aislamiento de cepas de E. coli O157:H7, serotipo más frecuentemente relacionado con brotes de SUH13,21. La contaminación en carne molida por E. coli diarreogénico de impacto en la infancia, no ha sido sistemáticamente investigada. En consecuencia, su detección aún no ha sido contemplada en la normativa del CAA18. La presencia de EPEC en alimentos es relevante debido a la alta casuística de diarreas, particularmente en niños de grupos vulnerables13. En España Kasnowski et al. (2008) señalaron una mayor frecuencia de aislamientos en carne molida por EPEC (19%). En nuestro estudio pudimos observar que la mayor contaminación, por el conjunto de los patotipos investigados, recae sobre la población más vulnerable (>75% de NBI). Referencias previas indican que la fuente de contaminación de los patotipos de E. coli en la carne cruda ocurre durante la evisceración en los mataderos, o dentro de las carnicerías a través del uso de equipos contaminados y prácticas no higiénicas3.
En conclusión, los resultados obtenidos sugieren que se debería ampliar el criterio obligatorio de ausencia de E. coli O157:H7 detallada por el CAA, al de ausencia de cepas AEEC en la muestra analizada. Una acción rápida sería determinar los genes eae y stx mediante una prueba de PCR en la línea de faena, evitando así el reclamo y retiro de productos.
A su vez, es necesario identificar los puntos de control a lo largo de la cadena alimentaria para reducir al mínimo los riesgos para la salud. Para las variedades AEEC, es necesario analizar la senda desde la granja al consumidor. Las cepas E. coli patógenas se comportan de manera similar que las E. coli genéricas y son capaces de persistir y crecer en muchos alimentos. Se deben seguir pasos para la mitigación de los riesgos de acuerdo con los códigos reconocidos de buenas prácticas y las recomendaciones pertinentes de los servicios veterinarios y de salud pública (Buenas Prácticas de Manufactura, Buenas Prácticas de Higiene, Buenas Prácticas Agrícolas y Análisis de Peligros y Puntos Críticos de Control)21. Además son esenciales conductas apropiadas en el área de distribución minorista que garantiza que las personas que tengan contacto directo o indirecto con los alimentos no se contaminen, debiendo los manipuladores de alimentos limitarse al Código Internacional Recomendado de Prácticas - Principios generales de Higiene de los Alimentos, del Codex Alimentarius21. Las recomendaciones para los consumidores con respecto a la cocción completa de los alimentos y los riesgos de contaminación cruzada en el hogar también pueden contribuir a la protección contra estas enfermedades2,21.
Conclusiones
Debido al grado de contaminación por cepas AEEC en carne molida, existe el riesgo de adquirir alimentos contaminados por la población. En consideración a ello es necesario implementar programas de control y educación para la salud sostenidos en el tiempo, destinados a la comunidad en general y a los manipuladores, alertando sobre los riesgos de este patógeno, sus vías de transmisión y las estrategias de prevención que deben aplicarse.
Dentro de las AEEC, las EPEC no son evaluadas y por lo tanto consideradas indebidamente como simbiontes inocuos. Lo mismo ocurre para serotipos de EHEC no- O157 y otras STEC. En relación a los resultados obtenidos sería conveniente establecer nuevos parámetros de inocuidad de la carne molida, en la normativa higiénica del CAA, con ausencia de E. coli AEEC y STEC por detección, mediante PCR de los genes eae y stx en productos cárnicos.
Agradecimientos: Este trabajo fue financiado parcialmente por la Secretaría de Ciencia y Técnica de la Universidad de Buenos Aires UBACyT V401, Agencia Nacional de Promoción Científica y Tecnológica PICTO 2010-125 y el Instituto de Ciencia y Tecnología ICyTDF, México. Este trabajo se desarrolló con el apoyo de la Dra. E. Gentilini y la colaboración del personal no docente de la Cátedra de Microbiología Veterinaria, FCV, UBA.
1. Blanco, M.; Schumacher, S.; Tasara, T.; Zweifel, C.; et. al. Serotypes, intimin variants and other virulence factors of eae positive Escherichia coli strains isolated from healthy cattle in Switzerland. Identification of a new intimin variant gen (eae-h2). BMC Microbiology 2005; 5:23. [ Links ]
2. Centers for Disease Control and Prevention (CDC). Prevention and Education for Consumers. Food Safety Homepage. National Center for Emerging and Zoonotic Infectious Disease (NCEZID). Atlanta, USA. En: http://www.cdc.gov/foodsafety/prevention.HTML, consultado 5 de Mayo. [ Links ]
3. Charimba, G.; Hugo, C.; Hugo, A. The incidence of diarrhoeagenic Escherichia coli in minced beef and boerewors. Food Research International 2012,; 47(2):353-8. [ Links ]
4. Chinen, I.; Notaro, JD.; Miliwebsky, E.; et. al. Isolation and characterization of Escherichia coli O157:H7 from retail meats in Argentina. J Food Prot. 2001; 64(9):1345- 51. [ Links ]
5. Costin, ID.; Voiculescu, D.; Gorcea, V. An outbreak of food poisoning in adults associated with Escherichia coli serotype 86:B:7:H34. Patol Microbiol. 1964; 27:68-78. [ Links ]
6. Elliott, SJ.; Sperandio, V.; Girón, JA.; et. al. The locus of enterocyte effacement (LEE)-encoded regulator controls expression of both LEE- and non-LEEencoded virulence factors in enterophatogenic and enterohemorrhagic Escherichia coli. Infect Immun. 2000; 68(11):6115-26. [ Links ]
7. Gianantonio, CA.; Vitacco, M.; Mendilaharzu, F.; Gallo, GE.; Soto, ET. The hemolytic-uremic síndrome. Nephron 1973; 11(2):174-92. [ Links ]
8. Griffin, PM.; Tauxe, RV. The epidemiology of infections caused by Escherichia coli O157:H7, other enterohemorrhagic Escherichia coli, and the associated hemolytic uremic sydrome. J Clin Microbiol. 1991; 13(1):60-8. [ Links ]
9. Hill, WE.; Suham, R.; Richter HC.; Smith, CR.; Buschow, AW.; Samadpour, M. Polymerase Chain Reaction screening for Salmonella and Enterohemorrhagic Escherichia coli on beef products in processing establishments. Foodborne Pathog Dis. 2011; 8(9):1045-53. [ Links ]
10. Instituto Nacional de Estadística y Censos -INDECEn: http://www.indec.mecon.ar/webcenso/index.asp. consultado el 10 agosto de 2006. [ Links ]
11. Kaper, JB.; Nataro, JP. Mobley, LH. Pathogenic Escherichia coli. Nature Rev Microbiol. 2004; 2(2):123-40. [ Links ]
12. Karch, H.; Bielaszewska, M.; Bitzan, M.; Schmidt, H. Epidemiology and diagnosis of Shiga toxin-producing Escherichia coli infections. Diagnostic Microbiology and Infectious Disease 1999; 34(3):229-43. [ Links ]
13. Kasnowski, CM.; Franco, M.; Trindade Oliveira, LA.; Valente, A.; Carvalho, JC.; Conte-Junior, C. Detección, caracterización serológica y antibiogramas de Escherichia coli aisladas de carne de ternera (babilla) entera y picada. Revista Salud Publica y Nutrición 2008; 9(3). En: http:// www.respyn.uanl.mx/ix/3/articulos/antibiogramas.htm consultado el 4 de abril de 2011. [ Links ]
14.Leotta, GA.; Chinen, I.; Epszteyn, S.; Miliwebsky, E.; et. al. Validación de una técnica de PCR múltiple para la detección de Escherichia coli productor de toxina Shiga. Rev Arg Microbiol. 2005; 37(1):1-10. [ Links ]
15. Levine, MM.; Prado, V.; Robins-Browne, R.; et al. Use of DNA probes and HEp-2 cell adherence assay to detect diarrheagenic Escherichia coli. J Infect Dis. 1988; 158(1):224-8. [ Links ]
16. Microorganisms in Foods 7. Microbiological Testing in Food Safety. The International Commission on Microbiological Specifications for Foods. En RB Tompkin (ed.). Kluwer Academic, Plenum Publishers, New York, NY, USA, 2002. [ Links ]
17. Ministerio de Salud de la Nación. Boletín Integrado de Vigilancia, Secretaría de Promoción y Programas Sanitarios. Septiembre 2012; 135, SE35. [ Links ]
18. Ministerio de Salud. Código Alimentario Argentino. Capítulo VI. Alimentos carneos y afines. Carnes de consumo frescas y envasadas. Administración Nacional de Medicamentos, Alimentos y Tecnología Médica. Actualización 2007-08. En: http://www.anmat.gov.ar/alimentos/normativas_alimentos_caa.asp consultado el 3 de noviembre de 2011. [ Links ]
19. Moon, HW.; Whip, SC.; Argenzio, RA.; Levine, MM.; Gianella, RA. Attaching and effacing activities of rabbit and human enterophatogenic Escherichia coli in pig and rabbit intestines. Infect Immun. 1983; 41(3): 1340-51. [ Links ]
20. Nataro, JP.; Kaper, JB. Diarrheagenic Escherichia coli. Clin Microbiol Rev. 1998; 11(1):142-201. [ Links ]
21. Organización de la Naciones Unidas para la Alimentación y la Agricultura. Prevención de la E. coli en alimentos. En: http://www.fao.org/alc/file/media/pubs/2011/prevecoli.pdf consultado 10 de mayo 2012. [ Links ]
22. Parashar, UD.; Bresee, J.; Glass, RI. The global burden of diarrhoeal disease in children. Bulletin of the World Health Organization 2003; 81: 236. [ Links ]
23. Rivas, M.; Voyer, L.; Tous, M.; De Mena, MF.; et. al. Verocytotoxin-producing E. coli infection in family members of children with hemolytic-uremic syndrome. Medicina (B.Aires) 1999; 56(2):119-25. [ Links ]
24. Smoot, LM.; Pierson, MD. Indicator microorganisms and microbiological criteria. En: Doyle, MP.; Beuchat, LR.,; Montville, TJ. (Eds) Food Microbiology, Fundamentals and Frontiers. ASM Press, Washington, D.C. 1997; 66-80. [ Links ]
25. Stacy-Phipps, S.; Mecca, JJ.; Weiss, JB. Multiplex PCR assay and simple preparation method for stool specimens detect enterotoxigenic Escherichia coli DNA during course of infection. J Clin Microbiol. 1995; 33(5):1054-9. [ Links ]
26.Tanaro, JD.; Miliwebsky, E.; Lound LH, et. al. Detección de Escherichia coli O157:H7 en carne bovina y derivados en carnicerías del municipio de Gualeguaychú. VI Congreso Latinoamericano de Microbiología de los Alimentos 2000; Poster C21. [ Links ]
27.Trabulsi L; Keller R; Tardelli Gomes, T. Typical and atypical enteropathogenic Escherichia coli. Emerg Infect Dis. 2002; 8(5):508-13. [ Links ]
28. Viljanen, MKT.; Peltola, T.; Junnila, SYT.; et. al. Outbreak of diarrhoea due to Escherichia coli O111:B4 in schoolchildren and adults: association of Vi antigen-like reactivity. Lancet 1990; 336(8719): 831-834. [ Links ]
29. Xia, X.; Meng, J.; McDermott, PF.; et. al. Presence and characterization of shiga toxinproducing Escherichia coli and other potentially diarrheagenic E. coli strains in retail meats. Appl Environ Microbiol. 2010; 76(6):1709-17. [ Links ]














