Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
InVet
versión On-line ISSN 1668-3498
InVet vol.16 no.1 Ciudad Autónoma de Buenos Aires jun. 2014
ARTÍCULO DE INVESTIGACIÓN
Vanadio en agua de bebida animal de tambos del sudeste de Córdoba, Argentina
Pérez Carrera, A. 1-2.; Alvarez Gonçalvez, C.V.2; Fernández Cirelli, A.1-2
1Instituto de Producción Animal (INPA – UBA - CONICET).
2Centro de Estudios Transdisciplinarios del Agua (CETA), Facultad de Ciencias Veterinarias, Universidad de Buenos Aires. Chorroarín 280 (1427) Buenos Aires.
Correspondencia e-mail: Alicia Fernández Cirelli afcirelli@fvet.uba.ar
Recibido: 08/04/2014
Aceptado: 22/12/2014
Resumen
En este trabajo se cuantificaron los niveles de vanadio presentes en el agua de bebida animal de 25 establecimientos lecheros, ubicados en el departamento de Unión, sudeste de la provincia de Córdoba, Argentina. Además, se cuantificaron sólidos totales disueltos (STD) e iones mayoritarios, a fin de determinar la calidad del agua con la que se abastecen los tambos relevados. A partir de los datos analizados, se evidenció que el 48% de los mismos se abastece de la capa freática, cuya calidad es inferior al agua proveniente de pozos más profundos. Asimismo se observó que la totalidad de las muestras de nivel freático superaban los valores máximos de vanadio recomendados para agua de bebida animal, alcanzándose niveles superiores a los 6 mg/L; y que las muestras con los niveles más bajos de vanadio presentaban, en contraposición, concentraciones elevadas de cloruros y sulfatos. Respecto de las aguas provenientes de pozos semisurgentes, menos del 10% de las muestras presentaban niveles de vanadio superiores a los establecidos, no alcanzándose en ningún caso valores por encima de los 0,3 mg/L. El presente estudio sugiere entonces que el agua procedente de la capa freática no sería segura para aprovisionamiento de los animales.
Palabras clave: Vanadio; Producción animal; Calidad de agua.
Vanadium in animal drinking water of dairy farms from Southeast Córdoba, Argentina
Summary
In this paper, vanadium levels, in animal drinking water, were quantified in water samples from 25 dairy farms located in the department of Union, southeast of the province of Cordoba, Argentina. In addition, total dissolved solids (TDS) and major ions were considered in order to determine the quality of water source used for livestock. Analyzed data showed that 48% of farms use a groundwater from the freatic aquifer (3 to 15 m), for animal drinking water, whose quality is worst than water from deeper wells (80 to 120 m). It was also noted that all the samples from the freatic aquifer exceeded the maximum vanadium levels considered for animal drinking water, reaching more than 6 mg/L. Regarding the water from deeper wells, less than 10% of them have vanadium concentrations above the recommended level, presenting a maximum level of 0.3 mg/L. The present study suggests that the water from the freatic aquifer would not be safe for use as water for livestock drinking; because of the levels of vanadium, arsenic, fluoride, chloride and sulphate.
Key words: Vanadium; Animal production; Water quality.
Introducción
El vanadio (V) es un elemento en abundancia en nuestro planeta3. Se encuentra ampliamente distribuido en la naturaleza y es abundante en rocas, petróleo, agua superficial y subterránea, etc.28 Aparece asociado a otros elementos traza como arsénico (As), flúor (F) y boro (B)10 y a condiciones óxicas y alcalinas29. La concentración de V en el agua es muy variable, con una concentración media de 10 μg/L siendo los niveles en agua dulce significativamente mayores que en los océanos3,11,18,22,25. El V tiene múltiples estados de oxidación entre el -1 y el +5. Está presente naturalmente en las aguas subterráneas en diferentes formas morfogénicas, siendo la más frecuente el V(+5)29. La especie predominante en el agua depende de factores tales como el pH, la concentración del mismo, el potencial redox y la fuerza iónica21. Gummow et al (2005) han reportado niveles de V en agua en concentraciones potencialmente peligrosas para la salud humana y animal9.
En los seres vivos, el V puede ingresar al organismo por inhalación o a través de la piel y la mucosa gastrointestinal1. En ganado bovino, se observó que el envenenamiento crónico estaría asociado a emaciación, diarrea crónica, trastornos en la absorción intestinal, inmunosupresión, rinitis, conjuntivitis y decúbito, ocurriendo eventualmente la muerte de los animales8. Por otra parte, otros autores discuten su papel como micronutriente12,15; trabajos en distintas especies animales y líneas celulares muestran que el V posee efectos variados y que cumple diversos roles biológicos, presentando efectos tanto beneficiosos como negativos. Se ha informado que el V presenta actividad insulinomimética12, inhibe la inducción de carcinogénesis mamaria23, es responsable de estrés oxidativo26 y apoptosis14,24,27. Los diferentes estudios muestran que los efectos del V en los seres vivos dependen de varios factores, entre ellos del organismo en cuestión, la especie química, la dosis, la ruta y la duración de la exposición. En el caso del ganado bovino, su rol metabólico y los efectos en la salud y la producción no han sido estudiados en profundidad.
En el caso del agua de bebida utilizada para producción animal, los establecimientos ganaderos de amplias regiones de nuestro país sufren limitaciones en cuanto a la disponibilidad y calidad del agua necesaria para el desarrollo de las diferentes actividades pecuarias. Los principales problemas que deben afrontar son la salinidad y la presencia de elementos inorgánicos en concentraciones que pueden llegar a ser tóxicas, como el V, As y F5,6,19,20. El ganado bovino es capaz de tolerar y adaptarse al consumo de diversas calidades de agua, considerándose aceptable en agua de bebida un nivel de sólidos totales disueltos de 2000 a 4000 mg/L. Sin embargo, la presencia de concentraciones salinas más elevadas a las recomendadas o la presencia de elementos traza inorgánicos pueden producir alteraciones en la salud, la producción o la calidad de los alimentos elaborados a partir de ellos, lo cual implica no sólo pérdidas económicas para los productores7, sino también riesgos potenciales para la salud de la población. En el caso del ganado bovino para producción lechera, se requiere una elevada disponibilidad de agua de bebida de buena calidad. Una parte significativa de los tambos de nuestro país, utilizan agua subterránea como principal fuente de abastecimiento para bebida animal. La concentración de V informada por distintos autores en agua subterránea es muy variable encontrándose fuentes de agua donde no es detectable su presencia hasta concentraciones que superan los 5,5 mg/L, como es el caso del sudeste de la provincia de Córdoba4,19. En otras zonas de la región pampeana donde se registra actividad ganadera, se encontraron concentraciones de V en agua subterránea entre 0,05 y 2,47 mg/L5, estando la mayor parte de las muestras en el rango de 0,20 a 1 mg/L, es decir por encima del límite recomendado para agua destinada al riego o bebida animal (Límite establecido para agua de riego: 100μg/L, bebida animal: 100 μg/L, Ley 24.051, Argentina)13. En nuestro laboratorio, los estudios sobre la calidad de agua para bebida animal se iniciaron en el sudeste de la provincia de Córdoba, uno de los lugares más afectados de la Argentina por la problemática del As en aguas subterráneas. Se analizó la concentración de este elemento en muestras de agua proveniente de la capa freática (3 a 15 m de profundidad) y de pozos semisurgentes (80 a 120 m de profundidad). En el agua proveniente de la capa freática se registraron las concentraciones más altas de As y otros elementos traza19.
El objetivo del presente trabajo es analizar los niveles de V a los que se encuentra expuesto el ganado bovino lechero en el sudeste de la provincia de Córdoba, y la relación del V con otros elementos traza y parámetros fisicoquímicos asociados con la calidad del agua utilizada para consumo animal.
Materiales y métodos
La cuenca lechera de Villa María, integrada por la zona del centro de Santa Fe y el sudeste de la provincia de Córdoba, es la región de producción láctea más importante de Argentina. Este trabajo se llevó a cabo en un área localizada entre los 62º 33´ y los 62º 57´ de longitud Oeste y los 32º 12´ y 32º 50´ de latitud Sur que comprende las localidades de Cintra, Bell Ville, Monte Leña y Morrison, pertenecientes al departamento de Unión, sudeste de la provincia de Córdoba (Figura 1). Las muestras de agua subterránea fueron colectadas en distintas campañas de muestreo entre 2002 y 2010, no encontrándose diferencias estadísticas significativas entre los parámetros analizados en las distintas campañas de muestreo.

Figura 1. Sitios de procedencia de las muestras de agua analizadas, tipos de fuente de agua y rango de concentraciones de V presente en las mismas.
Para el presente trabajo se analizaron muestras de agua de bebida animal procedentes de 25 establecimientos de producción lechera elegidos al azar, y representativos de los establecimientos existentes en la región.
Se tomaron muestras de agua subterránea (capa freática y semisurgente) de perforaciones que abastecen el consumo animal. Se colectaron en botellas de polipropileno que se mantuvieron refrigeradas hasta su llegada al laboratorio. En todos los casos se registró in situ, la temperatura, el pH y la conductividad eléctrica de las muestras (pHmetro y conductímetro Hanna). Se tomaron 500 ml para el análisis de los principales parámetros fisicoquímicos y 100 ml para la cuantificación de elementos traza inorgánicos. Esta última fue adicionada con HNO3 0,2% y se mantuvo refrigerada a 4ºC hasta el momento de las determinaciones. En el laboratorio las muestras fueron filtradas por una membrana de acetato de celulosa de 0,45 μ. La determinación de F se realizó mediante la utilización de un electrodo de ión selectivo de fluoruro (Thermo Scientific Orion). La cuantificación del As y V se realizó mediante la técnica de ICP-OES (inductively coupled plasma-optical emission spectroscopy, Perkin Elmer). Para la calibración del equipo se utilizaron materiales de referencia con certificado de trazabilidad. Además, se utilizaron materiales de referencia del National Water Research Institute of Canada (NWRI), con contenidos certificados de todos los elementos minoritarios para la verificación de la calibración y la validación del método analítico. El error del método fue menor al 1%.
Resultados
En la zona de estudio, se utiliza agua subterránea como fuente principal de provisión de agua de bebida para los animales. Esta proviene tanto de la capa freática (3 a 15 m de profundidad) como de pozos semisurgentes (80 a 120 metros de profundidad). En el presente trabajo se observó que aproximadamente la mitad de los establecimientos relevados (48%) se abastece de agua subterránea del estrato más superficial (freática).
La presencia de elementos traza inorgánicos afecta significativamente la calidad del agua y condiciona su utilización para bebida animal. En trabajos previos, realizados en nuestro laboratorio se caracterizó el agua de bebida animal y se analizó el contenido de As y F, encontrándose elevados niveles de estos elementos en las aguas utilizadas para el consumo de los animales que podían poner en riesgo la salud y producción del ganado bovino. En el caso del V, es un elemento que generalmente está asociado a la presencia de As y F, y del cuál se conoce poco acerca de su distribución y transferencia a la cadena agroalimentaria. Además, no se encuentra bien estudiado el impacto que puede tener sobre la salud y la producción animal. Para determinar la existencia de diferentes clases de agua de bebida animal, utilizadas en la región, a partir de sus características fisicoquímicas, se realizó un análisis de conglomerados utilizando como variables el pH, la conductividad y las concentraciones de V, sulfatos, cloruros, As y F. El dendograma obtenido sugiere que las muestras se agrupan en tres grupos naturales (Figura 2), con un coeficiente de correlación cofenética de 0,848.

Figura 2. Dendograma que muestra el agrupamiento de las muestras en tres grupos naturales. Freáticas -grupo A- (FA), Freáticas -grupo B- (FB) y semisurgentes (S).
Los resultados obtenidos muestran que dos de los grupos corresponden a muestras de la capa freática, difiriendo ambos significativamente, especialmente en los valores de pH y la conductividad (Figura 3). Uno de los grupos, que denominaremos, freáticas del grupo A (FA) presenta valores de pH ligeramente alcalinos (media = 7,73) y valores de conductividad más elevados (8,47 a 13,16 mS/cm) que los del otro grupo de muestras de la capa freática -grupo B- (FB) que presenta valores de pH mayores (media = 8,34) y niveles de conductividad entre 1,33 y 3,33 mS/cm. El tercer grupo se corresponde con la totalidad de las muestras de la capa semisurgente (S). Esto evidencia que las muestras de agua de la capa semisurgente se diferencian fisicoquímicamente de las aguas freáticas, y que estas a su vez, no forman un solo conjunto homogéneo, sino que se dividen en dos grupos con características diferentes. En las muestras analizadas los niveles de V en aquellas provenientes de la capa freática estuvieron entre 113 μg/L y 395 μg/L para las pertenecientes al grupo FA (media = 261 ± 105 μg/L) y entre 865 μg/L y 6203 μg/L para las del grupo FB (media = 3054 ± 1249 μg/L). En cambio, las muestras provenientes de la capa semisurgente presentaron concentraciones de V entre < 10 μg/L (límite de detección de la técnica utilizada) hasta 269 μg/L. A nivel internacional, la Guía de Calidad del Agua de Canadá (CCREM)2 estableció un límite superior para el V total en agua de bebida animal de todas las formas de ganadería de 100 μg/L2. El mismo límite se ha establecido a nivel nacional por la Ley 24.05113. Considerando la totalidad de las muestras analizadas, el presente estudio revela que el 56% presentan niveles de V significativamente mayores al límite recomendado para agua de bebida animal2,13; encontrándose algunas cuya concentración superó los valores reportados en otros trabajos4,16,17,19.

Figura 3. Diferencia de pH y conductividad entre los distintos grupos de muestras: FA, FB y S. Medias con una letra común no son significativamente diferentes (p > 0,05).
En función de los resultados obtenidos, y para analizar las diferencias de calidad de las aguas utilizadas para bebida animal entre los distintos grupos de muestras, se analizó a posteriori la existencia de diferencias significativas en los parámetros fisicoquímicos de los tres grupos, usando la prueba no paramétrica de Kruskal-Wallis (Figuras 3 y 4). Comparando los dos grupos de muestras de agua provenientes de la capa freática (FA y FB), puede observarse que las muestras del grupo FA poseen altas concentraciones de cloruros y sulfatos, además de una alta conductividad. Sin embargo, éstas presentan menores cantidades de V y otros elementos traza asociados tales como F y As. En contraposición, las muestras del grupo FB poseen baja concentración de cloruros y sulfatos, un pH significativamente mayor y una conductividad significativamente menor que las muestras del grupo FA, sin embargo, presenta elevadas cantidades de V, As y F. Las diferencias de casi todos estos parámetros entre ambos grupos resultaron estadísticamente significativas.
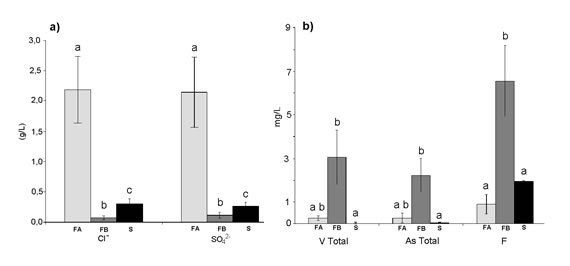
Figura 4. Concentración de (a) elementos mayoritarios: cloruros (Cl-), sulfatos (SO4 2-) y (b) elementos traza: V, As y F en los distintos grupos de muestras: FA, FB y S. Medias con una letra común no son significativamente diferentes (p > 0,05)
En la región estudiada, la calidad de agua para bebida de ganado se ve alterada tanto por la presencia de elevadas cantidades de elementos traza en concentraciones no aceptables como por concentraciones de sales en niveles que podrían ser perjudiciales para la salud animal. En el caso del agua proveniente de la capa freática ambos grupos son poco aptos para la bebida animal, ya sea por su alto contenido de sales (grupo FA), o su alto contenido de V y otros elementos traza tales como As y F (grupo FB). En el caso de las aguas semisurgentes (grupo S), forman un grupo homogéneo entre si, poseen valores de pH semejantes a los del agua del grupo FA (media = 7,83), de los que no difieren estadísticamente; pero bajos niveles de cloruros, sulfatos, V, F y As. Por esto, estas aguas serían las más aptas para el consumo animal.
Del presente análisis se desprende que el contenido de V en las aguas subterráneas es significativamente diferente según se trate de aguas semisurgentes o freáticas. En las primeras el nivel de V es bajo y en la mayoría de los casos por debajo del límite establecido por la Ley 24.051. Sin embargo en la capa freática, este alcanzaría valores elevados en las aguas con mayor pH. La concentración de este elemento en las aguas estudiadas mostró estar por encima del límite recomendado (100 μg/L) en la totalidad de las muestras de la capa freática y sólo en el 8,33% de las muestras de pozos semisurgentes.
Conclusiones
En este trabajo se analizó el contenido de V en muestras de agua de bebida animal en el sudeste de la Provincia de Córdoba. En función de los resultados obtenidos, se realizaron correlaciones entre la concentración de este elemento y otros parámetros analizados encontrándose que las muestras de agua de la capa freática pueden diferenciarse claramente en dos grupos. La concentración de V es notablemente mayor en las aguas de la capa freática, superando en todos los casos el límite recomendado para agua de bebida animal (100 μg/L)13. Sólo en una pequeña fracción de las muestras provenientes de pozos semisurgentes (8,33%), los niveles de V superaron el límite recomendado para el ganado. Los valores de V encontrados en las muestras de agua analizadas indican que el agua proveniente de la capa freática tampoco sería adecuada para la irrigación, ya que las muestras presentan concentraciones superiores al límite establecido para dicho uso (100 μg/L)13. De la comparación de los parámetros fisicoquímicos en los dos grupos de muestras de la capa freática se observó que aquellas donde las concentraciones de V y As son altas, el contenido de sales es bajo. Con lo cual; el agua proveniente del nivel freático es de mala calidad para el ganado bovino, tanto por su elevado contenido de elementos traza (grupo FB) como por su elevado contenido de sales (grupo FA). Por otro lado, el agua proveniente de perforaciones semisurgentes sería la de mejor calidad para la producción ganadera, si se consideran los valores máximos recomendados para cada uno de los parámetros analizados.
Asimismo, se observó que, en la región estudiada y para el agua de la capa freática, la conductividad se presentó como un indicador indirecto de la concentración de V, As F y, dado que las muestras con menor nivel de estos elementos se correspondían con las que presentaban los valores de conductividad más elevados, y un menor pH (grupo FA). Es posible que esta menor concentración de V se deba a que existe una menor disolución de los aniones del V, As y F a los niveles de pH hallados en ese grupo de muestras. En las aguas más profundas (semisurgentes) los bajos niveles de estos tres elementos traza pueden deberse a un origen diferente.
En la Argentina existen escasos estudios acerca de los niveles de elementos traza en el agua de bebida animal, y del impacto de los mismos en la calidad agroalimentaria, la salud y producción animal. No obstante, la elevada concentración de V hallada en el agua de bebida animal de los tambos estudiados en este trabajo sugiere la posibilidad de que representen un impacto negativo desde el punto de vista sanitario y productivo, como así también implican un riesgo de transferencia a los productos lácteos de consumo humano. Esto destaca la importancia de profundizar el análisis de la presencia de este elemento en el agua de bebida animal, su transferencia a alimentos y sus efectos sobre la salud bovina.
Agradecimientos: Se agradece a la Universidad de Buenos Aires y al CONICET por el financiamiento otorgado para la realización del presente trabajo. Agradecemos a Dra. Volpedo por sus sugerencias relacionadas con el análisis estadístico de los resultados obtenidos.
1. Barceloux, D.; Barceloux, D. Vanadium. Clin Toxicol. 1999; 37(2):265–278.
2. CCREM. Canadian water quality guidelines. Prepared by the Task Force on Water Quality Guidelines. 1987 [ Links ]
3. Crans, DC.; Tracey, AS. The chemistry of vanadium in aqueous and non aqueous solution. In ACS Sym Ser. 1998; 711:2-29 [ Links ]
4. Farías, S.; Casa, V.; Vázquez, C.; Ferpozzi, L.; Pucci, G.; Cohen, I. Natural contamination with arsenic and other trace elements in groundwaters of Argentine Pampean Plain. The Science of the Total Environment. 2003; 309:187-199. [ Links ]
5. Fiorentino, CE.; Paolini, JD.; Sequeira, ME.; Arosteguy, P. The presence of vanadium in groundwater of southeastern extreme the Pampean region Argentina. Relationship with other chemical elements. J Contam Hydrol. 2007; 93:122-129. [ Links ]
6. Francisca, FM.; Cebollada-Verdaguer MP.; Carro- Pérez ME. Distribución Espacial del Arsénico en las Aguas Subterráneas de la Provincia de Córdoba, Argentina. 2006. VIII Congreso de ALHSUD, Asociación Latinoamericana de Hidrología Subterránea para el Desarrollo. Paraguay. [ Links ]
7. Grant, R. Water quality and requirements for Dairy cattle, Institute of Agriculture and natural Resources. 1996, University of Nebraska, Available from: http:// ianrpubs.unl.edu/dairy [ Links ]
8. Gummow, B.; Bastianello, SS.; Botha, CJ.; Smith, HJC.; Basson, AJ.; Wells, B. Vanadium air pollution: a cuase of malabsortion and immunosuppression in cattle. Onderstepoort J Vet. 1994; 61: 303-316 [ Links ]
9. Gummow, B.; Botha, C.; Noordhuizen, J.; Hesterbeek, J. The public health implication of farming cattle in areas with high background concentration of vanadium. Prev Vet Med. 2005; 72:281-290. [ Links ]
10. Hernández García, ME.; Fernández Ruiz, L. Presencia de arsénico de origen natural en las aguas subterráneas del acuífero detrítico del Terciario de Madrid. Boletín Geológico y Minero. 2002; 113(2). [ Links ]
11. Holloway, CE.; Melnik, M. Vanadium coordination compounds: classification and analysis of crystallographic and structural data. Rev Inorg Chem. 1985; 7:75-159. [ Links ]
12. Kawachi, H. Micronutrients affecting adipogenesis in beef cattle. Anim Sci J. 2006; 77:463–471.
13. Ley 24.051 de Residuos peligrosos. Anexos del Decreto Reglamentario 831/93. [ Links ]
14. Markopoulou, S.; Kontargiris, E.; Batsi, C.; et al. Vanadium-induced apoptosis of HaCaT cells is mediated by c-fos and involves nuclear accumulation of clusterin. FEBS J. 2009; 276:3784–3799.
15. Mukherjee, B.; Patra, B.; Mahapatra, S.; Banerjee, P.; Tiwari, A.; Chatterjee, M. Vanadium - an element of atypical biological significance. Toxicol Lett. 2004; 150:135–143.
16. Nicolli, H.; O’Connor, T.; Suriano, J.; et al. Geoquímica del arsénico y otros oligoelementos en aguas subterráneas de la llanura sudoriental de la Provincia de Córdoba. Academia Nacional de Ciencia. Córdoba, Argentina. 1985.
17. Nicolli, H.; Suriano, J.; Gomez Peral, M.; Ferpozzi, L.; Balean, O. Groundwater contamination with arsenic and other trace elements in an area of the Pampa, Province of Córdoba, Argentina. Environ Geol Water S. 1989; 14:3-16. [ Links ]
18. Nriagu, JO. Ed. Vanadium in the environment. En: Adv. Environmental Science Technology. Jhon Wiley & Sons. Inc. New York, 1998. Vol. 30 & 31. [ Links ]
19. Pérez Carrera, A.; Fernández Cirelli, A. Problemática del arsénico en la llanura sudeste de la provincia de Córdoba. Biotransferencia a leche bovina. InVet. 2007; 9:132-135. [ Links ]
20. Pérez Carrera, A.; Pérez Gardiner, ML.; Fernández Cirelli, A. Presencia de arsénico en tejidos de origen bovino en el sudeste de la provincia de Córdoba, Argentina. InVet. 2010; 12(1), 59-67. [ Links ]
21. Pyrzyńska, K.; Wierzbicki, T. Determination of vanadium species in environmental samples. Talanta. 2004; 64(4), 823-829. [ Links ]
22. Pourret, O.; Dia, A.; Gruau, G.; Davranche, M.; Bouhnik-Le Coz, M. Assessment of vanadium distribution in shallow groundwaters. Chem. Geol. 2012; 294 , 89-102 [ Links ]
23. Ray, RS.; Basu, M.; Ghosh, B.; Samanta, K.; Chatterjee, M. Vanadium, a versatile biochemical effector in chemical rat mammary carcinogenesis. Nutr Cancer. 2005; 51:184–196.
24. Ray, RS.; Ranab, B.; Swanamia, B.; Venua, V.; Chatterjeea, M. Vanadium mediated apoptosis and cell cycle arrest in MCF7 cell line. Chem Biol Interac. 2006; 163:239–247
25. Teng, Y.; Yang, J.; Sun, Z.; Wang, J.; Zuo, R.; Zheng, J. Environmental vanadium distribution, mobility and bioaccumulation in different land-use Districts in Panzhihua Region, SW China. Environ mon assess. 2011; 176(1-4):605-620. [ Links ]
26. Valko, M.; Morris, H.; Cronin, MTD. Metals, toxicity and oxidative stress. Curr Med Chem. 2005; 12:1161-1208 [ Links ]
27. Wang, L.; Medan, D.; Mercer, R.; et al. Vanadiuminduced apoptosis and pulmonary inflammation in mice: Role of reactive oxygen species. J Cell Physiol. 2003; 195:99–107.
28. Winter, M. Vanadium. Web Elements TM Periodic Table, Professional edition. The University of Sheffield and Web Ele-ments Ltd, U.K. http://www. webelements.com. Acceso: 18 de septiembre de 2013. [ Links ]
29. Wrigth, M.; Belitz, K. Factors Controlling the Regional Distribution of Vanadium in Groundwater. Ground Water. 2010; 48(4):515–525














