Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
InVet
versión On-line ISSN 1668-3498
InVet vol.18 no.2 Ciudad Autónoma de Buenos Aires dic. 2016
ARTÍCULO DE INVESTIGACIÓN
Presencia de cromogranina a en el duodeno fetal y adulto de Myocastor coypus bonariensis (coipo)
Eyheramendy, V1; Ortega, H.2,3; Baravalle, C.2,3; Felipe, A.1
1UNCPBA, Fac. Cs. Veterinarias, Área de Cs. Morfológicas, Grupo de Investigaciones Biológicas.
2UNL, Facultad de Cs. Veterinarias, Departamento de Ciencias Morfológicas.
3CONICET.
Correspondencia e-mail: Verónica Eyheramendy veyheramendy@yahoo.com.ar
Recibido: 10/01/2016
Aceptado: 14/12/2016
Resumen
El objetivo de este trabajo fue identificar la presencia y localización de células secretoras de hormonas en el duodeno del coipo (Myocastor coypus bonariensis) tanto en estadios fetales como en el adulto mediante la utilización de un anticuerpo policlonal anticromogranina A. Se trabajó con duodenos de fetos de 60, 75, 90, 105, 120 y 135 días poscoito (dpc) y de adultos. Las muestras se fijaron en formol bufferado al 10%, se procesaron con técnicas histológicas de rutina y se efectuaron cortes seriados de 5 mm. Para la determinación de células secretoras de hormonas se utilizó el método avidina-biotina-peroxidasa. En adultos, la cromogranina A fue identificada en células subyacentes a los enterocitos del epitelio de revestimiento de las vellosidades y formando parte del epitelio de revestimiento de las criptas de Lieberkhün. En los cortes de duodeno de fetos de 90 dpc se identificaron células inmunopositivas localizadas entre las células epiteliales. En los fetos de 120 y 135 dpc, las células inmunopositivas mostraron una distribución heterogénea y diversidad morfológica.
Palabras clave: Duodeno; Coipo; Cromogranina A; Myocastor coypus; Feto.
Presence of chromogranin A in the duodenum of fetal and adult Myocastor coypus bonariensis (coypus)
Summary
The aim of the present study was to identify the presence of hormonal secretory cells and localize them in the fetal and adult duodena of the coypu (Myocastor coypus bonariensis), using a polyclonal antibody developed for detection of chromogranin A. Duodena from fetus aging 60, 75, 90, 105, 120 and 135 days post-coitum (dpc), and from adults were used. Samples were fixed and then embedded in paraffin until analysis. Serial cuts of 5 mm were obtained and were processed with routine histological techniques. An immunohistochemical technique (avidin-biotin-peroxidase) was used to detect the hormonal secretory cells. In adults, chromogranin A was identified in cells next to the enterocytes of the surface epithelium of the intestinal villi and in the luminal epithelium of Lieberkhün crypts. In fetal duodenum of 90 dpc, positive cells were detected between the epithelial cells, while in the duodenum of fetus of 120 and 135 dpc, the positive cells were distributed heterogeneously and showing morphological diversity.
Key words: Duodenum; Coypu; Chromogranin A; Myocastor coypus; Fetus.
Introducción
El desarrollo prenatal del tracto gastrointestinal está caracterizado por cambios estructurales y funcionales en el epitelio intestinal que muestra marcadas diferencias en los estadios de maduración entre especies de mamíferos al momento del nacimiento15. La diferenciación citológica del intestino implica modificaciones en sus componentes tisulares y la aparición de tipos celulares específicos como las células endócrinas. De acuerdo con estudios realizados en humanos es posible identificar durante el desarrollo distintas líneas celulares en el epitelio gastrointestinal, entre las que se incluyen células enteroendócrinas13. Para su identificación puede utilizarse la técnica de inmunohistoquímica en secciones de tejido fijado en formol que permite la identificación de cromogranina A3, 13. Las cromograninas son una familia de glicoproteínas sulfatadas presentes en gránulos secretorios de muchas células endocrinas y neuroendocrinas juntamente con aminas y péptidos regulatorios6. Las cromograninas participan en actividades como la inhibición enzimática, son precursoras de péptidos funcionales y junto a otras proteínas sinápticas tienen un papel importante en la biogénesis de gránulos secretorios, incluso en ausencia de hormonas4, 5. Las cromograninas han sido utilizadas en otras especies como un marcador común a todas las células endocrinas. Al presente no existen datos sobre la presencia ni la ontogenia de células endocrinas en el epitelio gastrointestinal del coipo (Myocastor coypus). Este roedor integra el Suborden Hystricognathi que incluye varias especies sudamericanas que son utilizadas como animales de laboratorio (Cavia porcellus, Octodon degu, Cavia aperea, Galea musteloides y Chinchilla laniger). El objetivo de este trabajo fue identificar en el duodeno del coipo en estadios fetales y en el adulto la presencia y localización de células secretoras de hormonas a través de la utilización de un anticuerpo policlonal anticromogranina A.
Materiales y métodos
Se trabajó con muestras museológicas de duodenos fetales de 60, 75, 90, 105, 120 y 135 días poscoito (dpc) y de adultos (edad media de 6 ± 1.03 meses) pertenecientes a M. coypus de la subespecie bonariensis. Las muestras, preservadas en formol tamponado, se procesaron con técnicas histológicas de rutina hasta su inclusión en parafina. Se efectuaron cortes seriados de 5 mm que se montaron en portas silanizados. Para la determinación de células secretoras de hormonas se realizó una técnica inmunohistoquímica indirecta2, 10. A los cortes desparafinados se les realizó recuperación antigénica, bloqueos de peroxidasa endógena y de uniones inespecíficas. El tratamiento de recuperación antigénica se realizó en microondas (potencia máxima 1000 W). Como solución se usó buffer citrato 0,01 M pH 6,0, el cual se calentó 3 minutos a 100% de potencia y 12 minutos a 40%, dejando luego enfriar los cortes por 20 minutos en la misma solución. Se utilizó un anticuerpo primario policlonal anticromogranina A (Rabbit Anti-Chromogranin A Polyclonal Antibody-Zymed CAT. Nº 18-0094), un anticuerpo secundario biotinilado, luego estreptavidina-peroxidasa y finalmente la reacción fue revelada utilizando 3,3' diaminobencidina como cromógeno. Se realizó la contracoloración nuclear con hematoxilina activada. Para cada tiempo de desarrollo se determinaron la morfología y el patrón de distribución de células endócrinas. Las microfotografías fueron realizadas con el programa fotográfico LASEZ (Leica Application Suite EZ®). Para la obtención de datos morfométricos se utilizó un analizador con frame graber y software Q-win plus de Leica®. El programa fue calibrado de acuerdo al aumento de las microfotografías.
Resultados
Etapa adulta:
La cromogranina A como indicador de la presencia de células secretoras de hormonas fue identificada en células subyacentes a los enterocitos del epitelio de revestimiento de las vellosidades (Fig. 1 A), tanto en lateral de las mismas como en sus bases (Fig. 1 B), y formando parte del epitelio de revestimiento de las criptas de Lieberkhün (Fig. 1 B).
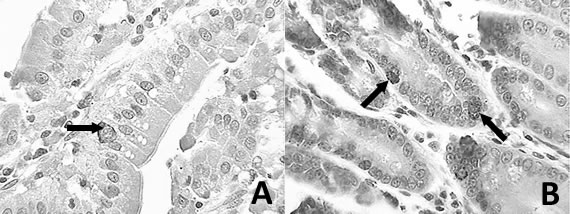
Figura 1. Microfotografías del duodeno en la etapa adulta mostrando células inmunopositivas (flechas) subyacentes al epitelio de revestimiento en lateral las vellosidades (A) e integrando el epitelio de las criptas (B). 100 x. Barra: 25 μm.
Etapas fetales:
No se observaron células inmunopositivas a cromogranina A en duodenos fetales de 60 y 75 dpc. En los cortes de duodeno a los 90 dpc se identificaron células inmunopositivas a cromogranina A que se localizaron entre las células epiteliales. Mostraron un núcleo redondeado y un tamaño promedio de 20.12 ± 0.6 μm. En los fetos de 120 y 135 dpc las células inmunopositivas para cromogranina A se observaron intercaladas en el epitelio de revestimiento de las caras laterales (Fig. 2 A) y de las bases de las vellosidades (Fig. 2 B), como células basales en el epitelio y en disposición subepitelial A nivel de las criptas, integraron la capa epitelial y se presentaron también como subepiteliales. Con respecto a su morfología, las células localizadas entre los enterocitos fueron de tipo columnar, con una altura media de 22.09 ± 1.23 μm. Las dispuestas en la línea basal del epitelio presentaron forma piramidal y un diámetro medio de 16.22 ± 0.7 μm. Las células subepiteliales mostraron un aspecto ovoidal o estrellado con diámetro medio de 19.55 ± 0.5 μm.

Figura 2. Microfotografías de la distribución de células inmunopositivas para cromogranina A en fetos de 135 dpc. Se observan en disposición subepitelial en las caras laterales de las vellosidades (A) y en las criptas (B). 100x. Barra: 25 μm.
Discusión y conclusiones
Durante el desarrollo el endodermo se diferencia en distintos tipos de células gastrointestinales que originan los diferentes linajes epiteliales, incluyendo las células enteroendócrinas12, 14. El linaje enteroendócrino consiste al menos en 15 tipos celulares que se categorizan sobre la base de su morfología, localización, expresión de hormona peptídica y abundancia de marcadores moleculares específicos8, 11.
Las células endócrinas del intestino constituyen una parte relevante del sistema endócrino difuso. Las mismas presentan dos patrones reguladores de la secreción caracterizados por la presencia de vesículas grandes de núcleo oscuro (large dense core vesicles - LDCV) o microvesículas semejantes a las sinápticas (synaptic-like microvesicles - SLMV). La cromogranina A empleada en este trabajo para identificar la presencia y localización de las células endócrinas duodenales es uno de los marcadores específicos de las LDCV15. En el caso del coipo se identificaron células inmunopositivas a cromogranina A durante el desarrollo fetal. Las mismas estaban dispersas entre las células epiteliales de las vellosidades y entre las células epiteliales de las criptas de Lieberkühn. Durante el desarrollo del intestino en diferentes mamíferos Höcker & Wiedenmann8 observaron, como en el coipo, una distribución topográfica heterogénea de las subpoblaciones de células enteroendocrinas.
La localización y distribución de las células enteroendocrinas han sido objeto de investigación, al igual que su origen. Con respecto a este último aspecto, algunos investigadores sugieren un origen endodérmico en tanto otros les atribuyen ser derivadas de células de las crestas neurales. Los experimentos de seguimiento de linaje demostraron que todos los tipos celulares del epitelio intestinal, incluyendo las células enteroendocrinas, se diferencian de células madre de las criptas y derivan del endodermo1, 11. Gunawardene et al.7, en una extensa revisión bibliográfica, señalan que los trabajos sobre el desarrollo embrionario se las células enteroendocrinas se han efectuado en ratones de laboratorio. En ellos se han identificado al menos tres factores de transcripción que intervienen en la diferenciación de las células enteroendocrinas (Math1, Neurogenin 3 y NeuroD)11. Math1 se activa inicialmente en las criptas y vellosidades intestinales y determina los linajes de todas las células secretoras. La expresion de Neurogenin 3 y NeuroD es necesaria para la diferenciación específica de células enteroendocrinas16. El proceso de diferenciación comienza con la proliferación de células pluripotentes en la base de las criptas y progresa, con la migración de las células hijas, en dirección apical. A nivel del tercio medio de las criptas se ubicaría un área de transición. Las células que continúan avanzando están destinadas a convertirse en enterocitos y células caliciformes, en tanto las que se detienen serían, en general, las enteroendocrinas7. Este patrón de diferenciación y localización de las células enteroendocrinas en un eje basal-apical de las criptas se asocia con un eje proximaldistal en el tracto gastrointestinal que ha sido observado en ratones y en ratas Wistar8.
1. Barker, N.; Clevers, H. Tracking down the stem cells of the intestine: strategies to identify adult stem cells. Gastroenterol. 2007; 133:1755-60. [ Links ]
2. Canaff, L.; Bevan, S.; Wheeler, D.G.; et al. Analysis of molecular mechanisms controlling neuroendocrine cell specific transcription of the chromogranin A gene. Endocrinol. 1998; 139 (3):1184-96. [ Links ]
3. Cetil, G.; Grube, D. Inmunoreactivies for chromogranin A and B, and secretogranin II in the guinea pig enteroendocrine system: cellular distributions and intercellular heterogeneities. Cell Tissue Res. 1991; 264(2):231-41. [ Links ]
4. El-Salhy, M.; Vaali, K.; Dizdar, V.; Hausken, T. Abnormal small intestinal endocrine cells in patients with irritable bowel syndrome. Dig Dis Sci. 2010; 55:3508-13. [ Links ]
5. El-Salhy, M.; Gilja, O.H.; Gundersen, D.; Hatlebakk, J.G.; Hausken, T. Duodenal Chromogranin A Cell Density as a Biomarker for the Diagnosis of Irritable Bowel Syndrome. Gastroenterol Res Pract. 2014; 18 (1):23-6. [ Links ]
6. Facer, P.; Bishop, A.E.; Lloyd, R.V.; Wilson, B.S.; Hennessy, R.J.; Polak, J.M. Chromogranin: a newly recognised marker for endocrine cells of the human gastrointestinal tract. Gastroenterol. 1985; 89: 1366-73. [ Links ]
7. Gunawardene, A.R.; Corfe, B.M.; Staton, C.A. Classification and functions of enteroendocrine cells of the lower gastrointestinal tract. Int. J. Exp. Path. (2011), 92, 219-231. [ Links ]
8. Höcker, M.; Wiedenmann, B. Molecular mechanisms of enteroendocrine differentiation. Ann N Y Acad Sci. 1998; 859:160-74. [ Links ]
9. Holle, G.E., Dietl, J.; Demir, I. Influence of the intramural innervation on the morphogenesis of the enteroendocrine cells and genetic construct involved (review). Int. J. Mol. Med. 2003; 11:275-285. [ Links ]
10. Huttner, W.B.; Gerdes, H.H.; Rosa, P. The granin (chromogranin/secretogranin) family. Trends Biol. Sci. 1991; 16:26-30. [ Links ]
11. Lee, C.S.; Kaestner, K.H. Clinical endocrinology and metabolism. Development of gut endocrine cells. Best Pract. Res. Clin. Endocrinol. Metab. 2004; 18 (4):453-62. [ Links ]
12. May, C.L.; Kaestner, K.H. Gut Endocrine Cell Development. Mol Cell Endocrinol. 2010; 323(1):70- 75. [ Links ]
13. Noah, T.K.; Donahue, B.; Shroyer, N.F. Intestinal development and differentiation. Exp Cell Res. 2011; 317(19):2702-10. [ Links ]
14. Pácha, J. Development of intestinal transport function in mammals. Physiol Rev. 2000; 80(4):1633-67. [ Links ]
15. Puzyrev, A.; Ivanova, F.V.F.; Kostiukevich, V.S.V. Regularities of cytogenesis in the endocrine gastroenteropancreatic system in vertebrates. Morfología 2003; 124(4):11-9. [ Links ]
16. Rindi, G.; Leiter, A.B.; Kopin, A.S.; Bordi, C.; Solcia, E. The "normal" endocrine cell of the gut: changing concepts and new evidences. Ann N Y Acad Sci. 2004; 1014:1-12. [ Links ]
17. Shroyer, N.F.; Helmrath, M.A.; Wang, V.Y.; Antalffy, B.; Henning, S.J.; Zoghbi, H.Y. Intestine-specific ablation of mouse atonal homolog 1 (Math1) reveals a role in cellular homeostasis. Gastroenterol. 2007; 132:2478-88. [ Links ]














