Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
InVet
versión On-line ISSN 1668-3498
InVet vol.18 no.2 Ciudad Autónoma de Buenos Aires dic. 2016
ARTÍCULO DE INVESTIGACIÓN
Desarrollo de una técnica de inmunodifusión para la detección del virus Sacbrood en abejas
Albo, GN.1*; Kuzmanich, R.1; Reynaldi, FJ.2,3; Picotto, LD.2,3; Sguazza, GH.3
1Curso de Producción Animal I. Facultad de Ciencias Agrarias y Forestales, UNLP,
2CCT-CONICET La Plata
3LAVIR (Laboratorio de Virología), Facultad de Ciencias Veterinarias, UNLP * e-mail: albo.graciela@yahoo.com.ar; Calle 60 y 118 s/n. Curso de Producción Animal I. FCAyF, UNLP. La Plata, Provincia de Buenos Aires. ARGENTINA
Recibido: 28/11/2016
Aceptado: 22/06/2017
Resumen
La apicultura es una de las actividades agrícolas más importantes de la República Argentina. En los últimos años se ha observado, a nivel mundial, una marcada disminución en el número de abejas. La mortalidad de las abejas, puede atribuirse a la interacción de factores ambientales, al manejo de las colonias o a la acción de diversos microorganismos, entre ellos los virus. Teniendo en cuenta que en la Argentina en este momento solamente se cuenta con técnicas de diagnostico moleculares para la detección de virus, el objetivo de este trabajo fue desarrollar un test de inmunodifusión que permita la detección del Virus de la Cría Ensacada de forma más sencilla y económica.
Para ello una cepa autóctona del virus Virus de la Cría Ensacada fue utilizada para inocular un conejo a partir del cual se obtuvieron anticuerpos específicos contra este virus, que posteriormente fueron utilizados para estandarizar la técnica de inmuodifusión. Esta técnica podría ser de gran utilidad en el futuro para realizar un relevamiento rápido de las condiciones sanitarias para SBV en colmenas de la República Argentina ya que debido a su baja complejidad podría ser llevada a cabo en laboratorios de baja complejidad de todo el país.
Palabras clave: Abejas melíferas; Virus; Cría ensacada; Inmunodifusión.
Development of an immunodiffusion technique for the detection of Sacbrood bee virus
Summary
Beekeeping is one of the most important agricultural activities in Argentine.In recent years, there has been a decrease in the number of bees worldwide. The mortality of bees can be attributed to several factors, such as the interaction of environmental factors, wrong management of colonies or the action of various patognes, including viruses. Considering that in Argentina, only molecular diagnostic techniques are available for the detection of viruses, the objective of this work was to develop an immunodiffusion test that allows the detection of the sacbrood bee virus as a simpler and Economical alternative. To developed the immunodiffusion test we use an indigenous virus strain of sacbrood was used to inoculate a rabbit from which specific antibodies were obtained against this virus. Later were used to standardize the immuodiffusion technique. This technique could be very useful in the future to carry out a rapid survey of the sanitary conditions for SBV in hives of Argentine, because due to its low complexity it could be carried out in laboratories of low complexity throughout the country.
Key words: Honey bees; Virus; Sacbrood; Immunodiffusion.
Introducción
La apicultura es importante para el hombre, fundamentalmente por el rol de la abeja melífera (Apis mellífera., L) en su desempeño como polinizador de cultivos10. La polinización no solo asegura la reproducción sexual en la mayoría de la plantas con flores, si no también, en forma indirecta la sustentabilidad productiva y el mantenimiento de la biodiversidad de la mayoría de los ecosistemas terrestres14. En particular la polinización producida por las abejas es necesaria para más del 35% de los cultivos del mundo que producen alimentos básicos para el hombre1.
Desde el punto de vista de la producción de miel, la apicultura es una de las actividades agrícolas más importantes de la República Argentina (en la actualidad, nuestro país ocupa el 5º lugar como productor mundial de miel) lo que representa un ingreso promedio anual cercano a los 100 millones de dólares, provenientes de la explotación de más de 4,5 millones de colmenas.
Desde octubre de 2006, comenzaron a producirse a gran escala, pérdidas inexplicables de abejas en Estados Unidos y la Unión Europea, que afectaron negativamente la oferta global de miel. El fenómeno, denominado âSíndrome de despoblamiento de las colmenasâ (SDC), fue en parte responsable de la disminución del 2% en la producción mundial de miel, desde 2006 hasta 2007. En la actualidad, el SDC sigue siendo un problema para la producción y el comercio de miel; particularmente en Estados Unidos y la Unión Europea, que han sido las regiones más afectadas.
Las abejas son susceptibles de padecer enfermedades causadas por distintos tipos de parásitos, hongos, bacterias y virus. En los últimos años las enfermedades de origen viral de las abejas han adquirido un particular interés ya que han causado diversos problemas en países productores como en Estados Unidos5. Hasta el presente se han identificado 24 virus de abejas que infectan las colonias 6, 9. La mayoría de estos virus tienen un genoma de ARN de simple cadena con polaridad positiva y son clasificados como virus tipo Picornavirus 4, 12. Si bien muchos de estos virus con frecuencia existen en la colonia como infecciones latentes pueden multiplicarse rápidamente bajo condiciones de estrés y causar enfermedad.
En A. mellifera la enfermedad de la cría ensacada es producida por el virus Sacbrood, también conocido como SBV (de acuerdo a su sigla en inglés). El SBV pertenece al Género Iflavirus, Familia Iflaviridae, Orden Picornavirales. SBV es una de las virosis de abejas más extensamente distribuidas, encuentrandose en colonias de A. mellifera de todos los continentes.
En la cría en desarrollo el virus se multiplica en el interior de las glándulas dermales que recubren el cuerpo del insecto; dichas glándulas son las encargadas de segregar enzimas que desprenden la cutícula durante el proceso de muda. El virus inhibe la secreción de estas enzimas, por lo que la larva no puede desprenderse de su cutícula. Por lo tanto, las larvas van cambiando de color conforme progresa la enfermedad.
No obstante, SVB también se multiplica en abejas jóvenes sin causar síntomas aparentes2, esto permite que el virus persista en las colonias año a año, sin embargo no se observa un gran porcentaje de muerte de larvas porque las abejas adultas detectan y remueven la mayoría de las larvas en estadios tempranos de infección. Los brotes más comunes de esta enfermedad ocurren en primavera y a comienzos de verano o cuando el forraje es limitado3. Ya que los efectos de la infección viral no siempre son observables, existe un reto adicional en el diagnóstico y seguimiento de estas infecciones virales6. El conocimiento de la incidencia y diseminación de cada uno de estos virus a nivel mundial, es vital para la predicción de epizootias, lo cual permite, el control más efectivo de la enfermedad. Los datos epidemiológicos de la enfermedad también aportarían información sobre la causa de la resistencia de las abejas de América del Sur con respecto a las de América del Norte y Europa6.
En base a lo anterior, el objetivo de este trabajo fue el de desarrollar un método de doble inmunodifusión con el fin de simplificar el diagnostico de esta enfermedad. .
Materiales y Métodos
Aislamiento y purificación viral
Para el desarrollo de este trabajo se utilizó como punto de partida una cepa autóctona de SBV, previamente aislada en la Cátedra de Virología de la Facultad de Ciencias Veterinarias de la UNLP durante el año 2011. Con el fin de aumentar el título viral de esta muestra, se inoculo inicialmente 10μl de la suspensión viral en el abdomen de 15 pupas de abejas de 15 días de edad (pupas de ojos rojos), utilizando una jeringa Hamilton. Una vez inoculadas las pupas fueron mantenidas a 22°C (±1) durante tres días (para permitir la replicación del virus). Transcurrido el tiempo de incubación, se realizo un macerado en mortero con arena estéril de las pupas infectadas con solución fisiológica. El homogenizado obtenido fue clarificado por centrifugación a 5.000 g durante 15 minutos, y posteriormente esterilizado por filtración (con filtro de 0,22 μm) y almacenado a -70°C hasta su uso. De la misma manera que se explicó anteriormente, se realizaron dos nuevos pasajes del virus en un mayor número de pupas de abeja (40 y 100 pupas respectivamente).
La suspensión viral obtenida en los tres pasajes se concentró por centrifugación a 28.000 g durante 5 horas y posteriormente fue purificada por ultra-centrifugación en gradiente de sacarosa (20-60%) a 40.000 g en una Ultracentrífuga (Beckman, Modelo L8-80M) con un rotor de ángulo fijo (Type 50Ti) a 5ºC durante 6 horas.
La fracción que contenía las partículas virales fue finalmente concentrada por ultracentrifugación a 28.000 g durante 4 horas. El pellet que se obtuvo fue resuspendido en solución fisiológica, la suspensión obtenida de esta manera se esterilizo por filtración con filtro de 0,22 μm y conservada a -70° C hasta su posterior uso en los ensayos de obtención de anticuerpos. Para confirmar la presencia del virus en la fracción purificada se llevo a cabo un examen por microscopia electrónica. La identidad del virus purificado fue corroborada por medio de una RT-PCR que permite la detección de distintos virus de abejas (entre ellos SBV) previamente estandarizada en nuestro laboratorio13.
Obtención de anticuerpos anti-SBV
Para la obtención de anticuerpos específicos contra SBV, la solución de virus previamente purificada fue inoculada en un conejo de acuerdo al protocolo estándar16. Brevemente, la suspensión de virus purificado conteniendo aproximadamente 250 μg de proteínas virales totales fue combinada en partes iguales con adyuvante completo de Freund y se mezcló enérgicamente con ayuda de un vortex durante 5 minutos. La emulsión así obtenida (aproximadamente 1 cm3) fue inoculada en un conejo por vía subcutánea. A los 15 días post-inoculación se efectuó una segunda inoculación (1er booster) con las mismas condiciones descriptas anteriormente, pero utilizando adyuvante incompleto de Freund. A los 30 días posteriores a la primo-inoculación se realizó una tercera inoculación (2do booster) utilizando 500 μg de la solución de proteínas virales totales en solución acuosa (sin adyuvante). Todas las técnicas previamente descriptas fueron avaladas por el CICUAL (protocolo nº 58-4-16P).
Pasados los 45 días post-inoculación, una muestra de suero del conejo inoculado fue analizada por un ensayo de western blot con el fin de confirmar la presencia de anticuerpos contra el virus.
Western Blot
El análisis del suero por western blot se llevo a cabo de acuerdo al protocolo original de Towbin15. Inicialmente se sembraron 15 μl de la solución viral (la misma con que se inoculó el conejo) en un gel de poliacrilamida al 12,5%. Luego de la electroforesis el gel se equilibro con un buffer de transferencia (48 mM Tris, 39 mM Glicina y 20% metanol - pH 9.2) y se transfirió a una membrana de nitrocelulosa, previamente humedecida en el mismo buffer, aplicando una corriente transversal de 15 V durante 30 min. Una vez realizada la transferencia, la membrana se bloqueo con una solución de PBS conteniendo 5% de leche en polvo durante toda la noche a 4ºC. Al día siguiente la membrana se incubó con una dilución 1:500 del suero obtenido del conejo durante 2 hs a 37ºC con agitación suave, luego se realizaron 3 lavados con PBS con 0.1% de Tween-20. Finalmente la membrana se incubó con una dilución 1:2000 del segundo anticuerpo (anti-conejo marcado con peroxidasa) durante 2 hs a 37º con agitación suave. El revelado se realizó incubando la membrana en una solución de diaminobencidina y agua oxigenada. También se utilizo como control negativo, un suero normal de conejo en las mismas condiciones previamente descriptas.
Desarrollo del test inmunodifusión
Una vez que se comprobó la presencia de anticuerpos en el conejo inoculado, este fue sangrado. El suero obtenido se fracciono en alícuotas y se conservaron a -20°C para su posterior uso en el desarrollo de la prueba de inmunodifusión. La técnica de inmunodifusión se realizó en placas de Petri de acuerdo al método de Ouchterlony8. Para ello, se realizaron perforaciones en el gel con un sacabocados de 6 pocillos periféricos alrededor de un pocillo central (en forma de roseta). El suero específico anti-SBV fue colocado en el pocillo central y el antígeno control (virus purificado) en tres pocillos exteriores alternados, mientras que las muestras a probar en los fueron sembradas en los tres pocillos restantes. Finalmente la placa fue incubada en atmósfera de humedad dentro de un rango de temperatura de 20 a 25ºC y se realizó la lectura de las líneas de precipitación utilizando una luz puntiforme a las 24-48 hs.
Para conseguir las condiciones óptimas de precipitación, en primer lugar se probaron distintas cantidades de salinidad y pH del agar y posteriormente se estandarizaron las concentraciones de antígeno y anticuerpos. Una vez puesta a punto la técnica, se analizaron 40 muestras de campo obtenidas a partir del sobrenadante del macerado de 15 abejas en 2 ml de PBS provenientes de distintos colmenares de la provincia de Buenos Aires. Todos los resultados obtenidos por la prueba de inmunodifusion (tanto positivos como negativos) fueron confirmados por medio de una RT-PCR13.
Resultados
Aislamiento y purificación viral
La suspensión viral obtenida luego de los tres pasajes por pupas fue concentrada y parcialmente purificada por ultra-centrifugación (Figura 1A). La fracción purificada fue analizada por microscopia electrónica para confirmar la presencia del virus, observándose partículas virales correspondientes a virus sin envoltura, con simetría icosaédrica y un diámetro de aproximadamente 30nm, consistente con las características esperadas para un picornavirus (Figura 1B). Para corroborar la identidad del virus purificado se realizó una RT-PCR, por medio de la cual pudo observarse la presencia de una banda de aproximadamente 350pb (Figura 1C), lo cual se condice con el tamaño esperado del fragmento amplificado a partir del virus SBV (342pb).
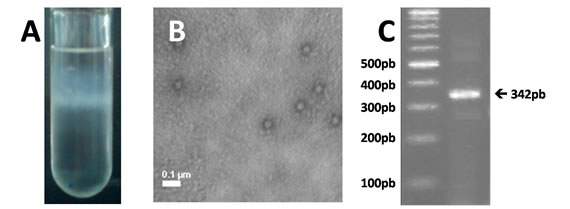
Figura 1. A: Purificación del virus por ultra-centrifugación. B: Micrografía electrónica de la muestra de virus purificado
Obtención de anticuerpos anti-SBV
Al analizar por Western Blot una muestra de suero del conejo inoculado (a los 45 días posteriores a la primer inoculación), se observó la presencia de varias bandas especificas para el virus SBV, de aproximadamente 25, 34, 37 y 44 KDa que pueden corresponder a las proteínas estructurales de virus y una banda de gran intensidad con un peso estimado de 80 KDa, posiblemente debido a la presencia de la pre-proteína VP0. Mientras que al realizar este mismo ensayo utlilizando un suero normal de conejo (control negativo) no se observo la presencia de ninguna de estas bandas (Figura 2).

Figura 2. Western blot. 1: Suero del conejo inoculado; 2: Marcador de peso molecular PegeRuler (Fermentas); 3: Suero normal de conejo (control negativo).
Desarrollo del test inmunodifusión
Para conseguir las condiciones óptimas de precipitación, en primer lugar se probaron distintas cantidades de salinidad y pH del agar. De todas las condiciones analizadas, la mejor definición de las líneas de precipitación fue conseguida con un gel a pH de 8.6, conteniendo un 1% de agar noble, 9% de acido bórico y 2% de hidróxido de sodio (Figura 3).

Figura 3. Inmunodifusion en gel de agar: Ag: Antigeno (Virus purificado); S+: Suero Control Positivo (obtenido a partir de la inoculacion del conejo); S-: Suero Control Negativo (proveniente de un conejo normal, sin inocular).
Una vez que se hallaron las condiciones óptimas para la precipitación, se estandarizaron las concentraciones de antígeno (virus purificado) y anticuerpos (suero de conejo) Con el fin de obtener una línea de precipitación nítida y equidistante entre el pocillo central y los pocillos periféricos. Una vez puesta a punto la técnica, se analizaron 40 muestras de campo obtenidas a partir del sobrenadante del macerado de 15 abejas en 2 ml de PBS provenientes de distintos colmenares de la provincia de Buenos Aires. Para el análisis de las muestras tomadas a campo, el suero específico anti-SBV fue colocado en el pocillo central y el antígeno control (virus purificado) fue sembrado en tres pocillos exteriores alternados. Las muestras a probar en los fueron sembradas en los tres pocillos restantes. Luego de las 48hs de incubación se procedió a la lectura de los resultados considerando positivas aquellas muestras formaban una línea continua (línea de identidad) con las líneas correspondientes a los pocillos de antígeno control flanqueantes (por ejemplo Figura 4 muestras 1 y 2). Las muestras en que solo aparecieron las líneas de los controles del antígeno, fueron consideradas negativas (Figura 4, muestra 3).

Figura 4. Resultados obserbados de la Inmunodifusion. Ag: Antigeno (Virus purificado); S+: Suero Control Positivo (obtenido a partir de la inoculacion del conejo). Muesta 1 y 2 positivas. Muestra 3 negativa.
Por medio de esta técnica, 4 de las muestras analizadas (10% del total de muestras) resultaron positivas para SBV. Para confirmar los resultados obtenidos con la prueba de inmunodifusión, las 40 muestras de campo fueron analizadas por medio de una RT-PCR (utilizando el mismo protocolo ya descripto en la sección de Materiales y Métodos), obteniéndose una total concordancia en el resultado de ambas técnicas.
Conclusiones
En el presente trabajo se logro poner a punto una técnica serológica de inmunodifusión doble que permite la detección del virus SBV a partir de muestras de abejas. También se compararon diferentes técnicas (RT-PCR y Western Wlot) con el objetivo de incrementar las herramientas diagnósticas de modo de aumentar la detección temprana de casos positivos de SBV y poder definir el diagnóstico de esta enfermedad aún en colmenas asintomáticas De todas las técnicas ensayadas, Western Blot es sin duda la más laboriosa de las tres debido que requiere varias horas de desarrollo (48 - 72hs). Mientras que por su parte, si bien la RT-PCR es una técnica mucho más rápida, su costo es muy elevado en comparación con las otras técnicas ensayadas.
En cuanto a la técnica de Inmunodifusión en Gel de Agar (IDGA), si bien son necesarias 48 horas para emitir el diagnóstico, la misma posee una alta especificidad. Es una técnica muy sencilla y de bajo costo, lo que la convierte en una técnica apropiada para su implementación en el diagnóstico de esta enfermedad.
La IDGA ya ha sido adoptada como Gold Standard para el diagnóstico de muchas enfermedades de interés veterinario, como por ejemplo la Anemia Infecciosa Equina, la Leucosis Bovina y la Brucelosis. Para el diagnostico de estas enfermedades, la IDGA ha sido considerada como una técnica moderadamente sensible pero altamente especifica (con una especificidad en algunos casos cercana al 100%). En un trabajo previo (con características similares al aquí desarrollado) realizado por Ribiere et. al (2000)11 con el virus de la Parálisis Crónica de la Abeja se ha demostrado que el Western Blot es un método eficaz en el diagnóstico de esta infección. Simultáneamente con el Western Blot también desarrollaron una técnica de IDGA. Los autores concluyeron que si bien es menos sensible que el Western Blot, la IDGA es más sencilla, rápida y no requerir grandes cantidades de reactivos. La comparación de los resultados de ambas técnicas mostró una buena concordancia.
Por todo lo expuesto se podría proponerse a la IDGA como una técnica económica destinada al screening de un gran número de muestras y utilizar otras técnicas más laboriosas con la RT-PCR para la confirmación de las muestras sospechosas. .
1. Aizen, M.A. & L.D. Harder. The global stock of domesticated honey bees is growing slower than agricultural demand for pollination. Cur Biol. 2009: 19 (11): 915-18. [ Links ]
2. Bailey, L.; R.D. Woods & A.G. Gibbs. Sacbrood virus of larval honey bee (Apis mellifera Linnaeus ). Virol . 1964; 23: 425-29. [ Links ]
3. Bruno, S.B. Enfermedades de las abejas. Nociones prácticas. Ed. Ciencia y Abejas. Gral. Belgrano. Buenos Aires. 2003; 104 pp. [ Links ]
4. Chen, Y.P. & R. Siede. Honey bee viruses. Advances in: Virus research. Maramorosch, K., A. J. Shatkin & F. A. Murphy. Ed. Elsevier Acad Press Inc., San Diego, 2007. 33-80 pp. [ Links ]
5. Cox-Foster, D.L.; S. Conlan, E.C.; Holmes, et al. A metagenomic survey of microbes in honey bee collapse disorder. Sci 2007.318: 283-87. [ Links ]
6. Freiberg, M.: D. De Jong, D.; Message, D.; Cox-Foster. First report of sacbrood virus in honey bee (Apis mellifera) colonies in Brazil. Gen Mol Res 2012; 11 (3): 3310-14 pp. [ Links ]
7. Genersch, E. & M. Aubert. Emerging and re-emerging viruses of the honey bee (Apis mellifera). Vet Res. 2010; 41 (6): 54. [ Links ]
8. Ouchterlony, O. Diffusion-in-gel methods for immunological analysis. Allergy 1958; 5: 1-78. [ Links ]
9. Mc Menamin A.J. & Genersch E. Honey bee colony losses and associated virus. Curr. Opin. Insect. Sci. 2015; 8: 121-129 [ Links ]
10. Rader R.; Howlett, B.G.; Cunningham, S.A.; et al. Alternative pollinator taxa are equally efficient but not as effective as the honeybee in a mass flowering crop. J Appl Ecol 2009; 46: 1080-87. [ Links ]
11. Ribiere M.; Faucon J.P. & Pépin M.. Detection of chronic honey bee (Apis mellifera L.) paralysis virus infection: application to a field survey. Apidologie 2000.; 31: 567-77. [ Links ]
12. Runckel, C., Flenniken, M.L.; Engel, J.C.; et al. Temporal analysis of the honey bee microbiome reveals four novel viruses and seasonal prevalence of known viruses, nosema and aethidia. PLoS ONE. 2011: 6 (6): e20656. doi:10.1371/journal.pone.0020656 [ Links ]
13. Sguazza, G.H., Reynaldi, F.J., Galosi, C.M., Pecoraro, M.R. (2013) Simultaneous detection of bee viruses by multiplex PCR. Journal of Virological Methods, 194: 102-106. [ Links ]
14. Spivak, M.; Mader, E.; Vaughan, M.; & Euliss, Jr. N.H. The Plight of the bees. Env Sci & Tech 2011; 45: 34-8. doi: 10.1021/es101468w. [ Links ]
15. Towbin, H.; Staehelin T. & Gordon, J.. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc Nat Acad Sci 1979; USA 76: 4350-54. [ Links ]
16. Vaitukaitis, J.; Robbins, J.B.; Nieschlag E. & Ross, G.T. A method for producing specific antisuera with small doses of immunogen. J Clin Endocrinol Metab 1971.; 33: 988-91. [ Links ]














