Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
InVet
versión On-line ISSN 1668-3498
InVet vol.18 no.2 Ciudad Autónoma de Buenos Aires dic. 2016
ARTÍCULO DE INVESTIGACIÓN
Farmacocinética plasmática, concentraciones tisulares y urinarias de cefuroxima en gatos luego de su administración parenteral*
Lorenzini, PM1; Passini, SM1; Lupi, MP1; Montoya, L1; Landoni, MF2; Albarellos, GA1
1Universidad de Buenos Aires, Facultad de Ciencias Veterinarias, Cátedra de Farmacología.
2Universidad Nacional de La Plata, Facultad de Ciencias Veterinarias, Cátedra de Farmacología.
*Premio Estímulo a la Investigación Científica 2015 (Resolución CD Nº 3055/17). Categoría: Alumnos de la Facultad de Ciencias Veterinarias de la Universidad de Buenos Aires.
Recibido: 30/09/2016
Aceptado: 05/09/2017
Correspondencia e-mail: Paula Lorenzini pmlorenzini@gmail.com
Resumen
Cefuroxima es una cefalosporina de segunda generación que incluye en su espectro antibiótico a cocos gram-positivos, bacilos gram-negativos y anaerobios. El objetivo de este trabajo es caracterizar la farmacocinética plasmática de cefuroxima en gatos luego de su administración por vía intravenosa, intramuscular y subcutánea, y determinar la concentración de cefuroxima en algunos tejidos y en la orina de los animales. Luego de la administración del antibiótico (20 mg/kg), se tomaron muestras sanguíneas y de orina durante 8 horas y muestras de tejidos entre las 1-1,5 horas. Los principales parámetros farmacocinéticos (media±desvío estándar) para la administración intravenosa fueron: concentración inicial (μg/mL): 135,46±81,42; vida media de eliminación (h): 0,21±0,15. Para las administraciones intramuscular y subcutánea los principales parámetros farmacocinéticos fueron respectivamente: concentración máxima (μg/mL): 48,65±6,71 y 28,17±8,44, tiempo de la concentración máxima (h): 0,18±0,06 y 0,82±0,30, y vida media de eliminación (h): 1,04±0,10 y 1,59±0,18. Las concentraciones (μg/g) en tejidos estuvieron entre 3, 35±0,65 y 23.02±8.77. Al cabo de 8 horas se recuperó en la orina el 78,09±24,59% de la dosis administrada. Estos resultados indicarían que cefuroxima administrada a una dosis de 20 mg/kg por las vías estudiadas sería de utilidad para el tratamiento de infecciones producidas por microorganismos susceptibles en gatos.
Palabras clave: Farmacocinética; Cefuroxima; Gatos; Antibióticos; Cefalosporinas.
Cefuroxime plasma pharmacokinetics, tissue and urine concentrations after parenteral administration to cats
Summary
Cefuroxime is a second generation cephalosporin active against gram-positive cocci, gramnegative rods and anaerobes. The aim of the present study is to characterize cefuroxime plasma pharmacokinetics after intravenous, intramuscular and subcutaneous administration to cats; and, to determine cefuroxime concentrations in some tissues and in urine of the animals. After antibiotic administration (20 mg/kg), blood and urine samples were taken during 8 hours and, tissue samples at 1-1.5 hours. After intravenous administration, main pharmacokinetic parameters (mean±SD) were: initial plasma concentration (μg/mL): 135.46±81.42; half-life (h): 0.21±0.15. After intramuscular and subcutaneous administration, main pharmacokinetic parameters were, respectively: maximum plasma concentrations (μg/mL): 48.65±6.71 and 28.17±8.44; time of maximum plasma concentration were 0.18±0.06 h and 0.82±0.30 h; and, elimination half-life (h): 1.04±0.10 and 1.59±0.18. Tissue concentrations (μg/g) ranged between 3,35±0,65 and 23.02±8.77. After 8 hours, 78,09±24,59% of the administered cefuroxime was recovered from urine. The present results showed that cefuroxime, administered at a dosage of 20 mg/kg by intravenous, intramuscular or subcutaneous route, would be a useful tool for the infection treatment in cats when produced by susceptible microorganisms.
Key words: Pharmacokinetic; Cefuroxime; Cats; Antibiotics; Cephalosporins.
Introducción
Cefuroxima (CFU) es una cefalosporina de segunda generación que incluye en su espectro a cocos gram-positivos (Staphylococcuss pp, Streptococcuss pp), bacilos gram-negativos (Enterobacteriaceae) y anaerobios11. Hasta la fecha no hay información publicada sobre la susceptibilidad de bacterias de origen animal a CFU. Para aislamientos bacterianos humanos la concentración inhibitoria mínima (CIM) es de 1 μg/ml (CIM90 para estafilococos) y 4 μg/ ml (CIM90 para E. coli)9, 16.
La eficacia antibiótica de las cefalosporinas se relaciona con el tiempo en que las concentraciones plasmáticas superan la CIM (T>CIM), y se considera que un T>CIM=40-60% del intervalo posológico es necesario para una adecuada eficacia terapéutica8, 10, 15.
La farmacocinética de CFU ha sido descripta en seres humanos4, en animales de laboratorio12 y en algunos animales domésticos: cabras1, terneros14 y perros2.
Luego de la administración parenteral, CFU se caracteriza por distribuirse ampliamente en los tejidos y por eliminarse rápidamente en forma activa por riñón (por filtración glomerular y secreción tubular) con una vida media (t½) â1 h1, 2, 4, 7, 12.
Las indicaciones terapéuticas de CFU en pacientes humanos son para el tratamiento de infecciones causadas por microorganismos susceptibles localizadas en vías respiratorias altas y bajas y en otros tejidos blandos, en las vías urinarias y en huesos y articulaciones. También se la indica para la profilaxis de infecciones en el sitio quirúrgico en cirugías limpiascontaminadas y contaminadas de la cavidad abdominal7. CFU también sería de utilidad para indicaciones similares en los animales domésticos lo que determina el interés de su estudio en estas especies. Hasta la fecha no se registran publicaciones sobre la farmacocinética de CFU en gatos, por este motivo, el objetivo del presente trabajo es caracterizar la farmacocinética plasmática de CFU en gatos luego de su administración por vía intravenosa (IV), intramuscular (IM) y subcutánea (SC), como así también determinar la concentración de CFU en algunos tejidos y las concentraciones de CFU en la orina de los animales.
Materiales y Métodos
Para obtener las muestras de sangre, tejidos y orina, el estudio se diseñó con gatos que iban a ser esterilizados quirúrgicamente, para lo que se utilizó la sedación y anestesia de los animales para obtener las muestras plasmáticas, de orina y de los tejidos abordados durante el procedimiento quirúrgico.
Animales de experimentación
Se trabajó con gatos jóvenes (1,5±0,5 años) clínicamente sanos. Para la administración IV se utilizaron 7 animales (4 hembras y 3 machos), 8 para la IM (5 hembras y 3 machos) y 7 para la SC (6 hembras y 1 macho).
Antibiótico
Se empleó cefuroxima sódica (Cefuroxima Richet 1,5 g®, Richet, Argentina) diluida en agua destilada (100 mg/ml).
Diseño experimental
Las muestras de plasma y tejidos se obtuvieron durante procedimientos quirúrgicos estándares (ovariectomías y orquidectomías) que se realizaron por las técnicas convencionales y bajo anestesia general5.
Luego de un ayuno de 12 horas se realizó la anestesia de los animales, utilizando midazolam 0,2 mg/kg, IM (Midazolam®, Richmond VetPharma, Buenos Aires, Argentina), ketamina 10 mg/kg, IM (Ketonal 100®, Richmond VetPharma, Buenos Aires, Argentina), xilazina 0,5 mg/kg IV (Rompun®, Bayer, Buenos Aires, Argentina) y butorfanol 0.2 mg/kg SC (Butormin®, Holliday, Buenos Aires, Argentina).
Para la toma de muestras sanguíneas y la administración de fluidos (solución fisiológica, 10 ml/kg/h) se colocaron catéteres intravenosos en la vena cefálica antebraquial derecha. Las muestras de tejidos (en hembras: piel, subcutáneo, músculo, ovarios y útero; y en machos: piel, testículos y epidídimos) se tomaron durante la cirugía a 60-90 minutos luego de la administración de CFU. A los gatos a los que se les administró CFU IV se les colocó una sonda uretral para la recolección de toda la orina producida durante las primeras 8 horas posteriores a la administración de CFU.
El diseño y los procedimientos empleados con los animales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de Laboratorio (CICUAL) de la Facultad de Ciencias Veterinarias, Universidad de Buenos Aires (protocolo n° 2013/25).
Administración del antibiótico
Para las diferentes vías de administración se utilizó la misma dosis de CFU (20 mg/kg). La aplicación IV se realizó a través de la vena cefálica antebraquial izquierda, la IM se realizó en la musculatura lumbar y la SC sobre la parrilla costal.
Muestreo sanguíneo
Con jeringas heparinizadas se tomaron muestras de sangre (0,7 ml), previo a la administración del antibiótico y a los 5, 10, 20, 30, 45, 60, 90, 120, 180, 240, 360 y 480 minutos posteriores. Las muestras se centrifugaron (1500g, 15 minutos), se separó el plasma y se almacenó a -20°C hasta su procesamiento.
Muestreo tisular
Los tejidos muestreados se secaron con gasa estéril para minimizar el contenido de sangre. Se pesaron y almacenaron a -20ºC hasta su procesamiento. Este consistió en la homogenización de las muestras en solución de buffer fosfato pH 7 (1:2 p/v), posterior centrifugado y recuperación del sobrenadante que se empleó para determinar la concentración de CFU.
Muestreo de orina
Se recolectó la orina producida a intervalos de 1 hora durante 8 horas. Se midió el volumen y se guardó una muestra a -20°C hasta su procesamiento.
Determinación de la concentración de CFU en las distintas matrices biológicas
Dado que CFU no se metaboliza, el método microbiológico3 resulta apropiado para determinar sus concentraciones en todas las matrices biológicas. Se utilizó Kokuria rhizophila ATCC 9341 como cepa test. Se construyeron curvas estándar de CFU en plasma normal de gato, buffer fosfato pH 7 y en orina normal de gato para el cálculo de las concentraciones incógnitas de CFU en las muestras de plasma, tejidos y orina, respectivamente. Las curvas fueron lineales entre 0,39 y 50 μg/ml (r=0.9985), con coeficientes de variación intra e inter-día <8%. El límite de cuantificación del método fue de 0,78 μg/ml.
Para estimar el grado de penetración tisular de CFU, se calculó la relación entre la concentración en tejido y la correspondiente concentración plasmática al momento de la obtención de la muestra tisular (concentración tejido/concentración plasma).
Análisis farmacocinético
Con las concentraciones plasmáticas de CFU se construyeron las curvas de concentración plasmática de CFU en función del tiempo para cada uno de los animales estudiados. Estas se analizaron por regresión no-lineal usando un programa computarizado (Phoenix WinNonlin 6.3, 2005-2012; Certara, USA). El número de exponentes necesarios para cada vía de administración se determinó aplicando los criterios de Schwartz13 y Akaike17 y la distribución de los residuales alrededor de las concentraciones estimadas. Los parámetros farmacocinéticos se calcularon mediante ecuaciones clásicas asociadas al análisis compartimental6.
Análisis estadístico
Los parámetros farmacocinéticos se expresaron como media±DE. Mediante un test de ANOVA y un test de comparaciones múltiples de Tukey (GraphPadPrism, GraphPad Software, version 5.00, 2007, San Diego, CA, USA) se compararon estadísticamente los parámetros farmacocinéticos, las concentraciones en tejidos y las relaciones de concentración en tejidos/concentración plasmática para cada una de las vías de administración estudiadas. Se consideraron diferencias significativas si P<0,05.
Integración Farmacocinética / Farmacodinamia
Se estimó el T>CIM para las 3 vías de administración evaluadas. Debido a la falta de valores de CIM a CFU para aislamientos bacterianos animales, se utilizaron valores de CIM para aislamientos bacterianos humanos tomados de bibliografía (CIM90=1 μg/ml para estafilococos y CIM90=4 μg/ml para E. coli).
Resultados
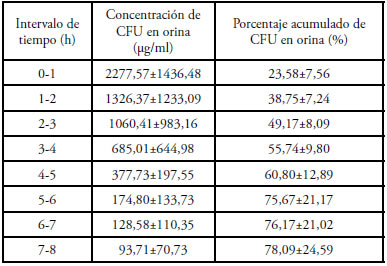
No se observaron efectos adversos en ningún animal ni durante ni después de la administración de CFU. Las curvas de concentración plasmática de CFU en función del tiempo se muestran en la Fig. 1. Para la administración IV el modelo farmacocinético que las describió mejor fue el bicompartimental abierto, mientras que para las vías IM y SC el modelo elegido fue el monocompartimental abierto. Los principales parámetros farmacocinéticos se muestran en la Tabla 1 y las concentraciones en tejidos y la relación entre las concentraciones en plasma/ tejido para cada vía de administración se muestran en la Tabla 2. Las concentraciones urinarias de CFU y los porcentajes acumulados de eliminación de CFU en orina luego de su administración IV se muestran en la Tabla 3.
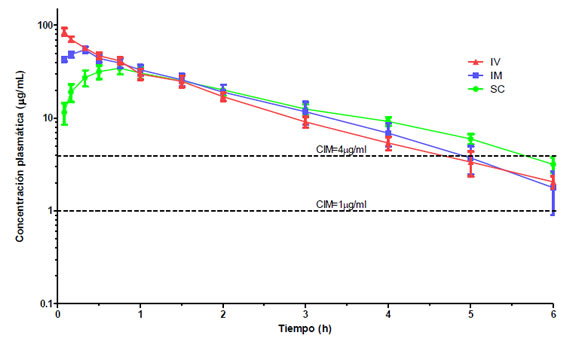
Figura 1. Concentración plasmática de CFU en función del tiempo luego de su administración IV, IM y SC (20 mg/kg) a gatos.
Tabla 1. Parámetros farmacocinéticos (media±DE) de CFU (20 mg/kg) administrada por vía IV (n=7), IM (n=8) y SC (n=7) a gatos.
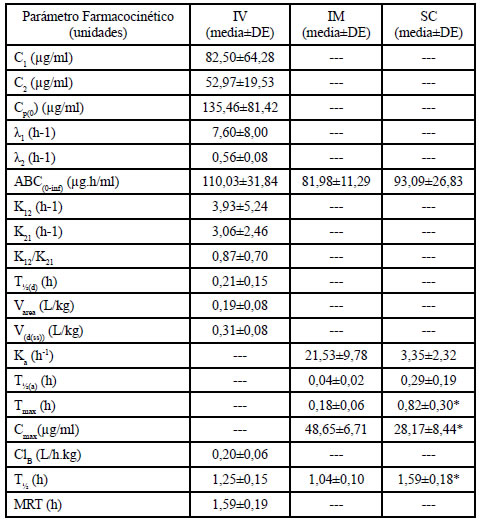
C1, C2 concentración al tiempo 0 de la fase de distribución y de eliminación, respectivamente; Cp(0) concentración plasmática al tiempo 0; λ1 constante de distribución; λ2 constante de eliminación; ABC(0-inf ) área bajo la curva de concentración plasmática en función del tiempo de 0 a infinito; K12 constante de pasaje del compartimiento central al periférico; K21 constante de pasaje del compartimiento periférico al central; t½(d) vida media de distribución; Varea volumen de distribución de la fase de eliminación; V(d(ss)) volumen de distribución en el estado estacionario; Ka constante de absorción; t½(a) vida media de absorción; Tmax tiempo de la concentración plasmática máxima; Cmax concentración plasmática máxima; ClB clearance corporal total; t½ vida media de eliminación; MRT tiempo medio de residencia. * Diferencias significativas (P<0,05)
Tabla 2. Concentraciones de CFU en tejidos luego de su administración por vía IV, IM y SC (20 mg/kg) a gatos
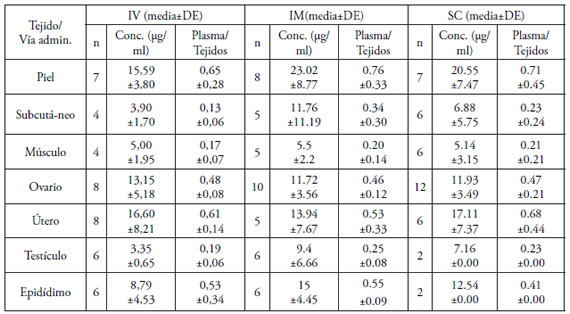
Tabla 3. Concentración urinaria de CFU luego de su administración IV a gatos (20 mg/kg) y porcentaje acumulado de la dosis administrada en la orina.
Discusión
El perfil farmacocinético de CFU en los gatos fue el esperado para un antibiótico betalactámico y resultó similar al informado para otras especies animales (cabras, terneros y perros)1, 2, 14.
Si bien en este trabajo se tomaron muestras sanguíneas durante 8 horas luego de la administración del antibiótico, las concentraciones de CFU solo fueron cuantificables durante las 6 primeras horas para todas las vías estudiadas. Luego de la administración IV de CFU las concentraciones plasmáticas iniciales fueron muy elevadas (Cp0: 135,46±81,42 μg/ml) y declinaron rápidamente (T½(d): 0,21±0,15) señalando una distribución muy rápida aunque aparentemente restringida al líquido extracelular (V(d(ss)): 0,31±0,08 L). La eliminación de CFU también fue relativamente rápida (ClB: 0,20±0,06 L/h.kg, t½: 1,25±0,15 h y MRT: 1,59±0,19 h) y, el 78,09±24,59% del total de la dosis administrada por vía IV se recuperó en la orina de las primeras 8 horas (Tabla 3). Por este motivo las concentraciones de CFU en orina fueron muy elevadas en todos los tiempos muestreados (Tabla 3) siendo siempre muy superiores a los valores de CIM de los posibles patógenos. Estos valores urinarios son similares a los informados para pacientes humanos4.
Luego de la administración IM, las concentraciones plasmáticas fueron significativamente mayores que luego de la administración SC (Cmax: 48,65±6,71 ug/ml y 28,17±8,44 ug/ml, respectivamente) y se alcanzaron antes (Tmax: 0,18±0,06 h y 0,82±0,30 h, respectivamente). Estas diferencias están en relación con una absorción retardada y más lenta luego de la administración SC que podría deberse a la menor irrigación propia de este tejido. Hallazgos similares han sido informados en perros2. La t½ fue significativamente mayor luego de la administración SC que luego de la IV o IM (Tabla 1). Estas diferencias se evidencian en la Fig. 1 donde las concentraciones de CFU SC permanecen â1,5 hora más por encima de una CIM=4 μg/ml que cuando administrada por vía IV o IM. Esto se traduce en una ventaja terapéutica práctica para la administración SC de CFU en gatos ya que permitiría un mayor intervalo posológico.
Las concentraciones de CFU en los tejidos para todas las vías estudiadas (Tabla 2) siempre fueron mayores que valores de CIM=4μg/ml. No se hallaron diferencias significativas entre las distintas vías para las concentraciones de CFU en cada tejido, ni entre las relaciones concentración plasma/tejido. Sin embargo debe considerarse que los valores calculados de concentración de CFU en los tejidos mostraron una gran variación individual y que en el caso de la vía SC los tejidos de gatos machos estuvieron poco representados (1 solo animal). La gran variación inter-individual observada pudo responder a factores relativos al método de procesamiento de las muestras (homogeneizado tisular), a los tiempos de extracción de las mismas (rango entre 60-90 minutos post-administración del antibiótico) o bien a variabilidad individual entre los animales empleados.
Las relaciones de concentraciones plasma/ tejido (Tabla 2) siempre se encontraron por debajo de la unidad, lo que ratifica una distribución predominantemente extracelular. Los valores de estos índices para cada tejido mostraron una gran constancia al comparar las distintas vías de administración. Esto estaría relacionado con las particularidades de perfusión sanguínea propias de cada tejido (mayor para tejidos tales como útero, ovarios y piel y, menor para testículo y subcutáneo).
Al estimar el T>CIM (Fig. 1) se observa que para valores de CIM=1μg/ml, todas las vías de administración estudiadas mantienen concentraciones de CFU muy superiores a este valor por más de 6 horas. En cambio, para CIM=4μg/ml, la vía IV e IM permanecen por â4,5 h y la SC por â5,5 h. Para estos valores los intervalos posológicos de CFU en gatos serían cada â9 h para las vías IV e IM y de â11 horas para la administración SC.
Conclusiones
Dado que no hay información bibliográfica sobre la farmacocinética de CFU en gatos consideramos que los resultados obtenidos en el presente estudio son un aporte valioso para orientar el uso racional de este antibiótico en esta especie animal. CFU en una dosis de 20 mg/kg cada 9-11 horas (según la vía de administración) sería de utilidad para el tratamiento de infecciones en gatos producidas por microorganismos susceptibles. Este esquema posológico aseguraría el éxito terapéutico minimizando la posibilidad de aparición de cepas bacterianas resistentes. CFU a 20 mg/ kg también sería una opción adecuada para la profilaxis de infecciones en el sitio quirúrgico en cirugías de cavidad abdominal.
1. Abo El-Sooud, K.; El-Banna, H.A.; Hanafy, M.S.M.; Goudah, A. Pharmacokinetics and intramuscular bioavailability of cefuroxime sodium in goats. Res Vet Sci. 2000; 69: 219-24. [ Links ]
2. Albarellos, G.A.; Montoya, L.; Lorenzini, P.M.; Passini, S.M.; Lupi, M.P.; Landoni, M.F. Pharmacokinetics of cefuroxime after intravenous, intramuscular, and subcutaneous administration to dogs. J vet Pharmacol Ther. 2015; doi: 10.1111/jvpt.12239 [ Links ]
3. Arret, B.; Johnson, D.P.; Kirshbaum, A. Outline of details for microbiological assays of antibiotics: second revision. J Pharm Sci. 1971; 60: 1689-94. [ Links ]
4. Foord, R.D. Cefuroxime: Human pharmacokinetics. Antimicrob Agents Chemother. 1976; 9: 741-7. [ Links ]
5. Fossum, T.W. Small Animal Surgery. 3rd Ed. Mosby Elsevier, St Louis, Missouri. 2007 [ Links ]
6. Gibaldi, M. & Perrier, D. Pharmacokinetics, 2nd ed. Marcel Dekker Inc., New York. 1982. [ Links ]
7. Kashfi ab Rahman, A.; Haslina A.F. Cefuroxime. En: Grayson, M.L. (Ed.). Kucers´ The use of Antibiotics. Ed. Hodder Arnold (an Hachette UK Company) 6th Ed., UK. 2010. 286-294. [ Links ]
8. Lees, P.; Concordet, D.; Shojaee Aliabadi, F.; Toutain, P.L. Drug selection and optimization of dosage schedules to minimize antimicrobial resistance. En: Antimicrobial Resistance in Bacteria of Animal Origin. Aarestrup, F. ASM Press, Washington, USA. 2006. [ Links ]
9. Lerma, M.; Cebrián, L.; Giménez, M.J. et al. β-lactam susceptibility of Escherichia coli isolates from urinary tract infections exhibiting different resistance phenotypes. Rev Esp Quimioter. 2008; 21: 149-52. [ Links ]
10. McKellar, Q.A.; Sanchez Bruni, S.F.; Jones, D.G. Pharmacokinetic/pharmacodynamic relationships of antimicrobial drugs used in veterinary medicine. J vet Pharmacol Ther. 2004; 27: 503-14. [ Links ]
11. Prescott, J.F. Beta-lactam antibiotics: cephalosporins. En: Antimicrobial Therapy in Veterinary Medicine, 4thedn. Ed. Giguère, S.; Prescott, J.F.; Dowling, P.M. Wiley Blackwell, Ames. Iowa, USA. 2013. 153-73. [ Links ]
12. Ruiz-Carretero, P.; Nacher, A.; Merino-Sanjuan, M.; Casabo, V.G. (2000) Pharmacokinetics and absolute bioavailability of oral cefuroxime axetil in the rat. Int J Pharm. 2000; 202: 89-96 [ Links ]
13. Schwartz, G. Estimating the dimension of a model. Ann Stat. 1978; 6: 461-4. [ Links ]
14. Soback, S.; Ziv, G.; Kokue, E.I. Probenecid effect on cefuroxime pharmacokinetics in calves. J vet Pharm Ther. 1989; 12: 87-93 [ Links ]
15. Turnidge, J.D. The pharmacodynamics of Ã-lactams. J Clin Infect Dis. 1998; 27: 10-22. [ Links ]
16. von Eiff, C.; Friedrich, A.W.; Becker, K.; Peters, G. Comparative in vitro activity of ceftobiprole against staphylococci displaying normal and small-colony variant phenotypes. Antimicrob Agents Chemother. 2005; 49: 4372-4. [ Links ]
17. Yamaoka, K., Nakagawa, T.; Uno, T. Application of Akaike´s information criterion (AIC) in the evaluation of linear pharmacokinetic equations. J Pharmacok Biopharm. 1978; 6: 165-75. [ Links ]














