Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
InVet
versão On-line ISSN 1668-3498
InVet vol.20 no.2 Ciudad Autónoma de Buenos Aires jun. 2018
ARTÍCULO DE INVESTIGACIÓN
Efecto de la deficiencia subclínica de zinc en corderos sobre parámetros bioquímicos, concentración tisular y balance de zinc
Pechin, GH1; Corbellini, CN2; Cseh, SB3; Stritzler, NP4
1Facultad de Ciencias Veterinarias, UNLPam, General Pico, La Pampa.
2INTA EEA Mercedes.
3INTA EEA Balcarce.
4Facultad de Agronomía, UNLPam.
Recibido: 31/10/2018
Aceptado: 06/03/2018
Correspondencia e-mail: Guillermo H. Pechin ghpechin@yahoo.com
Resumen
El objetivo de este ensayo fue estudiar el efecto de la deficiencia subclínica de Zn en ovinos sobre los niveles plasmáticos de Zn y fosfatasa alcalina (FA), la concentración tisular y la retención del mineral. Diez corderos fueron asignados aleatoriamente a dos grupos: basal (B; 10 ppm de Zn) y suplementado con 30 ppm de Zn (Z). El ensayo se extendió por el término de 20 semanas, con sangrados cada 4 semanas. En las semanas 6 y 20 se evaluó el balance de Zn. Al final del trabajo, se recogieron muestras de músculo, hígado, páncreas, testículo, riñón, pulmón, hueso y lana. Los niveles de Zn plasmático fueron significativamente mayores en el grupo Z (0,68 ïg/ml) que en el grupo B (0,40 ïg/ml), pero los niveles de FA plasmática fueron similares. En el primer período de balance, la retención porcentual de Zn en grupo B fue mayor (46,91 vs 26,07 %), pero la cantidad retenida fue menor (1,66 vs 3,72 mg/día). El segundo período de balance presentó resultados similares. La concentración de Zn en hueso fue mayor en el grupo Z (P < 0,01), con una tendencia similar en hígado (P < 0,10). El resto de las variables no difirieron entre tratamientos.
Palabras clave: Deficiencia de zinc; Corderos.
Effect of subclinical zinc deficiency in lambs on biochemical parameters, tissue zinc concentration and zinc balance
Summary
The objective of this trial was to study the effect of subclinical Zn deficiency in lambs on plasma levels of Zn and alkaline phosphatase (ALP), tissue Zn concentration and Zn balance. Ten lambs were randomly assigned to two groups: basal (B; 10 ppm of Zn) and supplemented with 30 ppm of Zn (Z). The trial lasted for 20 weeks. Blood samples were collected every 4 weeks by jugular venipuncture. In weeks 6 and 20, Zn balance was evaluated. At the end of the trial, samples of muscle, liver, pancreas, testis, kidney, lung, bone and wool were collected for Zn determination. Plasma Zn levels were significantly higher in the Z group (0.68 ïg/ml) than in the B group (0.40 ïg/ml), but ALP plasma levels did not differ between groups. In the first balance period, the percentage Zn retention in group B was higher (46.91 vs 26.07 %) but the amount retained was lower (1.66 vs 3.72 mg/day). The second balance period showed similar results. Bone Zn concentration was higher in Z group (P < 0.01), with a similar tendency in liver (P < 0.10). The rest of the parameters did not differ between treatments.
Key words: Zinc deficiency; Lambs.
Introducción
Las manifestaciones de la deficiencia de Zn en todas las especies animales incluyen anorexia, disminución de la ganancia de peso, anormalidades de la piel y sus apéndices, desórdenes esqueléticos y reproductivos23. La concentración de Zn en suero o plasma es el indicador de deficiencia más ampliamente utilizado7. Los niveles normales en animales domésticos se sitúan entre 0,8 y 1,2 μg/ml23. Sin embargo, otros factores, además de los niveles de Zn dietario, pueden causar una redistribución metabólica y disminuir la concentración de Zn sérico, por ejemplo, el estrés, las infecciones y la endotoxemia7,17, complicando así la interpretación de los datos.
Se han identificado varias metaloenzimas Zn dependientes con fines diagnósticos, pero la sensibilidad frente a una deficiencia de Zn puede ser baja en muchas de ellas11. La fosfatasa alcalina (FA), en suero o plasma, ha sido la enzima Zn dependiente más estudiada y se ha comprobado que disminuye notablemente en la deficiencia de Zn, a un nivel comparable al del Zn sérico1,12,21.
Una deficiencia de Zn genera una redistribución del mineral entre diferentes -pooles- orgánicos. La deficiencia clínica de Zn en ratas, en comparación con un grupo control pareado por consumo, produjo una disminución significativa del Zn en plasma y en algunos órganos, como hueso, hígado, riñón y testículo, pero no en músculo3, a pesar de ser el -pool- cuantitativamente más importante4,5.
En animales domésticos y de laboratorio, la mayoría de los trabajos relevados se han centrado en modelos que producen una deficiencia clínica de Zn. Por ello, resulta de interés profundizar en el estudio de los parámetros más sensibles que puedan colaborar en el diagnóstico de una deficiencia moderada o subclínica del mineral, con potenciales respuestas productivas a la suplementación.
Los objetivos de este ensayo incluyeron verificar el efecto de la deficiencia subclínica de Zn en corderos sobre parámetros bioquímicos, la concentración tisular y la retención del mineral.
Materiales y Métodos
Diez corderos de raza Corriedale, con un peso de 10,09 ± 1,285 kg, fueron asignados en forma aleatoria a dos grupos: basal (B) y suplementado con Zn (Z). Ambos grupos recibieron una dieta a base de paja de trigo (30 %), almidón de maíz (34,8 %), sacarosa (14 %), albúmina de huevo deshidratada (10 %), aceite de girasol (2 %), urea (2 %) y núcleo mineral-vitamínico sin Zn (4,2 %). Esta dieta fue similar a la utilizada por White et al.24, con algunas modificaciones (se disminuyó el contenido de paja de trigo, se incrementó el de albúmina de huevo y el de almidón (40 %, 7,5 % y 25 %, respectivamente, en dicho ensayo24, y se suplantó el aceite de soja por el de girasol). El alimento se administró dos veces al día, por la mañana y por la tarde, en forma restringida, a un nivel que fluctuó entre el 2,7 y el 3 % del peso de los animales. La dieta B contenía 10 ppm de Zn, base MS, y la dieta Z fue suplementada con sulfato de zinc monohidratado (ZnSO4.H2O), a un nivel extra de 30 ppm de Zn, para cumplir las recomendaciones del NRC15.
El protocolo de manejo de los animales fue aprobado por el Comité de Ãtica de la Facultad de Ciencias Veterinarias, UNLPam. Los corderos fueron alojados en jaulas de plástico, de 1 m x 0,5 m, con piso ranurado. El ensayo tuvo una duración de 20 semanas. Al inicio del ensayo, se esquiló un área de 80 cm2, del flanco de cada cordero, con el objeto de medir el crecimiento de la lana en ambos grupos. Cada 4 semanas, se extrajo una muestra de sangre de vena yugular, utilizándose heparina como anticoagulante. La muestra obtenida fue centrifugada a 2.000 rpm, durante 10 minutos, y el plasma sobrenadante se separó en dos submuestras para la posterior medición de los niveles de Zn y FA. En la sexta y la última semana del trabajo se evaluó el balance de Zn. Durante cada período de balance (5 días) se midió el alimento consumido por cada animal y la producción de heces y de orina, las que se recogieron diariamente. Se tomó una alícuota diaria de cada excreta (30 gr para heces y 20 ml para orina), y se guardaron a - 20 ºC hasta su análisis.
Al finalizar el ensayo, después del sacrificio de los animales, se recogieron muestras de músculo (longissimus dorsi, supraescapular y semimembranoso), hígado, páncreas, testículo, riñón, pulmón, hueso (metacarpo y metatarso) y lana para la determinación de los niveles de Zn, por espectrofotometría de absorción atómica19.
Las muestras de tejidos blandos fueron cortadas en trozos de 1 cm3 y secadas en estufa de flujo continuo a 100 °C hasta peso constante. Luego, se procedió al molido de las mismas y se tomó una submuestra de 500 mg de cada tejido. Cada submuestra fue sometida a una digestión ácida con una mezcla de 2 ml ácido nítrico (HNO3, 68% V/V), 2 ml de ácido sulfúrico (H2SO4, 98% V/V) y 2 ml de ácido perclórico (HClO4, 70% V/V). Una vez terminado el proceso de digestión se llevó a un volumen de 25 ml, utilizando agua deionizada. Las muestras de alimento y heces fueron secadas a 100°C y molidas en un molino a martillo tipo Resch. Luego de obtener una submuestra de 500 mg de cada una, se procedió de acuerdo a lo descripto para tejidos blandos.
Las muestras de hueso fueron desengrasadas con acetona, durante 48 hs, enjuagadas con agua deionizada y llevadas a una mufla a 500 °C, durante 5 hs. De las cenizas obtenidas, se pesaron 500 mg y se procedió a tratamiento ácido y dilución como se describió previamente.
Las muestras de lana fueron lavadas con una solución de agua bidestilada y detergente neutro. Luego de enjuagadas repetidas veces con agua deionizada, fueron secadas a 60°C. Una submuestra de 500 mg de cada una fue sometida a digestión ácida y dilución, para su posterior análisis.
Para la determinación de FA en plasma se utilizó el método colorimétrico cinético (ALP 405 AA) propuesto por Wiener Laboratorios (Rosario, Argentina).
Análisis estadístico: Los datos fueron analizados en un diseño completamente aleatorio. Para las variables concentración de Zn y FA en plasma se utilizó un modelo mixto con mediciones repetidas en el tiempo (PROC MIXED, SAS/STAT 9.110,20). El modelo incluyó los efectos fijos de tratamiento, tiempo e interacción tratamiento x tiempo, y el efecto aleatorio del animal dentro de tratamiento. Se usó una estructura de covarianza autoregresiva de orden 1 para varianzas homogéneas (AR1). Para el resto de las variables (concentración tisular y balance de Zn) se utilizó el procedimiento PROC GLM, del mismo paquete estadístico. Los efectos fueron considerados significativos cuando P<0,05 y tendencias cuando P<0,10.
Resultados
a. Primer período de balance.
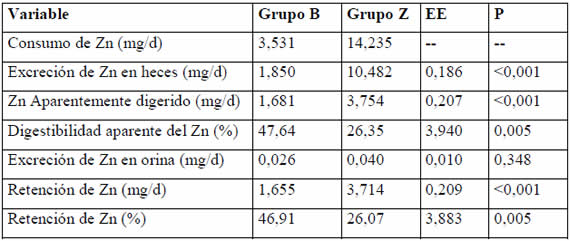
En ningún momento del ensayo los animales mostraron signos clínicos de deficiencia de Zn. El grupo Z evidenció, como era esperable, una mayor retención de Zn (en mg/día) (Tabla 1). Por el contrario, la absorción y la retención porcentuales fueron mayores en el grupo B.
Tabla 1. Balance de Zn, primer período.
b. Segundo período de balance.
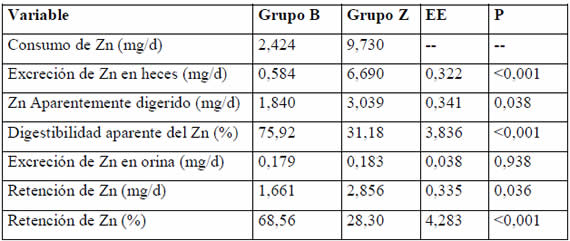
De manera similar al primer período, la retención de Zn fue mayor en el grupo Z, mientras que la absorción y la retención porcentuales fueron mayores en el grupo B (Tabla 2).
Tabla 2. Balance de Zn, segundo período.
c. Niveles de Zn y fosfatasa alcalina en plasma.
Para la variable Zn en plasma, la interacción tratamiento x tiempo fue muy significativa (P<0,01). Excepto para la medición inicial, el grupo Z tuvo mayores concentraciones de Zn plasmático que el grupo B en el resto de las mediciones a lo largo del ensayo (P<0,01). El nivel promedio de Zn en plasma fue 0,68 ïg/ml en el Grupo Z y 0,40 ïg/ml en el grupo B (Figura 1). Sin embargo, la suplementación con Zn no tuvo efecto sobre los niveles de FA en plasma (Figura 2).
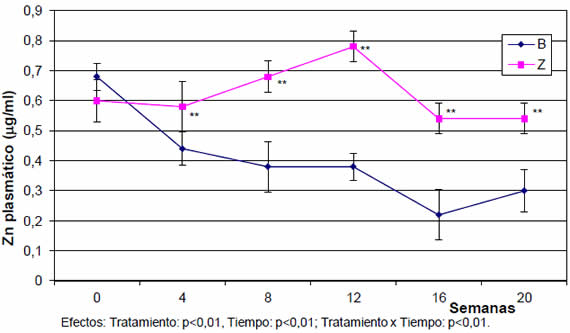
Figura 1. Evolución del Zn plasmático en los corderos de ambos grupos experimentales (valores promedio + DE).

Figura 2. Evolución de los niveles de fosfatasa alcalina plasmática en los corderos de ambos grupos experimentales (valores promedio + DE).
d) Concentración de Zn en órganos:
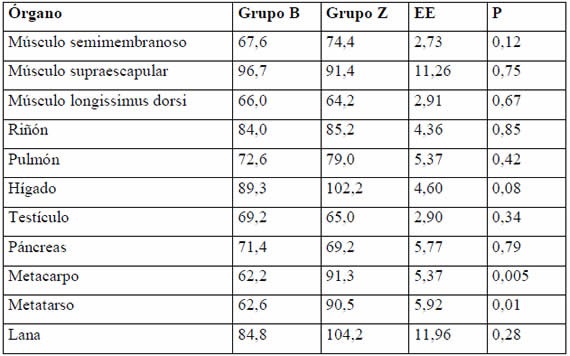
Como se observa en la Tabla 3, la deficiencia de Zn disminuyó los niveles de Zn, alrededor de un 30 %, en ambos huesos muestreados y tendió a disminuirlos en hígado, en una proporción menor (10 %)
Tabla 3. Concentración de Zn en órganos (mg/kg MS).
Discusión
La falta de signos clínicos de deficiencia en corderos alimentados con 10 ppm de Zn es coincidente con lo hallado en terneros que consumieron una dieta experimental a base de pulpa de remolacha, que contenía 8,6 ppm de Zn14. En el mismo sentido, y de acuerdo a los resultados con corderos18, se deben conseguir niveles menores de Zn (por ejemplo, 2,7 ppm) en dietas semisintéticas para la aparición de dichos signos.
La eficiencia de retención y la digestibilidad aparente del Zn fueron mayores en el grupo B, lo que demuestra la puesta en marcha de los mecanismos homeostáticos, relacionados con un incremento en la eficiencia de absorción y una disminución de la excreción fecal endógena del mineral, ya que la excreción urinaria no cumple un rol importante8,13. Los resultados de absorción aparente de Zn (47,6 % vs 26,3%) hallados en el primer período de balance son comparables con los valores de absorción neta informados por Neathery et al.16 y por Stake et al.22 en vacas lecheras, y con los valores de absorción aparente hallados por Kirchgessner et al.9, también en este tipo de animales.
En nuestro trabajo, la suplementación con Zn incrementó la retención absoluta de Zn en ambos períodos de balance. Kegley y Spears6 hallaron similares resultados en corderos, cuando adicionaron 27,5 ppm de Zn a una dieta basal que contenía 21,4 ppm de Zn. Esto sugiere que dietas con 10 ppm de Zn están lejos de maximizar la retención de Zn en corderos. Por otro lado, los resultados de retención absoluta de Zn de los grupos B en ambos ensayos de balance son equivalentes, aun cuando los consumos de Zn de los animales fueron diferentes, lo cual pone de manifiesto, nuevamente, la adaptación homeostática del organismo frente a la deficiencia de Zn.
Nuestros resultados confirman que el Zn plasmático es un indicador precoz y sensible de deficiencia de Zn, y revelan una relación lógica con los datos de ambos períodos de balance de Zn. Además, los niveles plasmáticos de Zn del Grupo B mostraron una tendencia lineal decreciente, a medida que progresaba la depleción.
Nuestro trabajo no puede discriminar si la menor concentración final de Zn óseo en el Grupo B es el resultado de un incremento en la resorción, una disminución en la deposición o ambas simultáneamente. En ratas en crecimiento25, se ha determinado que entre el 10 y el 20 % del -pool- óseo de Zn puede movilizarse rápidamente en una deficiencia marginal de Zn. En lo que parece un patrón común a varias especies, en lechones alimentados con dietas deficientes en el mineral2, se informaron pérdidas paulatinas de Zn óseo durante las 4 semanas del estudio. En nuestro ensayo, los hallazgos referidos a las concentraciones de Zn en tejidos al momento del sacrificio de los animales, parecen confirmar, entonces, el rol del hueso y, tal vez, del hígado dentro de los mecanismos homeostáticos frente a una deficiencia de Zn en corderos.
En nuestro trabajo, la concentración de Zn en lana fue numéricamente menor en el Grupo B, pero, probablemente, el alto coeficiente de variación y el bajo número de animales llevaron a que esa diferencia no fuera significativa. White et al.24 encontraron diferencias en esta variable entre los grupos deficiente (4 ppm) y suplementados, pero no entre los corderos alimentados con 10, 17 y 27 ppm de Zn en la dieta, lo cual señala, al igual que nuestros hallazgos, que el Zn en lana es un indicador menos sensible que el Zn plasmático.
Trabajos con ratas1, cerdos12 y corderos21 informaron aumentos significativos de los niveles de FA y de Zn sérico, causados por la suplementación con Zn, aunque con niveles muy bajos del mineral en la dieta basal. En nuestro ensayo, la falta de efectos de la suplementación con Zn sobre dicha enzima, además de los mayores niveles de Zn en la dieta B, puede parcialmente explicarse debido a su falta de especificidad, ya que, por un lado, este parámetro implica la medición de la actividad fosfatasa total del plasma, sin considerar su origen, y, por otro lado, puede responder a otros factores diferentes al Zn. Es valioso destacar que, en nuestro trabajo, la actividad de FA siempre fue afectada por un importante coeficiente de variación entre individuos. La búsqueda de biomarcadores del status de Zn y, en particular, de enzimas Zn dependientes, sigue siendo un campo de activa investigación7.
Conclusiones
Tomados en su conjunto, los resultados de este ensayo demuestran consistentemente la validez del modelo de deficiencia subclínica de Zn, hallándose una respuesta en varios indicadores relevantes, como balance de Zn y concentración plasmática y tisular de Zn, los que podrían utilizarse con fines diagnósticos.
1. Adeniyi, F.A.; Heaton, F.W. The effect of zinc deficiency on alkaline phosphatase (EC 3.1.3.1) and its isoenzymes. Br J Nutr. 1980; 43:561-69. [ Links ]
2. Bobilya, D.J.; Johanning, G.L.; Veum, T.L.; O-Dell, B.L. Chronological loss of bone zinc during dietary zinc deprivation in neonatal pigs. Am J Clin Nutr. 1994; 59:649-53. [ Links ]
3. Giuliano, R.; Millward, D.J. Growth and zinc homeostasis in the severely Zn-deficient rat. Br J Nutr. 1984; 52:545-60. [ Links ]
4. Grace, N.D. Amounts and distribution of mineral elements associated with fleece-free empty body weight gains in the grazing sheep. N Z J Agric Res. 1983; 26:59-70. [ Links ]
5. Jackson, M.J. Physiology of zinc: general aspects. En Mills C.F (ed.). Zinc in Human Biology. Springer-Verlag, London, UK., 1989:1-14. [ Links ]
6. Kegley, E.B.; Spears, J.W. Effect of zinc supplementation on performance and zinc metabolism of lambs fed forage-based diets. J Agric Sci. (Cambridge). 1994; 123:287-92. [ Links ]
7. King, J.C.; Brown, K.H.; Gibson, R.S.: Krebs, N.F.; Lowe, N.M.; Siekman, J.H.; Raiten, D.J. Biomarkers of nutrition for development (BOND) - Zinc review. J Nutr. 2016; 146(Supl.):858S-85S. [ Links ]
8. King, J.C.; Shames, D.M.; Woodhouse, L.R. Zinc homeostasis in humans. J Nutr. 2000; 130:1360S-66S. [ Links ]
9. Kirchgessner, M.; Schwarz, W.A.; Roth, H.-P. Homeostasis of Zn-metabolism in experimentally induced Zn deficiency of dairy cows. Trace Element Metabolism in Man and Animals-3. 1978. M. Kirchgessner, Ed. Freising-Weihenstephen, West Germany. p. 116-121. [ Links ]
10. Littell, R.C.; Henry, P.R.; Ammermann, C.B. Statistical analysis of repeated measures data using SAS procedures. J Anim Sci. 1998; 76:1216-31. [ Links ]
11. Lowe, N.M.; Fekete, K.; Decsi, T. Methods of assessment of zinc status in humans: a systematic review. Am J Clin Nutr. 2009; 89(Suppl.):2040S-51S. [ Links ]
12. Miller, E.R.; Luecke, R.W.; Ullrey, D.E.; Blaltzer, B.V.; Bradley, B.L.; Hoefer, J.A. Biochemical, skeletal and allometric changes due to zinc deficiency in the baby pig. J Nutr. 1968; 95:278-86. [ Links ]
13. Miller, W.J. Absorption, tissue distribution, endogenous excretion, and homeostatic control of zinc in ruminants. Am J Clin Nutr. 1969; 22:323-31. [ Links ]
14. Miller, W.J.; Clifton, C.M.; Cameron, N.W. Zinc requirement of Holstein bull calves to nine months of age. J Dairy Sci. 1963; 46:715-19. [ Links ]
15. National Research Council. Nutrient Requirements of Small Ruminants. 2007. National Academies Press, Washington, D.C., USA. [ Links ]
16. Neathery, M.W.; Miller, W.J.; Blackmon, D.M.; Gentry, R.P. Zinc-65 metabolism, secretion into milk, and biological half-life in lactating cows. J Dairy Sci. 1973; 56:1526-30. [ Links ]
17. Orr, C.L.; Hutcheson, D.P.; Graingers, R.B.; Cummins, J.M.; Mock, R.E. Serum copper, zinc, calcium and phosphorus concentrations of calves stressed by bovine respiratory disease and infectious bovine rhinotracheitis. J Anim Sci. 1990; 68:2893-900. [ Links ]
18. Ott, E.A.; Smith, W.H.; Stob, M.; Beeson, W.M. Zinc deficiency syndrome in the young lamb. J Nutr. 1964; 82:41-50. [ Links ]
19. Perkin Elmer. Analytical methods for atomic absorption spectroscopy. 1996. The Perkin- Elmer Corporation. Branford, Connecticut (USA). 300 p. [ Links ]
20. SAS Institute Inc. SAS/STAT 9.1 User-s Guide. 2004. Cary, NC, USALinks ] Helvetica, sans-serif">.
21. Spears, J.W. Zinc methionine for ruminants: relative bioavailability of zinc in lambs and effects on growth and performance of growing heifers. J Anim Sci. 1989; 67:835-43. [ Links ]
22. Stake, P.E.; Miller, W.J.; Neathery, M.W.; Gentry, R.P. Zinc-65 absorption and tissue distribution in two-, and six-month-old Holstein calves and lactating cows. J Dairy Sci. 1975; 58:78-81. [ Links ]
23. Suttle, N.F. Mineral nutrition of Livestock. Fourth Edition. CAB International. Wallinford. UK. 2010. [ Links ]
24. White, C.L.; Martin, G.B.; Hynd, P.I.; Chapman, R.E. The effect of zinc deficiency on wool growth and skin and wool follicle histology of male Merino lambs. Br J Nutr. 1994; 71:425-35. [ Links ]
25. Zhou, J.R.; Canar, M.M.; Erdman, J.W., Jr. Bone zinc is poorly released in young, growing rats fed marginally zinc-restricted diet. J Nutr. 1993; 123:1383-88. [ Links ]














