Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
RIA. Revista de investigaciones agropecuarias
versión On-line ISSN 1669-2314
RIA. Rev. investig. agropecu. vol.39 no.3 Ciudad Autónoma de Buenos Aires dic. 2013
ARTÍCULOS
Evaluación de la doble inoculación Bradyrhizobium-micorrizas y el uso de fitoterápicos de semilla en el crecimiento, eficiencia de inoculación y el rendimiento de un cultivo de soja
Clua, A.¹; Olgiati, J.¹; Beltrano, J.¹,²
¹INFIVE. CONICET-UNLP. Diagonal 113 Nº 495, CC 327, (1900) La Plata, Buenos Aires, Argentina. Correo electrónico: arielclua@yahoo.com.ar
²CICBA
Recibido 22 de octubre de 2012
Aceptado 12 de julio de 2013
Publicado online 28 de agosto de 2013
RESUMEN
La problemática de la fertilidad de suelos adquiere relevancia en la producción agrícola en general y en el cultivo de soja en particular. El interés creciente por los biofertilizantes surge de la necesidad de desarrollar alternativas más limpias y menos costosas para suministrar nutrientes a las plantas. La inoculación con Bradyrhizobium japonicum y hongos formadores de micorrizas arbusculares (HFMA) Glomus mosseae, es una alternativa a tener en cuenta. El objetivo de este trabajo fue evaluar el efecto de la doble inoculación Bradyrhizobium-micorrizas y su interacción con fitoterápicos de semillas, sobre el crecimiento y rendimiento final de Glycine max. El ensayo se llevó a cabo sobre un cultivo de soja, implantado en el partido de Lobos en la provincia de Buenos Aires. Se estableció un diseño experimental en bloques al azar, con cuatro repeticiones por tratamiento. Los tratamientos fueron: Control sin inoculación (C); Inoculación con B. japonicum (IB); Inoculación combinada Bradyrhizobium-micorrizas (IBM); Inoculación con Bradyrhizobium + curasemilla (IBC); Inoculación combinada + curasemilla (IBMC). Se determinaron parámetros de crecimiento, eficiencia de nodulación y micorrización, rendimiento y sus componentes. Comparados con el control, IBM e IBMC mostraron un aumento significativo, del orden del 40 %, en los parámetros de crecimiento. Todos los tratamientos aumentaron significativamente el número de plantas noduladas, comparados con el control. El número de nódulos por planta aumentó significativamente en todos los tratamientos de inoculación, con mayor nodulación en los tratamientos de inoculación combinada, comparados con los de inoculación simple. Sólo los tratamientos IBM e IBMC aumentaron significativamente el porcentaje de raíces micorrizadas, comparados con el control. Los tratamientos IB, IBC e IBMC aumentaron significativamente el rendimiento, con valores de 4.750, 4.825 y 4.850 Kg ha-1, respectivamente, comparados con el control (4.100 Kg ha-1). El rendimiento se incrementó significativamente en los tratamientos con doble inoculación y fitoterápicos de semilla (IBMC) y en aquellos con simple inoculación con B. japonicum, independientemente de la aplicación de fitoterápicos de semilla (IB e IBC).
Palabras clave: Glycine max; Glomus mosseae; Nodulación.
ABSTRACT
Soil fertility is a relevant aspect of agricultural production, particularly so in soybean crops. Biofertilizers such as Bradyrhizobium japonicum and arbuscular mycorrhizal fungi (AMF) are studied in order to find sustainable alternatives to providing crops with mineral nutrients. The aim of this work was to study the effect of the coinoculation of Bradyrhizobium-mycorrhizal fungi on the growth and yield of Glycine max and its interaction with the fungicides applied to seeds. The experiment was conducted on a soybean crop planted at Lobos, Buenos Aires province. The treatments were: Control: no inoculation (C); Inoculation with B. japonicum (IB); combined inoculation of Bradyrhizobium-mycorrhizal (IBM); Inoculation with Bradyrhizobium + fungicides (IBC); combined inoculation + fungicides (IBMC). In the experiment the following were determined: growth parameters, nodulation and mycorrhization efficiency, and yield and its components. The IBM and IBMC treatments showed a significant increase in growth parameters, around 40% compared to control. All treatments significantly increased the number of nodulated plants compared with the control. The number of nodules per plant was significantly higher in all inoculated treatments compared with the control, and the highest values were observed with the co-inoculation treatments as compared with single inoculation treatments. IBM and IBMC treatments increased the percentage of mycorrhizal roots compared with the control. IB, IBC, and IBMC treatments showed a significant increase in yield: 4,750 Kg ha-1; 4,825 Kg ha-1, and 4,850 Kg ha-1, respectively, compared with the control (4,100 Kg ha-1). The yield was increased in the combined inoculation and fungicide (IBMC) treatments and those inoculated with Bradyrhizobium japonicum only, independently of fungicide use (IB and IBC).
Keywords: Glycine max; Glomus mosseae; Nodulation.
INTRODUCCIÓN
En los últimos años el escenario agrícola de nuestro país experimentó cambios significativos a partir de la implementación de tecnologías que derivaron en el papel preponderante del cultivo de soja. El constante incremento del área sembrada con este cultivo, que en la actualidad alcanza 18 millones de hectáreas, posicionó a la Argentina en el primer y segundo lugar como exportador de aceite y de harina de soja, respectivamente, y el cuarto lugar como productor de grano (Bolsa de Cereales de Buenos Aires, 2010).
Se sabe que la disponibilidad y la eficiencia en el uso de los nutrientes, principalmente de nitrógeno, fósforo, azufre y potasio, afectan los procesos que regulan el crecimiento, la generación del rendimiento y la calidad de los granos (Satorre, 2003).
El incremento en la producción de soja es consecuencia no sólo del aumento en la superficie sembrada, sino también por incrementos en los rendimientos, los cuales se hallan entre los más altos del mundo (Melgar et al., 2011). Esto fue posible en parte debido al subsidio energético representado por el empleo de fertilizantes (Satorre, 2003).
En nuestro país, en los principales cultivos, incluido la soja, el aporte de nutrientes a través de la fertilización no es suficiente para compensar los extraídos del suelo. El balance entre los aportes de nutrientes y la extracción por los granos muestra, en promedio para todos los cultivos, una reposición de tan sólo 45, 25 y 10% para P, N y S, respectivamente (Quiroga et al., 2006).
La tendencia de la producción agrícola actual parece incompatible con la sustentabilidad de los agroecosistemas debido fundamentalmente a la potencial degradación del recurso suelo, la pérdida de fertilidad actual y la aplicación indiscriminada de fertilizantes químicos, con el consiguiente deterioro progresivo del ambiente y su contaminación (Altieri, 1997). Como consecuencia creció notablemente el interés por los biofertilizantes para desarrollar alternativas más limpias y menos costosas para suministrar nutrientes a las plantas. Entre los biofertilizantes más estudiados y utilizados se encuentran aquellos que contienen Bradyrhizobium japonicum en su formulación, así como los que contienen hongos formadores de micorrizas arbusculares (HFMA) (Corbera y Napoles, 2000).
Dado que en el cultivo de soja la vía de aporte más importante de nitrógeno es la proveniente de la fijación biológica de N (FBN), con valores que oscilan habitualmente entre el 25 y el 84% del total absorbido (Satorre, 2003), la práctica más recomendable para optimizar la FBN es la inoculación con cepas de B. japonicum incorporadas mediante preparados comerciales inoculantes (Gutiérrez Boem y Schainer, 2005; Ferraris y Couretot, 2010).
En el caso del fósforo, el bajo contenido en suelos (Darwich, 1983), sumado al hecho que su disponibilidad para las plantas está influenciada por factores edáficos como pH, materia orgánica y textura, suscitó un interés en el estudio de microorganismos como los HFMA, capaces de mejorar el aprovechamiento de este elemento.
La simbiosis micorrícica es una interacción entre especies de hongos del Phylum Glomeromycota y las raíces de la mayoría de las plantas terrestres (Schüssler et al., 2001). Esta simbiosis puede ocurrir naturalmente con la microflora autóctona del suelo, ya que incrementa la habilidad de las plantas para soportar situaciones adversas o de estrés como salinidad, sequía y patógenos (Rabie y Almadini, 2005; Juniper y Abbott, 2006; Beltrano et al., 2003). A su vez, produce incremento de la biomasa en plantas colonizadas (Porcel y Ruiz Lozano, 2004), lo que representa, de esta manera, un impacto positivo en la productividad de los cultivos (Johnson et al., 1997). Este efecto benéfico se puede deber a un incremento en la absorción de nutrientes con baja movilidad como P, Zn y Cu y a una mejora en las relaciones hídricas (Ruiz-Lozano y Azcon, 1995; Al-Karaki y Al-Raddad, 1997; Al-Karaki y Clark, 1998).
En el caso de la soja, esta asociación favorece el crecimiento en cultivos bajo condiciones de estrés (Tian et al., 2004). Además, Plenchette y Duponnois (2005) y Sharifi et al. (2007), determinaron un mayor crecimiento y una mayor absorción de P de las plantas inoculadas.
En función de lo expuesto, el estudio y desarrollo de prácticas sustentables, como la incorporación de microorganismos que establezcan una asociación positiva y que le permita a las plantas soportar situaciones adversas, es de importancia en sistemas degradados para el mejor aprovechamiento de los recursos. En este sentido, con el objeto de optimizar el aprovechamiento del nitrógeno y el fósforo en los cultivos, en los últimos años se realizaron experimentos con el empleo de inoculaciones conjuntas de rhizobios y hongos micorrícicos en oleaginosas, lo que provocó incrementos tanto en el crecimiento como en el rendimiento (Corbera y Napoles, 2000).
Además, es muy común que junto a la práctica de inoculación se realicen tratamientos con fitoterápicos de semillas para prevenir plagas y enfermedades. Generalmente, se mencionan los principios activos de estos compuestos como responsables de un efecto nocivo sobre la eficiencia de la inoculación con rhizobios (Perticari y Puente, 2006). La información acerca del efecto de estos terápicos de semillas y la eficiencia de colonización de los hongos micorrícicos es escasa, a pesar de que en los últimos años diversas investigaciones intentaron esclarecer el tema (Vijayalakshimi y Rao, 1993; Schreiner y Bethlenfalvay, 1997; Giovannetti et al., 2006; Samarbakhsh et al., 2009).
Este trabajo propone evaluar la eficiencia de la doble inoculación B. japonicum-hongos micorrícicos arbusculares (HFMA) sobre el crecimiento y rendimiento final del cultivo de soja, comparada con la inoculación tradicional con B. japonicum. A su vez, se busca observar el efecto de los terápicos de semillas sobre los distintos inóculos utilizados. De este modo, se plantean como hipótesis a) la co-inoculación rhizobio-HFMA en soja, produce efectos benéficos sobre el cultivo y b) la eficiencia de estos organismos en la simbiosis con la soja es modificada por el empleo de fitoterápicos de semilla.
MATERIALES Y MÉTODOS
El ensayo se llevó a cabo en el partido de Lobos, provincia de Buenos Aires (35º 11' 07" L.S.; 59º 05' 41" L.O). El lote de experimentación se encuentra en producción agrícola continua, al menos durante las últimas 15 campañas, con el maíz como cultivo antecesor en la campaña inmediata pasada y soja en rotaciones previas.
El lote fue seleccionado en base a su baja dotación de fósforo, determinada a partir de muestras compuestas de suelo (tabla1), sobre el cual se diseñó el experimento. El suelo se clasifica taxonómicamente como un Hapludol éntico, perteneciente a la serie Bolívar y su clasificación según capacidad de uso es IIIs (INTA, 1989).
Tabla 1. Análisis de suelo del lote de experimentación.

La siembra se realizó el día 13 de noviembre de 2010, en siembra directa, con una sembradora "Agrometal Mix", de 7,56 m de ancho de labor, con una distancia entre líneas de 21 cm. La variedad utilizada fue Don Mario 3700. Se estableció un diseño experimental en bloques completamente al azar, con cuatro repeticiones por tratamiento, en parcelas de 7,56 m de ancho por 10 m de largo. Los inoculantes utilizados fueron: B. japonicum, en concentración de 1 x 108 rhizobios vivos por cc de inoculante y una mezcla de trozos de raíces de trébol blanco (Trifolium repens) infectadas con micelio y esporas de Glomus mosseae, con una riqueza de 50 esporas g-1 de inóculo, más B japonicum en idéntica concentración al anterior. La inoculación fue realizada inmediatamente antes de la siembra, empleando dosis de 400 cc por cada 100 Kg-1 de semilla y 10 g por Kg-1 de semilla y 10 g Kg de semilla, para el primer y segundo inóculo, respectivamente. Conjuntamente con la inoculación se procedió al curado de la semilla mediante una combinación de fungicidas de acción complementaria (thiram‐ contacto‐ y carbendazim -sistémico‐), la composición de la mezcla utilizada fue 12,5% Thiram + 12,5% Carbendazim (p/v), aplicando una dosis de 200 cc por cada 100 Kg-1de semilla. Previo a la siembra, se tomaron muestras compuestas de suelo para su análisis (tabla 1). A la siembra se fertilizó en líneas, mediante cajón fertilizador, con 80 kg ha-1 de una mezcla física de grado 0 % N2, 32 % P (25 kg ha-1) y 4 % S (3,2 kg ha-1). Los tratamientos fueron: Control sin inoculación (C); Inoculación con B. japonicum (IB); Inoculación combinada Bradyrhizobium-micorrizas (IBM); Inoculación con Bradyrhizobium + curasemilla (IBC); Inoculación combinada + curasemilla (IBMC).
El control de plagas y malezas del cultivo se realizó de forma convencional para la región. Dos meses previos a la siembra y durante todo el periodo de evaluación del experimento, se registraron las precipitaciones (587 mm). Este registro fue inferior al promedio histórico del partido de Lobos, para el mismo período, que es de 795 mm (figura 1). Asimismo, se estimó la evapotranspiración, por medio de la metodología de Thornthwaite, confeccionando el balance hídrico para todo el ciclo del cultivo (figura 2).

Figura 1. Promedios mensuales históricos de precipitaciones (mm) en el partido de Lobos (1965-2007. Fuente: Sociedad Rural de Lobos). Precipitaciones mensuales (mm) ocurridas durante el periodo del ensayo.

Figura 2. Precipitaciones registradas durante el ensayo, evapotranspiración estimada y balance hídrico calculado (mm, Thornthwaite)
A los 30 días de la siembra, se evaluó la eficiencia de implantación del cultivo en los diferentes tratamientos, mediante el recuento de plantas por metro lineal, realizándose cuatro repeticiones por tratamiento. Asimismo, a los 30, 60 y 90 días, se extrajeron 10 plantas por tratamiento seleccionadas al azar y se midieron parámetros de crecimiento, como altura de planta, diámetro de tallo y materia seca de parte aérea. A los 90 días posteriores a la siembra se midió índice de verdor, sobre el primer par de hojas expandidas, inmediatamente por debajo del ápice, utilizando un SPAD.
A los 45 días de la siembra, se realizó una evaluación de la nodulación, considerándose infectivas aquellas plantas con más de tres nódulos funcionales, determinados por la coloración de los mismos (Vincent, 1970). Asimismo se evaluó la presencia de micorrizas, mediante observaciones en microscopio óptico, en cinco plantas por parcela, seleccionadas al azar. A la cosecha sobre 1 m2 de cada parcela, se determinaron los componentes del rendimiento como número de vainas por planta, número de granos por vaina y por planta, peso de 1000 granos y se calculó el rendimiento. Además, se calculó, en los tratamientos que correspondía, la dependencia micorrícica (DM), de acuerdo a la siguiente formula (Ruscitti et al., 2011):
DM = PS de plantas micorrizadas - PS de plantas no micorrizadas x 100
PS de plantas micorrizadas
Los datos se analizaron estadísticamente por análisis de varianza, mediante el programa STATGRAPHICS 7.0 y las medias se compararon por LSD (P < 0,05). Para el análisis estadístico, los datos expresados en porcentaje (plantas noduladas y micorrizadas, raíces micorrizadas) se transformaron en arcoseno y eso mejoró la homogeneidad de varianzas (Lison, 1976).
RESULTADOS Y DISCUSIÓN
En la eficiencia de implantación, no se observaron diferencias significativas entre los tratamientos y el porcentaje de emergencia fue del 90%. En la altura de plantas, a los 30 días no se observaron diferencias significativas entre tratamientos (tabla 2). A los 60 y 90 días, los tratamientos IBM e IBMC mostraron una altura significativamente mayor comparado con el resto de los tratamientos, sin diferir entre ellos.
Tabla 2. Número de plantas emergidas, a los 30 días de la siembra (pl m-1), altura de plantas (cm), diámetro de tallo (mm), materia seca de parte aérea (MS g pl-1), a los 30, 60 y 90 días de la siembra e índice de verdor (IV) a los 90 días de la siembra, en tratamientos de inoculación y co-inoculación en soja.

A los 30 días después de la siembra, el diámetro del tallo de todos los tratamientos fue significativamente superior al control, el IBM e IBMC fueron superiores a IB e IBC. Esta misma tendencia se mantuvo a los 60 y 90 días (tabla 2).
A los 30 días, la materia seca de la parte aérea, en los tratamientos IB, IBC e IBMC, fue significativamente superior a IBM y C, los cuales no difirieron entre sí. A los 60 días los tratamientos micorrizados, IBM e IBMC fueron significativamente superiores al resto (los cuales difirieron significativamente entre sí). IBC fue superior a IB y éste superior a C. A los 90 días, se observaron los mismos resultados para IBM e IBMC, aunque sin diferencias significativas entre IBC, IB y C (tabla 2).
El índice de verdor no mostró diferencias significativas entre tratamientos (tabla 2). Estas respuestas se produjeron en condiciones ambientales adversas, con déficit hídrico, durante el estado vegetativo del cultivo (meses de noviembre y diciembre). En el periodo crítico para la determinación del rendimiento, durante los meses de enero y febrero, las condiciones hídricas fueron adecuadas (figura 2).
Los tratamientos de micorrización con y sin curasemilla presentaron un mayor crecimiento (altura de planta, diámetro de tallo y materia seca), en comparación con las plantas no micorrizadas. Este efecto se puede atribuir a una mayor eficiencia en la absorción de agua y nutrientes, principalmente P, y en la resistencia a factores de estrés como el déficit hídrico (Porcel y Ruiz Lozano, 2004). También es sabido que las micorrizas incrementan el número y peso de los nódulos, cuando son co-inoculadas con B. japonicum. Consecuentemente, la dependencia micorrícica (esto es la relación entre la biomasa -PS aéreo- de las plantas micorrizadas comparadas con las no micorrizadas) alcanzó valores de más del 50% a los 60 días después de la siembra y de más del 30% a los 90 días (datos no presentados). Los mayores valores de DM de los tratamientos inoculados con micorrizas, demuestran la mayor eficiencia del inóculo micorrícico utilizado respecto de las cepas autóctonas. Por otra parte, la concentración de nitrógeno en las leguminosas con doble inoculación se incrementa gracias a una mayor fijación por parte de los nódulos y a un mayor aporte de P por acción de la inoculación micorrícica (Barea et al., 1987).
Los resultados de este trabajo coinciden con los presentados por Halos et al. (1982), Hernández y Hernández (1996) y Pijeira et al. (1996), quienes observaron estimulación del crecimiento vegetativo en soja, con inoculación conjunta Bradyrhizobium japonicum-Glomus mosseae.
La eficiencia de la nodulación, expresada a través del número de plantas noduladas, mostró la presencia de nódulos funcionales en los tratamientos de inoculación y coinoculación, con incrementos significativos, del orden del 20% (tabla 3) comparados con el control. En relación al número de nódulos por planta, todos los tratamientos presentaron diferencias significativas con respecto al control. Los tratamientos IBM e IBMC, sin diferencias entre ellos, presentaron un mayor número de nódulos comparados con los tratamientos IB e IBC. Estos resultados muestran una mayor nodulación en los tratamientos de inoculación combinada, con respecto a los de simple inoculación (tabla 3).
Tabla 3. Porcentaje de plantas noduladas, número de nódulos por planta, porcentaje de plantas micorrizadas y porcentaje de raíces micorrizadas, en tratamientos de inoculación y co-inoculación en soja.
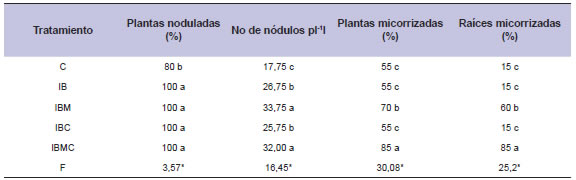
Los tratamientos IBM e IBMC también mostraron un porcentaje significativamente mayor de plantas micorrizadas, comparados con el control. Los restantes tratamientos no mostraron diferencias con el control (tabla 3). Con respecto al porcentaje de raíces micorrizadas, los resultados fueron similares a lo observado para la variable anterior (tabla 3). Si bien el cultivo de soja presenta necesidades muy elevadas de N, una parte importante de este requerimiento es cubierto, vía fijación biológica, a través de la simbiosis con B japonicum (Andrade y Cirilo, 2000).
La inoculación de la semilla es una práctica ya incorporada e indispensable, y de bajo costo, para lograr una adecuada provisión de nitrógeno para el cultivo. En la región pampeana se determinaron aportes de N por esta asociación del orden del 30 al 70% de las necesidades totales de N del cultivo, en función del nivel de fertilidad nitrogenada del suelo y las características climáticas de la estación de crecimiento (González, 2000). Los altos porcentajes de micorrización encontrados en este trabajo, del orden de 85 % para los tratamientos inoculados (IBM e IBMC), comparados con los tratamientos, control, IB e IBC (no inoculados) que presentaron valores significativamente inferiores del orden del 15%, demuestran la baja eficiencia en la colonización micorrícica por parte de poblaciones nativas.
Existe información que demuestra que la población nativa de HFMA presente en el suelo es afectada por las prácticas agrícolas como tipo de siembra (convencional o directa), aplicación de herbicidas y fertilizantes (Dodd y Jeffries, 1989; Schalamuk y Cabello, 2010). Además, otros autores observaron en siembra directa, como en este trabajo, un mayor porcentaje de hifas, arbúsculos, vesículas y número de propágulos infectivos de hongos micorrícicos de la familia Glomeromycota, comparados con suelos con labranza convencional (Douds et al., 1995; Mc Gonigle and Miller, 1996; Mozafar et al., 2000; Schalamuk et al., 2004).
El uso de herbicidas como glifosato es otro de los factores que puede afectar significativamente a las comunidades de Glomeromycota, debido a la eliminación de sus hospedantes alternativos, dada su característica de simbiontes obligados (Feldman y Boyle, 1998). Es así que el mayor uso de herbicidas, no sólo afectaría a la población nativa de HFMA, sino que también perjudicaría al inóculo utilizado. Sin embargo, los resultados de este trabajo muestran una elevada eficiencia de la inoculación micorrícica, contraponiéndose a lo observado en otros casos (Ronco et al., 2008; Savin et al., 2009). Ello puede deberse a las distintas características edáficas, en cuanto a textura, pH y dotación de fósforo, que influencian la adsorción-desorción del herbicida y su liberación en la solución del suelo (Clua et al., 2012).
El uso de fertilizantes y la fertilidad del suelo, constituyen otras variables que afectan marcadamente el desarrollo de los HFMA. En trabajos realizados por Hayman (1975) y Vivekanandan y Fixen (1991), en suelos deficientes en nutrientes, se observaron porcentajes de colonización micorrícica, significativamente más altos comparados con suelos bien provistos de nutrientes. Estos resultados, coincidentes con los observados en este trabajo, se deben fundamentalmente a que en suelos deficientes en nutrientes, principalmente fósforo, el costo energético que implica para la planta el mantenimiento de la simbiosis se justifica por la mayor provisión de este elemento.
En este trabajo se observó que los curasemillas utilizados, a base de Thiram y Carbendazim, no afectaron negativamente el desarrollo de nódulos, e inclusive en el caso particular de la doble inoculación, la micorrización se vio beneficiada cuando se la combinó con los terápicos, coincidentemente con lo observado por Giovannetti et al. (2006) y Samarbakhsh et al. (2009). Estos resultados son opuestos a los observados por Vijayalakshimi y Rao, (1993); Sreenivasa, (1989); y Hernández Dorrego y Mestre Parés, (2010), para el caso de la aplicación de ditiocarbamatos (Thiram) y por Ocampo (1993), Schreiner y Bethlenfalvay (1997) para aplicaciones de Carbendazim en suelo.
Estas diferencias pueden deberse a la oportunidad del uso de fitoterápicos, ya que la aplicación de los mismos inmediatamente a la siembra, como en este trabajo donde el funguicida fue aportado por el curado de la semilla, mostró un aumento en la colonización de micorrizas, en coincidencia con Vijayalakshmi y Rao (1993).
Los resultados obtenidos, en cuanto a los componentes de rendimiento, no mostraron diferencias significativas entre tratamientos para el número de granos por vaina (tabla 4). Con respecto al número de vainas por metro cuadrado, los tratamientos IBC e IBMC fueron significativamente mayores comparados con los demás tratamientos. El tratamiento IB mostró valores significativamente mayores comparado con el tratamiento IBM y el control, sin diferencias significativas entre estos dos últimos tratamientos (tabla 4).
Tabla 4. Numero de granos por vaina, número de vainas m-2, número de granos m-2 y peso de mil granos (PMG), en tratamientos de inoculación y co-inoculación en soja.

Para el número de granos por metro cuadrado, los tratamientos IB, IBC e IBMC fueron significativamente mayores comparado con el tratamiento IBM y el control (tabla 4). El peso de mil granos fue significativamente mayor en el control y el tratamiento IBM, comparado con los restantes tratamientos, mientras que no se observaron diferencias significativas entre los tratamientos IB, IBC e IBMC (tabla 4). Estos resultados son similares a los observados por Corbera y Nápoles (2000) y Bagyaraj et al. (1979), en ensayos con inoculación conjunta B. japonicum y Glomus fasciculatum, en un medio deficiente en fósforo, con incrementos significativos tanto para el número de vainas m-2 como para el número de granos m-2.
Con respecto al rendimiento, los tratamientos IB, IBC e IBMC mostraron diferencias significativas comparados con el control y el tratamiento IBM (tabla 5).
Tabla 5. Rendimiento final (Kg ha-1) y diferencias con el control (Kg ha-1 y %), en tratamientos de inoculación y co-inoculación en soja.

El incremento del rendimiento en los tratamientos con inoculación simple con B. japonicum (IB e IBC) fue del 16 y 18%, respectivamente, y son coincidentes con Díaz Zorita (2004), quien determinó incrementos promedio en el rendimiento de 806 kg ha-1, en 21 lotes sin historia de soja e incrementos de 342 kg ha-1, en 28 lotes con historia previa de soja.
A su vez, los incrementos en el rendimiento observados en el tratamiento de inoculación combinada, IBMC, del orden del 20% comparado con el control, se asemejan a experimentos con doble inoculación en el cultivo de soja, realizados por la EEA INTA Marcos Juárez (2010). En estos estudios se observaron aumentos del rendimiento del 12 al 26 %. Sin embargo, en ellos no se evaluó la variable del uso de fitoterápicos y su incidencia en la efectividad de la doble inoculación, como en el presente trabajo.
CONCLUSIONES
La doble inoculación (IBM e IBMC) incrementó la altura de las plantas, el diámetro de los tallos y la acumulación de materia seca. El rendimiento se incrementó significativamente en los tratamientos con doble inoculación y fitoterápicos de semilla (IBMC) y en aquellos con simple inoculación con Bradyrhizobium japonicum, independientemente de la aplicación de fitoterápicos de semilla (IB e IBC).
BIBLIOGRAFÍA
1. AL-KARAKI, G.N; AL-RADDAD, A. 1997. Effects of arbuscular mycorrhizal fungi and drought stress on growth and nutrient uptake of two wheat genotypes differing in drought resistance. Mycorrhiza, 7: 83-88. [ Links ]
2. AL-KARAKI, G.N.; CLARK, R.B. 1998. Growth, mineral acquisition, and water use by mycorrhizal wheat grown under water stress. Journal of Plant Nutrition, 21: 263-276. [ Links ]
3. ALTIERI, M.A. 1997. Agroecología. Bases científicas para una agricultura sustentable. En: http.//www.buitrago.com.ve/Gustavo/descargas/agroecologia.PDF, verificado: junio de 2011. [ Links ]
4. ANDRADE, F.; CIRILO, A. 2000. Bases para el manejo del Maíz, el Girasol y la Soja. ANDRADE, F. Y SADRAS V. (Eds). Buenos Aires, Argentina. 295 p. [ Links ]
5. BAGYARAJ, D.J.; MANJUNATH, A.; PATIL, R.B. 1979. Interaction between a vesicular-arbuscular mycorrhiza and Rhizobium and their effect on soybean in the field. New Phytologist, 82: 141-145. [ Links ]
6. BAREA, J.M.; AZCÓN AGUILAR, C.; AZCÓN, R. 1987. Vesicular- arbuscular mycorrhiza improve both symbiotic N 2 -fixation and N uptake from soil as assessed with a 15 N technique under field conditions. New Phytologist, 106: 717-721. [ Links ]
7. BELTRANO, J.; RONCO, M.G.; SALERNO, M.I.; RUSCITTI, M.; PELUSO, O. 2003. Respuesta de plantas de trigo (Triticum aestivum L.) micorrizadas en situaciones de déficit hídrico y de rehidratación del suelo. Revista de Ciencia y Tecnología, 8: 1-7. [ Links ]
8. BOLSA DE CEREALES DE BUENOS AIRES. 2010. Estadísticas. Cámara Arbitral de la Bolsa de Cereales de Buenos Aires, Argentina. [ Links ]
9. CLUA, A.; CONTI, M.; BELTRANO J. 2012. The effects of glyphosate on the growth of birdsfoot trefoil (Lotus corniculatus) and its interaction with different phosphorus contents in soil. Journal of Agricultural Science, 4 (7): 208-218. [ Links ]
10. CORBERA, J.; NAPOLES, M. 2000. Evaluación agronómica de la coinoculación de Bradyrhizobium y hongos micorrizógenos arbusculares en el cultivo de soya. En: http.//www.inca.edu.cu/otras_wevb/revista.PDF, verificado: noviembre de 2010. [ Links ]
11. DARWICH, N.A. 1983. Niveles de fósforo asimilable en los suelos pampeanos. IDIA enero-abril: 1-5. [ Links ]
12. DIAZ ZORITA, M.; BALIÑA, R.; FERNÁNDEZ CANIGIA, M. 2004. Inoculación con Bradhyrizobium japonicum en cultivos de Soja. En: Campaña 2003-04. Resumen de resultados de investigación y desarrollo aplicado. Nitragin Argentina S.A. Argentina, pp. 7-12. [ Links ]
13. DODD, J.C.; JEFFRIES, P. 1989. Effect of fungicides on three vesicular-arbuscular mycorrhizal fungi associated with winter wheat (Triticum aestivum L.). Biology and Fertility of Soils, 7:120-128. [ Links ]
14. DOUDS, D.D.; GALVEZ, L.; JANKE, R.R.; WAGONER, P.1995. Effect of tillage and farming systems upon populations and distribution of vesicular-arbuscular mycorrhizal fungi. Agriculture, Ecosystems and Environment, 52: 111-118. [ Links ]
15. EEA INTA MARCOS JUAREZ. 2010. Inoculación de semillas de soja con biofertilizante elaborado en base a micorrizas arbusculares. En: http.//www.inta.gov.ar/marcosjuarez/info/biblioteca/publicaciones.PDF, verificado: octubre de 2010. [ Links ]
16. FELDMAN, F.; BOYLE, C. 1998. Weed-mediated stability of arbuscular mycorrhizal fungi effectiveness in maize monocultures. Journal of Applied Botany, 73: 1-5. [ Links ]
17. FERRARIS, G.; COURETOT, L. 2010. Inoculación en soja con Bradyrhizobium japonicum y micorrizas: efecto de la anticipación del tratamiento, el uso de fungicidas y la fertilización fósforo-azufrada. Proyecto Regional Agrícola. Área de Desarrollo Rural EEA Pergamino. En: http.//www.inta.gov.ar/pergamino/info/biblioteca/publicaciones.PDF,verificado: octubre de 2010. [ Links ]
18. GIOVANNETTI, M.; TURRINI, A.; STRANI, P.; SBRANA, C.; AVIO, L.; PIETRANGELI, B. 2006. Mycorrhizal fungi in ecotoxicological studies: Soil impact of fungicides, insecticides and herbicides. Prevention Today, 2: 47-61. [ Links ]
19. GONZÁLEZ, N. 2000. Inoculación e inoculantes. Fertilizar, 21: 18-21. [ Links ]
20. GUTIERREZ BOEM, F.; SCHAINER, J. 2005. Soja. En: ECHEVERRÍA, H. Y GARCÍA, F. (Eds.) Fertilidad de Suelos y Fertilización de cultivos. Agroeditorial. Argentina, pp. 283-300. [ Links ]
21. HALOS, P.M.; MENDOZA, E.; BORJA, M. 1982. Synergism between endomycorrhizas Rhizobium japonicum. CB 1809 and soybean. Philippine Agricultural, 65 (1): 93-102. [ Links ]
22. HAYMAN, D.S. 1975. The occurrence of mycorrhiza in crops as affected by soil fertility. En: Sanders EF, Mosse, B and Tinker, P.B. (Eds.) Endomycorrhizas. Academic Press, London, UK. pp. 495-509. [ Links ]
23. HERNÁNDEZ, A.; HERNÁNDEZ, A.N. 1996. Efecto de la interacción rhizobium-MA en el cultivo de la soya (Glycine max). Cultivos tropicales, 17 (1): 5-7. [ Links ]
24. HERNÁNDEZ DORREGO, A.; MESTRE PARÉS, J. 2010. Evaluación del efecto de varios fungicidas sobre la simbiosis micorrícica entre dos especies de Glomus presentes en inóculos comerciales y plántulas de Allium porrum L. Spanish Journal of Agricultural Research, 8: 43-50. [ Links ]
25. INTA. 1989. Mapa de Suelos de la provincia de Bs As. Escala 1:50000. En: http.//www.inta.gov.ar/suelos/investiga/investigacion.HTM, verificado: octubre de 2010. [ Links ]
26. JOHNSON, N.C.; GRAHAM, J.H.; SMITH, F.A. 1997. Functioning of mycorrhizal associations along the mutualism-parasitism continuum. New Phytologist, 135: 575-585. [ Links ]
27. JUNIPER, S.; ABBOTT, L K. 2006. Soil salinity delays germination and limits growth of hyphae from propagules of arbuscular mycorrhizal fungi. Mycorrhiza, 5: 371-379. [ Links ]
28. LISON, L. 1976. Estadística aplicada a la biología experimental. EUDEBA. Buenos Aires, Argentina. 357pp. [ Links ]
29. MC GONIGLE, T.P.; MILLER, M.H. 1996. Mycorrhizae, phosphorus absorption, and yield of maize in response to tillage. Soil Science Society of America Journal, 60: 1856-1861. [ Links ]
30. MELGAR, R.; VITTI, G.; MELO BENITES, V. 2011. Fertilizando para altos rendimientos, Soja en Latinoamérica. International Potash Institute, Bol. 20, Horgen, Suiza. 175 pp. [ Links ]
31. MOZAFAR, A.; ANKEN, T.; RUH, R.; FROSSARD, E. 2000. Tillage intensity, mycorrhizal and non-mycorrhizal fungi, and nutrient concentrations in maize, wheat, and canola. Agronomy Journal, 92: 1117-1124. [ Links ]
32. OCAMPO, J.A. 1993. Influence of pesticides on VA mycorrhiza. En: ALTMAN, J. (Ed.) Pesticide-plant pathogen interactions in crop production: Beneficial and deleterious effects. CRC Press, Boca- Raton, USA. pp 213-216. [ Links ]
33. PERTICARI, A.; PUENTE, M. 2006. Promotores del crecimiento vegetal. Revista CREA XXXVI, 304: 66-69. [ Links ]
34. PIJEIRA, L.; TRETO, E.; MEDEROS, J.D.; CORBERA, J.; VELAZCO, A.; CASTELLANOS, M.; MEDINA, N. 1996. El uso del biofertilizante (inoculante micorrizógeno) en diferentes especies cultivadas en Bolivia. Actas XVIII, Reunión Latinoamericana de Rhizobiología. Santa Cruz de la Sierra, Bolivia, pp. 395-396. [ Links ]
35. PLENCHETTE, C.; DUPONNOIS, R. 2005. Growth response of the saltbush Atriplex nummularia L. to inoculation with the arbuscular mycorrhizal fungus Glomus intraradices. Journal of Arid Environment, 61: 35-40. [ Links ]
36. PORCEL, R.; RUIZ LOZANO, J.M. 2004. Evaluation of the role of genes encoding for dehydrin proteins during drought stress in arbuscular mycorrhizal Glicine max and Lactuca sativa plants. Journal of Experimental Botany, 56: 417-425. [ Links ]
37. QUIROGA, A.; SAKS, M.; FERNÁNDEZ, R.; FUNARO D. 2006. Aspectos del manejo del agua y la nutrición nitrogenada de maíz en la región semiárida y subhúmeda pampeana. En: http.//www.inta.gob.ar/anguil/info/pdfs/publicaciones/publi69.PDF,verificado:septiembre de 2010. [ Links ]
38. RABIE, G.G.; ALMADINI, A.M. 2005. Role of bioinoculants in development of salt-tolerance of Vicia faba plants under salinity stress. African Journal of Biotechnology, 4: 210-223. [ Links ]
39. RONCO, M.G.; BELTRANO, J.; RUSCITTI, M.; ARANGO, M.C. 2008. Glyphosate and mycorrhization induce changes in plant growth and in root morphology and architecture in pepper plants (Capsicum annuum L.). Journal of Horticultural Science and Biotechnology, 83 (4): 497-505. [ Links ]
40. RUIZ-LOZANO, J.M.; AZCON, R. 1995. Hyphal contribution to water uptake in mycorrhizal plants as affected by the fungal species and water status. Physiology Plantarum, 95: 472-478. [ Links ]
41. RUSCITTI, M.; ARANGO, C.;,RONCO, M.; BELTRANO, J. 2011. Inoculation with mycorrhizal fungi modifies proline metabolism and increases chromium tolerance in pepper plants (Capsicum annuum L.). Brazilian Journal of Plant Physiology, 23 (1): 15-25. [ Links ]
42. SAMARBAKHSH, S.; REJALI, F.; ARDAKANI, M.R.; PAKNEJAD, F.; MIRANSARI, M. 2009. The combined effects of fungicides and arbuscular mycorrhiza on corn (Zea mays L.). Growth and yield under field conditions. Journal of Biological Sciences, 9: 372-376. [ Links ]
43. SATORRE, E.H. 2003. El Libro de la Soja. Servicios y Marketing Agropecuario, Buenos Aires, Argentina. 264 pp. [ Links ]
44. SAVIN, M.; LARRY, C.; PURCELL, A.; DAIGH, A.; MANFREDINI, A. 2009. Response of mycorrhizal infection to glyphosate applications and P fertilization in glyphosate-tolerant Soybean, Maize, and Cotton. Journal of Plant Nutrition, 32: 1702-1717. [ Links ]
45. SCHALAMUK, S.; VELÁZQUEZ, S.; CHIDICHIMO, H.; CABELLO, M. 2004. Effect of no-till and conventional tillage on mycorrhizal colonization in spring wheat. Boletín de la Sociedad Argentina de Botánica, 39: 13-20. [ Links ]
46. SCHALAMUK, S.; CABELLO, M. 2010. Arbuscular mycorrhizal fungal propagules from tillage and no-tillage systems: possible impacts on Glomeromycota diversity. Mycologia, 102: 261-268. [ Links ]
47. SCHREINER, R.P.; BETHLENFALVAY, G.J. 1997. Plant and soil response to single and mixed species of arbuscular mycorrhizal fungi under fungicide strees. Applied Soil Ecology, 7: 93-102. [ Links ]
48. SCHÜSSLER, A.; SCHWARZOTT, D.; WALKER, C. 2001. A new fungal phylum, the Glomeromycota: phylogeny and evolution. Mycology Research, 105: 1413-1421. [ Links ]
49. SHARIFI, M.; GHORBANLI, M.; EBRAHIMZADEH, H. 2007. Improved growth of salinity-stressed soybean after inoculation with salt pre-treated mycorrhizal fungi. Journal of Plant Physiology, 164: 1144-1151. [ Links ]
50. SREENIVASA, M.N.; BAGYARAJ, D.J. 1989. Use of pesticides for mass production of vesicular-arbuscular mychorrhizal inoculum. Plant Soil, 119: 127-132. [ Links ]
51. TIAN, C.Y.; FENG, G.; LI, X.L.; ZHANG, F.S. 2004. Different effects of arbuscular mycorrhizal fungal isolates from saline or nonsaline soil on salinity tolerance of plants. Agricultural Ecosystem and Environmental Applied Soil Ecology, 26: 143-148. [ Links ]
52. VIJAYALAKSHMI, M.; RAO, A.S. 1993. Influence of fungicides on vesicular-arbuscular mycorrhizae in Sesamum indicum L. Microbiological Research, 148: 483-486. [ Links ]
53. VINCENT, J.M. 1970. A Manual for the practical study of root nodules bacteria. Blackwell Sci. Publications. Oxford, England. [ Links ] [ Links ]














