Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
RIA. Revista de investigaciones agropecuarias
On-line version ISSN 1669-2314
RIA. Rev. investig. agropecu. vol.40 no.1 Ciudad Autónoma de Buenos Aires Apr. 2014
ARTÍCULOS
Aportes a la Técnica de Insecto Estéril: Una cepa de Anastrepha fraterculus (Diptera: Tephritidae) con maduración sexual temprana
Peralta, P.A.; Milla, F.H. y Cladera J.L.1
1Instituto Nacional de Tecnología Agropecuaria (INTA), Instituto de Genética "Ewald A. Favret" Laboratorio de Genética de Insectos de Importancia Económica. pperalta@cnia.inta.gov.ar
Recibido el 15 de noviembre de 2011
Aceptado el 22 de noviembre de 2013
Publicado online el 08 de enero de 2014
RESUMEN
El proceso de maduración sexual de los machos de Anastrepha fraterculus (Wied.) es relativamente largo comparado con el de otros tefrítidos. Si se quiere aplicar la Técnica del Insecto Estéril (TIE), el costo se incrementa debido a que se necesita mantener los insectos en condiciones de cría artificial por un tiempo prolongado hasta su liberación. Nuestro objetivo fue estudiar los tiempos de maduración sexual en cinco cepas con mutaciones morfológicas y realizar cruzamientos para el estudio de la transmisión de este carácter en A. fraterculus. Asimismo, se estudió el efecto del tratamiento tópico con hormona juvenil (HJ) sobre la maduración sexual en estos machos mutantes. El tiempo que tardan los individuos en alcanzar la madurez sexual fue determinado mediante observaciones del comportamiento sexual, donde machos de distintas edades fueron confrontados con hembras vírgenes sexualmente maduras. Se encontró variabilidad en los tiempos de maduración sexual, y se detectó una cepa de maduración rápida (#3210), la cual al cruzarla con la cepa control manifestó un efecto paterno sobre la maduración sexual y este efecto se repitió en los descendientes de ambos sexos hasta la generación 14, independientemente del origen materno. La utilización de metopreno (análogo de la HJ), permitió acortar aún más los tiempos de maduración en ambas cepas. Estos resultados permiten proponer el uso de la cepa #3210 de A. fraterculus como modelo de estudio del carácter madurez sexual prematura y como material para desarrollar mejoras en el marco de la implementación de TIE para esta especie.
Palabras clave: Moscas de la fruta; TIE; Tefrítidos; HJ, Maduración sexual; Selección de tiempos de maduración; Metopreno.
ABSTRACT
Sexual maturation is a relatively long process in Anastrepha fraterculus males compared to other tephritids. This leads to an increase in the costs to apply the Sterile Insect Technique (SIT) because the flies must be kept in laboratory conditions for several days before being released. Our objective was to study the duration of the sexual maturation process in five mutant strain of A. fraterculus and to study the heredability of this trait. We also analyzed the effect of the juvenile hormone (JH) treatment on the sexual maturation of males of some of the mutant strains. To estimate sexual maturity we observed the sexual behavior of males at different ages, after offering them sexually mature virgin females. We found that males from strain #3210 had a significantly shorter pre-copulatory period than the males from the other strain. To study the heredability of this carácter in the mutant strain, we performed crosses between individuals from the #3210 strain and the males and females of the wild-type stock. We observed that the sons of #3210 males matured significantly faster than the descendants of wild-type males, irrespective of the origin of the mother. When the descendants of both sexes were analyzed at 14th generation, we found that these results were repeated. The use of methoprene (JH analog) reduced the duration of the sexual maturation process in both strains. These results encourage the use of the #3210 strain of A. fraterculus both as a model to study the inheritance of genes associated to sexual maturation, and also as a candidate strain for mass rearing and release within the framework of a SIT program against this fruit fly pest.
Keywords: Fruit flies; SIT; Tephritidae; JH; Sexual maturity; Mating time selection; Methoprene.
INTRODUCCION
Anastrepha fraterculus, es una de las plagas de rutáceas, moráceas, mirtáceas y cactáceas (entre otras plantas hospederas, Ovruski et al., 2003; Oroño et al., 2006) causantes de perjuicios importantes en la economía de América del Sur (Christenson y Foote, 1960), las cuales provocan impacto negativo en la comercialización frutihortícola debido a restricciones cuarentenarias para el ingreso de fruta por parte de los países importadores libres de estas plagas (Vreysen et al., 2006). Erradicar o suprimirlas, permitiría mantener un mercado frutihortícola más rentable y competitivo a nivel nacional e internacional.
Entre los métodos no contaminantes utilizados para controlar esta plaga se encuentra la Técnica del Insecto Estéril, (TIE) (Knipling 1959, 1979; Gilmore et al., 1989; revisión por Dyck et al., 2005). La fase final de la TIE es la liberación de moscas estériles en el campo, las cuales requieren ser alimentadas desde su emergencia y hasta alcanzar su madurez sexual. Como en los machos de Anastrepha la maduración sexual es un proceso largo en comparación con otros tefrítidos (Boletín de Sanidad Vegetal 45 ICA), se genera un incremento de los costos para la aplicación de la técnica. En este sentido, toda investigación acerca de algún aspecto relacionado con la madurez sexual puede resultar de importancia práctica.
En los insectos, la reproducción, el comportamiento y los procesos metabólicos, son estimulados y controlados por el sistema endócrino. En la larva de holometábolos, la presencia de hormona juvenil (HJ) durante la muda asegura que el desarrollo continúe en un estadío larval y no avance al de pupa o adulto. La metamorfosis ocurre cuando la HJ desaparece de la circulación pero su concentración vuelve a aumentar en el adulto reproductivamente activo (Truman y Riddiford, 1999). En el desarrollo reproductivo de los machos de algunas especies de insectos, la HJ promueve el desarrollo de los órganos sexuales accesorios.
En Anastrepha el desarrollo reproductivo y el llamado a través de feromonas juegan un rol importante en el proceso de maduración sexual del macho, estando involucrados en el apareamiento y competencia sexual (Teal et al., 2000 a; Lux et al., 2002; Hendrichs et al., 2002). En algunas especies de Anastrepha se han realizado ensayos de laboratorio y a campo sobre el estudio de metopreno, sobre pupas o con aplicaciones tópicas sobre adultos recién emergidos y su influencia en el desarrollo sexual y desempeño del macho (Segura et al., 2009; Aluja et al., 2009; Pereira et al., 2010). Existen también otros factores producidos en el cerebro que regulan el desarrollo sexual y son posteriormente transportados a través de la hemolinfa para promover su acción en los órganos blancos, aún sin explorar (Noriega et al., 2006). Sin embargo, el conocimiento de algunos aspectos fisiológicos y genéticos de esta especie es aún muy escaso, por ejemplo, el de los genes que regulan el tiempo de maduración sexual. Nuestro objetivo fue comparar el tiempo que tardan en madurar sexualmente los machos de distintas cepas de A. fraterculus mantenidas en nuestro laboratorio, a fin de seleccionar aquella que presente un menor tiempo para alcanzar la maduración sexual.
Además, realizar cruzamientos para comparar la herencia del carácter "maduración sexual masculina rápida" entre los hijos de los machos F1, y los hijos de las hembras F1 en la cepa seleccionada, y también examinar el efecto acelerador del metopreno sobre la maduración sexual en los machos de la cepa escogida.
MATERIALES Y MÉTODOS
Insectos
Se utilizaron las siguientes poblaciones de laboratorio de A. fraterculus mantenidas sobre dieta artificial, en el Laboratorio de Genética de Insectos de Importancia Económica, Instituto de Genética "E. A. Favret", INTA Castelar, Argentina:
HM: Población formada con larvas silvestres provenientes de guayabas (Psidium guajava L), colectadas en la localidad de Horco Molle, provincia de Tucumán, Argentina, e ingresada al laboratorio hace 4 años.
L-TUC: Cepa wild type en cruzamientos de laboratorio. Colonia originaria de la Estación Experimental Agro Industrial Obispo Colombres, Tucumán, Argentina (Vera et al., 2007), mantenida en cría por cinco años.
Las cepas puras fueron encontradas en frutos de falsa guayaba (Feijoa sellowiana), colectados en Ituzaingó, Provincia de Buenos Aires, y mantenidas en el laboratorio durante 14 años.
2975: Fundada a partir de una pareja individual de insectos descendientes de la cepa 294 (Delprat et al. 2001). Estas moscas no son portadoras de mutaciones.
3312: Originada en el cruzamiento entre machos de la cepas de laboratorio 1955 (variante fenotípica de color de ojo denominada orange) y hembras 3160 (variante fenotípica de color de cuerpo color castaño rojizo). Fue constituida solamente con descendientes de color de cuerpo salvaje y ojo orange.
#3210: Cepa construida a partir del cruzamiento entre macho 3160 y hembra 2975 y constituída solamente con los descendientes de color de ojo orange.

Procedimiento general para la observación de cópulas
Los insectos fueron mantenidos en cámara de cría bajo condiciones controladas (T: 24-26 °C, RH: 60-70%, fotoperíodo: 14-10 L-O), provistos de agua y dieta artificial de adultos (ver Vera et al., 2007 para detalles de cría). Para establecer la edad en que los machos llegan a la madurez sexual, se los evaluó mediante su capacidad de copular con hembras maduras y vírgenes.
En el día de su emergencia, los machos fueron separados y pintados en el tórax con un pincel fino, utilizando un color diferente para cada macho (pintura al agua ALBA, Induart S.A, Buenos Aires, Argentina). Luego fueron colocados en contenedores transparentes de vidrio de 3 l, en cuyo interior se introdujo una rama artificial, agua y alimento para adultos estándar ad libitum (Jaldo et al., 2001). Por cada contenedor se colocaron 5 machos de 2 días de edad, y 10 hembras vírgenes de la cepa L-TUC sexualmente maduras (7 días después de haber emergido).
En cada contenedor (repetición) se registró, cada 15 minutos, la ocurrencia de cópulas durante el período de actividad sexual de A. fraterculus (aproximadamente las 3 primeras horas de luz, según Petit-Marty et al., 2004). Se observaron los comportamientos normales de llamado y cortejo. Una vez detectadas las parejas en cópula, fueron retiradas del contenedor sin perturbar a los demás individuos y se continuó con las observaciones. Este procedimiento continuó hasta que todos los machos dentro de los 20 contenedores por cepa copularon.
Procedimiento para la comparación del tiempo de maduración sexual entre la cepa #3210 y L-Tuc.
Para la generación de las líneas M3210 y H3210 se realizaron cruzamientos con descendientes provenientes de hijos de machos #3210 (M3210) y los hijos provenientes de hembras #3210 (H3210). Las observaciones de cópulas se realizaron según el procedimiento general.
Procedimiento para el tratamiento con metopreno
El tratamiento con metopreno apropiado para A. fraterculus consistió en la aplicación de 1 μl de metopreno diluido en acetona (5 μg/ml) sobre el tórax de los machos recién emergidos, usando una micropipeta (Teal et al., 2000 b; Segura et al., 2008). Se observaron 10 repeticiones para cada cepa.
Análisis de datos
Para determinar la existencia de diferencias entre cepas en el tiempo de maduración sexual, se realizó un ANOVA utilizando la edad de apareamiento como variable dependiente y la cepa como factor. El mismo análisis fue realizado para detectar diferencias en los machos provenientes de distintos cruzamientos y para determinar el efecto del metopreno sobre el proceso de maduración sexual. En caso de encontrarse diferencias significativas se procedió a un análisis de contrastes. Cuando se detectó interacción, se realizó un análisis de efectos simples. Para los casos en que los datos crudos no tuvieron homogeneidad de varianza se realizó una transformación aplicando raíz cuadrada (Statistica 6).
RESULTADOS
Experimento 1: Comparación de tiempos de maduración entre distintas cepas
Con la finalidad de determinar los tiempos de maduración en las cepas disponibles, se analizaron 57 machos L-TUC, 51 machos de la cepa #3210, 115 machos para la HM, 117 machos para 3312 y 86 machos para 2975. Se encontraron diferencias significativas entre las cepas (F(4,81)=6,1847 P=0,0002). Al realizar los contrastes, se detectó que los machos de la cepa #3210 requieren menor tiempo para alcanzar la madurez sexual con respecto al resto de los machos de las cepas, entre las cuales existen tiempos intermedios de madurez (3312, 2975) y tiempos más largos (L-TUC y H-M) (tabla 1, figura 1). Por lo tanto, el tiempo que tardan en madurar sexualmente los machos de la cepa #3210 es significativamente menor que el que tardan en hacerlo los machos de las otras cepas disponibles en el laboratorio.
Tabla 1. Promedio (±EE) de la edad a la que los machos alcanzaron la madurez sexual para cada cruzamiento. Valores mostrados con la misma letra no difieren significativamente entre si (HSD, α=0,05)

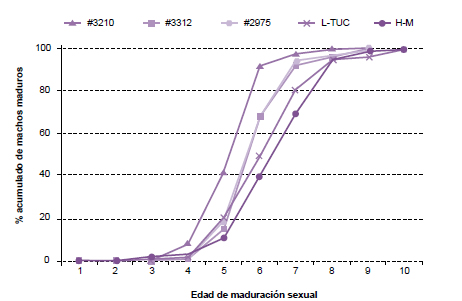
Figura 1. Porcentaje acumulado de machos apareados provenientes de 5 cepas diferentes, desde su emergencia hasta los 10 días de edad.
Experimento 2: Estudio de la herencia del carácter tiempo de maduración
Una vez determinada la existencia de una cepa de maduración más rápida (cepa #3210), se realizaron cruzamientos para estudiar de qué manera se hereda el carácter de madurez sexual de los machos. Para dichas observaciones se utilizaron 64 machos provenientes de la cruza #3210 x #3210, 49 machos de la cruza L-TUC x L-TUC, 53 machos de la cruza entre machos #3210 x hembras L-TUC (M3210) y 32 machos de la cruza entre machos L-TUC x hembras #3210 (H3210). Se encontraron diferencias estadísticamente significativas en los tiempos de maduración entre los machos provenientes de los cuatro cruzamientos (F(3,40)= 15,76 P=0,00001). Las comparaciones múltiples muestran que los machos provenientes de cruzamientos que involucran machos de la cepa #3210 maduran significativamente más rápido que los machos provenientes de cruzamientos que involucran machos L-Tuc, independientemente del tipo de hembra (tabla 2, figura 2). Es decir, que la cepa #3210 transmite a su progenie este carácter de maduración sexual temprana a través de los machos ya que la herencia de este carácter se verifica exclusivamente entre la descendencia de los hijos de la cepa de maduración más rápida (M3210), y la descendencia masculina de las hijas carece de dicha condición (H3210).
Tabla 2. Promedio (±EE) de la edad a la que los machos alcanzaron la madurez sexual para cada cruzamiento. Valores mostrados con la misma letra no difieren significativamente entre si (HSD, α=0,05).


Figura 2. Porcentaje acumulado de parejas (por cada cruzamiento) que fueron observadas en comportamiento de cópula durante un período de 8 días consecutivos. Los datos representan los porcentajes acumulados sobre el total de observaciones realizadas.
Experimento 3: Comparación del tiempo de maduración entre la F1, F6 y F14 de las cepas M 3210 y H3210.
Con los individuos obtenidos en el experimento 2 se realizaron comparaciones sobre el tiempo de maduración en tres generaciones entre las cepas M3210 y H3210 (F1, F6 y F14). Se detectó una interacción estadísticamente significativa entre la cepa y la generación (Cepa F(2,377)= 154,12 P=0,0000; Generación; F (2,377)= 14,12 P =0,000001; Interacción Cepa x Generación F(2,377)= 11,01 P =0,000023). (tabla 3, figura 3). Al analizar los efectos de cada factor por separado (análisis de efectos simples) se encontró que los machos provenientes de cruzamientos con machos de la cepa #3210 (M3210) maduran significativamente más rápido que los machos descendientes de cruzamientos que involucran hembras #3210 (H3210) para las 3 generaciones. (Generación F1; F(1,377)= 38,30 P<0,00005, Generación F6; F(1,377)= 128,59 P<0,00005, Generación F14; F(1,377)= 27,84 P<0,00005). Asimismo, existen diferencias entre generaciones sólo para H3210 destacándose la F6 que registra valores más altos (Cepa M3210; F(2,377)= 6,34 P = 0,136224; Cepa H3210; F(2,377)= 21,09 P = 0,045263). (Tabla 3, Figura 3). Se concluye que el carácter es heredado de manera estable al menos por el término de 14 generaciones.
Tabla 3. Promedio (±EE) de la edad a la que los machos alcanzaron la madurez sexual para cada cruzamiento y entre paréntesis se muestra el número de observaciones realizadas. Los resultados muestran que no existen diferencias entre generaciones, pero sí entre cepas.


Figura 3. Porcentaje de parejas descendientes de M3210 y H3210 (por cruzamiento, por generación) que fueron observadas en comportamiento de cópula, durante un período de 8 días consecutivos. Los datos representan los porcentajes acumulados sobre el total de observaciones realizadas.
Experimento 4: Efecto del metopreno sobre la cepa seleccionada.
En base a los resultados del experimento 1 se tomaron 54 machos de la cepa #3210 y se los trató con metopreno, y 62 machos de la misma quedaron sin tratar. Se procedió de la misma manera para la cepa L-TUC (50 machos tratados y 50 machos control). Ambos grupos fueron observados siguiendo el protocolo anteriormente detallado. El tiempo en que alcanzaron la madurez sexual los machos tratados y no tratados se muestra en la tabla 4. Se encontraron diferencias entre los cuatro tipos de machos. Las comparaciones múltiples permitieron determinar que los machos tratados maduran más rápido que los no tratados, que las diferencias en tiempos de maduración detectadas en el experimento 1 se mantienen por encima del tratamiento con la hormona y que los machos #3210 tratados con metopreno maduran sexualmente más rápido que su contraparte sin tratar (tabla 4, figura 4). Esto indica que la interacción entre este carácter genético y el efecto acelerador de la madurez ejercido por análogos de la hormona juvenil presenta un modo aditivo, lo cual permite concluir que la aceleración de la madurez en la cepa #3210 obedecería a un efecto diferente de aquel causado por el nivel de hormona juvenil.
Tabla 4. Promedio (±EE) de la edad a la que los machos alcanzaron la madurez sexual para cada cruzamiento, luego del tratamiento, acompañado de los machos control. Los valores mostrados con la misma letra no difieren entre sí en el test LSD. T: Tratados con metopreno; No T: No tratados con metopreno.


Figura 4. Porcentajes acumulados sobre el total de observaciones realizadas durante 10 días consecutivos. T: Tratados con metopreno; No T: No tratados con metopreno.
DISCUSIÓN
Sabiendo que la utilización de un análogo de HJ acelera el proceso de maduración sexual en A. fraterculus (Segura et al., 2010), mostramos aquí que existe una cepa (#3210) capaz de exhibir tiempos más cortos de madurez sexual en comparación con las otras, sin aplicar dicho tratamiento. En ella, la totalidad de los machos observados se encuentran sexualmente maduros al día 5 luego de la emergencia. En comparación, la cepa L-TUC, madura a los 6 días en promedio. Al realizar el cruzamiento entre machos #3210 y hembras normales para el carácter (cepa L-TUC) y su recíproco, se observó que los hijos de los machos presentaron una maduración más rápida que los descendientes de hembras #3210, hecho que indica que la herencia del carácter se realiza por vía paterna. Este efecto se mostró heredable hasta la finalización del presente estudio, es decir hasta la generación 14.
Nuestros resultados muestran que el tratamiento con un análogo de hormona juvenil (HJ) en esta cepa, produce una reducción adicional en los tiempos de madurez sexual. Los machos tratados y los no tratados presentaron diferencias significativas, indicando que esta reducción adicional en los tiempos de madurez debida al tratamiento con metopreno, se superpone al efecto de la maduración temprana de los machos de la cepa 3210.
Es conocido el hecho que muestra que las cepas adaptadas a cría masiva o laboratorio tienen a menudo tiempos de desarrollo más cortos que sus contrapartes silvestres, debido a la selección involuntaria de aquellos huevos que son depositados primero y a las óptimas condiciones de alimentación y cuidados. En este caso es posible que nuestro "wild type" (L-TUC), con cinco años de cría en laboratorio, ya tenga un desarrollo más rápido que las poblaciones silvestres de campo. Por tal motivo, se considera importante la selección inadvertida por desarrollo rápido que normalmente se presenta en cepas adaptadas a laboratorio.
Si bien los machos tratados con metopreno son capaces de copular y también de transferir esperma en forma equivalente a los no tratados (Segura et al., 2010), recientes observaciones (Abraham et al., 2012 a, 2012 b) indican que los individuos tratados no serían tan eficientes como los no tratados en impedir que sus parejas vuelvan a copular con otros machos. Aún concediendo que el agregado de HJ no es una condición natural, este problema debería ser investigado mejor en trabajos futuros, debido a su importancia para la aplicación de la TIE. En este sentido, sería muy interesante la comparación de los individuos que maduran tempranamente por causa genética (cepa #3210), con aquellos que lo hacen inducidos por una sobredosis de HJ, en cuanto a inhibición del re-apareo. También sería muy importante evaluar la competitividad sexual de la cepa #3210 (y su progenie) con moscas silvestres de campo, antes de decidir su incorporación a la cría masiva.
La identificación y selección de individuos de maduración sexual temprana, que muestren comportamiento normal en el cortejo, permitirá obtener ventajas como la reducción del tiempo de maduración en los centros de empaque y liberación. De ésta manera, disminuirán los costos de operación, permitiendo además la liberación de moscas estériles sexualmente maduras, lo que contribuirá a incrementar la eficiencia de la TIE para controlar A. fraterculus, investigaciones de gran necesidad en nuestro país. Asimismo, la investigación sobre la base genética de la maduración sexual en A. fraterculus permitirá un abordaje integral del tema, sentando las bases para futuros proyectos sobre la caracterización de genes involucrados en el proceso de maduración sexual y su posterior utilización en tecnologías asociadas al control de plagas.
AGRADECIMIENTOS
Agradecemos a la Dra. Leonela Carabajal Paladino y a los tres revisores anónimos por las valiosas sugerencias. El presente trabajo se desarrolló en el marco del Proyecto INTA AEPV-215022, y Subsidio IAEA-15745.
BIBLIOGRAFÍA
1. ABRAHAM, S.; CLADERA, C.; GOANE, L.; VERA, T. 2012a. Factors affecting Anastrepha fraterculus female receptivity modulation by accessory gland products. Journal of Insect Physiology 58, 1-6. [ Links ]
2. ABRAHAM, S.; LIENDO, M.C.; DEVESCOVI, F.;PERALTA, P.; YUSEF, V.; RUIZ, M.J.; CLADERA, C.; VERA, T. ; SEGURA, D. 2012b. Remating behaviour in Anastrepha fraterculus (Diptera: Tephritidae) females is affected by male juvenile hormone analogue treatment but not by male sterilization. En prensa. [ Links ]
3. ALUJA, M.; ORDANO, M.; TEAL, P.E.A.; SIVINSKI, J.; GARCIAMEDEL, D.; ANZURES-DADDA, A. 2009. Larval feeding substrate and species significantly influence the effect of a juvenile hormone analog on sexual development/performance in four tropical tephritid flies. Journal of Insect Physiology 55, 231-242. [ Links ]
4. (ICA) INSTITUTO COLOMBIANO AGROPECUARIO. 2006. Algunas especies de moscas de la fruta, exóticas para Colombia. Boletín de Sanidad Vegetal. ICA 45, 1-30. [ Links ]
5. CHRISTENSON, L.D.; FOOTE, R.H. 1960. Biology of fruit flies. Annual Review of Entomology 5, 171-192. [ Links ]
6. DELPRAT, M.A.; MANSO, F.C.; CLADERA, J.L. 2001. Morfología larvaria de la raza pura Arg294 de Anastrepha fraterculus (Wiedeman) (Diptera: tephritidae) de Argentina y una comparación con Ceratitis capitata. Revista Chilena de Entomologia. 28, 39-46. [ Links ]
7. DYCK, V.A.; HENDRICHS, J.; ROBINSON, A.S. 2005. Sterile Insect Technique. Principles and Practice in Area-Wide Integrated Pest Management 95-114 IAEA. Springer. [ Links ]
8. GILMORE, J.E. 1989. Sterile insect technique (SIT): In A.S. Robinson and G. Hooper (eds.), Fruit Flies: their biology, natural enemies and control. Elsevier Science Publishers B. V., Amsterdan, The Netherlands. 3B, 353-363. [ Links ]
9. HENDRICHS, J.; ROBINSON, A.S.; CAYOL, J.P.; ENKERLIN, W. 2002. Medfly areawide sterile insect technique programmes for prevention, suppression or eradication: the importance of mating behavior studies. Florida Entomologist 85 (1), 1-13. [ Links ]
10. JALDO, H.E.; GRAMAJO, M.C.; WILLINK, E. 2001. Mass rearing of Anastrepha fraterculus (Diptera: Tephritidae): a preliminary strategy. Florida Entomologist 84, 716-718. [ Links ]
11. KNIPLING, E.F. 1959. Sterile-male method of population control. Science 130 (3380) , 902-904. [ Links ]
12. KNIPLING, E.F. 1979. The Basic Principals of Insect Population Suppression y Management (U.S. Dept. of Agric., Washington, DC), USDA Agriculture Handbook 512 pp. [ Links ]
13. LUX, S.A.; MUNYIRI, F.N. VILARDI, J.C., LIEDO, P.; ECONOMOPOULOS, A.; HASSON, O.; QUILICI, S. GAGGL, K; CAYOL. J.P.; RENDON, P. 2002. Consistency in courtship pattern among populations of medfly (Diptera: Tephritidae): Comparisons among wild strains and strains mass reared for SIT operations. Florida Entomologist 85, 113-125. [ Links ]
14. NORIEGA, F.G.; RIBEIRO, J.M.C.; KOENER, J.F.; VALENZUELA, J.G.; HERNANDEZ-MARTINEZ, S.; PHAM, V.M.; FEYEREISEN, R. 2006. Comparative genomics of insect juvenile hormone biosynthesis. Insect Biochemistry and Molecular Biology 36, 366-374. [ Links ]
15. OROÑO, L.E; ALBORNOZ-MEDINA, P; NÚÑEZ-CAMPERO, S; VAN NIEUWENHOVE, G.A; BEZDJIAN, L.P; MARTIN, C.B; SCHLISERMAN, P; OVRUSKI, S.M. 2006. Update of host Plant list of Anastrepha fraterculus and Ceratitis capitata in Argentina. Proceedings of the 7th International Symposium on Fruit Flies of Economic Importance, 207-225. [ Links ]
16. OVRUSKI, S. M.; SCHLISERMAN, P; ALUJA, M. 2003. Native and introduced host plants of Anastrepha fraterculus and Ceratitis capitata (Diptera: Tephritidae) in Northwestern Argentina. J. Econ. Entomol. 96, 1108-1118. [ Links ]
17. PETIT-MARTY, N.; VERA, M.T.; CALCAGNO, G.; CLADERA, J.L.; SEGURA, D.F.; ALLINGHI, A.; RODRIGUERO, M.; GÓMEZ CENDRA, P.; VISCARRET, M.M.; VILARDI, J.C. 2004. Sexual behaviour and mating compatibility among four populations of Anastrepha fraterculus (Diptera: Tephritidae) from Argentina. Annals of the Entomological Society of America 97, 1320-1327. [ Links ]
18. PEREIRA, R.; SIVINSKI, J.; TEAL, P.E.A. 2010. Influence of a Juvenile Hormone Analog and Dietary Protein on Male Anastrepha suspensa (Diptera: Tephritidae) Sexual Success. Journal of Economic Entomology 103 (1), 40-46. [ Links ]
19. SEGURA, D.F.; LIENDO, M.C.; DEVESCOVI, F.; BACHMANN, G.; UTGÉS, M.E.; MILLA, F.H.; VERA, M.T.; TEAL, P.E.A.; CLADERA, J.L. 2008. JH treatment on Anastrepha fraterculus (Diptera: Tephritidae): effect of irradiation and protein content in the adult diet on JH treated males and mass deliver of JH. VII Meeting of the Working Group on Fruit Flies of the Western Hemiphere. Mazatlán, Mexico. [ Links ]
20. SEGURA, D.F.; CACERES, C.; VERA, T.; WORNOAYPORN, V.; ISLAM, A.; TEAL, P.; CLADERA, J.L.; HENDRICHS, J.; ROBINSON, A. 2009. Enhancing mating performance after juvenile hormone treatment in Anastrepha fraterculus (Diptera: Tephritidae): a differential response in males and females acts as a physiological sexing system. Entomologia Experimentalis et Applicata 131, 75-84. [ Links ]
21. SEGURA, D.F.; UTGÉS, M.E.; LIENDO, M.C.; RODRÍGUEZ, M.; DEVESCOVI, F.; VERA, M.T.; TEAL, P.E.A.; CLADERA, J.L. 2010. Methoprene treatment reduces the pre-copulatory period in Anastrepha fraterculus (Diptera: Tephritidae) sterile males. Journal of Applied Entomology 135 (8), 1-11. [ Links ]
22. TEAL, P.E.A.; GOMEZ-SIMUTA, Y.; PROVEAUX, A.T. 2000 a. Mating experience and juvenile hormone enhance sexual signaling and mating in male Caribbean fruit flies. Proceedings of the National Academy of Sciences 97, 3708-3712. [ Links ]
23. TEAL, P.E.A.; PROVEAUX, A.T.; HEATH, R.R. 2000 b. Analysis and Quantitation of Insect Juvenile Hormones Using Chemical Ionization Ion-Trap Mass Spectrometry. Analytical Biochemistry 277, 206-213. [ Links ]
24. TRUMAN, J.W; RIDDIFORD, L.M. 1999. The origins of insect metamorphosis. Nature 401, 447-452. [ Links ]
25. VERA, M.T.; ABRAHAM, S.; OVIEDO, A.; WILLINK, E. 2007. Demographic and quality control parameters of Anastrepha fraterculus (Diptera: Tephritidae) maintained under artificial rearing. The Florida Entomologist 90, 53-57. [ Links ]
26. VREYSEN, M.J.B.; HENDRICHS, J.; ENKERLIN, W.R. 2006. The Sterile Insect Technique as a Component of Sustainable Area- Wide Integrated Pest Management Of Selected Horticultural Insect Pest. Journal of Fruit and Ornamental Plant Research 14 (3), 107-131. [ Links ]














