Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
RIA. Revista de investigaciones agropecuarias
versión On-line ISSN 1669-2314
RIA. Rev. investig. agropecu. vol.41 no.2 Ciudad Autónoma de Buenos Aires ago. 2015
ARTÍCULOS
Zeranol y metabolitos urinarios de zearalenona en bovinos para carne
Salvat, A.E.1; Comerio, R.M.4; Balbuena, O2.; Rosello Brajovich, J.E. 2; Ricca, A. 3; Rojas, D. 3; Cristos, D.3; Ronco, S.6; Salerno, J.C.5
1Instituto de Patobiología. CICVyA-INTA. C.C. 25 1712 Castelar. Correo electrónico: salvat.adriana@inta.gob.ar
2EEA Colonia Benítez. CR Chaco-Formosa. Marcos Briolini s/n (3505) Colonia Benítez. Chaco.
3Instituto de Tecnología de Alimentos. CIA-INTA. C.C. 25 (1712) Castelar.
4Instituto de Microbiología y Zoología Agrícola. CICVyA-INTA. C.C. 25 1712 Castelar.
5Instituto de Genética. CICVyA-INTA. C.C. 25 (1712) Castelar.
6SENASA Centro Regional Chaco-Formosa. Av. Gobernador Gutnisky 4250. (3600) Formosa
Recibido el 09 de octubre de 2014
Aceptado el 04 de junio de 2015
Publicado online el 24 de junio de 2015
RESUMEN
El noreste argentino es, por sus características geográficas y ambientales, una región con fuerte potencial para la actividad ganadera. Los rodeos vacunos de esta zona tienen como base alimenticia pastizales y pasturas mejoradas, las que suelen suplementarse con granos, fuentes proteicas y reservas en forma de rollos o silaje. Estos alimentos son sustratos ricos para que especies de hongos produzcan micotoxinas como zearalenona (ZEA). El consumo de ZEA por los animales hace que se excreten diferentes metabolitos en orina entre los que se encuentra el zeranol. Por su parte, la presencia de zeranol en orina es utilizada como indicador del uso indebido de promotores de crecimiento que se hallan prohibidos en el país. El objetivo de este trabajo fue analizar los metabolitos relacionados con la ZEA excretados en la orina de novillos según los siguientes tratamientos: alimentación con un concentrado de ZEA, exposición a la aplicación de zeranol inyectable y acción simultánea de alimentación con un concentrado de ZEA más exposición a la aplicación de zeranol inyectable. Se presentan los perfiles de metabolitos excretados en orina y su evolución en el tiempo.
Palabras clave: Fusarium; Micotoxinas; Estrógenos; Zeranol; Zearalenona.
ABSTRACT
The northern east Argentinean region is, on the basis of its geographic and environmental features, an area with a strong growing cattle potential. Supplementation of natural feeding with protein sources and silage constitutes a usual practice. The feeding supplements supports fungal growth and subsequent micotoxins evolvement as well. Production of zearalenone (ZEA) is particularly relevant because, among its related metabolites excreted in urine there is the zeranol. The zeranol presence in urine is strongly regulated by Argentinean law because it is considered an indicator of forbidden growing promoters using. The objective of the present work was to analyze the ZEA related metabolites excreted in urine of cows exposed to ZEA and/or zeranol in three ways: ZEA concentrated feeding, zeranol injection, and a combined exposure to ZEA concentrate feeding plus zeranol injection. The urine ZEA metabolites profiles and their time evolvement are given.
Keywords: Fusarium; Mycotoxins; Oestrogens; Zeranol; Zearalenone.
INTRODUCCIÓN
El nordeste argentino (NEA) es la segunda zona ganadera de la Argentina representada con el 19% del stock de bovinos del país. Los sistemas productivos predominantes son la cría y el ciclo completo. La producción de ganado para carne se realiza mayoritariamente sobre campo natural y, en menor medida, sobre pasturas cultivadas. La alimentación es complementada con suplementos y más recientemente con forrajes conservados. En campos de esta zona, también se producen novillos pesados para exportación cuyo destino es la Unión Europea, por lo cual estos establecimientos se encuentran inscriptos en un registro. La contaminación con hongos pertenecientes al género Fusarium con capacidad para producir diferentes micotoxinas como la zearalenona (ZEA) fue hallada en diferentes recursos forrajeros de la región (Ramírez, 2013; Salvat et al., 2013a). Esta micotoxina y sus metabolitos son responsables de varios desórdenes reproductivos en mamíferos que incluyen infertilidad, interferencias en la ovulación, implantación y desarrollo fetal, hiperestrogenismo, etc. (Smith y Moss, 1985; EFSA, 2004; Zinedine et al., 2007).
El efecto tóxico y la degradación de la ZEA varían según sea la especie animal. Los bovinos degradan la ZEA mayoritariamente a β-zearalenol y en menor grado a α-zearalenol junto a otros metabolitos como zeranol, taleranol y zearalanona, en cambio en los cerdos la degradación mayor es a α-zearalenol (Malekinejad et al., 2006; Fink-Gremmels et al., 2007; Zinedine et al., 2007 ). Numerosos países utilizan libremente, dentro de una práctica productiva, formulaciones sintéticas denominadas anabólicos cuyo principio activo es el zeranol. En nuestro país, el uso de este promotor de crecimiento se encuentra prohibido al igual que en la Unión Europea. Debido a esta prohibición, como indicador de su administración ilegal en los animales, se investiga la presencia de zeranol en orina. En relación con el tema, en ocasiones, se han generado controversias de tipo legal (Erasmuson et al., 1994, Kleinova et al., 2002; Reed et al., 2004). Distintas publicaciones dan cuenta de la presencia de zeranol en orina cuando los animales son alimentados con pasturas conteniendo zearalenona (Erasmuson et al., 1994; Kennedy et al., 1995, Towers et al., 1995a; Towers et al., 1995b; Miles et al., 1996; Launay et al., 2004; Thevis et al., 2011). Por otra parte, Kleinova et al. (2002) establecieron que si se realiza un análisis del perfil metabólico en orina de animales tratados con ZEA e implantes de zeranol, se puede distinguir entre la ingesta natural de ZEA y la aplicación de zeranol en bovinos. Dichos perfiles metabólicos no han sido estudiados y descriptos aún en la Argentina. El objetivo de este trabajo fue establecer las relaciones cuali-cuantitativas en función del tiempo descriptas por la excreción de metabolitos en orina de bovinos del NEA según los siguientes tratamientos: alimentación con un concentrado de ZEA, exposición a la aplicación de zeranol inyectable y a la acción simultánea de alimentación con un concentrado de ZEA más exposición a la aplicación de zeranol inyectable.
MATERIALES Y MÉTODOS
Animales
Se utilizaron un total de 7 novillos con un peso promedio de 186 ± 16 kg alojados e identificados en corrales individuales de 10 m2 en la EEA Colonia Benítez, Chaco. Estos se dividieron en 4 grupos de 2 animales por tratamiento, excepto el tratamiento 4 (zeranol + zearalenona) en el que se utilizó solo 1 animal. Durante los 21 días de duración del estudio, todas las mañanas se alimentó a los animales con las distintas mezclas especialmente formuladas para cada uno de los tratamientos y, además, se les suministró heno, paja de arroz y agua ad líbitum.
Dieta base
La dieta base consistió en una mezcla de heno de paja de arroz y expeller de girasol cuyo contenido de ZEA fue de 33 μg/kg. Los animales correspondientes a los tratamientos con ZEA recibieron 1,6% del peso vivo de heno de paja de arroz y 0,73% del peso vivo de expeller de girasol, más un concentrado conteniendo ZEA. Por su parte, los animales del grupo control y los correspondientes al tratamiento de zeranol inyectable recibieron 1,93 y 0,76% del peso vivo de heno de paja de arroz y expeller de girasol respectivamente.
Concentrado de zearalenona
Se preparó un alimento fortificado con ZEA. La toxina se produjo sobre granos de arroz previamente humectados y esterilizados en autoclave. El arroz (150 g) se depositó en frascos de vidrio de 1,5 litros de capacidad al que se adicionaron 150 ml de agua destilada; el arroz humectado se esterilizó en autoclave (120 °C, 20 minutos). Para inocular el arroz se utilizaron 34 cepas de Fusarium semitectum productoras del ZEA correspondientes a las muestras A4, A5, B2, B6 y C3 (pasturas provenientes de Chaco) aisladas en 2011 y 2012 (Salvat et al., 2013a). Dichas cepas se sembraron en agar sintético pobre en nutrientes (SNA) preparado según Gams et al. 1987 y se incubaron durante 14 días a 25 °C. Cada frasco de arroz humectado estéril se sembró con tres trozos de 1 cm de cada cultivo en SNA. Se sembraron 3 frascos por cepa y se incubaron durante un mes a 28 °C. Finalmente, se esterilizaron en autoclave y se conservaron a -20 °C hasta su análisis. La determinación de la ZEA en el arroz contaminado se realizó mediante ensayos inmunoenzimáticos (ELISA) Ridascreen®Fast Zearalenon (RBiopharm–Alemania) y se confirmó por HPLC-FLD (Waters Alliance System). El arroz contaminado obtenido se molió y se realizó una mezcla con harina de maíz hasta una concentración 2 mg ZEA/kg.
Tratamientos
Los animales se sometieron a cuatro tratamientos:
1.Tratamiento control: alimentados con la dieta base (Animales A y B).
2.Tratamiento zearalenona: alimentados con la dieta base + concentrado con ZEA (Animales C y D).
3.Tratamiento zeranol: alimentados con la dieta base + aplicación zeranol (Animales E y F).
4.Tratamiento zeranol + zearalenona: Alimentado con la dieta base + concentrado con ZEA + aplicación zeranol (Animal G).
Dosis de exposición a zearalenona
Los animales correspondientes a los tratamientos 2 y 4 fueron alimentados con 0,5 kg del concentrado de zearalenona (1 mg de ZEA/día) desde el primer al quinto día inclusive. A partir del día 6 y hasta el día 16 recibieron 1 kg del concentrado de zearalenona (2 mg de ZEA/día). El día 17 se suspendió la oferta del concentrado de zearalenona.
Dosis de zeranol inyectable
Desde el primer día del ensayo se aplicó a los animales correspondientes a los tratamientos 3 y 4 una dosis de 40 mg de zeranol/animal (zeranol al 1% "Overgrow" inyectable subcutáneo). El zeranol fue producido y cedido por el Laboratorio Over, provincia de Santa Fe, Argentina.
Toma de muestras
El ensayo se desarrolló durante 21 días. Las muestras de orina se tomaron por la mañana los días 1, 7, 10, 15 y 21. Dichas muestras se mantuvieron a -20 °C hasta su posterior análisis en HPLC.
Determinación de metabolitos
Previo a la extracción de los metabolitos, las muestras de orina fueron hidrolizadas con 500 UE de la enzima β-Glucuronidasa de Helix pomatia tipo HP2 (Sigma Aldrich San Luis, MO, EE.UU.) a 37-40 °C durante la noche. La extracción de zearalenona, α-zearalenol, β-zearalenol, zeranol, taleranol, zearalanona se realizó con Ter-butilmetil-eter. La fase etérea se evaporó mediante flujo de nitrógeno, mientras que la fase acuosa se resuspendió en metanol:agua (1:9) grado HPLC. El extracto se purificó con un cartucho SPE NEXUS WCX (3 cc/60 mg, Agilent Technologies Palo Alto, CA, EE.UU.). El extracto purificado fue analizado por HPLC-MS/MS (LTQ-XL Linear Ion Trap Thermo, San José, CA, EE.UU.), mediante el modo de ionización ESI negativo. Los límites de detección y cuantificación del método fueron 0,003 μg/litro y 0,01μg/litro respectivamente (Cristos et. al., 2014). Los estándares y solventes utilizados se adquirieron en Sigma Aldrich (San Luis, MO, EE.UU.) y Carlo Erba Reagents (Cornaredo, MI, Italia), respectivamente.
RESULTADOS
Se determinó la presencia de ZEA y sus metabolitos relacionados en la orina de todos los animales correspondientes a los diferentes tratamientos. Con el objeto de obtener un panorama de la excreción total durante el período del ensayo, se calcularon las sumas de las concentraciones detectadas para cada analito en la orina de cada animal. Para el control y los dos primeros tratamientos se realizó el promedio de lo excretado por ambos animales utilizados. El tratamiento zeranol + zearalenona está representado por los resultados correspondientes a un solo animal. La tabla 1 resume los resultados mencionados y los presenta según el tratamiento realizado. Con la finalidad de explorar la cinética de eliminación de ZEA en orina, se realizaron para los tratamientos 2, 3 y 4, curvas que representan los perfiles temporales de la excreción total de ZEA y sus metabolitos relacionados (figuras 1, 2 y 4). A continuación se discuten los resultados obtenidos para cada tratamiento en particular.
Tabla 1. Promedio de la suma total excretada de ZEA y metabolitos relacionados (μg/l) según los tratamientos: control (n=2), zearalenona (ZEA) (n=2), zeranol (n=2). En el tratamiento zeranol + ZEA (n=1) se representa la suma total excretada. Sumatoria de cinco muestras por animal (días 1, 7, 10, 15 y 20).


Figura 1. Perfil temporal de excreción total de ZEA y sus metabolitos relacionados para el grupo de animales alimentado con el concentrado de zearalenona.

Figura 2. Perfil temporal de excreción total de ZEA y sus metabolitos relacionados para el grupo de animales inyectado con 40 mg de zeranol.
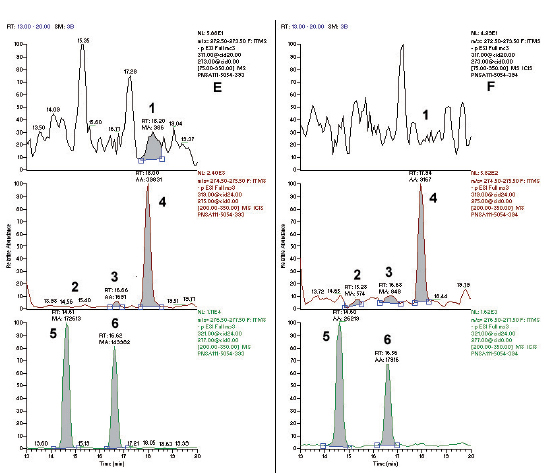
Figura 4. Cromatogramas de la orina relacionada con los animales E y F pertenecientes al tratamiento de zeranol inyectable; análisis correspondiente al día 10 del ensayo. La transición 317>273 corresponde al metabolito zearalenona (1). La transición 319>275 corresponde a los metabolitos: zearalanona (4), α-zearalenol (3) y β-zearalenol (2). La transición 321>277 corresponde a los metabolitos zeranol (6) y taleranol (5). En E2 y F1 no se observan picos cuantificables para los tiempos de retención vinculados con β-zearalenol y zearalenona respectivamente.
AA: integrado por el equipo, MA: integrado por el operador, RT: tiempo de retención.
Tratamiento control
Se observó la presencia de los metabolitos relacionados con ZEA, no obstante, se hallaron en baja concentración (tabla 1). Este hecho reflejaría la dificultad de obtener alimentos totalmente libres de ZEA para alimentar el ganado.
La ZEA, que fue suministrada a dosis crecientes en este tratamiento, se excretó mayoritariamente como β-zearalenol (36,30 μg/l), zearalenona (15,28 μg/l) y α-zearalenol (5,39 μg/l); mientras que el zeranol y taleranol se detectaron en una concentración de 2,41 y 0,19 μg/l respectivamente (tabla 1). En cuanto a la evolución de la excreción de ZEA y sus metabolitos, se pudo observar un incremento de la concentración al inicio de la administración de la ZEA principalmente durante los días 7 y 15. Los valores de las concentraciones disminuyeron notablemente sobre todo a partir del día 16 cuando se retiró el concentrado de zearalenona (figura 1).
Tratamiento zeranol inyectable
En este grupo se produjo un aumento en la concentración de zeranol y taleranol (4,75 y 0,44 μg/l) en comparación con el grupo de animales que solamente fueron alimentados con ZEA. En cambio, la excreción de zearalenona (0,25 μg/l) fue menor en relación con el grupo alimentado con ZEA (15,28 μg/l). Con respecto a los restantes metabolitos, los valores hallados de α y β zearalenol (0,04 y 0,94 μg/l respectivamente) resultaron más bajos inclusive que los del grupo control (tabla 1). En la figura 2 se puede observar, como fue el incremento en los niveles de concentración de zeranol y taleranol luego de la aplicación del anabólico al inicio del ensayo. Se observa un aumento progresivo del zeranol y taleranol desde el día 1 y hasta el día 7 con un pico máximo de excreción durante el día 10, luego de lo cual, se produce una disminución sostenida de ambos metabolitos hasta el final del ensayo. La figura 4 presenta los cromatogramas de la orina obtenida de los animales expuestos a zeranol inyectable el día 10 del ensayo.
Tratamiento zeranol inyectable + zearalenona
En cuanto al perfil de los metabolitos que se detectaron en el animal que fue expuesto al zeranol inyectable y a la alimentación con dosis crecientes de ZEA, se pudo observar un aumento en la concentración del zeranol excretado (6,63 μg/l) respecto a lo hallado en el grupo expuesto a ZEA (2,41 μg/l) y al grupo inyectado con zeranol (4,75 μg/l). En cambio, la concentración del taleranol (0,25 μg/l) fue un 25% más bajo que el grupo tratado con zeranol inyectable, pero un 60% mayor a lo que se detectó en el grupo expuesto a ZEA (tabla 1). Se pudo observar el incremento de las concentraciones de ZEA, β-zearalenol y zeranol al inicio del ensayo y el séptimo día, para decaer en forma abrupta el décimo día. Luego el día 15, se produjo un incremento en las concentraciones de manera similar a lo ocurrido en el tratamiento de ZEA, pero con un leve aumento a favor del metabolitozeranol. Del mismo modo que en los otros tratamientos, el resto de los metabolitos disminuyeron notablemente luego del día 15 (figura 3) a excepción del β-zearalenol (figura 2) que invierte esta tendencia y aumenta.
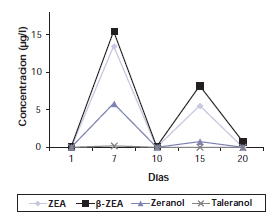
Figura 3. Perfil temporal de excreción total de ZEA y sus metabolitos relacionados para el grupo de animales inyectado con 40 mg de zeranol + concentrado de zearalenona.
DISCUSIÓN Y CONCLUSIONES
En el presente estudio se obtuvieron perfiles de los metabolitos excretados en la orina de bovinos y su evolución en el tiempo, resultando particularmente interesante el hecho de que el zeranol no se excreta continuamente en concentraciones elevadas, sino que se excreta mayoritariamente solo durante determinadas ventanas temporales. El metabolito β-zearalenol fue excretado en mayor cantidad por los animales expuestos al consumo de ZEA, mientras que en los inyectados con zeranol la excresión mayoritaria consistió en zeranol y taleranol. Estos resultados son coincidentes con lo referido por otros autores que realizaron ensayos similares (Metzer et al., 2010; Kleinova et al., 2002; Malekinejad et al., 2006).
Resulta oportuno mencionar que los niveles de ZEA que han sido detectados en pasturas y alimentos utilizados en el engorde de novillos en trabajos anteriores (Salvat et al., 2013a) fueron variables (ND-577,62 μg/kg) y además, dependientes de las condiciones climáticas (Moschini, comunicación personal). Por otra parte, se observaron aumentos significativos (hasta 6278,47 μg/kg) en las concentraciones de ZEA de las pasturas y alimentos durante los meses de invierno (Salvat, 2013b). De acuerdo con esta información, los animales en condiciones productivas podrían estar expuestos al consumo de dosis de ZEA más elevadas que las utilizadas en el presente trabajo. Consecuentemente, la detección de ciertos niveles de zeranol en la orina de los rodeos encontraría explicación a través de la contaminación natural de los piensos con ZEA. Las curvas de excreción evidenciaron incrementos y descensos acentuados. Esta particularidad podría atribuirse a factores como el diferente grado de hidratación de los animales al momento de tomar la muestra o a su distinta capacidad para eliminar los xenobióticos en orina. Cabe destacar la importancia de realizar nuevos ensayos que incluyan un mayor número de animales por tratamiento, como así también la determinación de la concentración de creatinina concomitante para estandarizar los resultados de concentración urinaria de ZEA y los restantes metabolitos.
El presente estudio puso énfasis en asemejar las condiciones que se pueden presentar en el ámbito productivo y pone de relieve la conveniencia de profundizar el tema con nuevos estudios que complementen la información hasta aquí alcanzada.
AGRADECIMIENTOS
Agradecemos el apoyo del Ing. Agr. Eduardo Delssin, director del Centro Regional Chaco-Formosa del INTA; del Ing. Agr. Enrique Bedascarrasbure, director del Centro de Investigación de Agroindustria (CIA); del Dr. Luis Samartino, del Instituto de Patobiología (CICVyA) y del Dr. Roberto Lecuona, del Instituto de Microbiología y Zoología Agrícola (CICVyA). Agradecemos, además, la colaboración del Dr. Ricardo Moschini, del Instituto de Clima y Agua (CIRN). Expresamos nuestro reconocimiento al Dr. Héctor Godoy, quien realizó una lectura crítica del manuscrito. Por otra parte, quedamos reconocidos con el señor Juan Carlos Torres y las técnicas Victoria Silva y Rosa Salvatierra por su asistencia técnica. Este trabajo fue solventado por el Proyecto INTA (PNSA 1115054): "Zearalenona en NEA argentino". Proyecto CHAFOR-124130. "Contribución al desarrollo territorial del este de la provincia del Chaco". Agradecemos también al Laboratorio OVER que desinteresadamente aportó el zeranol inyectable ("Overgrow") utilizado en el presente trabajo.
BIBLIOGRAFÍA
1. CRISTOS, D.S.; ROJAS, D.E.; SALVAT, A.E.; BALBUENA, O.; SALERNO J.C. 2014. Determinación analítica del complejo zeranol- zearalenona en orina de bovinos. II Congreso Argentino de Espectrometría de Masa. (Resumen en prensa). Córdoba del 9 al 11 de noviembre 2014. [ Links ]
2. ERASMUSON, A.F.; SCAHILL, B.G.; EST, D.M. 1994. Natural zeranol (R-zearalanol) in the urine of pasture-fed animals. J. Agric. Food Chem. 42, 2721-2725. [ Links ]
3. EFSA. 2004. Opinion of the Scientific Panel on Contaminants in the Food Chain on a request from the Commission related to Zearalenone as undesirable substance in animal feed. The EFSA Journal 89, 1-35. [ Links ]
4. FINK-GREMMELS, J.; MALEKINEJAD, H. 2007. Clinical effects and biochemical mechanisms associated with exposure to the mycoestrogen zearalenone. Animal Feed Science and Technology 137, 326–341.
5. GAMS, W.; VAN DER AA, H.A.; VAN DER PLAATS-NITERINK, A.J.; SAMSON, R.A.; STALPERS, J.A. 1987. CBS Course of Mycology. Centraalbureau voor Schimmelcultures. Baarn, Delft: 6. [ Links ]
6. KENNEDY, D.G.; HEWITT, S.A.; MCEVOY, J.D.G.; CURRIE, J.W.; BLANCHFLOWER, W.J.; CANNAVAN, A.; MCCAUGHEY, W.J.; ELLIOTT, C.T. 1995. Possible naturally occurring zeranol in bovine bile in Northern Ireland. J. Vet. Med. 42, 509-512. [ Links ]
7. KLEINOVA, M.; ZOLLNER, P.; KAHLBACHER, H.; HOCHSTEINER, W.; LINDNER, W. 2002. Metabolic Profiles of the Mycotoxin Zearalenone and of the Growth Promoter Zeranol in Urine, Liver, and Muscle of Heifers. J.Agric.Food Chem. 50, 4769-4776. [ Links ]
8. LAUNAY, F.M.; RIBEIRO, L.; ALVES, P.; VOZIKIS, V.; TSITSAMIS, S.; ALFREDSSON, G.; STERK, S.; BLOKLAND, M.; IITIA, A.; LÖVGREN T.; TUOMOLA, M.; GORDON, A.; KENNEDY, D.G. 2004. Prevalence of zeranol, taleranol and Fusarium spp. toxins in urine: implications for the control of zeranol abuse in the European Union. Food Additives and Contaminants 21, (9), 833-839. [ Links ]
9. MALEKINEJAD, H.; MAAS-BAKKER, R.; FINK-GREMMELS, J. 2006. Species differences in the hepatic biotransformation of zearalenone. The Veterinary Journal 172, 92-102. [ Links ]
10. METZLER, M.; PFEIFFER, E.; HILDEBRAND, A.A. 2010. Zearalenone and its metabolites as endocrine disrupting chemicals. World Mycotoxin Journal 3 (4), 385-401. [ Links ]
11. MILES, C.O.; ERASMUSON, A.F.; WILKINS, A. L.; TOWERS, N.R.; SMITH, B.L; GARTHWAITE, I.; SCAHILL, B.G.; HANSEN, R.P. 1996. Ovine Metabolism of Zearalenone to r-Zearalanol (Zeranol). J. Agric. Food Chem. 44, 3244-3250. [ Links ]
12. RAMIREZ, M.L. 2013. Presencia de micotoxinas en pasturas destinadas a la alimentación bovina. VII Congreso Latinoamericano de Micotoxicología. Río Cuarto, provincia de Córdoba. [ Links ]
13. REED, K.F.M.; WALSH, J.R.; MCFARLANE, N.M.; SPRAGUE, M. 2004. Zearalenone and its presence in pasture. Animal Production in Australia 25, 140-143. [ Links ]
14. SALVAT, A.E; BALBUENA, O.; RICCA, A.; COMERIO, R.M.; ROSELLO BRAJOVICH, J.E.; ROJAS, D.; BERRETTA M.F; DELSSIN, E.; BEDASCARRASBURE, E.; SALERNO, J.C. 2013a. Presencia de zearalenona en pasturas del este de Chaco. RIA 39 (1), 31-36. [ Links ]
15. SALVAT, A.E; BALBUENA, O.; RICCA, A.; COMERIO, R.M.; ROSELLO BRAJOVICH, J.E.; ROJAS, D.; BERRETTA, M.F; DELSSIN, E.; BEDASCARRASBURE, E.; SALERNO, J.C. 2013b. Presence of Zearalenone in Cattle Feeds During the Winter in the Province of Chaco (Argentina). 4th Latin American Pesticide Residue Workshop. LAPRW 2013. Bogotá, Colombia. Mayo 26-29. [ Links ]
16. SMITH, J.E.; MOSS, M.O. 1985. Mycotoxins. Formation, Analysis and Significance. John Wiley & Sons. Great Britain, p. 148. [ Links ]
17. THEVIS, M.; FUBHOLLER, G; SCHANZER, W. 2011. Zeranol: Doping offence or mycotoxin? A case-related study. Short communication. Drug Testing and Analysis 3, 777–783.
18. TOWERS, N.R.; SPROSEN, J.M.; WEBBER, W. 1995a. Zearalenone metabolites in cycling and non-cycling cows, .p. 46-47. En: "Toxinology and Food Safety". Toxinology and Food Safety Research Group, Ruakura Research Centre, Hamilton, Nueva Zelanda. [ Links ]
19. TOWERS, N.R.; WESSELINK, C.; FOWKE, E.A.; SPROSE, J.M. 1995b. Plasma vs. urinary "zearalenone" concentrations as indicators of zearalenone intake, p. 41 En: "Toxinology and Food Safety". Toxinology and Food Safety Research Group, Ruakura Research Centre, Hamilton, Nueva Zelanda. [ Links ]
20. ZINEDINE, A.; SORIANO, J.M.; MOLTÓ, J.C.; MAÑES, J. 2007. Review on the toxicity, occurrence, metabolism, detoxification, regulations and intake of zearalenone: an oestrogenic mycotoxin. Food Chem Toxicol. 45(1):1-18. [ Links ]














