Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
RIA. Revista de investigaciones agropecuarias
versión On-line ISSN 1669-2314
RIA. Rev. investig. agropecu. vol.41 no.2 Ciudad Autónoma de Buenos Aires ago. 2015
ARTÍCULOS
Resistencia de los botones florales del algodón Gossypium hirsutum L. a Spodoptera frugiperda Smith
Tcach, M.A.1; Fogar, M.N.2; Rios, R.D.3; Acuña, C.A.4
1Área de Mejoramiento y Protección Vegetal INTA EEA Sáenz Peña 3700, Chaco, Argentina .Correo electrónico: tcach.mauricio@inta.gob.ar
2Área de Mejoramiento y Protección Vegetal INTA EEA Sáenz Peña 3700, Chaco, Argentina .Correo electrónico: fogar.mariela@inta.gob.ar
3Instituto de Genética Ewald Favret INTA-Castelar, Buenos Aires
4Instituto de Botánica del Nordeste, Consejo Nacional de Investigaciones Científicas y Técnicas, Facultad de Ciencias Agrarias, Universidad Nacional del Nordeste. Correo electrónico: cacuna@agr.unne.edu.ar
Recibido el 21 de noviembre de 2014
Aceptado el 07 de mayo de 2015
Publicado online el 08 de julio
RESUMEN
En el género Gossypium existen alelos mutantes que confieren tolerancia a determinados insectos. Entre los de mayor eficacia se encuentra el rasgo denominado high glanding (presencia de glándulas de gosipol en el tercio superior del cáliz). Es necesario conocer la interacción de esta característica con los insectos plaga. El objetivo del trabajo fue estudiar la relación entre la edad de los botones florales y la resistencia a lepidópteros inducida por las glándulas de gosipol. Se diseñaron bioensayos con larvas de Spodoptera frugiperda Smith y caracterizaciones de la densidad de glándulas en botones florales de diferentes edades. Por un lado, en genotipos high y normal glanding el número de glándulas por unidad de superficie disminuyó en las estructuras reproductivas a medida que estas incrementaron su tamaño. Por otro lado, el peso y el tamaño de larvas de S. frugiperda fueron menores cuando se alimentaron con botones florales high glanding especialmente de menor tamaño. Estas evidencias demuestran que el carácter high glanding se comporta como un factor antibiótico en larvas de S. frugiperda.
Palabras clave: Algodón; Mejoramiento de plantas; Resistencia a insectos; Alelos mutantes; Alto gosipol.
ABSTRACT
There are mutant alleles in the genus Gossypium that increase the tolerance to insect pests. Among the features that are effective against different insects high glanding [i.e., presence of gossypol glands in the upper edge of the sepals of the flower bud] increases the tolerance to Lepidoptera insects. The objective of this research was to evaluate the relationship between the age of the flower buds and the resistance to Spodoptera frugiperda. Flower buds of different ages were characterized for gland densities and bioassays with larvae of S. frugiperda were carried using these buds. The density of gossypol glands in reproductive structures decreased as the size of flower buds increased while growing, in both high and normal glanding genotypes. The weight of the larvae of S. frugiperda was significantly lower when fed with smaller high glanding buds. The larvae fed with high glanding reproductive structures had lower weight when compared with those fed with material from the normal glanding genotypes. These evidences show that high glanding is an antibiotic factor in larvae of S. frugiperda, as in other lepidopteran species.
Keyword: Mutant alleles; Cotton; High glanding; Plant breeding; Insect resistant; Gossypol.
INTRODUCCIÓN
El cultivo de algodón, Gossypium hirsutum L., es atacado por diversos artrópodos entre los que se destacan por su importancia en el mundo los siguientes grupos: heliothines, miridos, aphidos, trips y aracnidos (Jenkins, 1994). En Argentina, los insectos que se alimentan del cultivo generan importantes pérdidas; son 15 las especies que lo afectan en diferentes fases (Polak et al., 2001). Uno de los avances de mayor importancia en el control de plagas fue la obtención de plantas de algodón genéticamente modificadas resistentes al ataque de determinados lepidópteros. Esta tecnología además de disminuir el daño ocasionado por dichas plagas redujo el número de tratamientos con insecticidas. Por otro lado, este nuevo escenario generó el avance de otras plagas no controladas por las variedades resistentes a lepidópteros (Meredith, 1998). Existen características morfológicas presentes en las plantas que generan resistencia a plagas. Scheffler et al. (2003) sugirieron la incorporación de estas características a las variedades comerciales de algodón. Una de las principales variantes fenotípicas es la ocurrencia en estructuras vegetativas y reproductivas de concentraciones variables de gosipol. Este compuesto es un pigmento amarillo de naturaleza polifenólica producido en estructuras subepidérmicas denominadas glándulas. Estas glándulas se encuentran en gran parte de los órganos de la planta de algodón y determinan un cierto grado de resistencia a plagas. Shaver et al. (1980) encontraron que el peso larval de Heliothis virescens F. está relacionado con el contenido de gosipol en las flores: el crecimiento de las larvas disminuye cuando aumenta el contenido de gosipol en los tejidos (R2 = 0.90). En relación con las hojas, Mcauslane et al. (1997) observaron que larvas de Spodoptera exigua H. en sus primeros estadios consumieron mayor cantidad de hojas desprovistas de glándulas. Resultados similares fueron observados en Heliothis armígera H. por Guangchao et al. (2010), destacando que las larvas alimentadas con tejidos con mayor gosipol presentaban menor peso. Con relación a la posturas de huevos de Earias vittella F., Keshav et al. (2013) observaron que los adultos disminuían la ovoposición en plantas con mayor contenido de gosipol. Existe una variante fenotípica estudiada por Calhoun (1997) que se caracteriza por presentar glándulas en el margen del cáliz de las flores. Este fenotipo fue denominado high glanding (hg), siendo una fuente de resistencia a insectos por su mayor contenido de gosipol en órganos reproductivos.
Si bien se ha comprobado que a mayor número de glándulas en las estructuras reproductivas aumenta la resistencia a lepidópteros, se desconoce cómo varía esta característica durante el crecimiento de las estructuras reproductivas y su relación con la resistencia a lepidópteros. En este contexto se plantean como objetivos de este trabajo: determinar la relación entre la resistencia inducida por glándulas de gosipol con el tamaño de las estructuras reproductivas en plantas de algodón, y evaluar el grado de antibiosis en botones florales de un genotipo high glanding frente a larvas de Spodoptera frugiperda S.
MATERIALES Y MÉTODOS
Material vegetal
El material vegetal corresponde a líneas puras de G. hirsutum pertenecientes al programa de mejoramiento genético del INTA. Una de estas líneas es SP 26 hg (que en el texto también se refiere como HG) y que se caracteriza por su fenotipo high-glanding. Las otras dos líneas están emparentadas con SP 26 hg, compartiendo un progenitor, y se identifican como NG1 y NG2. Estas líneas poseen fenotipos normal-glanding, no presentando glándulas de gosipol en el tercio superior del cáliz de las flores.
Análisis de la expresión de la densidad de glándulas en función del crecimiento de botones florales
Para determinar la relación entre la resistencia inducida por glándulas de gosipol y el tamaño de las estructuras reproductivas se diseñaron dos experimentos. El primero se implementó para determinar la relación entre la densidad de glándulas de gosipol y la edad de las estructuras reproductivas. Para ello fueron sembrados los genotipos: HG, NG1 y NG2, durante el mes de noviembre de 2009, en macetas de 5 litros con sustrato a base de 1/3 de arena y 2/3 suelo recolectado de los primeros centímetros de un tapiz vegetal de praderas correspondiente a un suelo clasificado como Argiudol údico. Cada maceta contenía 2 plantas distanciadas a 15 cm. Se utilizaron 10 macetas por genotipo distribuidas según un diseño completamente al azar con 5 repeticiones integradas por dos macetas cada una.
Para determinar la relación de crecimiento–resistencia fueron marcados 30 botones florales en 20 plantas de cada genotipo, a partir de 50 grados días, considerando como inicio la fase de botón "cabeza de alfiler". Posteriormente, se realizó el recuento de glándulas de gosipol en el tercio medio de los botones florales, empleando una lupa portátil 20x con campo visual definido de 25 mm2. Este registro consistió en 3 mediciones a intervalos de 6 días. El experimento fue realizado en dos períodos: septiembre 2009 y junio-julio 2010. Además del parámetro mencionado, también fueron medidos los diámetros de cada botón en los mismos momentos del recuento de glándulas. También en el genotipo HG se registró el número de glándulas en el tercio superior del cáliz, solo durante la tercera medición. Los datos fueron analizados estadísticamente empleando el software InfoStat (Di Rienzo et al., 2013). Se ajustó para cada genotipo un modelo de regresión lineal para el diámetro y el número de glándulas del tercio medio, para finalmente calcular las diferencias entre pendientes mediante una prueba de paralelismo.
Bioensayos con Spodoptera frugiperda S.
El segundo experimento fue diseñado para determinar la relación entre el crecimiento de las estructuras reproductivas y la resistencia provocada por las glándulas. Para ello se realizó un bioensayo con Spodoptera frugiperda. Se extrajeron botones florales de 2 tamaños (6,5 y 9 mm) de los tres genotipos: HG, NG 1 y NG 2. Estas plantas fueron sembradas en invernáculo en el mismo período que en el experimento anterior (septiembre 2009 y junio 2010). El diseño empleado fue completamente al azar con distribución factorial (tomando como factores tamaño de botón floral y genotipo) con 5 repeticiones. Las brácteas fueron eliminadas y se realizó la desinfección de los botones florales con una solución de hipoclorito de sodio al 1%. Los botones florales preparados fueron dispuestos en cubetas, uno por orificio, con un soporte de agar. Luego se liberó una larva neonata, proveniente del laboratorio de entomología de la Estación Experimental INTA Sáenz Peña por cada botón floral. Cada repetición estuvo integrada por 6 botones con 6 larvas. A los 7 días se registró el peso de las larvas y posteriormente se procesaron los datos con el software InfoStat (Di Rienzo et al., 2013). Se realizó el análisis de la variancia y la comparación de medias con el test de Tukey con nivel de significación de 5%.
RESULTADOS Y DISCUSIÓN
Análisis de la expresión de la densidad de glándulas en función del crecimiento de botones florales
Un total de 86 registros del número de glándulas y diámetro de los botones fueron realizados durante 16 días en septiembre 2009, y otros 68 registros en junio-julio 2010 para los tres genotipos evaluados. En la primera experiencia (septiembre 2009) la densidad de glándulas disminuyó con el incremento del diámetro de los botones florales; registrándose un máximo de 3,3 glándulas mm-2para HG en botones de 6,3 mm a un mínimo de 1,4 glándulas mm-2 en botones de 10,3 mm para el genotipo NG2 (tabla 1). Además, es importante destacar que la relación observada entre el tamaño de los botones florales y la densidad de glándulas de gosipol fue significativa y lineal para los tres genotipos: SP 26 hg (HG), NG1 y NG2 (tabla 2). En la segunda parte del experimento, realizada en junio-julio 2010, los resultados fueron similares y se presentan en la tabla 3. Para esta experiencia nuevamente se registró el máximo valor para el número de glándulas en la línea SP 26 hg con 2,1 glándulas mm-2 en botones cuyo diámetro promedio fue de 5,3 mm; el valor mínimo fue de 1,2 glándulas mm-2 en NG2 con botones de 7,5 mm de diámetro (tabla 3). Para este experimento, los modelos de los tres genotipos resultaron también lineales y significativos (tabla 4). Ambos experimentos demuestran claramente que existe una relación entre el número de glándulas y el diámetro de botones florales. En las tablas 2 y 4 se presentan los valores de R2, el mínimo es de 0,5 en el segundo experimento para SP 26 hg (tabla 4) y el máximo, de 0,8 en SP 26 hg en el primer experimento (tabla 2). Shaver et al. (1980) concluyeron que la densidad de glándulas presenta una asociación positiva con la resistencia a Heliothis virescens. Por un lado, Hedin et al. (1992) observaron larvas de H. virescens de menor peso cuando fueron alimentadas con estructuras con mayor número de glándulas. Por otro lado, Wilson y Shaver (1973) destacaron que los tejidos con mayor densidad de glándulas contienen más gosipol por unidad de masa, este compuesto es uno de los factores de mayor importancia en la antibiosis observada en algodón.
Tabla 1. Distribución de glándulas de gosipol en botones florales en función de diámetro, estadio y genotipo (registro realizado en septiembre del 2009).

Tabla 2. Parámetros estadísticos de comparación entre las pendientes de los genotipos HG, NG1y NG2, correspondientes a las regresiones entre el diámetro de los botones florales y el número de glándulas en 1 mm2. Aquellos valores de probabilidad menores a 0,05 indican diferencias significativas.

Tabla 3. Distribución de glándulas de gosipol en botones florales en función de diámetro, estadio y genotipo, registro realizado en junio julio del 2010.

Tabla 4. Parámetros estadísticos de comparación entre las pendientes de los distintos genotipos HG, NG1y NG2, correspondientes a las regresiones entre el diámetro de los botones florales y el número de glándulas en 1 mm2, aquellos valores de probabilidad menores a 0,05 indican diferencias significativas.

Teniendo en cuenta estos conceptos, se podría deducir que los botones florales de menor tamaño son más resistentes, ya que en estos fue observado, para todos los genotipos, el mayor número de glándulas en la unidad de área considerada de 1 mm2. Se deduce que existe relación significativa entre el tamaño de los botones florales, que a su vez está relacionada con la edad de dichas estructuras, y la resistencia frente a los lepidópteros plaga. La relación diámetro:número de glándulas observada en los tres genotipos considerados demuestra que en SP 26 hg la disminución de glándulas por unidad de superficie en función de la edad fue significativamente mayor en comparación con NG1 y NG2, aunque no hubo diferencias entre las pendientes de los genotipos normal-glanding (tabla 2). Si bien la pendiente fue mayor en SP 26 hg, el número final de glándulas para botones más grandes fue mayor en relación con los controles normal glanding (tabla 1).
Bioensayos con Spodoptera frugiperda S.
En función de los resultados obtenidos a partir de los bioensayos realizados con larvas de S. frugiperda se pueden destacar algunos aspectos sobresalientes. Si bien las repeticiones inicialmente estuvieron integradas por 6 larvas neonatas, solo un 70,3% de estas fueron recuperadas a los 7 días en el ensayo realizado en septiembre de 2009 y un 81% en el de junio-julio de 2010, lo que sugiere una de mortalidad similar en ambas experiencias. Cabe destacar que en todas las repeticiones fueron recuperadas, como mínimo, 3 larvas. En la figura 5 se observan larvas criadas con botones florales obtenidos de los tres genotipos (HG, NG1 y NG2) en dos tamaños de estructuras. Esta experiencia fue parte del ajuste de los bioensayos. En dicha experiencia se destacan las diferencias de crecimiento de larvas. En función de los resultados de los análisis de variancia, ambos ensayos presentaron interacciones significativas, lo cual generó la necesidad de analizar cada factor separadamente para cada nivel del otro.
En la experiencia realizada en septiembre de 2009 se observó, en los botones florales denominados E1 (edad 1), que el peso de las larvas fue significativamente menor en los genotipos HG y NG1 con relación a NG2 (figura 1.A), con pesos de 9,3 mg, 11,2 mg y 15,8 mg respectivamente. En la edad E2, HG presentó diferencias significativas con NG1 y NG2 (figura 1.B), registrándose pesos de 14,2 mg, 20,9 mg y 30,2 mg respectivamente. Se puede deducir que las larvas consumieron menor cantidad de tejidos en SP 26 hg en la segunda edad respecto de ambos controles. Considerando estos resultados, SP 26 hg fue el genotipo que presentó mayor antibiosis en ambas edades. El número de glándulas observado en los experimentos anteriores permitió deducir que SP 26 hg presentaría una menor pérdida de resistencia por efecto del incremento de tamaño de las estructuras, ya que si bien tiene una pendiente de dilución significativamente mayor que NG1 y NG2, el número de glándulas en todos los estadios fue mayor (tabla 1). Por lo tanto, el factor densidad de glándulas que Hedin et al. (1992) relacionaron con la resistencia a H. virescens presenta un comportamiento similar en S. frugiperda. En los gráficos de la figura 2 se puede observar la relación existente entre la edad de los botones florales y el grado de antibiosis para los tres genotipos, este es significativamente mayor en botones E1 para los tres genotipos ensayados. Estos resultados están relacionados con la pérdida de antibiosis ocasionada por la disminución del número de glándulas en función del crecimiento de estructuras reproductivas. Los resultados de la experiencia realizada en junio de 2010 se presentan en las figuras 3 y 4. Estos corresponden a la segunda experiencia, la cual registró un comportamiento similar al descripto en el párrafo anterior. Para este caso, para la primera edad de botones florales, el peso de larvas no difiere significativamente entre los genotipos (figura 3). Por otro lado, al incrementar el tamaño de botones florales en la segundad edad, el grado de antibiosis solo difiere significativamente entre NG1 y HG, NG1 y NG2 (figura 3). Posiblemente las diferencias entre experimentos se deban a otros factores genéticos que inciden en la resistencia de los tejidos a los lepidópteros. Al respecto, Scheffler et al. (2012) encontraron variaciones en la resistencia a H. virescens, en genotipos que presentaban similares concentraciones de gosipol en hoja y semilla.
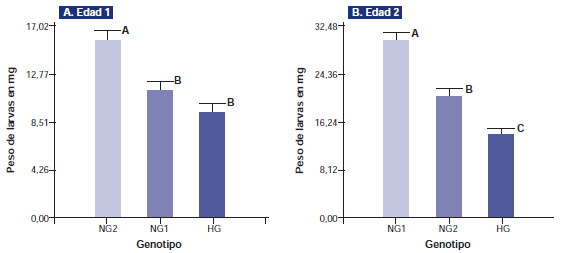
Figura 1. A. Prueba de antibiosis correspondiente al experimento realizado en septiembre de 2009 con tres genotipos uno high glanding (SP 26 hg) y dos normal glanding (NG1 y NG2), con botones florales de 6,5 mm de diámetro (E1: edad1). El peso de larvas en mg corresponde al registro efectuado 7 días posteriores al contacto insecto-estructura floral. B. Prueba de antibiosis similar a las descriptas en A, pero con botones de 9 mm de diámetro (E2: edad 2). Letras distintas representan diferencias significativas p<0,05.

Figura 2. A. Antibiosis expresada en peso de larvas en mg para dos edades de botones florales E1=6,5 mm y E2=9,5 mm en HG. B. Antibiosis expresada en peso de larvas en mg para dos edades de botones florales E1=6,5 mm y E2=9,5 mm en NG1. C. Antibiosis expresada en peso de larvas en mg para dos edades de botones florales E1=6,5 mm y E2=9,5 mm en NG2. Letras distintas representan diferencias significativas p<0,05. Datos correspondientes al experimento realizado en septiembre 2009.

Figura 3. A. Prueba de antibiosis correspondiente al experimento realizado en junio de 2010 con tres genotipos uno high glanding (SP 26 hg) y dos normal glanding (NG1 y NG2), con botones florales de 6,5 mm de diámetro (E1: edad1). El peso de larvas en mg corresponde al registro efectuado 7 días posteriores al contacto insecto-estructura floral. B. Prueba de antibiosis similar a las descriptas en A, pero con botones de 9 mm de diámetro (E2: edad 2). Letras distintas representan diferencias significativas p<0,05.
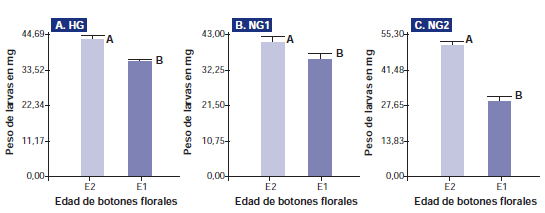
Figura 4. A. Antibiosis expresada en peso de larvas en mg, para dos edades de botones florales E1=6,5 mm y E2=9,5 mm en HG. B. Antibiosis expresada en peso de larvas en mg para dos edades de botones florales E1=6,5 mm y E2=9,5 mm en NG1. C. Antibiosis expresada en peso de larvas en mg para dos edades de botones florales E1= 6,5mm y E2=9,5 mm en NG2. Letras distintas representan diferencias significativas p<0,05. Datos correspondientes al experimento realizado en junio-julio 2010.

Figura 5. Experiencia realizada con estructuras recolectadas a campo para ajustar un ensayo preliminar durante enero de 2010. Clasificación: T1-T6 según los siguientes genotipos y edades de botón floral: T1 HG-E1 (high glanding edad 1), T2 HG-E2 (high glanding edad 2), T3 NG1-E1 (normal glanding 1 edad 1), T4 NG1- E2 (normal glanding 1 edad 2), T5 NG2-E1 (normal glanding 2 edad 1) y T6 NG2-E2 (normal glanding 2 edad 2).
Con relación a la pérdida de antibiosis observada en función de la edad, en el experimento realizado durante el año 2010, se puede observar un comportamiento similar al descripto en 2009 (figura 4). Los resultados observados en S. frugiperda en este trabajo presentan una estrecha similitud a los encontrados por Mcauslane et al. (1997) en larvas de S. exigua, Parrott et al. (1989), Hedin et al. (1992) en larvas de H. virescens y Guangchao et al. (2010) en H. armigera. Los resultados demuestran una relación estrecha entre la resistencia varietal generada por las glándulas de gosipol, el genotipo y la edad de las estructuras consideradas, de donde puede deducirse que a medida que los botones florales crecen se vuelven menos tolerantes al daño causado por S. frugiperda. Este comportamiento puede resultar similar en otras especies de lepidópteros que atacan las estructuras reproductivas, como las del complejo Heliothis. Además, el genotipo HG high glanding presentó resistencia varietal frente a S. frugiperda similar a la observada por Parrott et al. (1989) y Hedin et al. (1992) en H. virescens. Por un lado, los resultados alcanzados en estos experimentos permiten una mejor comprensión de las interacciones de los lepidópteros con el cultivo, ya que durante la floración una gran proporción de estructuras es más vulnerable que en la prefloración, caracterizada principalmente por presentar estructuras jóvenes. Por otro lado, la característica high glanding podría permitir ampliar, en los genotipos que la porten, el grado de tolerancia a los lepidópteros del complejo Heliothis y a S. frugiperda.
CONCLUSIONES
Los resultados presentados demuestran que existe una relación entre el tamaño de los botones florales y la resistencia de los tejidos a larvas de S. frugiperda. Este proceso está asociado a una disminución en la densidad de glándulas de gosipol en los tejidos por efecto del crecimiento. Además, las evidencias observadas demuestran que el carácter high glanding se comporta como un factor antibiótico en larvas de S. frugiperda.
BIBLIOGRAFÍA
1. CALHOUN, D.S. 1997. Inheritance of high glanding, an insect resistance trait in cotton. Crop Sci. 37:1181-1186. [ Links ]
2. DI RIENZO, J. A.; CASANOVES, F.; BALZARINI, M. G.; GONZALEZ, L.; TABLADA, M. y ROBLEDO, C. W. 2013. InfoStat versión 2013. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. URL http://www.infostat.com.ar. [ Links ]
3. HEDIN, P.A.; PARROTT, W.L.; y JENKINS, J.N. 1992. Relationship of glands cotton square terpenoid aldehydes and other allelochemicals to larval growth of Heliothis virescens Lepidoptera: Noctuidae. J. Econ. Entomol. 85:359–364.
4. GUANGCHAO, K.; MUHAMMAD, K. D.; y DAUDA, S. Z. 2010. Effects of pigment glands and gossypol on growth, development and insecticide-resistance of cotton bollworm (Heliothis armigera (Hübner). Crop Protections. 29:813.919. [ Links ]
5. JENKINS, J.N. 1994. Host plant resistance to insect in cotton. In Proceeding of 1st World Cotton Conference Research, Brisbane Australia. 1:359-372. [ Links ]
6. KESHAV, A.; SHERA, P.S. y SINGH, J. 2013. Morphological basis of resistance to spotted bollworm, Earias vittella Fabricius in Asiatic cotton. Phytoparasitica 41:235 [ Links ]
7. McAUSLANE, H.J.; ALBORN, H.T. y TOTH, J.P. 1997. Systemic induction of terpenoid aldehydes in cotton pigment glands by feeding of larval Spodoptera exigua. Journal of Chemical Ecol. 23:2861-2879. [ Links ]
8. PARROTT, W.L.; JENKINS, J.N.; MULROONEY, J.E.; McCARTY, J.C. y SHEPHERD, R.L. 1989. Relationship between gossypol gland density on cotton squares and resistance to tobacco budworm larvae. J. Econ. Entomol. 82:589–592.
9. POLAK, M.G.A.; PRAUSE, J., CONTRERAS, G. Y CARAM, G.E. 2001. Plagas en el cultivo de algodón Gossypium hirsutum (L.) (Malvales: Malvaceae) en relación a las condiciones ambientales y a sus estados fenológicos. Comunicaciones Científicas y Tecnológicas. SGC y T-UNNE. (Área: Agronomía). [ Links ]
10. SCHEFFLER, J.A.; DOWD, M.K.; MEREDITH, W.R. y SCHEFFER, B.E. 2003. New posibilities for some old genes: improved host plant resistance. In Procceding of the 3rd World Cotton Conference Research, South Africa 1:175-182. [ Links ]
11. SCHEFFLER, J.; ROMANO, G.B. y BLANCO, C.A. 2012. Evaluating host plant resistance in cotton (Gossypium hirsutum L.) with varying gland densities to tobacco budworm (Heliothis virescens F.) and bollworm (Helicoverpa zea Boddie) in the field and laboratory. Agricultural Sciences.3:14-23 [ Links ]
12. SHAVER, T.N.; DILDAY, R.H. y WILSON, F.D. 1980. Use of glandless breeding stocks to evaluate unknown Heliothis growth inhibitors (X-Factors) in cotton. Crop Sci. 20:545-548. [ Links ]
13. WILSON, F.D. y SHAVER, T.N. 1973. Glands, gossypol content, and tobacco budworm development in seedlings and floral parts of cotton. Crop Sci. 13:107–110.














