Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
RIA. Revista de investigaciones agropecuarias
versión On-line ISSN 1669-2314
RIA. Rev. investig. agropecu. vol.41 no.2 Ciudad Autónoma de Buenos Aires ago. 2015
ARTÍCULOS
Sensibilidad a fungicidas in vitro de micelios de Drechslera siccans aislada a partir de trigo
Tonin, R.B.1; Reis, E.M.1,2 ; Gómez, D.E.3
1Facultad de Agronomía y Medicina Veterinaria, Departamento de Fitosanidad, Universidad de Passo Fundo - UPF, 99001, Passo Fundo, RS, Brasil.
2Profesor de FAMV/PPGAgro/UPF.
3Investigador del Instituto Nacional de Tecnología Agropecuaria, INTA Sáenz Peña. Autor para correspondencia: rosanetonin@yahoo.com.br
Recibido el 18 de agosto de 2013
Aceptado el 25 de junio de 2015
Publicado online el 29 de julio de 2015
RESUMEN
La principal mancha foliar del trigo es la mancha amarilla causada por Drechslera tritici-repentis (Dtr). Durante las últimas campañas los productores indicaron la baja eficacia del control químico de esta enfermedad. En la búsqueda de información a fin de esclarecer la falla en el control, se organizó una recolección de aislamientos de Dtr y se identificó una nueva especie del género, D. siccans (Ds) asociada a los síntomas de la mancha amarilla. Los acontecimientos pueden ser atribuidos a alteraciones en la sensibilidad de Dtr o a una menor sensibilidad de Ds a los fungicidas usados. El objetivo de este trabajo fue determinar la sensibilidad miceliar de Ds, aislada de trigo, a fungicidas en experiencias in vitro. Se analizaron los fungicidas inhibidores de la desmetilación de esteroles (IDMs) (ciproconazol, epoxiconazol, propiconazol, protioconazol y tebuconazol) y los inhibidores de la quinona externa (IQEs) (azoxistrobina, picoxistrobina, piraclostrobina y trifloxistrobina) utilizando siete concentraciones (0.00; 0.01; 0.10; 1.00; 10.00; 20.00 e 40.00 mg/L de i.a. - ingrediente activo) y cinco aislamientos del hongo. El crecimiento miceliar fue evaluado midiendo diámetro de las colonias en un medio agarizado. Los porcentajes de inhibición del crecimiento miceliar fueron sometidos a análisis de regresión logarítmica y se calculó la CI50. Los resultados mostraron variación de la fungitoxicidad entre los ingredientes activos, desde altamente fungitóxicos a atóxicos para los aislados de D. siccans. Los fungicidas IDMs presentaron las CI50 más bajas comparados con los IQEs, con valores entre < 0,1 y 0,66 mg/L. Los valores de la CI50 para IQEs se situaron entre 0,84 a 72,90 mg/L. En los aislamientos estudiados se registró una baja sensibilidad del hongo a los ingredientes activos azoxistrobina, picoxistrobina y trifloxistrobina.
Palabras claves: Triticum aestivum; Mancha amarilla; Fungitoxicidad; CI50.
ABSTRACT
The main leaf blight of wheat is yellow leaf spot caused by Drechslera tritici-repentis (Dtr). During the last growing seasons, producers noted the low rate of chemical control achieved its control. A new species of fungus, D. siccans (Ds), was identified when seeking to clarify the causes of failure in the control of Dtr isolates. It was found that Ds is associated to the yellow leaf spot symptoms in wheat. The events can be attributed to alterations in the sensitivity of Dtr or to the lowest sensitivity of Ds to fungicides. The objective of this study was to determine the in vitro mycelial sensitivity of Ds, isolated from wheat, to the fungicides. We tested demethylation inhibitor fungicides (DMIs) (cyproconazole, epoxiconazole, propiconazole, tebuconazole and prothiocona and quinone outside inhibitors (QoIs) (azoxystrobin, picoxystrobin, pyraclostrobin and trifloxystrobin) at seven concentrations: 0.00, 0.01, 0.10, 1.00, 10.00; 20.00 and 40.00 mg/L a.i. (active ingredient) and five fungus isolates. We evaluated mycelial growth by measuring the diameter of the colonies in agar cultures. The percentage of inhibition of mycelial growth was subject to logarithmic regression analysis and we calculated the IC50. The data shows a variation in the fungitoxicity in D. siccans isolates, ranging from nontoxic to highly fungitoxic. IDM fungicides presented the lowest IC50 (< 0.1 to 0.66 mg/L.) when compared to QoIs. The IC50 values for QoI ranged from 0.84 to 72.90 mg/L. A low sensitivity of the fungus is reported for the active ingredients azoxystrobin, trifloxystrobin and picoxystrobin in the studied isolates.
Keywords: Triticum aestivum; Yellow leaf spot; Fungitoxicity; IC50.
INTRODUCCIÓN
El trigo (Triticum aestivum L.) es el principal cultivo de invierno en términos de áreas para su crecimiento, volumen de producción e importancia económica en el sur de Brasil. De acuerdo con la Compañía Nacional de Abastecimiento (Conab, 2012), la producción nacional de trigo para la temporada de crecimiento 2011/12 fue de 5.788.000 toneladas, mientras que el consumo fue de 11 millones de toneladas. Entre los factores que afectan negativamente la producción de trigo se encuentran las enfermedades causadas principalmente por hongos, que incluyen las manchas en las hojas, que dañan los cultivos si no se controlan adecuadamente. La mancha amarilla del trigo causada por el hongo Drechslera tritici-repentis (Dtr) (Died.). Shoemaker es una enfermedad foliar común en la mayor parte de la producción de trigo, especialmente en aquellos cultivos obtenidos por monocultivo y siembra directa. La mancha amarilla del trigo está presente en más de 21 países, se considera una enfermedad cosmopolita (Metha, 1993). El daño causado por la mancha foliar amarilla del trigo puede determinarse usando la ecuación Y= 1,000 - 6.005 LI (y= rendimiento de grano normalizado a 1.000 kg.ha-1; LI = incidencia foliar) (Reunião, 2011). En las muestras de hojas de trigo analizados en la Universidad de Passo Fundo, durante la temporada de crecimiento de 2008, se observó un hecho nuevo. Se identificó y cuantificó la presencia de una nueva especie, Drechslera siccans (Drechsler) Shoemaker, un agente etiológico asociado con la mancha foliar amarilla del trigo (Tonin y Reis, 2009). El hongo D. siccans (Ds) ataca principalmente al raigrás (Lolium multiflorum L. y L. perenne L.) (Schubiger y Boller, 2009).
En la literatura también hay reportes de otras gramíneas que funcionan como hospedadores (Shoemaker, 1962; Ammon, 1963; Latch, 1966; Mäkelä, 1971; Ellis, 1971). El patógeno está distribuido a lo largo de las regiones templadas de Europa, Australia y América del Norte. Causa patologías principalmente en especies del género Lolium y Festuca (Schubiger, 2009). Según Araujo (1976) el raigrás es una de las mejores pasturas para pastos de invierno y se ha convertido actualmente en un cultivo perenne en los parques, terrenos baldíos y a lo largo de caminos, rutas y granjas del sur de Brasil. Por lo tanto, dos hongos similares desde el punto de vista sistemático están relacionados con la etiología de la mancha amarilla del trigo: Dtr y ahora Ds. Ambos causan síntomas generales. El manejo de esta patología se realiza a través de prácticas integradas como cultivares resistentes/tolerantes, semillas sanas, tratamientos de semillas con fungicidas, siembra en épocas correctas, rotación de cultivos y aplicación de fungicidas en los órganos aéreos (Reis y Casa, 2007). El uso de fungicidas es uno de los principales métodos para controlar las enfermedades en plantas, pero su uso constante puede conducir a la selección de cepas de hongos resistentes, que ponen en peligro la eficiencia del método (Ghini y Kimati, 2000). Luego de la temporada de cultivo de trigo de 2008 en adelante, se han registrado quejas sobre la baja eficiencia de las mezclas de fungicidas para el control de la mancha amarilla. La hipótesis para este hecho estuvo relacionada con la aparición de la población Dtr y la reducción/pérdida de sensibilidad a los fungicidas. Por lo tanto se organizó la recolección de diferentes aislamientos de Dtr de diferentes lugares y cultivares de trigo, para encontrar pruebas de este evento. En esta etapa se encontró una alta frecuencia e incidencia de Ds en las hojas de trigo.
Este estudio se llevó a cabo con el fin de determinar la sensibilidad miceliar in vitro de Ds, aislado a partir de trigo, a los fungicidas inhibidores de la desmetilación de esteroles (IDMs) y a los inhibidores de la quinona externa (IQEs) para echar luz sobre la dificultad de controlar la mancha amarilla.
MATERIALES Y MÉTODOS
Los experimentos fuero conducidos en el Laboratorio de Fitopatología-Micología, Facultad de Agronomía y Veterinaria de la Universidad de Passo Fundo, Passo Fundo/ RS, Brasil. Para los bioensayos de sensibilidad miceliar de D. siccans a fungicidas se usó la técnica para incorporar fungicidas al medio de cultivo agarizado, similar al método descrito por Russel (2004)
Aislamientos de hongos
Las cepas de D. siccans fueron aisladas a partir de hojas con síntomas de mancha amarilla, recogidas en granjas de trigo. Los cultivos monospóricos de cinco aislamientos seleccionados fueron almacenados en tubos de ensayo con agar papa dextrosa (APD) en heladera a 5 °C.
Fungicidas
Para los test de sensibilidad en aislamientos de Ds se usaron cinco fungicidas pertenecientes a la familia de inhibidores de la desmetilación de esteroles (IDMs) o grupo triazol (ciproconazol, epoxiconazol, propiconazol, protioconazol y tebuconazol) y cuatro fungicidas inhibidores de la quinona externa (IQEs), o el grupo químico estrobilurina (azoxistrobina, pycoxystrobina, piraclostrobina trifloxistrobina) Se recomiendan estos fungicidas (mezcla de IDM más IQE) para el control de mancha amarilla en cultivos de trigo (Reunião, 2011). Un nuevo fungicida, protioconazol, fue comparado en las pruebas.
Crecimiento miceliar in vitro en agar modificado con fungicidas
Se analizaron siete concentraciones de cada fungicida: 0.00, 0.01, 0.10, 1.00, 10.00, 20.00 y 40.00 mg/L de ingrediente activo. La concentración de 0.00 mg/L representó el control en cada experimento. Las alícuotas de fungicidas fueron transferidos a matraces que contenían agua destilada-esterilizada (ADE), y se llevó a suspensiones de volumen final de 100 ml. Se transfirió luego 1 ml de esta suspensión, junto con 99,0 ml de ADE, a otro matraz aforado (segunda dilución). Después se añadió la suspensión resultante a los volúmenes requeridos de APD deshidratado (39 g/L de agar papa dextrosa - Himedia Laboratorios Pvt, Mumbai, India) para alcanzar las concentraciones deseadas. Los matraces fueron agitados y se vertió el contenido en placas de Petri plásticas (tamaño 90x15 mm.) previamente esterilizadas con vapor de formaldehído en una campana de flujo laminar en condiciones asépticas. Se tomaron discos miceliales de 5 mm de diámetro de cada aislamiento, del área del borde de las colonias, tras siete días de crecimiento y se colocaron en el centro de cada placa de Petri. Las placas contenían el sustrato suplementado con las concentraciones de los fungicidas a analizar. Las placas se incubaron en una cámara de crecimiento a una temperatura de 25 ± 2 °C, fotoperíodo 12 h (proporcionado por tres lámparas fluorescentes, 40 W, colocadas 50 cm por encima de las placas). Se evaluó la inhibición del crecimiento (CI) del micelio por la limitación en la obtención de esporas de Ds, tanto para fungicidas IDM como IQE.
Tabla 1. Identificación de aislamientos de Drechslera siccans.
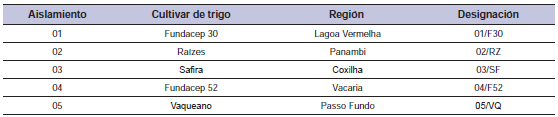
Tabla 2. Fungicidas analizados para determinar la sensibilidad in vitro de aislamientos de Drechslera siccans. Fuente: AGROFIT, 2012.

Determinaciones
Se usó un calibre digital (Mitutoyo - Digimatic caliper) para determinar el diámetro de la colonia en dos direcciones perpendiculares, cuando el crecimiento del micelio en el tratamiento de control alcanzó el borde de la placa. El diseño experimental fue factorial completo aleatorizado (fungicidas x aislamientos) con cuatro repeticiones. Cada unidad experimental fue representada por una placa de Petri.
Análisis de datos
Los experimentos se repitieron dos veces y para el análisis estadístico se utilizaron los promedios de dos ensayos. Se analizaron los datos de porcentaje de inhibición de crecimiento miceliar y, por regresión logarítmica, se calculó la concentración que inhibe el 50% el crecimiento del micelio (CI50) usando el programa estadístico Costat. La CI50 para el crecimiento del micelio se calculó a través de las ecuaciones generadas.
RESULTADOS
Las tablas 3, 4, 5, 6 y 7 muestran los valores calculados de concentración inhibitoria (CI50) para cada fungicida y para los cinco aislamientos. La sensibilidad de los aislamientos se puede clasificar en base a Edgington et al. (1971), modificada por las siguientes criterios: insensible (I) cuando CI50 > 50 mg/L; baja sensibilidad (BS) cuando CI50 tiene valores entre 10 y 50 mg/L; sensibilidad moderada (SM) cuando CI50 se encuentra entre 1 y 10 mg/L; y alta sensibilidad (AS) cuando CI50 < 1 mg/L. Los mismos autores clasifican la fungitoxicidad de compuestos químicos: los que presentan una CI50 < 1 mg/L son considerados altamente fungitóxicos; aquellos con CI50 entre 1 y 50 mg/L son moderadamente fungitóxicos, y aquellos con CI50 > 50 mg/L son considerados no tóxicos.
Tabla 3. Fungicida, ecuación, coeficiente de determinación (R2), concentración para inhibir el 50% del crecimiento miceliar de Drechslera siccans (CI50), y sensibilidad (S) del aislamiento 01/F30.
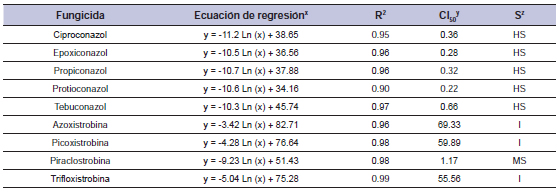
x= porcentaje de inhibición del crecimiento miceliar, x= concentración fungicida; y= concentración calculada con la ecuación (mg/L); z= sensibilidad de Drechslera siccans al fungicida: AS (alta sensibilidad), SM (sensibilidad moderada), I (insensibilidad). Promedio de dos experimentos.
Tabla 4. Fungicida, ecuación, coeficiente de determinación (R2), concentración para inhibir el 50% del crecimiento miceliar de Drechslera siccans (CI50), y sensibilidad (S) del aislamiento 02/RZ.
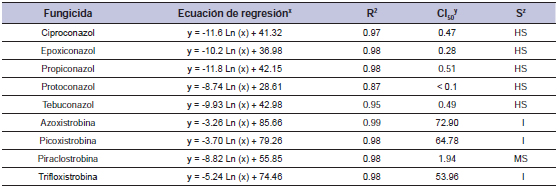
x= porcentaje de inhibición del crecimiento miceliar, x= concentración fungicida; y= concentración calculada con la ecuación (mg/L); z= sensibilidad de Drechslera siccans al fungicida: AS (alta sensibilidad), SM (sensibilidad moderada), I (insensibilidad). Promedio de dos experimentos.
Tabla 5. Fungicida, ecuación, coeficiente de determinación (R2), concentración para inhibir el 50% del crecimiento miceliar de Drechslera siccans (CI50), y sensibilidad (S) del aislamiento 03/SF.

x= porcentaje de inhibición del crecimiento miceliar, x= concentración fungicida; y= concentración calculada con la ecuación (mg/L); z= sensibilidad de Drechslera siccans al fungicida: AS (alta sensibilidad), SM (sensibilidad moderada), I (insensibilidad). Promedio de dos experimentos.
Tabla 6. Fungicida, ecuación, coeficiente de determinación (R2), concentración para inhibir el 50% del crecimiento miceliar de Drechslera siccans (CI50), y sensibilidad (S) del aislamiento 04/F52.
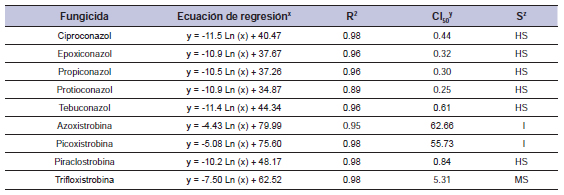
x= porcentaje de inhibición del crecimiento miceliar, x= concentración fungicida; y= concentración calculada con la ecuación (mg/L); z= sensibilidad de Drechslera siccans al fungicida: AS (alta sensibilidad), SM (sensibilidad moderada), baja sensibilidad (BS) I (insensibilidad). Promedio de dos experimentos.
Tabla 7. Fungicida, ecuación, coeficiente de determinación (R2), concentración para inhibir el 50% del crecimiento miceliar de Drechslera siccans (CI50), y sensibilidad (S) del aislamiento 05/VQ.
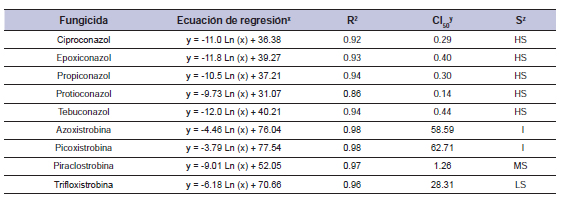
x= porcentaje de inhibición del crecimiento miceliar, x= concentración fungicida; y= concentración calculada con la ecuación (mg/L); z= sensibilidad de Drechslera siccans al fungicida: AS (alta sensibilidad), SM (sensibilidad moderada), baja sensibilidad (BS) I (insensibilidad). Promedio de dos experimentos.
En lo que respecta al aislamiento 01/F30, el coeficiente de determinación R2 varió entre 0,90 y 0,99, y el CI50 para IDM fue entre 0,22 y 0,66 mg/L, mientras que para IQEs se encontró entre 1,17 y 69,33 mg/L (tabla 3). El aislamiento 01/F30 mostró una alta sensibilidad (CI50 < 1,0 mg/L) para ciproconazol, epoxiconazol, propiconazol, protioconazol y tebuconazol. Para fungicidas IQE el aislamiento fue considerado como insensible para azoxistrobina (CI50 69.33 mg/L), picoxistrobina (CI50 59.89 mg/L) y trifloxistrobina (CI50 55.56 mg/L). Sin embargo este aislamiento mostró una sensibilidad moderada a la piraclostrobina (CI50 1.17 mg/L). Para el aislamiento 02/RZ, el coeficiente de determinación (R2) osciló entre 0.87 y 0,99, mientras que CI50 para IDM fue < 0,1 a 0,51 mg/L y para IQE de 1.94 a 72.90 mg/L (tabla 4). Este aislamiento fue AS para tebuconazol (CI50 0.49 mg/L), ciproconazol (CI50 0.47 mg/L), epoxiconazol (CI50 0.28 mg/L), propiconazol (CI50 0.51 mg/L) y protioconazol (CI50 < 0,1 mg/L) Para fungicidas IQE el aislamiento fue considerado I para azoxistrobina (CI50 72.90 mg/L), picoxistrobina (CI50 64.78 mg/L) y trifloxistrobina (CI50 53.96 mg/L), y SM para piraclostrobina (CI50 1,94 mg/L).
Para la cepa 03/SF, el coeficiente de determinación (R2) tuvo valores entre 0.90 y 0.99, mientras que CI50 para IDM fue entre 0.26 y 0.65 mg/L y para IQE de 1.50 a 67.49 mg/L (tabla 5). Este aislamiento fue AS para tebuconazol, ciproconazol, epoxiconazol, propiconazol y protioconazol. Los fungicidas IQE azoxistrobina, picoxistrobina y trifloxistrobina (CI50 67.49, 65.09, y 58.60 mg/L) fueron no tóxicos para el aislamiento analizado, y el aislamiento fue considerado SM para piraclostrobina (CI50 1.50 mg/L). El CI50 para los aislamientos 04/F52 estuvo en el rango entre 0.25 y 0.61 mg/L para IDM y entre 0.84 y 62.66 mg/L para IQE (tabla 6). El coeficiente de determinación (R2) tuvo valores entre 0.89 y 0.98. Este aislamiento fue AS a IDMs e insensible a azoxistrobina (CI50 62.66 mg/L), picoxistrobina (CI50 55.73 mg/L), SM para trifloxistrobina (CI50 5.31 mg/L) y AS para piraclostrobina (CI50 0.84 mg/L). Con respecto al aislamiento 05/VQ el coeficiente de determinación (R2) estuvo entre 0.86 y 0.98, mientras que el CI50 para IDM fue entre 0.14 y 0.44 mg/L, y para IQE estuvo entre 1.26 a 62.71 mg/L (tabla 7). Este aislamiento fue AS para IDMs e insensible para azoxistrobina y picoxistrobina, BS para trifloxistrobina y SM para piraclostrobina (tabla 7). Tomando en cuenta las medias globales (tabla 8) no hubo diferencias en la sensibilidad entre los aislamientos que presentan CI50 entre 0.31 (aislamiento 05/VQ) y 0.38 mg/L (aislamientos 03/SF y 04/F52). En lo que respecta a los fungicidas, el protioconazol mostró la CI50 media más baja (0.21 mg/L), mientras que el ciproconazol, el propiconazol y el epoxiconazol mostraron un CI50 intermedio y el tebuconazol presentó el CI50 más alto (0.57 mg/L).
Tabla 8. Concentraciones para inhibir el 50% el crecimiento miceliar (CI50) de cinco aislamientos de Drechslera siccans por cinco fungicidas IDM.
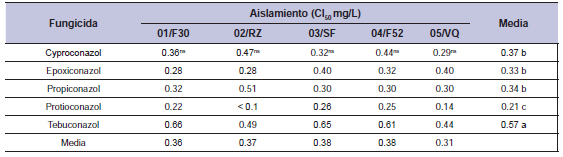
ns no significativo. Las medias seguidas por la misma letra no presentan diferencias en la prueba de Tukey a 5%. Las letras minúsculas comparan las medias de la columna y las superiores en la línea. Medias de dos experimentos.
El fungicida IDM protioconazol mostró la CI50 más baja para los cinco aislamientos y presenta entonces la inhibición de crecimiento miceliar más alta (tabla 8). Los valores oscilaron entre < 0.1 y 0.26 mg/L. A una concentración de 10 mg/L el crecimiento miceliar fue inhibido en un 100%. En promedio, se encontraron los valores más altos de CI50 (menos fungitóxicos) para el fungicida tebuconazol, que van desde 0.44 a 0.66 mg/L, mostrando que in vitro los aislamientos son menos sensibles a este fungicida. Hubo diferencias en la sensibilidad entre los aislamientos de fungicidas IQE. El más sensible fue 04/F52 (CI50: 31.13 mg/L), seguido por 05/VQ (CI50: 37.72 mg/L), y los aislamientos eran menos sensibles fueron 02/RZ (CI50= 48.39 mg/L), 03/SF (CI50: 48.17 mg/L) y 01/F30 (CI50: 46.49 mg/L). En cuanto a los fungicidas, la CI50 para la piraclostrobina fue 1.34 mg/L, para la azoxistrobina 66.19 mg/L, picoxistrobina 61.64 mg/L y para la trifloxistrobina fue 40.35 mg/L. Para piraclostrobina estos aislamientos fueron SM, excepto por 04/F52 que era sensible (CI50 0.84 mg/L). Los valores de CI50 para IQEs variaron entre 0.84 y 72.90 mg/L, respectivamente (tabla 9). Los fungicidas azoxistrobina y picoxistrobina fueron no tóxicos en los aislamientos analizados.
Tabla 9. Concentraciones para inhibir el 50% del crecimiento miceliar (CI50) de cinco aislamientos de Drechslera siccans por cinco fungicidas IQE.
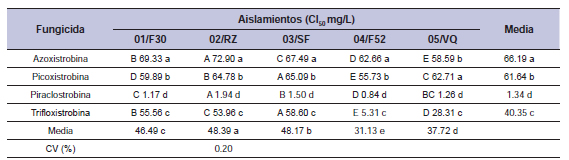
Las medias seguidas por la misma letra no presentan diferencias en la prueba de Tukey a 5%. Las letras minúsculas comparan las medias de la columna y las superiores en la línea. Medias de dos experimentos.
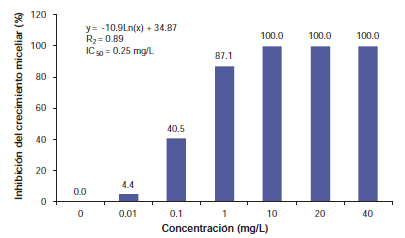
Figura 1. Inhibición in vitro del crecimiento de micelios (%) de Drechslera siccans, aislamiento de trigo 04/F52, con siete concentraciones de protioconazol [y: crecimiento miceliar; x: concentración fungicida; CI50: concentración (mg/L) para inhibir el 50% del crecimiento miceliar].
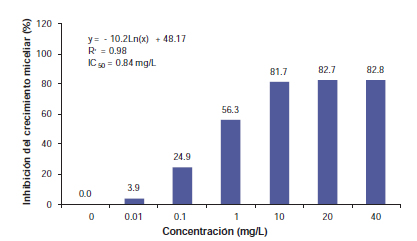
Figura 2. Crecimiento miceliar (%) in vitro de Drechslera siccans, aislamiento de trigo 04/F52, a siete concentraciones de piraclostrobina [y= crecimiento miceliar; x= concentración fungicida; CI50= concentración (mg/L) para inhibir 50% del crecimiento miceliar].
DISCUSIÓN
Stolte (2006) encontró que para Dtr los valores de CI50 eran < 0.1 mg/L para los fungicidas propiconazol, epoxiconazol y ciproconazol, mientras que la CI50 era superior (0.54 mg/L) para tebuconazol. En nuestra investigación encontramos resultados similares. La alta sensibilidad al ingrediente activo propiconazol fue también reportada por Sartori y Maringoni (2008) que trabajaron con Colletotrichum lindemuthianum (Sacc. Y Magn.) Scrib., con valores de CI50 < 1 mg/L. El fungicida azoxistrobina fue considerado como no tóxico (ED50 > 50 mg/L) para Amphobotrys ricini (Buchwald) Hennebert (Chagas, 2009). También Kimura et al. (2001) evaluaron la sensibilidad in vitro a varios fungicidas de Botrytis cinerea Pers. ex. Fr, aislado de viveros de eucalipto, y observaron una baja sensibilidad a la azoxistrobina tanto para el crecimiento miceliar como para la germinación de esporas.
Los fungicidas IQE no detuvieron el crecimiento miceliar en todos los aislamientos, aún a concentraciones de 40 mg/L. El ingrediente activo piraclostrobina presentó la acción fungicida más potente en comparación con otros IQEs analizados, con valores de CI50 entre 0.84 y 1.94 mg/L. Gulart (2009) y Sartorato (2006) clasificaron aislamientos de Colletotrichum lindemuthianum como altamente sensibles a este fungicida. El Protioconazol fue el más potente entre los IDMs para inhibir el crecimiento miceliar de D. siccans, mientras que la piraclostrobina lo fue entre los IQEs. Tebuconazol, azoxistrobina y picoxistrobina presentaron el menor crecimiento miceliar menos con los valores más altos de CI50. Aunque los fungicidas IDMs pertenecen al mismo grupo químico y tienen el mismo mecanismo de acción (inhibidores de desmetilación) mostraron comportamientos diferentes para el mismo hongo (Ds), siendo tebuconazol el menos fungitóxico y protioconazol el más fungitóxico. El mismo comportamiento se observó en los IQEs, donde los menos fungitóxicos fueron azoxistrobina, picoxistrobina y trifloxistrobina, mientras que la mayor acción fungitóxica se observó con piraclostrobina. Al momento no tenemos ninguna explicación para este comportamiento diferente, en términos de fungitoxicidad, entre fungicidas que tienen el mismo modo de acción bioquímico. Los resultados presentados en este trabajo no son suficientes para confirmar la hipótesis de que la baja eficiencia para controlar la mancha amarilla del trigo (de 2008 en adelante) está solamente relacionada con la presencia de una nueva especie y su menor sensibilidad a los fungicidas IQE. Por lo tanto, se está realizando una investigación similar y adicional con aislamientos Dtr y los mismos fungicidas.
CONSIDERACIONES FINALES
Entre los grupos químicos estudiados, los IDM mostraron la mayor fungitoxicidad para D. siccans. Entre los IDM el protioconazol fue el más potente para inhibir el crecimiento miceliar de D. siccans, mientras que tebuconazol presentó la menor potencia, con los valores más altos de CI50 entre los triazoles. Entre los fungicidas IQEs, la piraclostrobina fue el más potente.
BIBLIOGRAFÍA
1. AGROFIT (Base de dados de produtos agrotóxicos e fitossanitários). 2012. Secretaria de Defesa Agropecuária/ Ministério da Agricultura e do Abastecimento. Brasília. [ Links ]
2. AMMON, H.U. 1963. Übereinige Artenaus den Gattungen Pyrenophora Fries und Cochliobolus Drechsler mit Helminthosporium als Nebenfruchtform. Phytopathologische Zeitschrift 47: 244-300. [ Links ]
3. ARAUJO, A.A. 1976. Melhoramento das pastagens - Agrostologia Rio-Grandense, Porto Alegre, Livraria Editora Sulina, 4ª edição, 208p. [ Links ]
4. CHAGAS, H.A. 2009. Controle de mofo-cinzento (Amphobotrys ricini) da mamoneira (Ricinus communis L.) por métodos químico, biológico e com óleos essenciais. Dissertação (Mestrado em Agronomia) - Universidade Estadual Paulista, Faculdade de Ciências Agronômicas, Botucatu, 67p. [ Links ]
5. CONAB - (Companhia Nacional de Abastecimento). 2012. Acompanhamento de safra brasileira: Último levantamento, janeiro/ 2012. Disponível em: www.conab.gov.br/. [ Links ]
6. EDGINGTON, L.V.; KHEW, K.L.; BARROW, G.L. 1971. Fungitoxic spectrum of benzimidazole compounds. Phytopathology 61:42- 44. [ Links ]
7. ELLIS, M.B.1971.Dematiaceous Hyphomycetes. Commonwealth Mycological Institute Kew, Surrey England: 608 p. [ Links ]
8. GHINI, R.; KIMATI, H. 2000. Resistência de fungos a fungicidas. Jaguariúna: Embrapa Meio Ambiente, 78 p. [ Links ]
9. GULART, C.A. 2009. Sensibilidade in vitro e in vivo de isolados de Colletotrichum lindemuthianum (SACC y MAGN.) BRIOSI y CAV., a fungicidas sistêmicos. Dissertação (Mestrado em Agronomia) - Universidade Federal de Santa Maria. Santa Maria, RS, Brasil. [ Links ]
10. KIMURA, M.K.; SOUZA, P.E.; CASTRO, H.A. 2001. Sensibilidade in vitro de Botrytis cinérea a fungicidas. Ciência e Agrotecnologia 25 (5):1150-1160. [ Links ]
11. LATCH, G.C.M. 1966.Fungus diseases of ryegrasses in New Zealand: I. Foliage diseases. New Zealand Journal of Agricultural Research, 9 (2)394-409. [ Links ]
12. MÄKELÄ, K. 1971. Some graminicolous species of Helminthosporium in Finland. Karstenia. 12 (1): p. 5-35. [ Links ]
13. METHA, Y.R. 1993. Manejo integrado de enfermedades del trigo. Imprenta Landivar, Santa Cruz de La Sierra, Bolivia, 319 p. [ Links ]
14. REIS, E. M.; CASA, R.T. 2007. Doenças dos cereais de inverno: diagnose, epidemiologia e controle. 2ed. Lages: Graphel, 176 p. [ Links ]
15. REUNIÃO DA COMISSÃO BRASILEIRA DE PESQUISA DE TRIGO E TRITICALE, 5., 2011, Dourados. Informações técnicas para trigo e triticale - safra 2012. Dourados: Embrapa Agropecuária Oeste, 2011. 204 p. [ Links ]
16. RUSSEL, P.E. 2004. Sensitivity baselines in fungicide resistance researchand management. FRAC Monograph n° 3, Cambridge CB2 5AN, UK. [ Links ]
17. SARTORATO, A. 2006. Sensibilidade in vitro de isolados de Colletotrichum lindemuthianum a fungicidas. Pesquisa Agropecuária Tropical, 36 (3): 211-213. [ Links ]
18. SARTORI, J.E.; MARINGONI, A.C. 2008. Effect of fungicides on colony growth of Colletotrichum lindemuthianum (SACC.y MAGN.) SCRIB. Journal of Plant Protection Research. vol. 48, no. 2,p. 203-214. [ Links ]
19. SHOEMAKER, R.A. Drechslera Ito. 1962. Canadian Journal of Botany 40: p. 809-836. [ Links ]
20. STAUB, T.; SOZZI, D. 1984. Fungicide resistance. Plant Disease, 86 (12): 1026-1031. [ Links ]
21. SCHUBIGER, F.X. Drechslera siccans. Hofenstrasse. Männedorf, 2009. Disponível em: www.pflanzenkrankheiten.ch [ Links ]
22. SCHUBIGER, F.X.; BOLLER,B. 2009. Blattfleckenkrankheiten der Gräser in der Schweiz. Agroscope Reckenholz-Tänikon (ART), Reckenholzstrasse 191, Zürich. [ Links ]
23. STOLTE, R.E. 2006. Sensibilidade de Bipolaris sorokiniana e de Drechslera tritici-repentis a fungicidas in vitro. Dissertação (Mestrado em Agronomia)-Universidade de Passo Fundo/UPF. Passo Fundo/RS. [ Links ]
24. TONIN, R.B.; REIS, E.M. 2009. Incidência de Drechslera sp.em folhas de trigo. In: XLII Congresso Brasileiro de Fitopatologia. Tropical Plant Patology 34 (Suplemento), Resumo 490 (Epidemiologia). [ Links ]














