Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
RIA. Revista de investigaciones agropecuarias
versión On-line ISSN 1669-2314
RIA. Rev. investig. agropecu. vol.42 no.3 Ciudad Autónoma de Buenos Aires dic. 2016
REVISIONES
Técnicas de análisis de crecimiento de plantas: su aplicación a cultivos intensivos
Di Benedetto, A.1,2; Tognetti, J.2,3
1Facultad de Agronomía, Universidad de Buenos Aires, Av. San Martín 4453 (C1417DSE), Ciudad Autónoma de Buenos Aires, Argentina.
2Facultad de Ciencias Agrarias, Universidad Nacional de Mar del Plata, Ruta 226, km 73,5 (B7620ZAA), Balcarce, provincia de Buenos Aires, Argentina. Correo electrónico: dibenede@agro.uba.ar
3Comisión de Investigaciones Científicas de la Provincia de Buenos Aires, Calle 526 entre 10 y 11 (1900), La Plata, Provincia Buenos Aires, Argentina. Correo electrónico: jtognetti2001@yahoo.com.ar
Recibido 19 de febrero de 2016
Aceptado 24 de mayo de 2016
Publicado online 07 de diciembre de 2016
RESUMEN
La descripción del crecimiento de una planta, o de un cultivo, a lo largo de su ciclo de vida o de producción, así como la evaluación de tratamientos capaces de modificar la acumulación de biomasa de un vegetal requieren indicadores objetivos que puedan ser validados estadísticamente. Las técnicas de análisis del crecimiento son herramientas útiles para estos fines. Pueden aplicarse en múltiples situaciones, pero su empleo en cultivos intensivos presenta aspectos particulares y precauciones a ser tenidos en cuenta, acerca de los cuales la información disponible es relativamente escasa y dispersa. En este trabajo de revisión se describen los estimadores del crecimiento más apropiados para ser empleados en especies hortícolas, frutales y ornamentales. Asimismo, se discuten e ilustran distintas alternativas para la utilización de estos indicadores tanto a nivel de planta aislada como de cultivo.
Palabras clave: Alometría; Análisis funcional; Asimilación neta; Crecimiento; Hortalizas; Frutales; Ornamentales; Partición.
ABSTRACT
The description of plant or crop growth, throughout their life or production cycles, as well as the evaluation of treatments that may modify vegetable biomass accumulation, require the estimation of parameters, which can be statistically tested. Growth analysis methods provide useful tools for these purposes. They can be applied to multiple situations, but their use in intensive cropping systems show particularities and cautions that need to be taken into account, about which information is relatively scarce and scattered. This review describes the most appropriate parameters to be used in vegetable, fruit and ornamental species, and both discusses and illustrates the use of different alternatives that can be chosen for growth description at either the isolated plant or crop levels.
Keywords: Allometry; Functional analysis; Net assimilation; Growth; Vegetables; Fruit crops; Ornamentals; Partition.
INTRODUCCIÓN
La productividad de un cultivo, en términos biológicos, comienza a definirse desde el inicio del ciclo de producción comercial, y es afectada por una multiplicidad de factores, algunos de ellos propios del genotipo, otros del ambiente, y otros de las condiciones de manejo (Poorter y Lambers, 1991; Anten y Poorter, 2009; Poorter et al., 2014; Körner, 2015). Estos factores ejercen sus efectos a través de cambios en la diferenciación y expansión de órganos, en la captación de recursos por parte de ellos, y también en la distribución ("partición") de esos recursos entre los distintos órganos de la planta. Como resultado de estos efectos se producen modificaciones en la acumulación de biomasa entre las distintas partes de esta. Para poder evaluar cómo las variaciones en el genotipo, el ambiente y en el manejo modifican la acumulación de biomasa a nivel de planta aislada se han desarrollado, desde las primeras décadas del siglo xx, las técnicas matemáticas de "análisis de crecimiento vegetal". A partir de mediciones sencillas (básicamente, área foliar y peso de los diferentes órganos) se han derivado parámetros que permiten estimar, con suficiente precisión, procesos fundamentales que hacen a la productividad, tales como la tasa de fijación de carbono y la partición de fotoasimilados entre los diferentes órganos de un vegetal. Desarrollos posteriores han permitido evaluar la eficiencia de la planta en cuanto a la utilización de los recursos del ambiente para la producción de biomasa. Actualmente, el análisis de crecimiento se ha establecido como una disciplina relacionada con la ecofisiología y la agronomía, con sus propios conceptos, términos y herramientas de cálculo (Poorter, 1989; Poorter y Garnier, 1996; Ordoñez et al., 2009; Poorter y Sack, 2012), sirviendo como base del desarrollo de modelos de crecimiento generales (Niinemets y Tenhunen, 1997; Yang y Midmore, 2005; Fourcaud et al., 2008) e incluso para especies hortícolas bajo cultivo intensivo (Gary et al., 1998; Marcelis et al., 1998; Kage et al., 2004).
El presente trabajo de revisión tiene como objetivo principal la descripción de los fundamentos teórico-prácticos de estas herramientas, con énfasis en sus alcances y limitaciones, para facilitar su empleo en especies bajo cultivo intensivo. Se discutirá la potencialidad de estas herramientas para explicar las respuestas de las plantas tanto en experimentos de investigación como en cultivos bajo producción comercial. Se revisará la bibliografía más relevante actualmente disponible sobre el tema, particularmente en relación con este tipo de especies, y se ilustrarán los principales puntos a través de la reelaboración de datos de ensayos previamente publicados, ya sean propios o de otros autores.
Análisis clásico y análisis integrado: alcances y limitaciones
El actualmente denominado "análisis clásico" es un análisis a nivel de una planta aislada, que, en su forma más simple, permite estimar en qué medida la fijación de carbono por unidad de área foliar, y la proporción del carbono disponible que se emplea en la producción de área foliar, contribuyen a la acumulación de biomasa de la planta entera. Este tipo de análisis es particularmente apropiado para plantas que se encuentran en una fase exponencial de crecimiento, y es por ello que es muy usado, en estudios ecológicos, en los que se evalúa la competencia temprana entre plantas (Tei et al., 1996; Grotkopp et al., 2010). Sin embargo, puede adaptarse satisfactoriamente al estudio de etapas más tardías.
A pesar de que la metodología del análisis clásico ha sido extensamente utilizada en estudios ecológicos y fisiológicos básicos, y también se ha aplicado a cultivos extensivos, su empleo en producciones vegetales bajo cultivo intensivo ha tenido mucho menos difusión (Di Benedetto et al., 2013, 2015a, b; Di Matteo et al., 2015). Diversos factores han contribuido a esta situación, tales como la complejidad en el manejo de muchos cultivos intensivos y el hecho de que la cosecha, en muchos casos, se realiza en un estado avanzado del ciclo de vida de la planta que hace tiempo ha dejado de crecer, al menos, exponencialmente. Esto dificulta la aplicación de una técnica de análisis de crecimiento pensada originalmente para situaciones mucho más sencillas. Otro factor puede ser que el análisis del crecimiento se ha desarrollado para estudiar la acumulación de biomasa seca; sin embargo, en cultivos intensivos, la acumulación de peso fresco suele tener mayor significancia comercial. De todas maneras, es posible salvar estas dificultades para permitir el empleo de esta herramienta de análisis del crecimiento vegetal que puede ofrecer numerosas ventajas, especialmente a la hora de evaluar efectos de tratamientos experimentales. Este análisis ha sido extendido a nivel de canopeo para evaluar el crecimiento, ya no de plantas aisladas, sino de cultivos, especialmente extensivos. Sin embargo, su aplicación no siempre ha sido suficientemente útil para obtener conclusiones respecto del rendimiento, por razones que expondremos brevemente más adelante.
Para suplir este déficit se ha desarrollado el a veces llamado "análisis integrado", en el que se evalúa por un lado la producción de biomasa por parte de la planta en relación con la disponibilidad, captación y utilización de un recurso ambiental esencial (generalmente la radiación, aunque en otros casos agua o nitrógeno) y, por otro, el empleo de esa biomasa para la producción del órgano de interés agronómico. Este tipo de análisis requiere de mediciones precisas de la cantidad del recurso que es efectivamente adquirido por la planta; en el caso de la radiación es necesario contar con un ceptómetro. De todos modos, también en este tipo de análisis existen reparos a su utilización irrestricta para el caso de cultivos intensivos, como veremos más adelante. Dado que el uso e interpretación de los estimadores de crecimiento permite establecer las relaciones causales entre la capacidad de adaptación y el crecimiento de las plantas en ambientes específicos y el rendimiento potencial que es posible obtener para un genotipo dado (Hunt et al., 2002, 2003), su empleo brinda al fisiólogo de cultivos información elemental acerca del comportamiento de las plantas en el sistema de producción.
Acumulación de biomasa
El crecimiento es definido generalmente como un incremento irreversible en las dimensiones de la planta. Para determinarlo pueden medirse los cambios en volumen, pero debido a las dificultades prácticas que genera este tipo de mediciones, suelen determinarse variables relacionadas, tales como la acumulación de peso, las variaciones en altura o diámetro, o los cambios en el área foliar. En condiciones de turgencia plena, el peso fresco o húmedo es un buen estimador del volumen, ya que en general las variaciones en el peso específico de los tejidos vegetales son bajas. Esto es así debido a que el agua es el principal componente en casi todos los órganos y tejidos (las semillas son una notoria excepción). Sin embargo, el análisis clásico del crecimiento es un análisis de la acumulación de peso seco, que no estima bien el volumen, debido a que los tejidos pueden experimentar variaciones en su contenido porcentual de materia seca (ya que una proporción importante de los fotoasimilados almacenados en una célula pueden ser transitorios). Pero en contrapartida, el peso seco es un muy buen estimador del carbono total de la planta, lo que permite analizar importantes aspectos de su fisiología. Por eso, podríamos decir, estrictamente hablando, que el análisis de crecimiento clásico es, en realidad, un análisis de la fijación y partición del carbono.
La biomasa seca acumulada de una planta (u órgano) se incrementa inicialmente a una tasa exponencial, más tarde lo hace linealmente y finalmente crece a una tasa decreciente hasta alcanzar un nivel máximo ("plateau"), lo que se asemeja a una curva sigmoidea (Poorter, 2002). La pendiente (primera derivada) de esta curva es la tasa de crecimiento absoluto (AGR, g día-1, por sus iniciales en inglés "absolute growth rate") de una planta u órgano (Broadley et al., 2000; 2003; Filho et al., 2009). Para cualquier instante de tiempo (t), AGR se define como el incremento de peso seco de material vegetal (W) por unidad de tiempo, es decir:
![]()
La biomasa acumulada durante la fase juvenil de la planta u órgano puede describirse mediante una función exponencial simple:
![]()
Wt: peso final; W0 = peso inicial; RGR: tasa de crecimiento relativo y t: tiempo
La tasa de crecimiento relativo (RGR, g g-1 día-1, por sus iniciales en inglés "relative growth rate") es el concepto central del análisis de crecimiento, y ampliamente empleada en producciones intensivas (ver por ejemplo, Bruggink, 1992; Broadley et al., 2003; van Iersel, 2003; Del Amor, 2006; Gweyi-Onyango et al., 2009; Ghanem et al., 2011; Zhang et al., 2015). Durante los primeros estadios, el crecimiento suele tener una dinámica de acumulación de biomasa exponencial y suele reflejar diferencias significativas entre especies y dentro de estas frente a variaciones en la oferta agroclimática o cultural del establecimiento productor. El cálculo de RGR de una planta y órgano para cada instante (t) se define como el incremento de material vegetal por unidad de material vegetal existente y por unidad de tiempo:
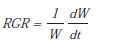
Matemáticamente es la pendiente de la ecuación que relaciona el logaritmo natural del peso seco total con el tiempo transcurrido.
Suponiendo que el crecimiento de las plántulas en los primeros estadios suele ser de tipo exponencial, el peso de la plántula en un momento dado queda determinado por la ecuación:
![]()
W2 y W 1 son el peso de la plántula en los tiempos 2 y 1 (t2 y t1, respectivamente) y RGR la tasa de crecimiento relativo. Si aplicamos los logaritmos neperianos a los dos términos de la ecuación, tenemos que:
![]()
Despejando, tendríamos la fórmula para calcular RGR
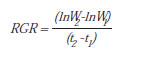
Dado que es imposible realizar medidas de la biomasa seca de una misma planta en distintos momentos (ya que es una medición destructiva), RGR se calcula a partir de muestreos de plantas diferentes a lo largo del período experimental.
El método más usado para el cálculo de RGR consiste en cosechar un número suficiente de plantas (10 a 15 submuestras por repetición) en tiempos distintos (mínimo dos; usualmente de cuatro a cinco según el ciclo de cultivo de la especie en estudio). RGR se puede calcular con los promedios de peso de todas las cosechas parciales o a partir del peso seco total de cada planta individual (separada por tratamiento y repetición) (Poorter y Garnier, 1996; Hoffmann y Poorter 2002). La pendiente de la regresión lineal obtenida cuando se grafica el logaritmo natural del peso seco total en función de los días es RGR y, como una primera aproximación, el coeficiente de determinación (r2) indicaría el grado de asociación entre los datos. En la figura 1 se muestra que la pendiente de la relación entre el ln de peso y los días (RGR) es constante durante más de 150 días. Una RGR constante significa que el crecimiento se mantiene exponencial. Esto solo es posible en este ejemplo porque E. aureum es una especie umbrófila con ciclos de producción de entre 12 a 18 meses. Sin embargo es importante tener en cuenta que en especies heliófilas bajo cultivo intensivo el período de crecimiento exponencial es mucho más limitado.
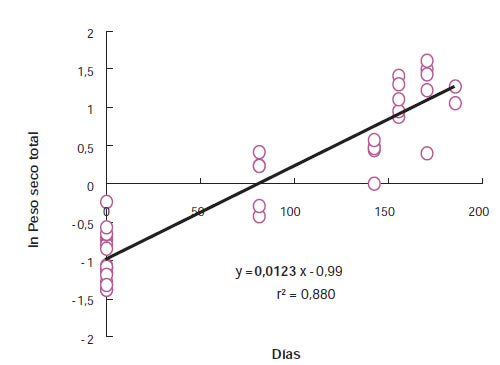
Figura 1. Cálculo de RGR (pendiente de la línea de regresión) a partir de los datos de peso seco total (g planta-1) y momento de cosecha (días desde el inicio del experimento) para un ensayo desarrollado durante 184 días con 6 cosechas parciales sobre plantas de Epipremnun aureum (Di Benedetto et al., 2015a).
Un aspecto importante a tener en cuenta es que para calcular el valor de RGR de la planta entera debe obtenerse la medida del peso radical, lo que es generalmente difícil de lograr sin pérdidas significativas. Por una parte, cuando se intenta recuperar el sistema radical completo es conveniente, en general, que las plantas se cultiven en macetas. Sin embargo, cuando se realizan experimentos en macetas, debe cuidarse que el sistema radical se desarrolle de modo similar al que hubiera tenido en el suelo. En este sentido, dos variables importantes que se deben tener en cuenta son el efecto de la restricción radical asociada con el tamaño del contenedor (Pagani et al., 2013; Coro et al., 2014; Di Matteo et al., 2015) y el efecto de la calidad del sustrato de cultivo utilizado (Di Benedetto, 2011; Di Benedetto y Pagani, 2012; Thibaud et al., 2012; Pagani et al., 2015), dos aspectos a los que se le ha prestado relativamente poca atención (Poorter et al., 2012a) y que pueden causar alteraciones en el desarrollo radical y, por lo tanto, en su tasa de crecimiento relativa. Por otra parte, para cultivos a campo, hay métodos de muestreo de raíz con extracción de cilindros de suelo, que permiten estimar la biomasa radical total (Rowell, 2014).
La capacidad de producción de fotoasimilados a través del mecanismo fotosintético y su distribución dentro de la planta dependen de la capacidad de fijación del dióxido de carbono ambiental y de su partición entre los distintos órganos de la planta. Como una primera aproximación es posible desdoblar RGR como el producto entre la tasa de asimilación neta (NAR, g cm-2 día-1, por sus iniciales en inglés "net assimilation rate") o "componente fisiológico" y la relación de área foliar (LAR, cm2 g-1, por sus iniciales en inglés "leaf area ratio") o "componente morfológico" (Johnson et al., 2003; Osone et al., 2008), es decir:
RGR= NAR×LAR
Las siguientes fórmulas sirven para calcular NAR y LAR entre dos momentos puntuales del ciclo de vida de la planta:
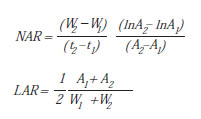
W y A son los valores de peso seco y área foliar y los subíndices 1 y 2 se corresponden con el tiempo de muestreo inicial y final del intervalo bajo estudio, t1 y t2, respectivamente.
Asimismo, se puede calcular el valor medio de NAR a lo largo del ciclo de vida, empleando la fórmula siguiente (Potter y Jones, 1977):
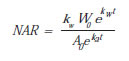
kw: RGR (días-1); W0: peso seco total en el tiempo cero, obtenido por extrapolación (g); A0: área foliar total en el tiempo cero, obtenida por extrapolación (cm2); ka: tasa de expansión foliar relativa (días-1) (ver "Expansión del área foliar"); t: tiempo (en días) en la mitad del período experimental; e: base de los logaritmos naturales.
Por un lado, NAR es una estimación de la capacidad fotosintética de la planta y, si se dispone de medidas del contenido de nitrógeno foliar (Zotarelli et al., 2008), puede desdoblarse en dos componentes: la productividad del nitrógeno foliar (LNP, g g-1N día-1, por sus iniciales en inglés "leaf nitrogen productivity") y la concentración de nitrógeno por unidad de área foliar (LNCa, gN cm-2, por sus iniciales en inglés "leaf area-based nitrogen concentration") (Osone et al., 2008). Esta última variable suele ser designada alternativamente como "specific leaf nitrogen" (Ordóñez et al., 2015).
a NAR= LNP×LNC
Por otro lado, LAR es el producto entre el área foliar específica (SLA, cm2 g-1, por sus iniciales en inglés, "specific leaf area") y la relación de peso foliar (LWR, g g-1, por sus iniciales en inglés, "leaf weight ratio") (Broadley et al., 2000; Adams et al., 2008; Khavari-Nejad et al., 2009):
LAR = SLA×LWR
SLA se obtiene dividiendo el área foliar por el peso seco de cada hoja, mientras que LWR se calcula dividiendo el peso seco de las hojas sobre el peso seco total de la planta (Poorter et al., 2009). En general, se emplea SLA medio de toda la planta, si bien puede haber algunas diferencias entre hojas individuales. Tradicionalmente se ha utilizado SLA como un estimador del espesor foliar, el cual tiende a aumentar a medida que disminuye SLA. Sin embargo, se ha demostrado que se obtiene una mejor correlación con el espesor foliar cuando SLA se calcula en base al peso fresco, lo que equivale a multiplicar SLA en base peso seco por el contenido de materia seca de la hoja (Di Benedetto et al., 2013).
Para facilitar el cálculo de la mayor parte de estos estimadores de crecimiento es posible utilizar un archivo Excel disponible en Hunt et al., (2002) (http://people.exeter.ac.uk/rh203/growth_analysis.html).
Expansión del área foliar
El aumento de biomasa de un vegetal se realiza a partir del área foliar expandida como fuente de producción de fotoasimilados (Cookson et al., 2005). Por lo tanto, es una variable crítica para la productividad. Para cuantificar la tasa de expansión del área foliar se requiere obtener la sumatoria del área foliar de todas las hojas individuales en cada fecha de muestreo a lo largo del período total de evaluación. A partir de estos datos, se construye una curva de acumulación del área foliar en función del tiempo cuya forma es similar a la de acumulación de biomasa, es decir, que consta de una etapa exponencial, una lineal y una de incrementos decrecientes.
Análogamente al cálculo de RGR se suele cuantificar el incremento relativo en área foliar a través de la tasa de expansión foliar relativa (RLAE, cm2 cm-2 día-1, por sus iniciales en inglés, "relative rate of leaf area expansión"). Para su cálculo se utiliza el logaritmo natural del área foliar total de cada planta () y se lo grafica en función de los días transcurridos desde el inicio del experimento. La pendiente de la regresión que relaciona ambas variables es RLAE (figura 2). En el caso de la especie representada en esta figura, de lento desarrollo, la pendiente que relaciona el ln del área foliar expandida y los días considerados se mantiene exponencial durante un período inusualmente largo.
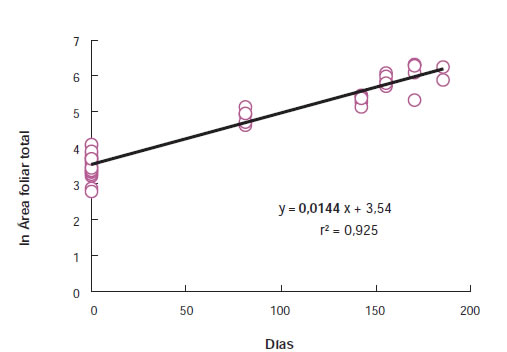
Figura 2. Cálculo de RLAE (pendiente de la línea de regresión) a partir de los datos de área foliar total (g planta-1) y el momento de cosecha (días desde el inicio del experimento) para un experimento desarrollado durante 184 días con 6 cosechas parciales sobre plantas de Epipremnun aureum (Di Benedetto et al., 2015a).
En el caso particular de especies dicotiledóneas cultivadas desde semilla, para estimar el área foliar de los cotiledones en el tiempo cero es necesario esperar a que estos se expandan completamente. Aunque el tamaño final alcanzado depende de diversas variables relacionadas con el proceso de germinación las diferencias potenciales se diluyen durante el proceso de análisis entre cosechas parciales sucesivas. Para obtener el área foliar expandida de cada hoja existen varias aproximaciones:
a. se puede utilizar un medidor de área foliar, es decir, un equipo que registra el paso de la hoja por sensores lumínicos. Son equipos muy precisos que requieren un mantenimiento constante para evitar que la acumulación de polvo o pequeñas partes de las hojas que ya hayan sido medidas incrementen el área de las siguientes. Su costo es quizás su mayor limitante.
b. recientemente se ha extendido el uso de escáneres, incluso portátiles, de bajo costo, que permiten con suma facilidad la adquisición de imágenes de las hojas en formato digital. Posteriormente, mediante programas informáticos tales como el ImageJ® (National Institute for Healt, EUA) se puede calcular el área foliar individual con una altísima precisión.
c. estimaciones a partir de mediciones sencillas de largo o ancho de la lámina foliar (De Swart et al., 2004; Di Benedetto et al., 2006; Mokhtarpour et al., 2010). Para ello se dibujan las hojas sobre papel, se miden los valores de largo y/o ancho, se recortan las improntas, se pesan, se estima el área foliar utilizando una unidad de peso del papel o se mide directamente (ver punto d) y se genera una regresión lineal entre los parámetros de ancho y largo lineales y el área foliar. Su construcción es trabajosa así como la toma posterior de los datos pero, en general, el coeficiente de determinación (r2) suele mostrar un ajuste extremadamente alto. Su uso está virtualmente limitado a especies con hojas enteras.
d. finalmente, una estimación indirecta se puede hacer extrayendo, con un calador, pequeños discos de lámina foliar de una superficie conocida, pesarlos (antes o después de secado a estufa) y calcular el área foliar total a partir de su peso fresco o seco. Su precisión es limitada debido a que no se tiene en cuenta el espesor de cada hoja individual.
Por lo indicado, la determinación del área foliar no es necesariamente un proceso destructivo, lo que permite evaluar la evolución de esta variable a lo largo de la vida de una misma planta, a diferencia de lo que ocurre con RGR. Una variable importante asociada a la expansión foliar es la tasa de aparición de hojas (RLA, hojas día-1, por sus iniciales en inglés, "rate of leaf appearance"), que se calcula como la pendiente de la regresión lineal del número de hojas en función del tiempo. También suele expresarse como su inversa, el filocrono, que a su vez puede representar una estimación de la duración del plastocrono (Lee et al., 2009), es decir, del tiempo de iniciación de dos hojas sucesivas (Fleming, 2005, 2006). Dado que es difícil observar la evolución del ápice vegetativo sin efectuar una disección (Fiorani y Beemster, 2006), es posible estimar este tiempo a partir del número de hojas expandidas que tengan un largo o tamaño mayor al previamente establecido en el momento de la cosecha parcial.
Tiempo cronológico y tiempo térmico
Varios de los estimadores que caracterizan el crecimiento (RGR, NAR, RLAE y RLA) llevan en su denominador la variable tiempo. Lo más común es expresar el tiempo en días o en alguna otra medida cronológica; no obstante, en ciertos casos es necesario el empleo del tiempo térmico como unidad (Wang, 1960). Una situación en la que es obvia esta necesidad es cuando se quiere evaluar el efecto de cierto tratamiento sobre un parámetro de crecimiento comparando diferentes años o localidades (asumiendo, desde ya, que las condiciones de suelo y otros factores ambientales y de manejo sean similares) (Tei et al., 1996; Jenni et al., 2000; Boschi et al., 2004; Coro et al., 2014). Pero también se puede dar esta necesidad aun en tratamientos aplicados en simultáneo. Dado que los cultivos intensivos suelen desarrollarse bajo condiciones ambientales solo parcialmente controladas (salvo en experimentos, o en algunas producciones hidropónicas), la temperatura diaria suele ser variable. Por ese motivo, si un tratamiento influye sobre la tasa de aparición de hojas (RLA) como, por ejemplo, niveles hídricos o aplicaciones de hormonas (Savvides et al. 2014; Di Benedetto et al., 2013, 2015a, b; De Lojo y Di Benedetto, 2014; Di Matteo et al., 2015), puede resultar que el ambiente bajo el cual se desarrollan las plantas tratadas difiera en la temperatura media respecto del testigo, porque se adicionarían o restarían días, que pueden ser particularmente fríos o cálidos, para llegar a un mismo estadio de desarrollo. También puede ocurrir que la aplicación del tratamiento per se afecte colateralmente la temperatura media (un caso típico es lo que ocurre cuando se comparan niveles de radiación lumínica). En todos estos casos, el empleo del tiempo térmico como base permite separar los efectos del tratamiento sobre la temperatura media de aquellos provocados estrictamente por la aplicación del tratamiento para evaluar (Machado et al., 2004).
Para estimar la acumulación de biomasa vegetal a través de la metodología de tiempo térmico deben definirse fases de desarrollo separadas por eventos específicos y visualmente observables (Dambreville et al., 2015). La metodología de sumatoria de temperaturas (Thornley y Johnson, 1990) requiere el cálculo de la temperatura base (tb) para cada fase de desarrollo. Para hacerlo se grafican las tasas de desarrollo (p, día-1) en función de la temperatura media (Ts).
![]()
La intercepción de Ts sobre el eje x de esta ecuación constituye la temperatura base, que se obtiene resolviendo la anterior ecuación para p=0.
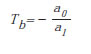
El cálculo de las unidades térmicas para completar cada fase de desarrollo se calcula sumando las temperaturas diarias disponibles por encima de la tb:
![]()
D: Unidades térmicas (°C día-1), Tb: temperatura base; Δts es la duración del evento j (días).
El crecimiento proporcional de los órganos
Cuando se analiza el modelo de crecimiento de una planta o el efecto de diferentes tratamientos sobre dicho modelo es importante cuantificar cómo se distribuyen los fotoasimilados entre diferentes órganos (Shipley y Meziane, 2002; Niklas, 2004; Makarieva et al., 2008; Robinson et al., 2010; Renton y Poorter, 2011; Poorter et al., 2012b); para ello existen varias aproximaciones, que podemos agrupar en dos tipos principales: cálculos de proporciones (ratios) de pesos y/o áreas entre distintos órganos y cálculos de alometrías.
Proporciones o ratios
Ya hemos mencionado dos herramientas matemáticas, que son esenciales para el análisis de crecimiento clásico: LAR y LWR, pero existen además otras medidas, de uso muy frecuente.
a. relación raíz: parte aérea (R: S, del inglés root: shoot ratio) a partir de los pesos de raíces, tallos, pecíolos y hojas (Hunt, 2003; Albacete et al., 2008; Bozokalfa, 2008).
b. relación parte aérea: raíz (S: R, del inglés shoot: root ratio) es la inversa de la anterior; es empleada en ciertas ocasiones (Schwarz et al., 2002; Kang y van Iersel, 2004; Xu et al., 2004; Al-Maskri et al., 2010; He et al., 2010).
c. proporción de raíz (RMF) (por sus iniciales en inglés "root mass fraction") representa la relación entre la biomasa del sistema radical y la biomasa total de la planta (Poorter et al., 2010; 2012a). Se expresa en g (raíz) g-1 (planta).
d. proporción de parte aérea (LMF) (por sus iniciales en inglés "leaf mass fraction") cuantifica la relación entre la biomasa de la parte aérea y la biomasa total de la planta (Poorter, 2002; Poorter et al., 2009; Poorter y Sack, 2012; Poorter et al., 2014). Se expresa en g (parte aérea) g-1 (planta).
En general, las proporciones de peso entre los diferentes órganos cambian durante la ontogenia. Lo que se está cuantificando cuando se pesa un órgano en un determinado momento es el resultado de la distribución del carbono en etapas previas y no necesariamente indica cómo está siendo particionado el carbono al momento de la medición. Por ejemplo, al germinar una semilla, el primer órgano que se desarrolla es la raíz. Sin embargo, hacia el final de su ciclo de vida de la planta, las raíces generalmente crecen muy poco. Por este motivo, la relación raíz: parte aérea puede mostrar valores muy superiores a la unidad en etapas tempranas, aun cuando el carbono se esté particionando preferentemente hacia la parte aérea. En consecuencia, las proporciones dan idea de la situación en un instante dado, pero no su proyección en el tiempo. Por el contrario, los cálculos de alometría brindan una medida de los cambios relativos en las proporciones entre distintos órganos y, por lo tanto, pueden usarse para dimensionar la partición del carbono entre órganos. La elección de una u otra de estas relaciones debe ser tomada teniendo en cuenta qué es lo que se pretende describir. En primer lugar, la relación raíz: parte aérea y su inversa, la relación parte aérea: raíz, son útiles para caracterizar el equilibrio funcional de la planta en sus intercambios con el ambiente aéreo y subterráneo (Brouwer, 1983; Kang y van Iersel, 2004). Pero si se las quiere usar para estimar partición, presentan un problema adicional (al de la instantaneidad ya mencionada), puesto que pequeños cambios en la asignación del carbono llevan a grandes cambios en estas relaciones. Por ejemplo, en la relación raíz: parte aérea, si disminuye la asignación de carbono a la raíz (numerador), ese mismo carbono se asigna al tallo (denominador), magnificando el efecto sobre dicha relación. Justamente para evitar este problema se desarrollaron las relaciones RMF y SMF, en las que el denominador es el peso total de la planta (Poorter et al., 2012b). Sin embargo, estas relaciones tienen a su vez la dificultad de que pequeños cambios en ellas pueden representar grandes modificaciones en el equilibrio funcional de la planta, Por ejemplo, si una SMF inicial de 0,5 (que significa igualdad de peso entre tallo y raíz) disminuyera un 20%, es decir, a 0,4 (representando 0,4 partes de tallo y 0,6 de raíz), la relación raíz: parte aérea estaría aumentando un 50%, de 1 a 1,5.
Una complicación adicional de SMF y RMF radica en que están dadas en peso seco, a diferencia de la relación raíz: parte aérea, que pueden expresarse tanto en peso seco como en peso fresco. Dado que en general los contenidos de materia seca de las raíces suelen ser mucho menores que los de la parte aérea (González et al., 2009), un cambio en la partición del carbono hacia la raíz generalmente determina un cambio mucho mayor en la proporción de los órganos aéreos, medidos en términos de peso fresco. Finalmente, es útil tener en cuenta que la relación raíz: parte aérea también puede expresarse en términos de áreas expuestas al ambiente, lo que generalmente les otorga una mayor significancia ecofisiológica. Para esto es menester determinar la superficie radical, lo cual puede hacerse empleando métodos químicos sencillos como el de la adsorción de ácido clorhídrico (Equiza et al., 2001; Equiza y Tognetti, 2002), o bien utilizando programas de análisis de imágenes que calculan la superficie radical a partir del área proyectada de una imagen digital del sistema radical tomada por un escáner (por ejemplo, el programa WinRhizoTM). También es posible usar imágenes de resonancia magnética no destructivas para cuantificar el desarrollo de la raíz a partir de las deformaciones de la rizósfera y las interfaces generadas por la tasa de expansión celular en diferentes especies tales como arveja (Bengough et al., 2011) y remolacha (Poorter et al., 2012a).
Alometrías y otros coeficientes de partición
Los coeficientes alométricos cuantifican la distribución de la biomasa entre diferentes órganos de la planta. Se expresan como la pendiente de la ecuación que representa la biomasa (o el logaritmo natural de la biomasa) de un órgano vs. la de otro. En la mayoría de los casos, el uso de logaritmos es necesario para que dicha relación sea lineal. Si bien no aparecen unidades de tiempo en las alometrías, el tiempo se encuentra implícito, ya que para la construcción de los gráficos se requieren puntos muestrales a lo largo del ciclo de vida de la planta. Resultan particularmente útiles cuando aparecen órganos nuevos (por ejemplo tubérculos, bulbos, raíces reservantes o frutos) durante el ciclo de vida. En estos casos, la alometría permite comparar el carbono particionado a este órgano desde el momento que se formó en adelante bajo distintos tratamientos (Li et al., 1996; Niklas, 2004; Niklas et al., 2008; John et al., 2013; Feller et al., 2015).
Como ejemplo de alometrías se pueden mencionar las que relacionan el peso seco de raíces y parte aérea (figura 3A) y aquellas que relacionan el peso seco de hojas y tallos (figura 3B) (McCarthy et al., 2006; McCarthy y Enquist, 2007; Niklas et al., 2009). Con los mismos datos y fechas de muestreo es posible obtener un único valor (el de la pendiente) que caracteriza la partición cuando se utiliza la alometría raíces: parte aérea (figura 4A) mientras que, si se usan los datos directos, la relación raíces: parte aérea disminuye a lo largo del experimento (figura 4B).
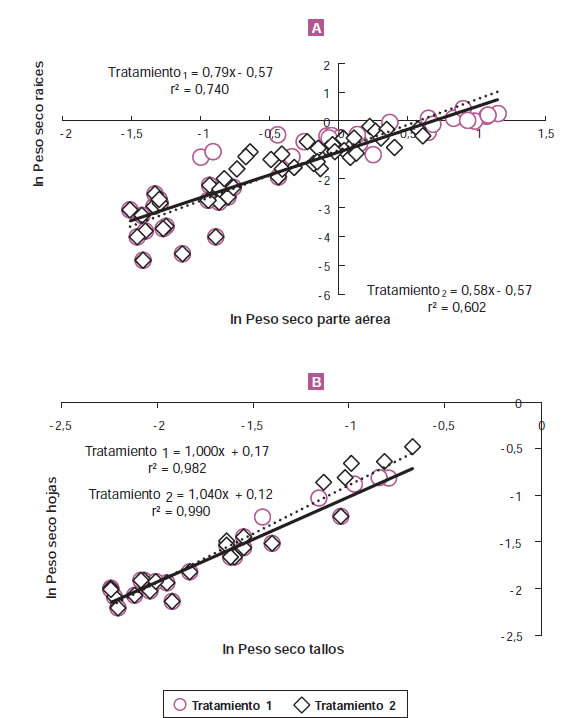
Figura 3. Relaciones alométricas raíz: parte aérea (A) y hojas: tallos (B) a partir de los datos de peso seco para cada parte de la planta (g planta-1) y momento de cosecha para un experimento desarrollado durante 185 días con 5 cosechas parciales sobre plantas de Epipremnun aureum (Di Benedetto et al., 2015a).
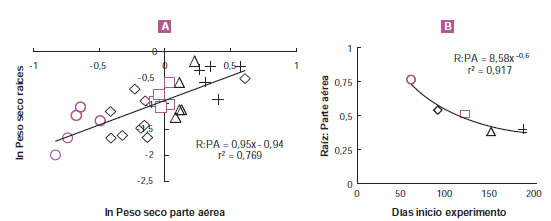
Figura 4. Relaciones alométricas raíz: parte aérea (A) y cambios en la relación parte raíz: parte aérea (B) sobre una base de peso seco para un experimento desarrollado durante 185 días con 5 cosechas parciales (○; □; ◊; Δ; +) sobre plantas de Epipremnun aureum (Di Benedetto et al., 2015a).
Una medida interesante, aunque no muy frecuentemente empleada, consiste en la determinación de la proporción de peso seco destinado a la producción de área foliar. Este es el coeficiente de partición de área foliar (LAP, cm2 día-1/g día-1, por sus iniciales en inglés, "leaf area partitioning") desarrollado por Potter y Jones (1977) con los mismos valores utilizados para calcular NAR y LAR, es decir, las pendientes de las ecuaciones de regresión de RGR y RLAE:
![]()
kw: RGR (días-1); W0: ordenada al origen de la línea de regresión que relaciona el peso seco total en el momento cero del cálculo (g); A0: ordenada al origen de la línea de regresión que relaciona el área foliar total en el momento cero del cálculo (cm2); ka: RLAER (días-1); t: tiempo (en días) en la mitad del período experimental; e: base de los logaritmos naturales. El cálculo de LAP, como una estimación de la partición, se corresponde con la medida instantánea de LAR, la relación entre estas es parecida a lo encontrado entre la alometría raíz: parte aérea y la relación raíz: parte aérea (figura 4A, B).
En tanto las alometrías clásicas, que relacionan los pesos secos de los órganos, dan idea de la partición del carbono entre ellos, también es factible realizar alometrías que relacionen el peso fresco de los órganos, y en este caso los coeficientes alométricos dan idea del crecimiento relativo en volumen de esos órganos. Un ejemplo de estas alometrías, aplicadas a la planta de zanahoria, puede encontrarse en González et al. (2009).
Análisis funcional
Hemos visto que la curva de acumulación de biomasa solo sigue una forma exponencial durante un breve período, al inicio del desarrollo de una planta (u órgano), y que si se considera el ciclo de vida completo, la forma resulta sigmoidea. Este hecho se basa en que la proporción de tejidos meristemáticos, que crecen exponencialmente, disminuye conforme avanza la ontogenia de una planta, haciéndose finalmente muy baja. Por este motivo RGR, que es inicialmente alta, decae rápidamente con la ontogenia, hasta llegar a valores cercanos a cero en plantas adultas y próximas a la senescencia. A su vez, esto implica que el análisis de crecimiento clásico, que hemos visto se basa en el cálculo de RGR y sus componentes a partir de determinaciones espaciadas en el tiempo, y que se adapta muy bien al estudio de plantas que crecen exponencialmente, deje de representar adecuadamente el crecimiento de la planta en situaciones de desarrollo avanzado, a menos que se tomen muestras repetidamente en el tiempo que permitan dar cuenta de estos cambios en RGR.
Sin embargo, la disponibilidad de datos sucesivos en el tiempo permite el ajuste de funciones curvilíneas continuas, en lo que se denomina "análisis funcional" del crecimiento. Desde inicios del siglo xix se han ido desarrollando ecuaciones que permiten modelar la acumulación sigmoidal de la biomasa, cuya aplicación se ha hecho cada vez más frecuente debido a las mayores facilidades computacionales.
Las más empleadas de estas funciones son las polinómicas de diverso grado (Poorter y Lewis, 1986), Gompertz (Gompertz, 1825), Logística (Verhulst, 1838); Monomolecular (Weber, 1891), Richards (Richards, 1959), y la función beta (Yin et al., 2003). A su vez, a cada una de estas funciones se corresponden, por derivación, ecuaciones que representan AGR y RGR (tabla 1). Estas ecuaciones pueden ser a su vez modificadas para ser aplicadas a situaciones particulares. Por ejemplo, para el modelado del crecimiento de frutos que presentan un patrón doble-sigmoideo, como ocurre con las bayas de los arándanos, se ha recurrido a la adición de un término exponencial de tipo polinómico cúbico a las ecuaciones originales de Gompertz, denominado Logística y Monomolecular, con resultados satisfactorios tanto para el ajuste de la acumulación de volumen como para el cálculo de AGR y RGR de estos frutos (Godoy et al., 2008).
Tabla 1. Funciones para calcular las tasas de crecimiento absoluto y relativo de uso frecuente. Se indican los parámetros de los modelos (a, b, c, d), mientras que t indica tiempo o edad (Pommerening y Muszta 2015; Yin et al., 2003).

Si bien existen a priori criterios que pueden emplearse para decidir cuál de estas ecuaciones puede resultar más adecuada para un análisis en particular (por ejemplo, las ecuaciones polinómicas tienden a ser evitadas ya que emplean parámetros que carecen de significado biológico), también es cierto que lo más común es el criterio empírico. Es decir, que se suelen probar distintas funciones, eligiéndose aquella que presente un mejor ajuste a los datos, como por ejemplo, en Godoy et al. (2008) y Wubs et al. (2012) para el modelado de frutos de arándano y pimiento, respectivamente. Existen asimismo varios criterios para evaluar la bondad de ajuste, algunos de los cuales, como el criterio de Akaike, "penalizan" el número excesivo de parámetros (Posada y Rosero Noguera, 2007).
Dado que existe gran interés en encontrar funciones que permitan evaluar el crecimiento de las plantas empleando parámetros que tengan el máximo sentido biológico posible, la investigación sobre el análisis funcional del crecimiento es un área de activa investigación. No obstante, cabe tener en cuenta que más allá de constituir una herramienta que permite la evaluación del crecimiento de un modo continuo, el análisis funcional no deja de ser una generalización de los mismos conceptos del análisis clásico, y por lo tanto no ahondaremos en su estudio. El lector interesado puede, por ejemplo, encontrar un tratamiento más detallado del tema en los trabajos de revisión de Paine et al. (2012) y de Pommerening y Muszta (2015).
Validación estadística
Es posible comparar estadísticamente los coeficientes estimados a partir de regresiones lineales (RLAE, RLA, RGR, NAR, LAR, LAP y las alometrías) de dos formas:
a. si en el experimento se utiliza un diseño estadístico en bloques totalmente aleatorizados es posible calcular cada estimador para cada bloque y luego utilizar un test de análisis de varianzas convencional, en caso de que se cumplan los supuestos para tal fin (Tukey, ANOVA) para calcular la significancia estadística.
b. con el paquete estadístico SMATR (Warton et al., 2012) es posible calcular las diferencias significativas en las ordenadas al origen y la pendiente de las regresiones lineales utilizadas.
c. en ajustes funcionales, el paquete de software R Commander permite el análisis de los parámetros correspondientes a través de la opción GLM (Generalized Linear Models).
Procesos y mecanismos involucrados en las respuestas ecofisiológicas
Los estimadores de crecimiento descriptos precedentemente permiten cuantificar en términos estadísticos los mecanismos ecofisiológicos que determinan la acumulación de biomasa. La figura 5 es solo un esquema conceptual que puntualiza las variables principales asociadas con la acumulación de biomasa aérea y radical. Aunque la oferta agroclimática sobre la planta-cultivo determina la disponibilidad de radiación fotosintéticamente activa y la velocidad de las reacciones bioquímicas, tanto la producción de fotoasimilados como su distribución dentro de la planta son procesos modificados por el funcionamiento endógeno de la planta y que pueden ser adecuadamente cuantificados por los estimadores de crecimiento. La intercepción de la radiación fotosintéticamente activa tiende a aumentar conforme la planta aumenta su área foliar y, en general, su tamaño, a pesar del sombreado de las hojas inferiores por la superiores. La temperatura también puede modificar algunos de los componentes de RGR (Loveys et al., 2002; Medek et al., 2007). Se debe tener en cuenta que cada una de estas variables funciona como una "caja negra" la que puede ser desglosada para describir mecanismos diferentes avanzando desde los procesos principales a sus componentes; tal es el caso de RGR cuando se desdobla en NAR y LAR, en el de NAR cuando se desdobla en LNP y LNCa, o en el de LAR cuando se desdobla en SLA y LWR.
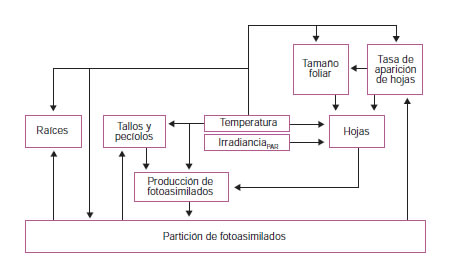
Figura 5. Esquema conceptual que describe las variables principales asociadas con la acumulación de biomasa vegetal.
En principio, la acumulación de biomasa total puede ser cuantificada a través de RGR; sin embargo, cuando se desea caracterizar el proceso de acumulación de fotoasimilados es necesario estimar la tasa fotosintética a través de NAR, y el uso de estos para generar un mecanismo de retroalimentación positiva (RLAE y RLA) (Di Benedetto et al., 2013; 2015a). Un aspecto determinante de la captación de luz y que puede influir sobre RGR es el ritmo de producción y renovación de las hojas. La fenología foliar es parte integrante de la estrategia de captura de luz de las plantas e influye significativamente en la producción del vegetal. Se pueden distinguir dos aspectos bien diferenciados: el ritmo de emergencia de las hojas y la longevidad foliar (vida media de cada hoja individual) (Laclau et al., 2008). Se ha comprobado que la longevidad de la hoja está interrelacionada con su costo de construcción y con su tasa fotosintética máxima (Wright et al., 2004). Así, hojas longevas, costosas y con tasas fotosintéticas generalmente bajas compensan sus altos costos de construcción mediante largos períodos productivos (Pickup et al., 2005; Terashima et al., 2005). A nivel de planta entera, existe una diferencia en el contenido de carbono entre órganos, de forma que las hojas son más costosas que los tallos, en parte debido a su mayor contenido en proteínas (Poorter y Villar, 1997). En las últimas décadas se ha generado una considerable base de datos sobre el costo de construcción, principalmente de hojas, que ha permitido conocer la variación de este entre especies, comparar diferentes grupos funcionales de plantas, contrastar los valores medios de biomasa, o el posible efecto del aumento de dióxido de carbono en la atmósfera sobre el contenido de carbono de las plantas (Poorter et al., 1997; 2006; Poorter y De Jong, 1999).
Dado el carácter dinámico de la acumulación de biomasa, la partición diferencial de fotoasimilados puede verse como un mecanismo controlado por la fuerza del "destino" y que modifica cuantitativamente la figura 5 (Enquist y Niklas, 2002; Enquist et al., 2007). El uso de LAP y las alometrías entre el sistema radical y la parte aérea de la planta o entre las hojas y tallos son un claro ejemplo de ello. NAR es el resultado del balance neto entre las ganancias generadas a través de la fotosíntesis neta y las pérdidas relacionadas con la respiración de hojas, tallos y raíces. No obstante, también intervienen otros factores, tales como la distribución de biomasa a diferentes órganos, la composición química y la formación de área foliar (Poorter, 1989). La partición de fotoasimilados depende de estímulos ambientales (Minchin et al., 1994; Schieving y Poorter, 1999; Linker y Johnson-Rutzke, 2005; Hermans et al., 2006; Grechi et al., 2007) mediados por señales endógenas (Forde, 2002; Gupta y Kaur, 2005), aunque el genotipo tiene una importancia crítica sobre la respuesta esperada.
Contribución de los aspectos morfológicos y fisiológicos a RGR
Al analizar los componentes de la tasa de crecimiento relativo (RGR), podemos conocer la contribución relativa de los aspectos morfológicos (LAR, SLA y LWR) frente a los fisiológicos (NAR), y la variabilidad interespecífica de RGR (Gandolfo et al., 2014; Di Benedetto et al., 2015a; Di Mateo et al., 2015). Si tenemos un conjunto numeroso de especies o de genotipos de una misma especie, podremos calcular regresiones entre sus valores promedio de RGR (considerada como variable dependiente) y sus rasgos morfológicos (por ejemplo SLA o LMF) o actividades fisiológicas (NAR) (como variables independientes) para investigar cuáles son las variables que están asociadas en mayor grado a esas diferencias en la velocidad de crecimiento entre distintas especies (Feng et al., 2007; James y Drenovsky 2007; Milla et al., 2008; Price y Weitz, 2010; Van Kleunen et al. 2010; Westoby et al., 2013).
Cuando se disecciona RGR en sus componentes, existe un acuerdo casi general entre los ecólogos en que el componente morfológico, y en particular el área foliar específica (SLA), es el factor más importante para las plantas herbáceas (Poorter y Remkes, 1990; Poorter et al., 1990; Poorter y Pothmann, 1992; Roche et al., 2004; Leishman et al., 2007) y leñosas (Hoffmann et al., 2005; Marron et al., 2005; Dahlgren et al., 2006; Poorter y Bongers, 2006; Grotkopp y Rejmánek, 2007; Santiago y Wright, 2007; Poorter, 2009; Nouvellon et al., 2010). Este rasgo aparentemente simple de la planta, es decir, el cociente entre la superficie de la hoja y su peso, puede explicar en ocasiones hasta el 80% de la variación en sus tasas de crecimiento. Es interesante notar que el criterio de las diferencias en RGR y en componentes del LAR entre especies podría ser empleado para decidir la conveniencia de la introducción de cultivos hortícolas u ornamentales foráneos que podrían eventualmente convertirse en especies invasivas en su nuevo hábitat (Grotkopp y Rejmanek, 2007; Grotkopp et al., 2010).
Sin embargo, en algunos estudios se ha demostrado que el componente fisiológico (NAR) es importante a la hora de explicar las diferencias en RGR entre especies. En el trabajo con 24 especies leñosas de Villar et al. (2005) se ha encontrado que NAR explica una parte significativa (36%) de la variación de RGR. Para resolver esta aparente contradicción, se ha propuesto (Shipley, 2002, 2005, 2006) que la importancia de NAR sobre RGR puede efectivamente ser muy alta si las condiciones de radiación son intensas. Estos estudios han puesto de manifiesto la importancia de la tasa fotosintética de las hojas sobre el crecimiento de la planta. Cuando la intensidad de radiación es baja, la inversión en enzimas fotosintéticas no se maximiza y las diferencias intrínsecas entre especies, respecto a su capacidad fotosintética, no se expresan. Por tanto, en estas condiciones de baja iluminación cobran mayor importancia relativa la morfología y la arquitectura de la copa, es decir, se maximiza LAR, pero existen limitaciones para maximizar NAR en especies heliófilas al derivarse el nitrógeno foliar hacia la captura de fotones. Se debe tener en cuenta que esta hipótesis es válida cuando se analizan diferencias entre especies, pero no entre tratamientos que causan cambios en RGR dentro de una misma especie. Por ejemplo, si se reduce la intensidad de la luz, RGR sufrirá una fuerte disminución debido a una brusca caída de NAR, manteniéndose LAR (y SLA y LWR) constante por un cierto tiempo. Por esa razón se deben separar las cuestiones de estrategia evolutiva (especies que son intrínsecamente de alta RGR vs. baja RGR) de los resultados de una condición ambiental o de manejo que hagan cambiar RGR (Gandolfo et al., 2014; Di Benedetto et al., 2013, 2015a, b; Di Mateo et al., 2015).
Aunque el uso de los estimadores de crecimiento permite identificar los mecanismos ecofisiológicos involucrados ante cambios en el ambiente o en el manejo cultural, estos deben ser considerados como herramientas y no tomadas como "dogmas" que describen comportamientos generales. Diferentes autores han utilizado los cambios en LAR y específicamente en SLA para describir el comportamiento ecológico de muchas especies; sin embargo, es un error generalizar. Datos recientes muestran que, para especies ornamentales y hortícolas bajo cultivo intensivo (figura 6), los incrementos en RGR en respuesta a cambios en el balance hormonal se encuentran básicamente asociados con aumentos en NAR mientras que LAR es una variable que reduce el valor de RGR, aunque el efecto cualitativo puede ser diferente en Impatiens wallerana (figura 6A) que en Spinacea oleracea (figura 6B). Resultados similares se han encontrado cuando se contrastaron diferencias en irradiancias (Di Benedetto et al. 2013, 2015a), tamaño de celdas pretrasplante (Di Benedetto y Pagani, 2013; Gandolfo et al., 2014) y la calidad del sustrato (Pagani et al., 2015).
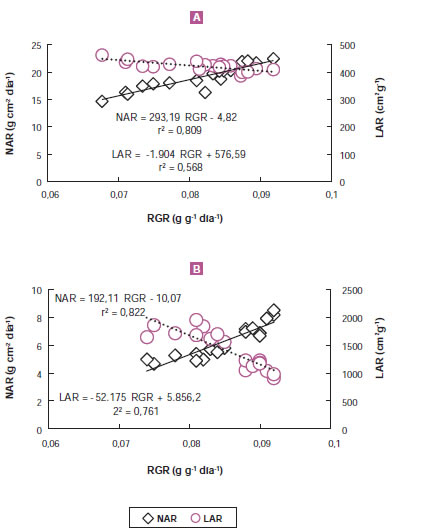
Figura 6. Cambios en NAR y LAR en función de RGR para dos especies umbrófilas facultativas bajo cultivo intensivo. A: Impatiens wallerana L. (Gandolfo et al., 2014) y Spinacea oleracea L. (Di Matteo et al., 2015).
El ambiente y las condiciones de manejo pueden tener un elevado impacto sobre RGR. No obstante, la contribución relativa de los cambios en NAR, LAR, LWR y SLA sobre RGR puede variar mucho según cuál sea el factor ambiental considerado. La tabla 2 muestra el efecto de un incremento en la irradiancia, la temperatura, la concentración de dióxido de carbono, el suministro de nitrógeno y el asperjado con citocininas o auxinas sobre los principales estimadores de crecimiento (RGR, NAR, LAR y SLA). Como puede verse, existen condiciones que impulsan un aumento de RGR a través de incrementos simultáneos en NAR y en LAR mientras que otras condiciones causan incrementos en RGR fundamentalmente a través de un mayor NAR, aun a pesar de pequeñas disminuciones en los componentes morfológicos.
Tabla 2. Efecto relativo de un incremento en diversos factores sobre la respuesta de los principales estimadores de crecimiento que definen la acumulación de biomasa en especies hortícolas y ornamentales. El grosor de las flechas es una indicación del efecto relativo de cada factor ambiental sobre los diferentes estimadores de crecimiento.
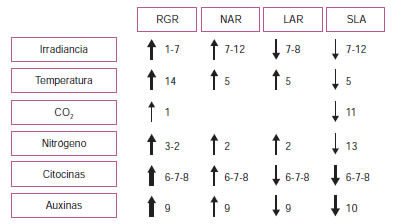
1Alscher et al. (2001) (lechuga); 2Ballio et al. (2007) (pimiento, berenjena); 3 Bennincasa et al. (2011) (lechuga, pimiento, tomate); 4 Coro et al. (2015) (lechuga); 5 De Swart et al. (2006) (pimiento); 6 Di Matteo et al. (2015) (espinaca); 7 Di Benedetto et al., (2013) (potus); 8 Di Benedetto et al., (2015a) (potus); 9 Di Benedetto et al. (2015b) (potus); 10 Di Benedetto et al. (inédito) (alegría del hogar); 11 Poorter (1993); 12Sirtautas et al. (2014) (lechuga); 13 Soundy y Cantliffe (2001) (lechuga); 14 van der Ploeg y Heuvelink (2005) (tomate).
NAR y tasa fotosintética
La tasa fotosintética es, sin duda, la fuerza motriz de la acumulación de biomasa. Su determinación requiere de costosos equipos tales como el LI-6200 (LI-COR Inc., EUA), aunque existen algunos recaudos para tener en cuenta cuando se utilizan (Long y Bernacchi, 2003) Dado que se ha encontrado una relación positiva entre tasa fotosintética y NAR (Poorter y van der Werf, 1998; figura 7A) es posible utilizar esta última como una estimación aceptable. Las figuras 7B y 7C muestran también que, en plantas de la especie ornamental Epipremnum aureum, la tasa fotosintética depende del espesor foliar (puede ser estimado a partir del SLA) y de la distribución de espacios intercelulares. Se debe tener en cuenta que es necesaria una medición independiente de la tasa fotosintética porque, cuando se estima NAR, cualquier error en una determinación de área foliar repercute simultáneamente tanto sobre esta como sobre LAR, de modo que una compensa a la otra, manteniéndose el valor de RGR. SLA no necesariamente explica el espesor foliar debido a que pueden presentarse variaciones en el porcentaje de espacios que, a su vez, afectan la fijación del carbono en la planta. Gandolfo et al., (2014) y Di Matteo et al., (2015) han mostrado una falta de respuesta de LAR, pero cambios en diferentes atributos de la lámina foliar tales como el espesor foliar y la proporción de espacios intercelulares que disminuyen las resistencias a la difusión del dióxido de carbono entre la cámara subestomática y el sitio de carboxilación en los cloroplastos, lo que podría contribuir al aumento en NAR (figura 8A y B). De la misma manera, a pesar de que las relaciones cualitativas son positivas entre diferentes especies, es posible encontrar variaciones cuantitativas entre ellas. El tamaño de las plantas al inicio del experimento es una fuente de variación para tener en cuenta (Liu et al., 2010).
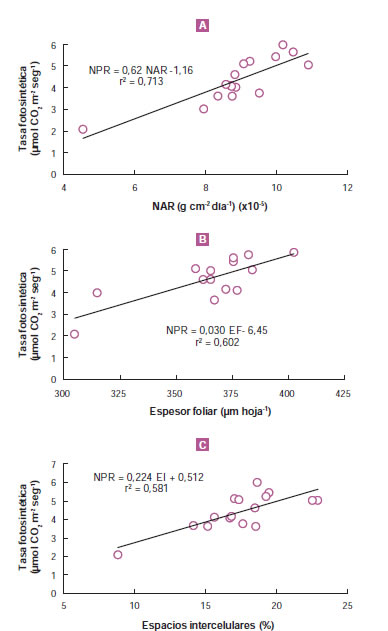
Figura 7. Relación entre la tasa fotosintética neta (NPR, por sus iniciales en inglés "net photosynthetic rate") y NAR (A), el espesor foliar (B) y la proporción de espacios intercelulares (C) en una especie umbrófila (Epipremnum aureum) (Di Benedetto et al., 2015a).
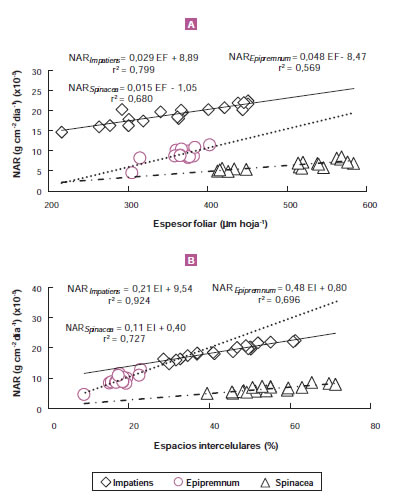
Figura 8. Relación entre la tasa de asimilación neta (NAR) y el espesor foliar (A) o la proporción de espacios intercelulares (B) en tres especies bajo cultivo intensivo: Impatiens wallerana (Gandolfo et al., 2014), Epipremnum aureum (Di Benedetto et al., 2015a) y Spinacea
Se ha encontrado también una relación entre SLA y el suministro de macronutrientes (Gerardeaux et al., 2009), especialmente nitrógento (Evans y Poorter, 2001; White y Scott, 2006). Los nutrientes se consideran actualmente como señales endógenas capaces de modificar el funcionamiento de los ápices de crecimiento (Francis y Halford, 2006; Schachtman y Shin, 2007). De todas formas, el aumento en el contenido de nitrógeno foliar es probable que incremente la concentración de Rubisco y, por lo tanto NAR, más allá de los posibles efectos de señalización.
Crecimiento y productividad a nivel de cultivo
La información anterior se halla asociada al análisis del crecimiento de cada planta individual; sin embargo, cuando se trabaja a nivel de cultivo es común utilizar CGR (tasa de crecimiento del cultivo, g m-2 día-1, por sus iniciales en inglés "crop growth rate" (Hardwick, 1984; Foster et al., 1987; Boroujerdnia y Ansari, 2007), pero teniendo en cuenta que CGR no es equivalente a RGR ya que la primera representa una tasa absoluta mientras que la segunda es una tasa relativa:
![]()
dW: diferencial de peso seco; dt = diferencial de tiempo; S: área de suelo.
CGR puede ser desglosada en dos componentes:
CGR = NAR× LAI
El índice de área foliar (LAI, m2 m-2, por sus iniciales en inglés "leaf area index") es una medida instantánea que relaciona el área de superficie asimiladora (A) por unidad de superficie de suelo (S) (De Pinheiro Enriques y Marcelis, 2000; Scholberg et al., 2000; Li y Stanghellini, 2001; Gimenez et al., 2002; Tei et al., 2002; Martini et al., 2004; Briand et al., 2008; Fallovo et al., 2009; Chatterjee, 2010):
![]()
A medida que aparecen nuevas hojas y se incrementa LAI, las superiores reducen la irradiancia fotosintéticamente activa que reciben las que se encuentran por debajo de ellas. Análogamente, un aumento en la densidad de plantación determina incrementos acelerados en LAI, un más rápido "cierre’ del canopeo y también mayor sombreo de las hojas inferiores. Esto lleva a una disminución de NAR, que va a depender en buena parte de la estructura del canopeo (por ejemplo, la disposición más o menos erecta de las hojas). Esto indica que las dos variables que definen CGR no son independientes entre sí, lo que ciertamente reduce la utilidad de esta aproximación al análisis de crecimiento de cultivos. Un segundo factor importante que también contribuye a restarle utilidad a este tipo de análisis es que la productividad de los cultivos no se encuentra asociada a la acumulación de biomasa total, sino a la proporción que se particiona hacia los órganos de cosecha (Andrade et al., 1999; Mbah y Eke-Okoro; 2015). Por estos motivos, se ha desarrollado una variante del análisis del crecimiento para su empleo en cultivos extensivos, denominado a veces "análisis integrado", que es actualmente preferida sobre el análisis clásico (Hardwick, 1984).
El valor de CGR a nivel de cultivo es función de la radiación incidente y de las eficiencias de intercepción lumínica y de conversión de la radiación interceptada en biomasa. El área foliar de los cultivos y el coeficiente de extinción de la radiación fotosintéticamente activa influyen sobre la radiación fotosintéticamente activa (IPAR) interceptada por el cultivo y están significativamente relacionados con la producción de biomasa y el rendimiento (Bos et al., 2000; Tsubo et al., 2001; Lizaso et al., 2003). En el análisis integrado, en vez de calcularse tasas instantáneas de crecimiento o de asimilación, se estudia la producción de biomasa a lo largo del ciclo de cultivo en relación con la radiación recibida, ya que esta consiste, en definitiva, en el sustrato principal de la fotosíntesis y, por ende, en la acumulación de materia seca. De acuerdo con este análisis, la producción de biomasa de un cultivo depende tanto de la radiación incidente entre emergencia y madurez como de las eficiencias de intercepción lumínica (Eint.) y conversión (Econv.) en biomasa (Andrade et al., 1996) de tal modo que:
![]()
Suponiendo una distribución uniforme del área foliar en el plano horizontal, la IPAR interceptada puede ser calculada a partir de:
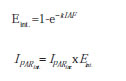
k es el coeficiente de extinción lumínica.
Hay que tener en cuenta que si la distribución de la luz no es uniforme, se afecta la medición del coeficiente de extinción lumínica. La medición de la intensidad de la luz se realiza con células solares de silicio monocristalinas. La firma Li-Cor (Lincoln, NE, EUA) comenzó a fabricar sensores para medir fotones provenientes de la radiación solar en forma puntual; con posterioridad se desarrolló una barra que integra el flujo de fotones recibido en un metro lineal. Matemáticamente la Iinterceptada acumulada a fin del ciclo es la integral de las Iinterceptada diarias y depende, además de LAI, de la arquitectura del cultivo (Maddonni et al., 2001; Anda y Loke, 2005). La radiación interceptada varía durante el ciclo de cultivo y en función de diferentes tratamientos capaces de modificar la producción de biomasa aérea (figura 9), por lo que se aconseja calcular el producto de la radiación interceptada y el porcentaje de intercepción en forma diaria.
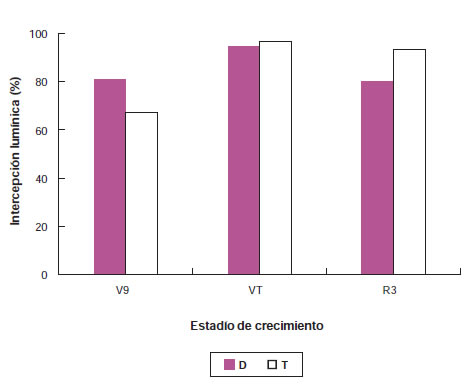
Figura 9. Cambios en la intercepción lumínica entre los estadios V9, VT y R3 en plantas del híbrido de maíz súper dulce ‘Canner’ iniciado por siembra directa (D) o trasplante (T). (Di Benedetto y Rattin, 2008).
Paralelamente, la producción de materia seca está linealmente relacionada con la IPAR interceptada y acumulada. Dicha relación muestra la eficiencia con la que el cultivo convierte la energía lumínica en biomasa vegetal y se denomina eficiencia en el uso de la radiación (RUE, g m2 día-1 MJ-1, por sus iniciales en inglés "radiation use efficiency") (Tei et al., 2002; Lecoeur y Ney, 2003; Cho et al., 2015). Matemáticamente representa el promedio ponderado de las eficiencias de conversión (Econv.) diarias. RUE no es un parámetro muy estable en ambientes contrastantes (Kiniry et al., 1989; Andrade et al., 1992; Sinclaire y Muchow, 1999); todos los factores que modifican la capacidad fotosintética de la planta pueden afectarlo. Modificando el ángulo de las hojas (Duncan et al., 1967), optimizando la distribución de la IPAR (Duncan, 1971), la presencia de hojas erectas en la parte superior y planófilas en la parte inferior del canopeo y aumentando la temperatura (Andrade et al., 1993) se ha logrado incrementar RUE a nivel de cultivo. Los valores de RUE pueden ser significativamente diferentes para muchas especies hortícolas bajo cultivo intensivo (tabla 3). El rendimiento de un cultivo a madurez puede definirse como:
Rendimiento = Biomasa x HI
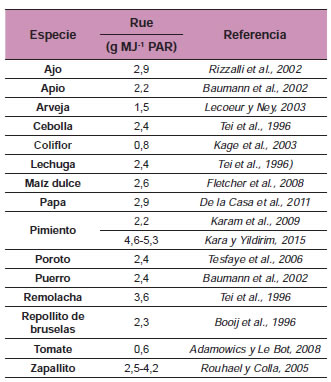
Tabla 3. Valores promedios de RUE (g MJ-1 PAR) para diferentes especies hortícolas.
El índice de cosecha o HI (por sus iniciales en inglés "harvest index") representa el promedio ponderado de las eficiencias de partición diarias y puede definirse como la relación entre el rendimiento del órgano cosechable y la biomasa de la planta (Liu et al., 2004; Ding et al., 2005; Malash et al., 2005; Moriondo et al., 2005; Di Benedetto y Rattin, 2008). Idealmente se calcula sobre la biomasa total de la planta, incluyendo las raíces (HIreal) (Schapaugh y Wilcox, 1980; Walker y Fioritto, 1984). Sin embargo, debido a las dificultades de extracción de raíces, frecuentemente se calcula como la relación entre el rendimiento del órgano cosechado y la biomasa total por encima del nivel del suelo (HIaparente) (Donald y Hamblin, 1976). HI depende del producto cosechado, es mayor en hortalizas de hojas que en frutos o granos y, en general, ha permanecido constante para la mayor parte de las especies bajo cultivo intensivo durante las últimas dos décadas. Sin embargo, a través de prácticas culturales (figura 10) o tratamientos hormonales es posible modificar la partición de fotoasimilados a favor del órgano de cosecha. Como fuera expresado anteriormente, este es un análisis apropiado para evaluar la conversión de radiación en biomasa seca, por lo que no necesariamente es conveniente emplearlo para estudios en especies cuyo producto se comercializa en fresco. Como regla general, podemos decir que el análisis integrado brinda información agronómicamente útil en los casos en que el contenido porcentual de materia seca (DM %) es relativamente poco afectado por condiciones ambientales o de manejo. En general, este es el caso de los bulbos y tubérculos, pero no el de las hortalizas de hoja, que suelen variar ampliamente en la concentración de la materia seca de acuerdo con las condiciones de cultivo, incrementándose generalmente bajo situaciones de estrés. Por ejemplo, como consecuencia de un déficit de N, se han encontrado incrementos en el DM % de más del 25% en lechuga (De Pinheiro Henriques y Marcelis, 2000) y de alrededor del 50% en espinaca y repollo crespo (Lefsrud et al., 2008). Es importante tener en cuenta tales efectos cuando se realiza un análisis integrado en este tipo de hortalizas.
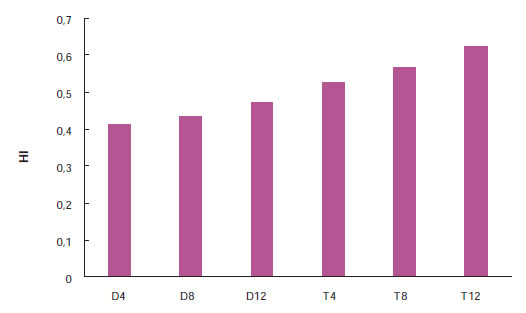
Figura 10. Cambios en HI en función de la densidad de plantación (4, 8 o 12 plantas m-2), la rutina de implantación (D: siembra directa; T: trasplante) en maíz súper dulce ‘Butter Sweet’ en el estadio R3. (Rattin et al., 2015).
CONCLUSIONES
Los métodos de análisis del crecimiento han sido extensamente aplicados a estudios fisiológicos y ecológicos básicos y a cultivos extensivos, pero su empleo en producciones vegetales bajo cultivo intensivo (frutihortícola y ornamental) ha tenido menos difusión. Han contribuido a esta situación, por una parte, las características de muchos cultivos intensivos en los que suele ser de fundamental interés lo que ocurre en etapas vegetativas avanzadas, cuando la planta ha dejado de crecer exponencialmente, lo que dificulta la aplicación de las técnicas de análisis clásico. Y, por otra parte, el hecho de que en este tipo de cultivos, la acumulación de peso fresco suele tener mayor significancia comercial que la del peso seco, lo que dificulta la aplicación tanto del análisis clásico como del análisis integrado, que han sido originalmente desarrollados para estudiar la acumulación de biomasa seca. No obstante, observando ciertas precauciones tratadas en el presente trabajo, estos análisis pueden al menos parcialmente ser extendidos a producciones intensivas.
De la misma forma, en este tipo de cultivos, suele ser importante la evaluación del crecimiento proporcional de órganos. Para esto, pueden determinarse tanto las proporciones de biomasa entre los órganos, como sus relaciones alométricas; las primeras generalmente cambian con la ontogenia mientras que las segundas brindan información acerca de la partición de los fotoasimilados a lo largo del desarrollo. A su vez, los análisis alométricos pueden realizarse tanto en términos de peso fresco como de peso seco, pero ambas formas no son equivalentes, dado que en general los contenidos de materia seca de las distintas partes de la planta suelen ser muy diferentes, por lo que un cambio en la partición del carbono suele determinar un cambio diferente en la proporción de peso fresco entre los distintos órganos. También requiere precaución la aplicación del análisis integrado a los cultivos intensivos, ya que su empleo directo en forma análoga a la habitual en cultivos extensivos para grano no es necesariamente apropiado, especialmente en los casos en que el contenido porcentual de materia seca es afectado por condiciones ambientales o de manejo, como suele ocurrir típicamente en hortalizas de hoja o plantas de follaje ornamental.
Las técnicas de análisis de crecimiento brindan la posibilidad de comparar las respuestas frente a modificaciones del ambiente aéreo y radical, y facilitan cambios en las rutinas de manejo y conducción de cultivos a través de los efectos que estos generan sobre los procesos fisiológicos asociados con la productividad a nivel de planta y cultivo. Constituyen, además, una herramienta que amplía nuestro horizonte de conocimiento agronómico y facilita su difusión. Es por lo tanto deseable una más frecuente aplicación a los estudios sobre cultivos intensivos, más allá de la existencia de aspectos particulares y precauciones a ser tenidos en cuenta, que el presente trabajo de revisión intenta explicitar.
AGRADECIMIENTOS
Los autores expresan su profundo agradecimiento a los Dres. Silvia G. Assuero, Guillermo A. Dosio y Fernando H. Andrade (Unidad Integrada Balcarce, FCA, UNMdP - EEA INTA Balcarce) por su lectura crítica del manuscrito y por las valiosas sugerencias vertidas.
BIBLIOGRAFÍA
1. ADAMOWICZ, S.; LE BOT, J. 2008. Altering young tomato plant growth by nitrate and CO2 preserves the proportionate relation linking long-term organic-nitrogen accumulation to intercepted radiation. New Phytologist 180 (3), 663-672. [ Links ]
2. ADAMS, S.R.; VALDÉS, V.M.; LANGTON, F.A. 2008. Why does low intensity, long-day lighting promote growth in Petunia, Impatiens, and tomato? Journal of Horticultural Science & Biotechnology 83 (5), 609-615. [ Links ]
3. ALBACETE, A.; GHANEM, M.E.; MARTÍNEZ-ANDÚJAR, C.; ACOSTA, M.; SÁNCHEZ-BRAVO, J.; MARTÍNEZ, V.; LUTTS, S.; DODD, I.C.; PÉREZ-ALFOCEA, F. 2008. Hormonal changes in relation to biomass partitioning and shoot growth impairment in salinized tomato (Solanum lycopersicum L.) plants. Journal of Experimental Botany 59 (15), 4119-4131. [ Links ]
4. AL-MASKRI, A.; AL-KHARUSI, L.; AL-MIQBALI, H. 2010. Effects of salinity stress on growth of lettuce (Lactuca sativa) under closedrecycle nutrient film technique. International Journal of Agricultural Biology 12 (3), 377-380. [ Links ]
5. ALSCHER, G.; KRUG, H.; LIEBIG, H.P. 2001. Optimisation of CO2 and temperature control in greenhouse crops by means of growth models at different abstraction levels II. Growth models and parameter generation for lettuce crops. Gartenbauwissenschaft 66 (4), 152-163. [ Links ]
6. ANDA, A.; LOKE, Z. 2005. Radiation balance components of maize hybrids grown at various plant densities. Journal of Agronomy and Crop Science 191 (3), 202-209. [ Links ]
7. ANDRADE, F.H.; UHART, S.A.; ARGUISSAIN, G.G.; RUIZ, R.A. 1992. Radiation use efficiency of maize grown in a cool area. Field Crops Research 28 (4), 345-354. [ Links ]
8. ANDRADE, F.H.; UHART, S.; FRUGONE, M.I. 1993. Intercepted radiation at flowering and kernel number in maize: Shade versus plant density effects. Crop Science 33 (3), 482-485. [ Links ]
9. ANDRADE, F.H.; CIRILO, A.; UHART, S.A.; OTEGUI, M. 1996. Ecofisiología del cultivo de maíz. Editorial La Barrosa. [ Links ]
10. ANDRADE, F.H.; VEGA, C.; UHART, S.; CIRILO, A.; CANTARERO, M.; VALENTINUZ, O. 1999. Kernel number determination in maize. Crop Science 39 (2), 453-459. [ Links ]
11. ANTEN, N.P.R.; POORTER, H. 2009. Carbon balance of the oldest and most-shaded leaves in a vegetation: a litmus test for canopy models. New Phytologist 183 (1), 1-3. [ Links ]
12. BALLIU, A.; BANI, A.; SULÇE, S. 2007. Nitrogen effects on the relative growth rate and its components of pepper (Capsicum annuum) and eggplant (Solanum melongena) seedlings. Acta Horticulturae 747, 257-262. [ Links ]
13. BAUMANN, D.T., BASTIAANS, L., KROPFF, M.J. 2002. Intercropping system optimization for yield, quality, and weed suppression combining mechanistic and descriptive models. Agronomy journal 94 (4), 734-742. [ Links ]
14. BENGOUGH, A.G.; MCKENZIE, B.M.; HALLETT, P.D.; VALENTINE, T.A. 2011. Root elongation, water stress, and mechanical impedance: a review of limiting stresses and beneficial root tip traits. Journal of Experimental Botany 62 (1), 59-68. [ Links ]
15. BENINCASA, P.; GUIDUCCI, M.; TEI, F. 2011. The nitrogen use efficiency: Meaning and sources of variation-case studies on three vegetable crops in central Italy. Horttechnology 21 (3), 266-273. [ Links ]
16. BOOIJ, R.; KREUZER, A.D.H.; SMIT, A.L.; VAN DER WERF, A. 1996. Effect of nitrogen availability on dry matter production, nitrogen uptake and light interception of Brussels sprouts and leeks. Netherlands Journal of Agricultural Science 44 (1), 3-19. [ Links ]
17. BOS H.J.; TIJANI-ENIOLA, H.; STRUIK, P.C. 2000. Morphological analysis on leaf growth of maize: responses to temperature and light intensity. Netherlands Journal of Agricultural Science 48 (2), 181-198. [ Links ]
18. BOSCHI, C.; DI BENEDETTO, A.; PASIAN, C. 2004. Prediction of developmental events on Spathiphyllum floribundum cv. Petite based on air thermal units and photon flux density. Journal of Horticultural Science & Biotechnology 79 (5), 776-782. [ Links ]
19. BOROUJERDNIA, M.; ANSARI, N.A. 2007. Effect of different levels of nitrogen fertilizer and cultivars on growth, yield and yield components of Romaine lettuce (Lactuca sativa L.). Middle Eastern and Russian Journal of Plant Science and Biotechnology 1 (2), 47-53. [ Links ]
20. BOZOKALFA, M.K. 2008. Irrigation temperature effects on seedling growth and transplant quality of tomato, pepper and eggplant. Spanish Journal of Agricultural Research 1, 120-124. [ Links ]
21. BRIAND, B.; DURAND, V.; MERCAT-ROMMENS, C. 2008. Identifying the relationships between agronomic and radioecological variables using a crop model applied to lettuce. Journal of Agronomy 7 (2), 148-155. [ Links ]
22. BROADLEY, M.R.; ESCOBAR-GUTIERREZ, A.J.; BURNS, A.; BURNS, I.G. 2000. What are the effects of nitrogen deficiency on growth components of lettuce? New Phytologist 147 (3), 519-526. [ Links ]
23. BROADLEY, M.R.; SEGINER, I.; BURNS, A.; ESCOBAR-GUTIERREZ, A.J.; BURNS, I.G.; WHITE, P.J. 2003. The nitrogen and nitrate economy of butterhead lettuce (Lactuca sativa var. capitata L.). Journal of Experimental Botany 54 (390), 2081-2090. [ Links ]
24. BROUWER, R. 1983. Functional equilibrium: sense or nonsense? Netherlands Journal of Agricultural Science 31 (4), 335-348. [ Links ]
25. BRUGGINK, G.T. 1992. A comparative analysis of the influence of light on growth of young tomato and carnation plants. Scientia Horticulturae 51 (1-2), 71-81. [ Links ]
26. CHATTERJEE, R. 2010. Physiological attributes of cabbage (Brassica oleracea) as influenced by different sources of nutrients under eastern Himalayan region. Research Journal of Agricultural Sciences, 1 (4): 318-321. [ Links ]
27. CHO, Y.Y.; LEE, J.H.; SHIN, J.H.; SON, J.E. 2015. Development of an expolinear growth model for pak-choi using the radiation integral and planting density. Horticulture, Environment, and Biotechnology 56(3), 310-315. [ Links ]
28. COOKSON, S.J.; VAN LIJSEBETTENS, M.; GRANIER, C. 2005. Correlation between leaf growth variables suggest intrinsic and early controls of leaf size in Arabidopsis thaliana. Plant, Cell and Environment 28 (11), 1355-1366. [ Links ]
29. CORO, M.; ARAKI, A.; RATTIN, J.; MIRAVÉ, P.; DI BENEDETTO, A. 2014. Lettuce and celery responses to both BAP and PBZ related to the plug cell volume. American Journal of Experimental Agriculture 4 (10), 1103-1119. [ Links ]
30. DAHLGREN, J.P.; ERIKSSON, O.; BOLMGREN, K.; STRINDELL, M.; EHRLÉN, J. 2006. Specific leaf area as a superior predictor of changes in field layer abundance during forest succession. Journal of Vegetation Science 17 (5), 577-582. [ Links ]
31. DAMBREVILLE, A.; LAURI, P.É.; NORMAND, F.; GUÉDON, Y. 2015. Analysing growth and development of plants jointly using developmental growth stages. Annals of Botany 115(1), 93-105. [ Links ]
32. DE LA CASA, A.; OVANDO, G.; BRESSANINI, L.; MARTÍNEZ, J.; RODRÍGUEZ, A. 2011. Eficiencia en el uso de la radiación en papa estimada a partir de la cobertura del follaje. Agriscientia 28 (1), 21-30. [ Links ]
33. DEL AMOR, F.M. 2006. Growth, photosynthesis and chlorophyll fluorescence of sweet pepper plants as affected by the cultivation method. Annals of Applied Biology 148 (2), 133-139. [ Links ]
34. DE LOJO, J.; DI BENEDETTO, A. 2014. Biomass accumulation and leaf shape can be modulated by an exogenous spray of 6-benzylaminopurine in the ornamental foliage plant Monstera deliciosa (Liebm.). Journal of Horticultural Science & Biotechnology 89 (2), 136-140. [ Links ]
35. DE PINHEIRO HENRIQUES, A.R.; MARCELIS, L.F.M. 2000. Regulation of growth at steady-state nitrogen nutrition in lettuce (Lactuca sativa L.): Interactive effects of Nitrogen and Irradiance. Annals of Botany 86 (6), 1073-1080. [ Links ]
36. DE SWART, E.A.M.; GROENWOLD, R.; KANNE, H.J.; STAM, P.; MARCELIS, L.F.M.; VOORRIPS,R.E. 2004. Non-destructive estimation of leaf area for different plant ages and accessions of Capsicum annuum L. Journal of Horticultural Science & Biotechnology 79 (5), 764-770. [ Links ]
37. DE SWART, E.A.; MARCELIS, L.F.; VOORRIPS, R.E. 2006. Variation in relative growth rate and growth traits in wild and cultivated Capsicum accessions grown under different temperatures. Journal of Horticultural Science & Biotechnology 81 (6), 1029-1037. [ Links ]
38. DI BENEDETTO, A. 2011. Root restriction and post-transplant effects for bedding pot plants. En: AQUINO, J.C. (Ed.), Ornamental Plants: Types, Cultivation and Nutrition. Nova Science Publishers, Inc. Nueva York, EUA. Capítulo 2: 47-79. [ Links ]
39. DI BENEDETTO, A.; PAGANI, A. 2012. Difficulties and possibilities of alternative substrates for ornamental bedding plants: An ecophysiological approach. En: DRAGUHN, C.; CIARIMBOLI, N. (Eds.), Peat: Formation, Uses and Biological Effects. Nova Science Publishers, Inc. Nueva York, EUA. Capítulo: 1: 1-34. [ Links ]
40. DI BENEDETTO, A.; PAGANI, A. 2013. Dry weight accumulation in the Impatiens walleriana pot plant in responses to different pre-transplant plug cell volume. European Journal of Horticultural Science 78 (2), 76-85. [ Links ]
41. DI BENEDETTO, A.; RATTIN, J. 2008. Transplant in sweet maize: A Tool for improving productivity. The Americas Journal of Plant Science and Biotechnology 2 (2), 96-108. [ Links ]
42. DI BENEDETTO, A.; MOLINARI, J.; BOSCHI, C.; BENEDICTO, D.; CERROTTA, M.; CERROTTA, G. 2006. Estimating crop productivity for three ornamental foliage plants. International Journal of Agricultural Research 1 (6), 522-533. [ Links ]
43. DI BENEDETTO, A., GALMARINI, C.; TOGNETTI, J. 2013. Changes in leaf size and in the rate of leaf production contribute to cytokinin- mediated growth promotion in Epipremnum aureum L. cuttings. Journal of Horticultural Science & Biotechnology 88 (2), 179-186. [ Links ]
44. DI BENEDETTO, A.; GALMARINI, C.; TOGNETTI, J. 2015a. Exogenous cytokinin promotes Epipremun aureum L. growth through enhanced dry weight assimilation rather than through changes in partitioning. American Journal of Experimental Agriculture 5 (5), 419-434. [ Links ]
45. DI BENEDETTO, A.; GALMARINI, C.; TOGNETTI, J. 2015b. Effects of combined or single exogenous auxin and/or cytokinin applications on growth and leaf area development in Epipremnum aureum. Journal of Horticultural Science & Biotechnology 90 (6), 643-654. [ Links ]
46. DI MATEO, J.; RATTIN, J.; DI BENEDETTO, A. 2015. Increase of spinach growth through the use of larger plug cell volume and an exogenous BAP spray. American Journal of Experimental Agriculture 6 (6), 372-383. [ Links ]
47. DING, K.; WANG, K.J.; JIANG, G.M.; LIU, M.Z.; LIU, S.L.; GAO, L.M. 2005. Post-anthesis changes in photosynthetic traits of maize hybrids released in different years. Field Crops Research 93 (1), 108-115. [ Links ]
48. DONALD, C.M.; HAMBLIN, J. 1976. The biological yield and harvest index of cereals as agronomic and plant breeding criteria. Advance in Agronomy 28, 361-411. [ Links ]
49. DUNCAN, W.G. 1971. Leaf angles, leaf area, and canopy photosynthesis. Crop Science 11 (4), 482-485. [ Links ]
50. DUNCAN, W.G.; LOOMIS, R.S.; WILLIAMS, W.A.; HANAU, R. 1967. A model for simulating photosynthesis in plant communities. Hilgardia 38, 181-205. [ Links ]
51. ENQUIST, B.J.; NIKLAS, K.J. 2002. Global allocation rules for patterns of biomass partitioning in seed plants. Science 295 (5559), 1517-1520. [ Links ]
52. ENQUIST, B.J.; KERKHOFF, A.J.; STARK, S.C.; SWENSON, N.G.; MCCARTHY, M.C.; PRICE, C.A. 2007. A general integrative model for scaling plant growth, carbon flux, and functional trait spectra. Nature 449 (7159), 218-222. [ Links ]
53. EQUIZA, M.A.; MIRAVE, J.P.; TOGNETTI, J.A. 2001. Morphological, anatomical and physiological responses related to differential shoot vs. root growth inhibition at low temperature in spring and winter wheat. Annals of Botany 87 (1), 67-76. [ Links ]
54. EQUIZA, M.A.; TOGNETTI, J.A. 2002. Morphological plasticity of spring and winter wheats under changing temperatures. Functional Plant Biology 29 (12), 1427-1436. [ Links ]
55. EVANS, J.R.; POORTER, H. 2001. Photosynthetic acclimation of plants to growth irradiance: the relative importance of specific leaf area and nitrogen partitioning in maximizing carbon gain. Plant, Cell and Environment 24 (8), 755-767. [ Links ]
56. FALLOVO, C.; ROUPHAEL, Y.; CARDARELLI, M.; REA, E.; BATTISTELLI, A.; COLLA, G. 2009. Yield and quality of leafy lettuce in response to nutrient solution composition and growing season. Journal of Food, Agriculture & Environment 7 (2), 456-462. [ Links ]
57. FELLER, C.; FAVRE, P.; JANKA, A.; ZEEMAN, S.C.; GABRIEL, J.P.; REINHARDT, D. 2015. Mathematical modeling of the dynamics of shoot-root interactions and resource partitioning in plant growth. Plos One 10 (7), e0127905. [ Links ]
58. FENG, Y.; WANG, J.; SANG, W. 2007. Biomass allocation, morphology and photosynthesis of invasive and noninvasive exotic species grown at four irradiance levels. Acta Oecologica 31 (1), 40-47. [ Links ]
59. FILHO, B.G.S.; LOBATO, A.K.S.; SILVA, R.B.; SCHIMIDT, D.; COSTA, R.C.L.; ALVES, G.A.R. OLIVEIRA NETO, C.F. 2009. Growth of lettuce (Lactuca Sativa L.) in protected cultivation and open field. Journal of Applied Sciences Research 5 (5), 529-533. [ Links ]
60. FIORANI, F.; BEEMSTER, G.T.S. 2006. Quantitative analyses of cell division in plants. Plant Molecular Biology 60 (6), 963-979. [ Links ]
61. FLEMING, A.J. 2005. Formation of primordia and phyllotaxy. Current Opinion in Plant Biology 8 (1), 53-58. [ Links ]
62. FLEMING, A.J. 2006. Leaf initiation: the integration of growth and cell division. Plant Molecular Biology 60 (6), 905-914. [ Links ]
63. FLETCHER, A.L.; MOOT, D.J.; STONE, P.J. 2008. Radiation use efficiency and leaf photosynthesis of sweet corn in response to phosphorus in a cool temperate environment. European Journal of Agronomy 29 (2), 88-93. [ Links ]
64. FORDE, B.G. 2002. The role of long-distance signalling in plant response to nitrate and other nutrients. Journal of Experimental Botany 53 (366), 39-43. [ Links ]
65. FOSTER, B.M.; PEARCE, R.B.; MCWILLIAMS, M.D. 1987. Greenhouse experiment for teaching crop growth analysis. Journal of Agronomic Education 16, 33-36. [ Links ]
66. FOURCAUD, T.; ZHANG, X.; STOKES, A.; LAMBERS, H.; KÖRNER, C. 2008. Plant growth modelling and applications: The increasing importance of plant architecture in growth models. Annals of Botany 101 (8), 1053-1063. [ Links ]
67. FRANCIS, D.; HALFORD, N.G. 2006. Nutrient sensing in plant meristems. Plant Molecular Biology 60 (6), 981-993. [ Links ]
68. GANDOLFO, E.; DE LOJO, J.; GÓMEZ, D.; PAGANI, A.; MOLINARI, J.; DI BENEDETTO, A. 2014. Anatomical changes involved in the response of Impatiens wallerana to different pre-transplant plug cell volumes and BAP sprays. European Journal of Horticultural Science 79 (4), 226-232. [ Links ]
69. GARY, C.; JONES, J.W.; TCHAMITCHIAN, M. 1998. Crop modelling in horticulture: state of the art. Scientia Horticulturae 74 (1), 3-20. [ Links ]
70. GERARDEAUX, E.; SAUR, E.; CONSTANTIN, J.; PORTÉ, A.; JORDAN-MEILLE, L. 2009. Effect of carbon assimilation on dry weight production and partitioning during vegetative growth. Plant Soil 324 (1-2), 329-343. [ Links ]
71. GHANEM, M.E.; ALBACETE, A.; SMIGOCKI, A.C.; FREBORT, I.; POSPISILOVA, H.; MARTINEZ-ANDUJAR, C.; ACOSTA, M.; SANCHEZ-BRAVO, J.; LUTTS, S.; DODD, I.C.; PEREZ-ALFOCEA, F. 2011. Root-synthesized cytokinins improve shoot growth and fruit yield in salinized tomato (Solanum lycopersicum L.) plants. Journal of Experimental Botany 62 (1), 125-140. [ Links ]
72. GIMENEZ, C.; OTTO, R.F.; CASTILLA, N. 2002. Productivity of leaf and root vegetable crops under direct cover. Scientia Horticulturae 94 (1), 1-11. [ Links ]
73. GODOY, C.; MONTERUBBIANESI, G.; TOGNETTI, J. 2008. Analysis of highbush blueberry (Vaccinium corymbosum L.) fruit growth with exponential mixed models. Scientia Horticulturae 115 (4), 368-376. [ Links ]
74. GOMPERTZ, B. 1825. On the nature of the function expressive of the law of human mortality, and on a new mode of determining the value of life contingencies. Philosophical Transactions Royal Society 115, 513-585. [ Links ]
75. GONZÁLEZ, M.V.; SADRAS, V.O.; EQUIZA, M.A.; TOGNETTI, J.A. 2009. Suboptimal temperature favors reserve formation in biennial carrot (Daucus carota) plants. Physiologia Plantarum 137 (1), 10-21. [ Links ]
76. GRECHI, I.; VIVIN, PH.; HILBERT, G.; MILIN, S.; ROBERT, T.; GAUDILLERE, J.P. 2007. Effect of light and nitrogen supply on internal C:N balance and control of root-to-shoot biomass allocation in grapevine. Environmental and Experimental Botany 59 (2), 139-149. [ Links ]
77. GROTKOPP, E.; REJMÁNEK, M. 2007. High seedling relative growth rate and specific leaf area are traits of invasive species: phylogenetically independent contrasts of woody angiosperms. American Journal of Botany 94 (4), 526-532. [ Links ]
78. GROTKOPP, E.; ERSKINE-OGDEN, J.; REJMANEK, M. 2010. Assessing potential invasiveness of woody horticultural plant species using seedling growth rate traits. Journal of Applied Ecology 47 (6), 1320-1328. [ Links ]
79. GUPTA, A.K.; KAUR, N. 2005. Sugar signalling and gene expression in relation to carbohydrate metabolism under abiotic stresses in plants. Journal of Bioscience 30 (5), 761-776. [ Links ]
80. GWEYI-ONYANGO, J.P.; NEUMANN, G.; ROEMHELD, V. 2009. Effects of different forms of nitrogen on relative growth rate and growth components of tomato (Lycopersicon esculentum Mill.). African Journal of Horticultural Science 2, 43-55. [ Links ]
81. HARDWICK, R.C. 1984. Some recent developments in growth Analysis ― A review. Annals of Botany 54 (6), 807-812. [ Links ]
82. HE, J.; AUSTIN, P.T.; LEE, S.K. 2010. Effects of elevated root zone CO2 and air temperature on photosynthetic gas exchange, nitrate uptake, and total reduced nitrogen content in aeroponically grown lettuce plants. Journal of Experimental Botany 61 (14), 3959-3969. [ Links ]
83. HERMANS, C.; HAMMOND, J.P.; WHITE, P.J.; VERBRUGGEN, N. 2006. How do plants respond to nutrient shortage by biomass allocation? Trends in Plant Science 11 (12), 610-617. [ Links ]
84. HOFFMANN, W.A.; POORTER, H. 2002. Avoiding bias in calculations of relative growth rate. Annals of Botany 90 (1), 37-42. [ Links ]
85. HOFFMANN, W.A.; FRANCO, A.C.; MOREIRA, M.Z.; HARIDASAN, M. 2005. Specific leaf area explains differences in leaf traits between congeneric savanna and forest trees. Functional Ecology 19 (6), 932-940. [ Links ]
86. HUNT, R.; CAUSTON, D.R.; SHIPLEY, B.; ASKEW, A.P. 2002. A modern tool for classical plant growth analysis. Annals of Botany 90 (4), 485-488. [ Links ]
87. HUNT, R. 2003. Growth analysis, individual plants. En: MURPHY, B.T.; MURRAY, D. (Eds.), Encyclopedia of Applied Plant Sciences, 588-596. [ Links ]
88. JAMES, J.J.; DRENOVSKY, R.E. 2007. A basis for relative growth rate differences between native and invasive forb seedlings. Rangeland Ecology Management 60 (4), 395-400. [ Links ]
89. JENNI, S.; BOURGEOIS, G.; LAURENCE, H.; ROY, G.; TREMBLAY, N. 2000. Improving the prediction of processing bean maturity based on the growing-degree day approach. HortScience 35 (7), 1234-1237. [ Links ]
90. JOHN, G.P.; SCOFFONI, C.; SACK, L. 2013. Allometry of cells and tissues within leaves. American Journal of Botany 100 (10), 1936-1948. [ Links ]
91. JOHNSON, H.E.; BROADHURST, D.; GOODACRE, R.; SMITH A.R. 2003: Metabolic fingerprinting of salt-stressed tomatoes. Phytochemistry 62 (6), 919-928. [ Links ]
92. KAGE, H.; KOCHLER, M.; STÜTZEL H. 2000. Root growth of cauliflower (Brassica oleracea L. botrytis) under unstressed conditions. Measurement and modelling. Plant and Soil 223 (1-2), 131-145. [ Links ]
93. KAGE, H.; ALT, C.; STÜTZEL, H. 2003. Aspects of nitrogen use efficiency of cauliflower II. Productivity and nitrogen partitioning as influenced by N supply. Journal of Agricultural Science 141, 17-29. [ Links ]
94. KANG, J.G.; VAN IERSEL, M.W. 2004. Nutrient solution concentration affects shoot:root ratio, leaf area ratio, and growth of subirrigated salvia (Salvia splendens). HortScience 39 (1), 49-54. [ Links ]
95. KARA, O.H.; YILDIRIM, M. 2015. Water and radiation use efficiencies of pepper (Capsicum annuum L. cv. Carliston). School Journal of Agriculture and Veterinary Sciences 2 (2), 87-93. [ Links ]
96. KARAM, F.; MASAAD, R.; BACHOUR, R.; RHAYEM, C.; ROUPHAEL, Y. 2009. Water and radiation use efficiencies in dripirrigated pepper (Capsicum annuum L.): Response to full and deficit irrigation regimes. European Journal of Horticultural Science 74 (2), 79-85. [ Links ]
97. KHAVARI-NEJAD, R.A.; NAJAFI, F.; TOFIGHI, C. 2009. Diverse responses of tomato to N and P deficiency. International Journal of Agricultural Biology 11, 209-213. [ Links ]
98. KINIRY, J.R.; JONES, C.A.; O’TOOLE, J.C.; BLANCHET, R.; CABELGUENE, M.; SPANEL, D.A. 1989. Radiation use efficiency in biomass accumulation prior to grain filling for five grain-crop species. Field Crop Research 20 (1), 51-64.
99. KÖRNER, C. 2015. Paradigm shift in plant growth control. Current Opinion in Plant Biology 25,107-114. [ Links ]
100. LACLAU, J.-P.; ALMEIDA, J.C.R.; GONCALVES, J.L.M.; SAINTANDRÉ, L.; VENTURA, M.; RANGER, J.; MOREIRA, R.M.; NOUVELLON, Y. 2008. Influence of nitrogen and potassium fertilization on leaf lifespan and allocation of above-ground growth in Eucalyptus plantations. Tree Physiology 29 (1), 111-124. [ Links ]
101. LECOEUR, J.; NEY, B. 2003. Change with time in potential radiation- use efficiency in field pea. European Journal of Agronomy 19 (1), 91-105. [ Links ]
102. LEE, B.; YU, S.; JACKSON, D. 2009. Control of plant architecture: The role of phyllotaxy and plastochron. Journal of Plant Biology 52 (4), 277-282. [ Links ]
103. LEFSRUD, M.; KOPSELL, D.; SAMS, C.; WILLS, J.; BOTH, A.J. 2008. Dry matter content and stability of carotenoids in kale and spinach during drying. Hortscience 43 (6), 731-1736. [ Links ]
104. LEISHMAN, M.R.; HASLEHURST, T.; ARES, A.; BARUCH, Z. 2007. Leaf trait relationships of native and invasive plants: community- and global-scale comparisons. New Phytologist 176 (3), 635-643. [ Links ]
105. LI, B.; WATKINSON, A.R.; HARA, T. 1966. Dynamics of competition in populations of carrot (Daucus carota). Annals of Botany 78 (2), 203-214. [ Links ]
106. LI, Y.L.; STANGHELLINI, C. 2001. Analysis of the effect of EC and potential transpiration on vegetative growth of tomato. Scientia Horticulturae 89 (1), 9-21. [ Links ]
107. LINKER, R.; JOHNSON-RUTZKE, C. 2005. Modeling the effect of abrupt changes in nitrogen availability on lettuce growth, root- shoot partitioning and nitrate concentration. Agricultural Systems 86 (2), 166-189. [ Links ]
108. LIU, W.; TOLLENNAR, M.; STEWART, G.; DEEN, W. 2004. Response of corn grain yield to spatial and temporal variability in emergence. Crop Science 44 (3), 847-854. [ Links ]
109. LIU, F.; YANG, W.; WANG, Z.; XU, Z.; LIU, H.; ZHANG, M.; LIU, Y.; AN, S.; SUN, S. 2010. Plant size effects on the relationships among specific leaf area, leaf nutrient content, and photosynthetic capacity in tropical woody species. Acta Oecologica 36 (2), 149- 159. [ Links ]
110. LIZASO, J.I.; BATCHELOR, W.D.; WESTGATE, M.E. 2003. A leaf area model to simulate cultivar-specific expansion and senescence of maize leaves. Field Crops Research 80 (1), 1-17. [ Links ]
111. LONG, S.P.; BERNACCHI, C.J. 2003. Gas exchange measurements, what can they tell us about the underlying limitations to photosynthesis? Procedures and sources of error. Journal of Experimental Botany 54 (392), 2393-2401. [ Links ]
112. LOVEYS, B.R.; SCHEURWATER, I.; PONS, T.L.; FITTER, A.H.; ATKIN, O.K. 2002. Growth temperature influences the underlying components of relative growth rate: an investigation using inherently fast- and slow-growing plant species. Plant, Cell and Environment 25 (8), 975-987. [ Links ]
113. MACHADO, R.M.A.; BUSSIERES, P.; KOUTOS, T.V.; PRIETO, M.H.; HO, L.C. 2004. Prediction of optimal harvest date for processing tomato based on the accumulation of daily heat units over the fruit ripening period. Journal of Horticultural Science & Biotechnology 79 (3), 452-457. [ Links ]
114. MADDONNI, G.A.; OTEGUI, M.E.; CIRILO, A.G. 2001. Plant population density, row spacing and hybrid effects on maize canopy architecture and light attenuation. Field Crop Research 71 (3), 183-193. [ Links ]
115. MAKARIEVA, A.M.; GORSHKOV, V.G.; LI, B.L.; CHOWN, S.L.; REICH, P.B.; GAVRILOV, V.M. 2008. Mean mass-specific metabolic rates are strikingly similar across life’s major domains: Evidence for life’s metabolic optimum. Proceedings of the National Academy USA 105 (44), 16994-16999.
116. MALASH, N.; FLOWERS, T.J.; RAGAB, R. 2005. Effect of irrigation systems and water management practices using saline and non-saline water on tomato production. Agricultural Water Management 78 (1), 25-38. [ Links ]
117. MARCELIS, L.F.M.; HEUVELINK, E.; GOUDRIAAN, J. 1998. Modelling biomass production and yield of horticultural crops: a review. Scientia Horticulturae 74 (1), 83-111. [ Links ]
118. MARRON, N.; VILLAR, M.; DREYER, E.; DELAY, D.; BOUDOURESQUE, E.; PETIT, J.M.; DELMOTTE, F.M.; GUEHL, J.M.; BRIG-NOLAS, F. 2005. Diversity of leaf traits related to productivity in 31 Populus deltoides x Populus nigra clones. Tree Physiology 25 (4), 425-435. [ Links ]
119. MARTINI, E.A.; JEFFREY, S.; BUYER, S.; BRYANT, D.C.; HARTZ, T.K.; DENISON, R.F. 2004. Yield increases during the organic transition: improving soil quality or increasing experience? Field Crops Research 86 (2), 255-266. [ Links ]
120. MBAH, E.U.; EKE-OKORO, O. 2015. Relationship between some growth parameters, dry matter content and yield of some sweet potato genotypes grown under rainfed weathered Ultisols in the humid tropics. Journal of Agronomy 14(3), 121-130. [ Links ]
121. MCCARTHY, M.C.; ENQUIST, B.J. 2007. Consistency between an allometric approach and optimal partitioning theory in global patterns of plant biomass allocation. Functional Ecology 21 (4), 713-720. [ Links ]
122. MCCARTHY, H.R.; OREN, R.; FINZI, A.C.; JOHNSEN, K.H. 2006. Canopy leaf area constrains [CO2]-induced enhancement of productivity and partitioning among aboveground carbon pools. Proceedings of the National Academy USA 103 (51), 19356-19361. [ Links ]
123. MEDEK, D.E.; BALL, M.C.; SCHORTEMEYER, M. 2007. Relative contributions of leaf area ratio and net assimilation rate to change in growth rate depend on growth temperature: comparative analysis of subantarctic and alpine grasses. New Phytologist 175 (2), 290-300. [ Links ]
124. MEDIAVILLA, S.; ESCUDERO, A.; HEILMEIER, H. 2001. Internal leaf anatomy and photosynthetic resource-use efficiency: interspecific and intraspecific comparisons. Tree Physiology 21 (4), 251-259. [ Links ]
125. MILLA, R.; REICH, P.B.; NIINEMETS, Ü.; CASTRO-DÍEZ, P. 2008. Environmental and developmental controls on specific leaf area are little modified by leaf allometry. Functional Ecology 22 (4), 565-576. [ Links ]
126. MINCHIN, P.E.H.; THORPE, M.R. 1996. What determines carbon partitioning between competing sinks? Journal of Experimental Botany 47, 1293-1296. [ Links ]
127. MINCHIN, P.E.H.; THORPE, M.R.; FARRAR, J.F. 1994. Shortterm control of root: shoot partitioning. Journal of Experimental Botany 45 (5), 615-622. [ Links ]
128. MOKHTARPOUR, H.; THE, C.B.S.; SALEH, G.; SELAMAT, A.B; ASADI, M.E.; KAMKAR, B. 2010. Non-destructive estimation of maize leaf area, fresh weight, and dry weight using leaf length and leaf width. Communications in Biometry and Crop Science 5 (1), 19-26. [ Links ]
129. MORIONDO, M.; BINDI, M.; SINCLAIR, T. 2005. Analysis of Solanaceae species harvest-organ growth by linear increase in harvest index and harvest-organ growth rate. Journal of the American Society for Horticultural Science 130 (6), 799-805. [ Links ]
130. NIINEMETS, Ü; TENHUNEN, J.D. 1997. A model separating leaf structural and physiological effects on carbon gain along light gradients for the shade-tolerant species Acer saccharum. Plant, Cell and Environment 20 (7), 845-866. [ Links ]
131. NIKLAS, K.J. 2004. Plant allometry: is there a grand unifying theory? Biological Review 79 (4), 871-889. [ Links ]
132. NIKLAS, K.J.; DE MASON, D.A.; COBB, E.D. 2008. Genetic effects on the biomass partitioning and growth of Pisum and Lycopersicon. American Journal of Botany 95 (4), 424-433. [ Links ]
133. NIKLAS, K.J.; COBB, E.D.; SPATZ, H.C. 2009. Predicting the allometry of leaf surface area and dry mass. American Journal of Botany 96 (2), 531-536. [ Links ]
134. NOUVELLON, Y. LACLAU, J.P.; EPRON, D.; KINANA, A.; MABIALA, A.; ROUPSARD, O.; BONNEFOND, J.M.; MAIRE, G.L.; MARSDEN, C.; BONTEMPS, J.D.; SAINT-ANDRE, L. 2010. Within-stand and seasonal variations of specific leaf area in a clonal Eucalyptus plantation in the Republic of Congo. Forest Ecology and Management 259 (9), 1796-1807. [ Links ]
135. ORDOÑEZ, J.C.; VAN BODEGOM, P.M.; WITTE, J.P.M.; WRIGHT, I.J.; REICH, P.B.; AERTS, R. 2009. A global study of relationships between leaf traits, climate and soil measures of nutrient fertility. Global Ecology and Biogeography 18 (2), 137-149. [ Links ]
136. ORDÓÑEZ, R. A.; SAVÍN, R.; SLAFER, G.A. 2015. Genetic variation in the critical specific leaf nitrogen-maximizing yield among modern maize hybrids. Field Crops Research 172, 99-105. [ Links ]
137. OSONE, Y.; ISHIDA, A.; TATENO, M. 2008. Correlation between relative growth rate and specific leaf area requires associations of specific leaf area with nitrogen absorption rate of roots. New Phytologist 179 (2), 417-427. [ Links ]
138. PAGANI, A.; MOLINARI, J.; DI BENEDETTO, A. 2013. BAP spray and plastic container responses on Asparagus officinalis L. crown growth. Journal of Life Science 7 (8), 827-835. [ Links ]
139. PAGANI, A.; MOLINARI, J.; LAVADO, R.S.; DI BENEDETTO, A. 2015. Behavior of Impatiens wallerana Hook. F in alternative pot substrates: mechanisms involved and research perspectives. Journal of Plant Nutrition 38 (14), 2135-2203. [ Links ]
140. PAINE, C.E.T.; MARTHEWS, T.R.; VOGT, D.R.; PURVES, D.; REES, M., HECTOR, A.; TURNBULL, L.A. 2012. How to fit nonlinear plant growth models and calculate growth rates: an update for ecologists. Methods in Ecology and Evolution 3 (2), 245-256. [ Links ]
141. PICKUP, M.; WESTOBY, M.; BASDEN, A. 2005. Dry mass costs of deploying leaf area in relation to leaf size. Functional Ecology 19 (1), 88-97. [ Links ]
142. POMMERENING, A.; MUSZTA, A. 2015. Methods of modelling relative growth rate. Forest Ecosystems 2 (1): 5. [ Links ]
143. POORTER, H. 1989. Plant growth analysis: towards a synthesis of the classical and the functional approach. Physiologia Plantarum 75 (3), 237-244. [ Links ]
144. POORTER, H. 1993. Interspecific variation in the growth response of plants to an elevated ambient CO2 concentration. Vegetatio 104 (1), 77-97. [ Links ]
145. POORTER, H. 2002. Plant growth and carbon economy. En: Encyclopedia of life science, Macmillan Publishers Ltd, Nature Publishing Group. [ Links ]
146. POORTER, L. 2009. Leaf traits show different relationships with shade tolerance in moist versus dry tropical forests. New Phytologist 181 (4), 890-900. [ Links ]
147. POORTER, L.; BONGERS, F. 2006. Leaf traits are good predictors of plant performance across 53 rain forest species. Ecology 87 (7), 1733-1743. [ Links ]
148. POORTER, H.; DE JONG, R. 1999, A comparison of specific leaf area, chemical composition and leaf construction costs of field plants from 15 habitats differing in productivity. New Phytologist 143 (1), 163-176. [ Links ]
149. POORTER, H.; GARNIER, E. 1996, Plant growth analysis: an evaluation of experimental design and computational methods. Journal of Experimental Botany 47 (9), 1343-1351. [ Links ]
150. POORTER, H.; LAMBERS, H. 1991. Is interspecific variation in relative growth rate positively correlated with biomass allocation to the leaves? The American Naturalist 138 (5), 1264-1268. [ Links ]
151. POORTER, H.; LEWIS, C. 1986. Testing differences in relative growth rate: A method-avoiding curve fitting and pairing. Physiologia Plantarum 67 (2), 223-226. [ Links ]
152. POORTER, H.; POTHMANN, P. 1992. Growth and carbon economy of a fast-growing and a slow-growing grass species as dependent on ontogeny. New Phytologist 120 (1), 159-166. [ Links ]
153. POORTER, H.; REMKES, C. 1990. Leaf area ratio and net assimilation rate of 24 wild species differing in relative growth rate. Oecologia, 83 (4): 553-559. [ Links ]
154. POORTER, H.; SACK, L. 2012. Pitfalls and possibilities in the analysis of biomass allocation patterns in plants. Frontiers in Plant Science, 3 (259): 1-10. [ Links ]
155. POORTER, H.; VILLAR, R. 1997. The fate of acquired carbon in plants: chemical composition and construction costs. En: BAZZAZ, F.A.; GRACE, J. (Eds.). Resource allocation in plants. Academic Press, San Diego, EUA, 39-72. [ Links ]
156. POORTER, H.; VAN DER WERF, A. 1998. Is inherent variation in RGR determined by LAR at low irradiance and by NAR at high irradiance? A review of herbaceous species. En: Inherent variation in plant growth. Physiological mechanisms and ecological consequences. Leiden, the Netherlands: Backhuys Publishers, 309-336. [ Links ]
157. POORTER, H.; REMKES, C.; LAMBERS, H. 1990. Carbon and nitrogen economy of 24 wild species differing in relative growth rate. Plant Physiology 94 (2), 621-627. [ Links ]
158. POORTER, H.; VAN BERKEL, Y.; BAXTER, R.; DEN HERTOG, J.; DIJSTRA, P.; GIFFORD, R.M.; GRIFFIN, K.L.; ROUMET, C.; ROY, J.; WONG, S.C. 1997. The effect of elevated CO2 on the chemical composition and construction costs of leaves of 27 C3 species. Plant, Cell and Environment 20 (4), 472-482. [ Links ]
159. POORTER, H.; PEPIN, S.; RIJKERS, T.; DE JONG, Y.; EVANS, J.R.; KÖRNER, C. 2006. Construction costs, chemical composition and payback time of high- and low-irradiance leaves. Journal of Experimental Botany 57 (2), 355-371. [ Links ]
160. POORTER, H.; NIINEMETS, Ü.; POORTER, L.; WRIGHT, I.J.; VILLAR, R. 2009. Causes and consequences of variation in leaf mass per area (LMA): a meta-analysis. New Phytologist 182 (3), 565-588. [ Links ]
161. POORTER, H.; NIINEMETS, Ü.; WALTER, A.; FIORANI, F.; SCHURR, U. 2010. A method to construct dose-response curves for a wide range of environmental factors and plant traits by means of a meta-analysis of phenotypic data. Journal of Experimental Botany 61 (8), 2043-2055. [ Links ]
162. POORTER, H.; BÜHLER, J.; VAN DUSSCHOTEN, D.; CLIMENT, J.; POSTMA, J.A. 2012a. Pot size matters: a meta-analysis of the effects of rooting volume on plant growth. Functional Plant Biology 39 (11), 839-850. [ Links ]
163. POORTER, H.; NIKLAS, K.J.; REICH, P.B.; OLEKSYN, J.; POOT, P.; MOMMER, L. 2012b. Biomass allocation to leaves, stems and roots: meta-analyses of interspecific variation and environmental control. New Phytologist 193 (1), 30-50. [ Links ]
164. POORTER, H.; LAMBERS, H.; EVANS, J.R. 2014. Trait correlation networks: a whole-plant perspective on the recently criticized leaf economic spectrum. New Phytologist 201 (2), 378-382. [ Links ]
165. POSADA, S.L.; ROSERO NOGUERA, R. 2007. Comparación de modelos matemáticos: una aplicación en la evaluación de alimentos para animales. Revista Colombiana de Ciencias Pecuarias 20, 141-148. [ Links ]
166. POTTER. J.R.; JONES, J.W. 1977. Leaf area partitioning as an important factor in growth. Plant Physiology 59 (1), 10-14. [ Links ]
167. PRICE, C.A.; WEITZ, J.S. 2012. Zero-sum allocational strategies determine the allometry of specific leaf area. American Journal of Botany 97 (11), 1808-1815. [ Links ]
168. RATTIN, J.; VALINOTE, J.P.; GONZALO, R.; DI BENEDETTO, A. 2015. Transplant and a change in plant density improve sweet maize (Zea mays L.) yield. American Journal of Experimental Agriculture 5 (4), 336-351. [ Links ]
169. RENTON, M.; POORTER, H. 2011. Using log-log scaling slope analysis for determining the contributions to variability in biological variables such as leaf mass per area: why it works, when it works and how it can be extended. New Phytologist 190 (1), 5-8. [ Links ]
170. RICHARDS, F.J. 1959. A flexible growth function for empirical use. Journal of Experimental Botany 10 (2), 290-300 [ Links ]
171. RIZZALLI, R.H.; VILLALOBOS, F.J.; ORGAZ, F. 2002. Radiation interception, radiation-use efficiency and dry matter partitioning in garlic (Allium sativum L.). European Journal of Agronomy 18 (1), 33-43. [ Links ]
172. ROBINSON, D.; DAVIDSON, H.; TRINDER, C.; BROOKER, R. 2010. Root-shoot growth responses during interspecific competition quantified using allometric modelling. Annals of Botany 106, 921-926. [ Links ]
173. ROUPHAEL, Y.; COLLA, G. 2005. Radiation and water use efficiencies of greenhouse zucchini squash in relation to different climate parameters. European Journal of Agronomy 23 (2), 183-194. [ Links ]
174. ROWELL, D.L. 2014. Soil Science: Methods and Applications. Routledge, Nueva York, EUA. [ Links ]
175. ROCHE, P.; DÍAZ-BURLINSON, N.; GACHET, S. 2004. Congruency analysis of species ranking based on leaf traits: which traits are the more reliable? Plant Ecology 174 (1), 37-48. [ Links ]
176. SANTIAGO, L.S.; WRIGHT, S.J. 2007. Leaf functional traits of tropical forest plants in relation to growth form. Functional Ecology 21 (1), 19-27. [ Links ]
177. SAVVIDES, A.; NTAGKAS, N.; IEPEREN, W.; VAN DIELEMAN, J.A.; MARCELIS, L.F.M. 2014. Impact of light on leaf initiation: a matter of photosynthate availability in the apical bud? Functional Plant Biology 41 (5), 547-556. [ Links ]
178. SCHACHTMAN, D.P.; SHIN, R. 2007. Nutrient sensing and signaling: NPKS. Annual Review of Plant Biology 58, 47-69. [ Links ]
179. SCHAPAUGH, W. T.; WILCOX, J. R. 1980. Relationships between gravest indices and other plant characteristics in soybean. Crop Science 20, 529-533. [ Links ]
180. SCHIEVING, F.; POORTER, H. 1999. Carbon gain in a multispecies canopy: the role of specific leaf area and photosynthetic nitrogen-use efficiency in the tragedy of the commons. New Phytologist 143 (1), 201-211. [ Links ]
181. SCHOLBERG, J.; MCNEAL, B.L.; JONES, J.W.; BOOTE, K.J.; STANLEY, C.D.; OBREZA, T.A. 2000. Growth and canopy characteristics of field-grown tomato. Agronomy Journal 92 (1), 152-159. [ Links ]
182. SCHWARZ, D.; KLÄRING, H.P.; VAN IERSEL, M.W.; INGRAM, K.T. 2002. Growth and photosynthetic response of tomato to nutrient solution concentration at two light levels. Journal of the American Society for Horticultural Science 127 (6), 984-990. [ Links ]
183. SHIPLEY, B. 2002. Trade-offs between net assimilation rate and specific leaf area in determining relative growth rate: relationship with daily irradiance. Functional Ecology 16 (5), 682-689. [ Links ]
184. SHIPLEY, B. 2006. Net assimilation rate, specific leaf area and leaf mass ratio: which is most closely correlated with relative growth rate? A meta-analysis. Functional Ecology 20 (4), 565-574. [ Links ]
185. SHIPLEY, B.; MEZIANE, D. 2002. The balanced-growth hypothesis and the allometry of leaf and root biomass allocation. Functional Ecology 16 (3), 326-331. [ Links ]
186. SHIPLEY, B.; VILE, D.; GARNIER, E.; WRIGHT, I.J.; POORTER, H. 2005. Functional linkages between leaf traits and net photosynthetic rate: reconciling empirical and mechanistic models. Functional Ecology 19 (4), 602-615. [ Links ]
187. SINCLAIR, R.T.; MUCHOW R.C. 1999. Radiation use efficiency. Advances in Agronomy 65 (21), 215-265. [ Links ]
188. SIRTAUTAS, R.; VIRSILE, A.; SAMUOLIENE, G.; BRAZAITYTE, A.; MILIAUSKIENE, J.; SAKALAUSKIENE, S.; DUCHOVSKIS, P. 2014. Growing of leaf lettuce (Lactuca sativa L.) under highpressure sodium lamps with supplemental blue, cyan and green LEDs. Zemdirbyste-Agriculture 101 (1), 75-78. [ Links ]
189. SOUNDY, P.; CANTLIFFE, D.J. 2001. Improving lettuce transplant quality in response to nitrogen nutrition in a floatation production system. Proceedings Florida State Horticultural Society 114, 294-303. [ Links ]
190. TEI, F.; SCAIFE, A.; AIKMAN, D.P. 1996. Growth of lettuce, onion, and red beet. 1. Growth analysis, light interception, and radiation use efficiency. Annals of Botany 78 (5), 633-643. [ Links ]
191. TEI, F.; BENINCASA, P.; GUIDUCCI, M. 2002. Critical nitrogen concentration in processing tomato. European Journal of Agronomy 18 (1), 45-55. [ Links ]
192. TERASHIMA, I.; ARAYA, T.; MIYAZAWA, S.I.; SONE, K.; YANO, S.S. 2005. Construction and maintenance of the optimal photosynthetic systems of the leaf, herbaceous plant and tree: an ecodevelopmental treatise. Annals of Botany 95 (3), 507-519. [ Links ]
193. TESFAYE, K.; WALKER, S.; TSUBO, M. 2006. Radiation interception and radiation use efficiency of three grain legumes under water deficit conditions in a semi-arid environment. European Journal of Agronomy 25 (1), 60-70. [ Links ]
194. THIBAUD, J.; MC. LOUGHLIN, T.; PAGANI, A.; LAVADO, R.; DI BENEDETTO, A. 2012. Alternative substrates and fertilization routine relationships for bedding pot plants: Impatiens wallerana. European Journal of Horticultural Science 77 (4), 182-191. [ Links ]
195. THORNLEY, J.H.; JOHNSON, I.R. 1990. Plant and crop modelling. A mathematical approach to plant and crop physiology. Clarendon Press, Oxford, Reino Unido. [ Links ]
196. TSUBO, M.; WALKER, S.; MUKHALA, E. 2001. Comparisons of radiation use efficiency of mono-/inter-cropping systems with different row orientations. Field Crops Research 71 (1), 17-29. [ Links ]
197. VAN DER PLOEG, A.; HEUVELINK, E. 2005. Influence of suboptimal temperature on tomato growth and yield: a review. Journal of Horticultural Science & Biotechnology 80 (6), 652-659. [ Links ]
198. VAN IERSEL, M.W. 2003. Carbon use efficiency depends on growth respiration, maintenance respiration, and relative growth rate. A case study with lettuce. Plant, Cell and Environment 26 (9), 1441-1449. [ Links ]
199. VAN KLEUNEN, M.; WEBER, E.; FISCHER, M. 2010. A metaanalysis of trait differences between invasive and non-invasive plant species. Ecology Letters 13 (2), 235-245. [ Links ]
200. VERHULST, P.F. 1838. Notice sur la loi que la population pursuit dans son accroissement [A note on population growth]. Correspondence Mathematiques et Physiques 10,113-121. [ Links ]
201. VILLAR, R.; MARAÑÓN, T.; QUERO, J.L.; PANADERO, P.; ARENAS, F.; LAMBERS, H. 2005. Variation in relative growth rate of 20 Aegilops species (Poaceae) in the field: The importance of net assimilation rate or specific leaf area depends on the time scale. Plant and Soil 272 (1-2), 11-27. [ Links ]
202. WALKER, A.K.; FIORITO, R.J. 1984. Effect of cultivation and plant pattern on yield an apparent harvest index soybean. Crop Science 24, 154-155. [ Links ]
203. WANG, J.Y 1960. A critique of the heat unit approach to plant response studies. Ecology 41 (4), 785-790. [ Links ]
204. WARTON, D.I.; DUURSMA, R.A.; FALSTER, D.S.; TASKINEN, S. 2012. SMATR 3- an R package for estimation and inference about allometric lines. Methods in Ecology and Evolution 3 (2), 257-259. [ Links ]
205. WEBER, R. 1891. Lehrbuch der Forsteinrichtung [Textbook of forest planning]. Springer-Verlag, Berlin. [ Links ]
206. WESTOBY, M.; REICH, P.B.; WRIGHT, I.J. 2013. Understanding ecological variation across species: area-based vs mass-based expression of leaf traits. New Phytologist 199 (2), 322-323. [ Links ]
207. WHITE, J.D.; SCOTT, N.A. 2006. Specific leaf area and nitrogen distribution in New Zealand forests: Species independently respond to intercepted light. Forest Ecology and Management 226 (1), 319-329. [ Links ]
208. WRIGHT, I.J.; REICH, P.B.; WESTOBY, M.; ACKERLY, D.D.; BARUCH, Z.; BONGERS, F.; CAVENDER-BARES, J.; CHAPIN, T.; CORNELISSEN, J.H.C.; DIEMER, M.; FLEXAS, J.; GARNIER, E.; GROOM, P.K.; GULIAS, J.; HIKOSAKA, K.; LAMONT, B.B.; LEE, T.; LEE, W.; LUSK, C.; MIDGLEY, J.J.; NAVAS, M.L.; NIINEMETS, Ü.; OLEKSYN, J.; OSADA, N.; POORTER, H.; POOT, P.; PRIOR, L.; PYANKOV, V.I.; ROUMET, C.; THOMAS, S.C.; TJOELKER, M.G.; VENEKLAAS, E.J.; VILLAR, R. 2004. The world-wide leaf economics spectrum. Nature 428, 821-827. [ Links ]
209. WUBS, A.M.; MA, Y.T.; HEUVELINK, E.; HEMERIK, L.; MARCELIS, L.F.M. 2012. Model selection for nondestructive quantification of fruit growth in pepper. Journal of Horticultural Science & Biotechnology 137 (2), 71-79. [ Links ]
210. XU, G.; LEVKOVITCH, I.; SORIANO, S.; WALLACH, R.; SILBER, A. 2004. Integrated effect of irrigation frequency and phosphorus level on lettuce: P uptake, root growth and yield. Plant and Soil 263 (1), 297-309. [ Links ]
211. YANG, Z.; MIDMORE, D.J. 2005. Modelling plant resource allocation and growth partitioning in response to environmental heterogeneity. Ecological Modelling 181 (1), 59-77. [ Links ]
212. YIN X.; GOUDRIAAN, J.; LANTINGA, E.A.; VOS, J.; SPIERTZ, H.J. 2003. A flexible sigmoid function of determinate growth. Annals of Botany 91 (3), 361-371. [ Links ]
213. ZEIDE, B. 1993. Analysis of growth equations. Florest Science 39 (3), 594-616. [ Links ]
214. ZHANG, D.; ZHANG, Z.; LI, J.; CHANG, Y.; DU, Q.; PAN, T. 2015. Regulation of vapor pressure deficit by greenhouse micro- fog systems improved growth and productivity of tomato via enhancing photosynthesis during summer season. Plos One, 10(7), e0133919. [ Links ]
215. ZOTARELLI, L.; DUKES, M.D.; SCHOLBERG, J.M.; HANSELMAN, T.; LE FEMMINELLA, K.; MUÑOZ-CARPENA, R. 2008. Nitrogen and water use efficiency of zucchini squash for a plastic mulch bed system on a sandy soil. Scientia Horticulturae 116 (1), 8-16. [ Links ]














