Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
RIA. Revista de investigaciones agropecuarias
versión On-line ISSN 1669-2314
RIA. Rev. investig. agropecu. vol.44 no.1 Ciudad Autónoma de Buenos Aires abr. 2018
ARTÍCULOS
Caracterización de genotipos de Gossypium hirsutum L. sobre su tolerancia a estrés hídrico
Spoljaric, M.V.1; Tcach, M.A.1; Rojas, J.M.1; Tarrago, J.R.2; Cointry, E.L.3
1 Instituto Nacional de Tecnología Agropecuaria (INTA), Estación Experimental Agropecuaria (EEA) Sáenz Peña, Ruta Nacional Nº 95 km 1108, 3700, Pcia. R. Sáenz Peña, Chaco, Argentina. Correo electrónico: spoljaric.monica@inta.gob.ar
2 Instituto Nacional de Tecnología Agropecuaria (INTA), Estación Experimental Agropecuaria (EEA) Las Breñas, Ruta Nacional Nº 89 km 227, 3722 Las Breñas, Chaco, Argentina. Correo electrónico: tarrago.jose@inta.gob.ar
3 Universidad Nacional de Rosario, Facultad de Ciencias Agrarias, Campo Experimental Villarino, CC Nº 14 (S2125ZAA), Zavalla, Santa Fe, Argentina. Correo electrónico: ecointry@unr.edu.ar
Recibido 09 de febrero de 2017
Aceptado 22 de junio de 2017
Publicado online 10 de abril de 2018
RESUMEN
El déficit hídrico y la alta demanda atmosférica en climas subhúmedos limita la productividad de los cultivos, la selección de variedades tolerantes es una estrategia para minimizar el impacto. El objetivo fue caracterizar 20 genotipos de Gossypium hirsutum L. pertenecientes al banco de germoplasma de INTA EEA Sáenz Peña por su tolerancia al estrés hídrico mediante variables fisiológicas. El ensayo se realizó bajo condiciones controladas en la Estación Experimental Agropecuaria (EEA) INTA Las Breñas durante el año 2014. Se utilizó un diseño experimental bifactorial; el factor A fue la presencia o ausencia de estrés (se suspendió la oferta de agua a partir de la tercera hoja verdadera y 50% de CC por seis días) y el factor B fueron 20 genotipos de algodón. Se midieron conductancia estomática (Ce, mmol/m-2/s-1), temperatura foliar (T, ºC) y contenido de agua relativo (CAR, %). Por un lado, los resultados del análisis univariado mostraron interacción significativa entre el efecto del tratamiento y los genotipos, tanto para Ce como para CAR. En T solo se observó diferencia entre los genotipos. Por otro lado, las diferencias genéticas en las variables fisiológicas fueron bajas debido a un fuerte efecto ambiental causado por las condiciones de estrés, que enmascararon la variancia genética. Las variables analizadas en conjunto en el análisis de componentes principales pudieron separar a los tratamientos significativamente y clasificar a los genotipos en tres grupos contrastantes. Los genotipos con mejor comportamiento frente al estrés hídrico en relación con el CAR y la Ce conjuntamente fueron BGSP 756, BGSP 463, BGSP 804, BGSP 735, BGSP 803, BGSP 514, BGSP 67, BGSP 475, BGSP 507 y SP 48114.
Palabras clave: Caracterización; Gossypium hirsutum L.; Tolerancia a estrés hídrico.
ABSTRACT
Water deficit and high atmospheric demand in subhumid climates limit the productivity of crops, being the selection of tolerant varieties a strategy to minimize their impact. The objective was to characterize 20 genotypes of Gossypium hirsutum L. belonging to the germplasm bank of INTA EEA Sáenz Peña for their tolerance to water stress by means of physiological variables. The trial was carried out under controlled conditions in the EEA INTA Las Breñas during the year 2014. A bifactorial experimental design was used, being the factor A the presence or absence of stress (water supply was suspended from the third true leaf and 50% FC for six days), and factor B 20 cotton genotypes. Stomatal conductance (Sc, mmol / m-2 / s-1), leaf temperature (T, °C) and relative water content (RWC, %) were measured. The results of the univariate analysis showed a significant interaction between the factors treatment and genotype for Sc and RWC. For T, only difference between genotypes was observed. On the other hand, the genetic differences in the physiological variables were low due to a strong environmental effect caused by the stress conditions, which masked the genetic variance. The variables analyzed together by a main component analysis were able to separate the treatments significantly and classified the genotypes into three contrasting groups. The genotypes with the best behavior against water stress in relation to RWC and Sc together were BGSP 756, BGSP 463, BGSP 804, BGSP 735, BGSP 803, BGSP 514, BGSP 67, BGSP 475, BGSP 507 y SP 48114.
Keywords: Characterization; Gossypium hirsutum L.; Tolerance to water stress.
INTRODUCCIÓN
El algodón (Gossypium spp.) es el principal cultivo de fibra natural en el mundo y, en la Argentina es de gran importancia en el norte del país, especialmente en la provincia de Chaco que concentra aproximadamente el 50% del área de siembra (Delssin, 2015), y donde se registra cerca del 70% de la producción nacional. Las provincias con mayor superficie sembrada son: Chaco (269.350 ha), Santiago del Estero (135.000 ha), Santa Fe (96.000 ha), y Formosa (16.000 ha); y en menor porcentaje Salta (9.000 ha), San Luis (2.700 ha), Entre Ríos (1.100 ha), Corrientes (480 ha) y Córdoba (350 ha). En la mayor parte de la región del noreste (NEA) y noroeste (NOA) el algodón se siembra bajo secano, lo cual provoca inestabilidad en los rendimientos entre campañas agrícolas debido a su dependencia de la oferta hídrica.
El crecimiento y desarrollo del algodón no solo se ve influenciado por el promedio anual de precipitaciones, sino también por la regularidad y su distribución estacional (Arturi, 1984). El Chaco presenta zonas con clima subtropical con y sin estación seca. Las precipitaciones oscilan de este a oeste, entre 1300 y 500 mm anuales, dependiendo del año climático. El área principal de producción de secano se encuentra en la zona con estación seca, en el centro y sudoeste provincial (Rofman, 1999). En secano con precipitaciones inferiores a los 750 mm disminuye notoriamente la posibilidad de éxito. Otro factor climático importante es la evapotranspiración potencial que en la región puede alcanzar hasta 1600 mm anuales, indicando en meses de alta temperatura y velocidades de viento, déficit o balance hídrico negativo entre precipitación y evapotranspiración. La disponibilidad y calidad del agua afectan al crecimiento y los procesos fisiológicos de todas las plantas, ya que el agua es el componente principal de las plantas en crecimiento activo, representando un 70-90% de materia fresca de esta (Gardner y Gardner, 1983), y es el principal factor limitante del crecimiento. El algodón se considera bajo estrés hídrico cuando el agua útil del suelo, o utilizable por las plantas, alcanza niveles inferiores al 50% (Paytas et al., 2014). Sin embargo, algunos autores (Brubaker y Wendel, 1994; Brubaker et al., 1999) sugieren que el algodón está adaptado a episodios de sequía periódica, ya que el 90% del algodón cultivado en el mundo fue domesticado en regiones semiáridas del sur de México y norte de Guatemala. Sin embargo, Roark y Quisenberry (1977) reportaron que la variabilidad genética en los rasgos de tolerancia a estrés hídrico en los cultivares modernos es potencialmente baja, debido a que la mayoría fueron seleccionados bajo condiciones limitantes. No obstante, las razas primitivas de algodón han sido identificadas como fuentes potenciales de características asociadas a la tolerancia a estrés hídrico (Quisenberry et al., 1982; Basal et al., 2003).
Las plantas pueden soportar condiciones de sequía evitando la deshidratación de sus tejidos manteniendo al mismo tiempo el potencial de agua tisular tan alto como le sea posible (Ehleringer y Cooper 1992). Paralelamente existen otras especies que toleran bajos contenidos hídricos en los tejidos por mantenimiento del potencial de turgencia, ajuste osmótico y alta elasticidad de la pared celular (Evans, 1983; Kramer, 1983; Salisbury y Ross, 1985; Loomis y Connor, 1992). La regulación de estomas, o ajuste estomático, es un mecanismo para ajustar la pérdida de agua, utilizado como indicador de estrés hídrico (Fambrini et al., 1995; Franca et al., 2000). Asimismo, el contenido de agua relativo es un indicador de tolerancia a la desecación en cultivos como trigo y soja (Schonfeld et al., 1988; Carter, 1989). En este contexto, el objetivo fue caracterizar 20 genotipos de algodón pertenecientes al banco de germoplasma de INTA EEA Sáenz Peña por su tolerancia al estrés hídrico mediante variables fisiológicas.
MATERIALES Y MÉTODOS
Se utilizaron 20 genotipos pertenecientes a entradas de la colección de algodón del Banco de Germoplasma de INTA EEA Sáenz Peña, seleccionados por sitio de origen y tipo de población (tabla 1). La selección se realizó de acuerdo a lo reportado por Gómez (2007) cuando estimó la diversidad genética en entradas de G. hirsutum L. del banco a través de marcadores moleculares, concluyendo que la mayor distancia genética o variabilidad comprendían genotipos de diferentes orígenes y población. Para el tratamiento de estrés hídrico en etapa de crecimiento vegetativo se utilizó el protocolo de Parkhi et al. (2009), el cual se ajustó según los requerimientos del experimento. El ensayo se realizó en la EEA INTA Las Breñas, Chaco, durante los meses de mayo y junio de 2014, en cámaras climatizadas bajo condiciones controladas de luz (300 μm/seg*m2), temperatura (16 h de oscuridad a 20 ºC y 8 h de luz a 30 ºC) y 80% de humedad relativa. Este se considera un ensayo de corto plazo, por abarcar la etapa vegetativa solamente. Se diseñó un experimento bifactorial donde el factor A correspondió al tratamiento principal: sin estrés (control: sin limitaciones de agua) y con estrés (con suspensión de la oferta de agua a partir de tres hojas y 50% de capacidad de campo). El factor B fueron los 20 genotipos caracterizados de diversos orígenes y población.
Tabla 1. Genotipos de algodón pertenecientes al banco de germoplasma de EEA Sáenz Peña.
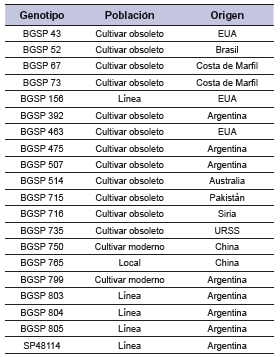
*Cultivar obsoleto o en desuso y moderno: hace referencia a la sustitución en el uso por el productor. Línea: se refiere al material desarrollado por los mejoradores que son conservados en los bancos de germoplasma por su valor real o potencial. Local: son variedades primitivas, tradicionales o criollas y que son producto de una selección por parte de los agricultores con gran adaptación a condiciones abióticas y bióticas.
Se utilizaron 40 macetas de 2 L de capacidad, distribuidas al azar dentro de las cámaras. Las macetas fueron cargadas con suelo seco de textura franca y se llevó a todas al mismo peso de 1.3 kg de suelo seco. Se calcularon los mm necesarios para llevar el suelo a capacidad de campo (CC) y se regaron todas las macetas con ese volumen, llevándose a un peso de 1.55 kg. Se sembraron diez semillas por maceta, las cuales fueron regadas cada tres días hasta la germinación mantenidas entre 90 y 100% de CC. Se realizó un raleo en las macetas dejando cinco plantas uniformes en altura, tamaño y número de hojas verdaderas. Luego se regó periódicamente hasta la aparición de tres hojas verdaderas desplegadas, momento en el cual se suspendió el riego para lograr condiciones de estrés en 20 macetas. En el tratamiento control se mantuvo el contenido de humedad óptimo. Previo al inicio del estrés, se equipararon los pesos de las macetas mediante riego. Cada dos días se pesaron las macetas y se equipararon los pesos a la de mayor valor para que de esta manera lleguen todas a un mismo contenido de humedad en la misma cantidad de días. Se consideró el inicio del estrés cuando las macetas presentaron el peso correspondiente al 50% de CC. A los seis días de suspendido el riego con manifestación de marchitamiento en todas las plantas, se midió la conductancia estomática (Ce, mmol m-2s-1) para evaluar el grado de apertura estomática, y la temperatura foliar (T, ºC) por medio de un porómetro foliar (SC-1 Decagon) con rango de mediciones desde 0 hasta 1.000 mmol m-2s-. Se registraron ambas variables en el mismo momento para evitar que el aumento de temperatura de la hoja disminuyera la conductancia estomática (Möller et al., 2007). Para determinar el contenido de agua relativo (CAR, %) se extrajeron las hojas inmediatamente después de medir las variables mencionadas y se estimó CAR con la fórmula descripta por Schonfeld et al. (1988):
![]()
PF= Peso fresco de la tercera hoja verdadera diferenciada.
PT= Peso de máxima turgencia.
Luego de determinar PF se dejaron las hojas en agua destilada en placas de Petri selladas con parafilm por 24 horas a temperatura ambiente. Transcurridas 24 h se pasaron a papel de filtro para eliminar el excedente de agua para luego ser pesadas.
PS = Peso seco. Se colocaron las muestras en estufa a 70 ºC por 72 h y se pesaron.
El ensayo se realizó dos veces en momentos de tiempo (mayo y junio) diferentes, elegidos aleatoriamente, que se consideraron repeticiones. La duración del ensayo fue de 30 días. El análisis estadístico se dividió en dos aproximaciones: univariado y multivariado. Para el primero se realizó un análisis inferencial por medio de modelos generales lineales y mixtos con el programa estadístico InfoStat/P (Di Rienzo et al., 2014) a través de su interfaz con el programa R. Se consideraron tratamiento y genotipos como efectos fijos y a las repeticiones como efecto aleatorio. Se evaluó además la interacción entre los efectos fijos. Se comprobaron los supuestos de normalidad y homogeneidad de varianzas para cada modelo y se corrigió, cuando fue necesario, la heterogeneidad de las varianzas, seleccionando el modelo más parsimonioso en cada caso por medio de los coeficientes AIC y BIC. Para la comparación de los valores promedios se utilizó la prueba LSD de Fisher con un valor de significancia del 5% (p<0,05). Además se calcularon los componentes de la varianza para determinar la Heredabilidad en sentido amplio (H2) o Grado de Determinación Genética (GDG) en las variables que presentaron diferencias significativas para tratamiento principal siguiendo el modelo propuesto por Mariotti (1986) y utilizando la fórmula de Falconer (1981).
![]()
Vg: varianza genética
Vf: varianza fenotípica
Para el análisis multivariado se utilizó el programa R versión 3.0.1 (R, 2011). Se estandarizaron los datos y se construyó una matriz de correlaciones lineales, luego se realizó un Análisis de Componentes Principales (ACP) por medio del paquete FactoMineR, que posibilita realizar elipses de confianza para las medias de grupo según el tratamiento principal y conocer los p-valores (p<0,05) de la correlación entre grupos. Una vez verificado si las variables podían separar significativamente a los tratamientos, se procedió a realizar nuevamente ACP solo con los datos del tratamiento con déficit hídrico. Con estos resultados se confeccionaron biplots sobre las dos primeras componentes principales (CP) y luego se realizó un análisis de conglomerados para profundizar en los agrupamientos.
RESULTADOS
Análisis univariado Conductancia estomática (mmol m-2s-1)
La Ce presentó diferencias significativas entre tratamientos, genotipos y su interacción (tabla 2). La Ce fue afectada por el estrés hídrico (3,82 mmol m-2s-1) al compararla con el promedio del control (125,37 mmol m-2s-1). La interacción significativa expresó que la Ce en condiciones de estrés hídrico fue similar entre genotipos, presentando valores mínimos y máximos de 2,32 a 11,55 mmol m-2s-1, respectivamente. Sin embargo, en condiciones de buena disponibilidad hídrica (sin estrés) los genotipos mostraron mayor variación, con un valor mínimo y máximo de 12,28 y 269,25 mmol m-2s-1, respectivamente. El genotipo BGSP 799 presentó el mayor valor de Ce (269,25 mmol m-2s-1) en condiciones sin estrés y el menor valor (2,32 mmol m-2s-1) el genotipo BGSP 52 en condiciones de estrés (tabla 3).
Tabla 2. Pruebas de hipótesis secuenciales para las variables conductancia estomatica (Ce), temperatura foliar (T) y contenido de agua relativo (CAR).
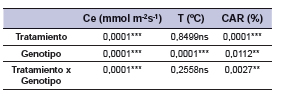
*, **, ***, Significado de la prueba F a p ≤ 0,05, 0,01 o 0,0001, respectivamente; ns, indican no significancia.
Tabla 3. Interacción entre Tratamiento y Genotipos para los parámetros conductancia estomática (Ce) y contenido de agua relativo (CAR).
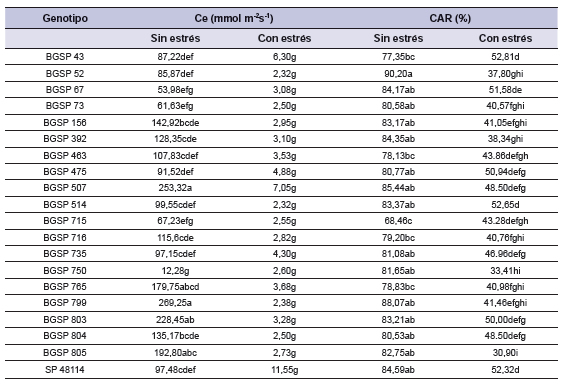
*Medias con una letra común no son significativamente diferentes (p > 0,05).
Temperatura foliar (ºC)
Los resultados no presentaron diferencias significativas para el tratamiento (p<0,8499) y la interacción entre tratamiento y genotipos (p<0,2558). Sin embargo las diferencias entre genotipos fueron significativas (p<0,0001) (tabla 2). Las entradas BGSP 715, BGSP 716, BGSP 67 y BGSP 750 presentaron mayores temperaturas (30,5; 30,3, 30,2 y 30,2ºC) y BGSP 43 denominada “Stoneville 508” exhibió el menor valor (28,0 ºC).
Contenido de agua relativo (%)
El CAR presentó diferencias significativas para tratamiento (p<0,0001), genotipo (p<0,0112) e interacción (p<0,0027) (tabla 2). Los valores medios alcanzados en condiciones de estrés fueron de 44,3% y sin estrés de 81,8%. El genotipo BGSP 52 presentó mayor turgencia en el tratamiento sin estrés (90,2%), y presentó diferencias significativas con BGSP 43, BGSP 463, BGSP 715, BGSP 716 y BGSP 765. El genotipo BGSP 715 presentó el CAR más bajo dentro del control, con un promedio de 68,5%. Los genotipos que presentaron mayor valor de CAR sin presentar diferencias significativas en condiciones bajo estrés hídrico fueron BGSP 43 (52,8%), BGSP 514 (52,65%) y SP 48114 (52,32%) y en relación con los genotipos más afectados fueron BGSP 805 quien presentó el menor valor (30,9%) seguido de BGSP 750 (33,41%), BGSP 52 (37,80%), BGSP 392 (38,34%), BGSP 73 (40,57%), BGSP 716 (40,76%), BGSP 765 (40,96%), BGSP 156 (41,05%) y BGSP 799 (41,46% (tabla 3).
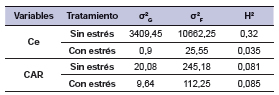
Heredabilidad en sentido amplio
A partir de los componentes de la varianza se determinó la heredabilidad en sentido amplio (H2) (tabla 4). Los componentes genéticos para Ce expresaron mayor variabilidad en el tratamiento sin estrés hídrico en comparación al tratamiento con estrés, indicando que la variabilidad genética disponible en condiciones de estrés hídrico disminuye. La heredabilidad en sentido amplio en condiciones de estrés hídrico (H2= 0,035) fue baja. El 3,5% de la variación fenotípica se debió al genotipo, mientras que 96,5% al ambiente. Distinta fue la respuesta para buenas condiciones de humedad donde el 32% del fenotipo se debió a la expresión del genotipo y el 68% al ambiente (H2= 0,32). Los componentes genéticos y fenotípicos en CAR mostraron similar variabilidad en condiciones de estrés hídrico y sin principales fue 90,5%. Las variables que definieron el componente principal 1 (CP1) fueron CAR y Ce, mientras que la T definió el componente principal 2 (CP2) (figura 1). Además se obtuvieron dos grupos significativamente diferentes para el factor A, tratamiento principal: sin estrés y con estrés hídrico y con dispersiones en condiciones sin estrés por los genotipos BGSP 43 (23) y BGSP 52 (40) y también en condiciones de estrés (3) y (8) respectivamente. La significancia estadística de estas diferencias pudo comprobarse a través de elipses de confianza y p-valores (p<0,05) de la correlación entre grupos, es decir, que las coordenadas de los tratamientos fueron significativamente diferentes (tabla 5) estrés, siendo la heredabilidad (H2= 0,085) en condiciones de estrés hídrico baja a nula, es decir, que el 8,5% de variación fenotípica se debió al genotipo y el 91,5% al ambiente. En condiciones de buena disponibilidad hídrica (sin estrés) el CAR presentó una heredabilidad (H2= 0,081) similar a la anterior.
Tabla 4. Varianzas genética (σ2 G), fenotípica (σ2 F) y heredabilidad (H2) en sentido amplio en los dos tratamientos para contenido de agua relativo (CAR) y conductancia estomática (Ce).
Análisis multivariado
Se realizó un análisis de componentes principales (ACP) con los datos estandarizados de las variables respuesta, donde la variabilidad total explicada por dos componentes principales fue 90,5%. Las variables que definieron el componente principal 1 (CP1) fueron CAR y Ce, mientras que la T definió el componente principal 2 (CP2) (figura 1). Además se obtuvieron dos grupos significativamente diferentes para el factor A, tratamiento principal: sin estrés y con estrés hídrico y con dispersiones en condiciones sin estrés por los genotipos BGSP 43 (23) y BGSP 52 (40) y también en condiciones de estrés (3) y (8) respectivamente. La significancia estadística de estas diferencias pudo comprobarse a través de elipses de confianza y p-valores (p<0,05) de la correlación entre grupos, es decir, que las coordenadas de los tratamientos fueron significativamente diferentes (tabla 5) presentando el grupo sin estrés coordenadas mayores en la CP1, es decir, valores más altos de Ce y CAR.
Tabla 5. Prueba de significancia de la correlación de la variable categórica Tratamiento con la CP1 (Test de Student).
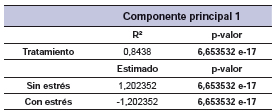
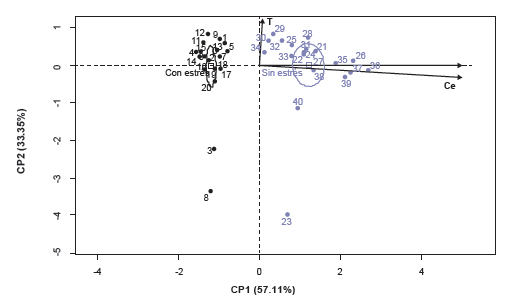
Figura 1. Gráfico de las variables conductancia estomática (Ce), temperatura foliar (T) y contenido de agua relativo (CAR) y diferencias significativas (elipses) en los tratamientos sin estrés y con estrés hídrico en las CP1 y CP2.
Una vez realizado el ACP para todos los individuos se analizó únicamente el tratamiento con estrés hídrico utilizando la misma metodología. El objetivo de este análisis fue visualizar la distribución de los genotipos de acuerdo a los valores que mostraron las variables en conjunto. La variabilidad total explicada por ambos componentes fue del 83,3%. Las variables respuesta se comportaron de manera similar que en el análisis anterior, es decir, que la CP1 fue definida por Ce y CAR, y la CP2 por la T. El árbol jerárquico o dendrograma dividió a los genotipos en tres grupos (figura 2). El nivel óptimo sugerido por este método (presentado por una línea negra sólida) también es de tres. De esta manera, el grupo uno, mostrado por un recuadro negro, presentó los siguientes genotipos: el 37,5% de los genotipos fueron originarios de Argentina (BGSP 805, BGSP 799, BGSP 392) mientras que 62,5% restantes por poblaciones de China (BGSP 750), Siria (BGSP 716), EUA (BGSP 156), Costa de Marfil (BGSP 73) y Pakistán (BGSP 715), en igual proporción. Para el grupo dos (recuadro de color rojo), el 50% de las poblaciones fueron provenientes de Argentina (SP 48114, BGSP 804, BGSP 803, BGSP 507) y el otro 50% de China (BGSP 765), EUA (BGSP 463), Australia (BGSP 514), Costa de Marfil (BGSP 67) y URSS (BGSP 735).Con respecto al grupo tres (recuadro de color verde), estuvieron conformadas por los genotipos BGSP 43 de origen americano y BGSP 52 de origen brasilero teniendo en común que son materiales obsoletos, siendo el grupo más uniforme respecto de la población. Los porcentajes de los dos primeros grupos sugieren que las características fisiológicas presentaron mayor peso en separar a los genotipos en tres grupos y el agrupamiento no correspondió al origen de la población, ya que en los diferentes grupos se encuentran genotipos provenientes de todos los continentes y poblaciones diversas en cuanto a si corresponde a un material moderno, obsoleto, línea y local.
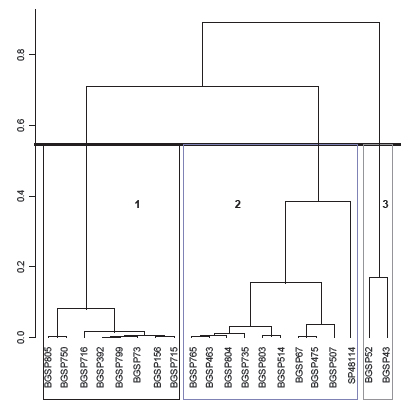
Figura 2. Árbol jerárquico de los genotipos en condiciones de estrés sobre la CP1 y CP2.
En la tabla 6 se muestra la descripción de los grupos a través de las variables. Los genotipos del grupo uno se caracterizan por tener un CAR menor (38,72%) a la media general (44,32%), las del grupo dos un CAR mayor (48,6%) a la media general (44,32%) y las del grupo tres una T menor (28,32°C) a la media general (29,83 °C).
Tabla 6. Descripción de los grupos a través de las variables de contenido de agua relativo (CAR) y temperatura foliar (T).

Media de la categoría: describe el promedio para las variables que caracterizan cada grupo; Media general: el promedio para la variable para el conjunto total de datos; p-valor correspondiente a la hipótesis de que la media de la categoría es igual a la media global. Si el pvalor es menor a 0,05 la media del grupo es significativamente mayor o menor a la media global, según el signo del test de valor (v. test). El test de valor es considerado una desviación “estandarizada” entre la media de los individuos de una categoría y la media global. Según el signo indica si la desviación del grupo es con valores menores o mayores.
La descripción de los grupos por las CP indicaron que los genotipos del grupo uno tienen menores coordenadas en la CP1, es decir, valores menores de CAR y Ce; los genotipos del grupo dos que tienen coordenadas mayores en la CP1, es decir, mayor valor de CAR y Ce, y los del agrupamiento tres tienen coordenadas menores en la CP2 respecto de la media general presentando valores significativamente menores de T.
DISCUSIÓN Y CONCLUSIONES
El estrés hídrico es un fenómeno complejo que afecta a la fisiología, (Grimes y El-Zik, 1990), al crecimiento y a la productividad en las plantas de algodón (Chu et al., 1995). En el presente trabajo se pudo comprobar que las variables fisiológicas Ce y CAR fueron las más afectadas por el estrés hídrico. El valor promedio de los genotipos en la Ce fue 3,82 mmol m-2s-1 para el tratamiento con estrés y 125,37 mmol m-2s-1 para el control, indicando el cierre de los estomas en condiciones de déficit de humedad (Pagán Rubio, 2012). Similares respuestas encontraron Pilon et al. (2012), cuando estudiaron el efecto del estrés hídrico sobre la termosensibilidad del Fotosistema ii en cultivares de algodón, la Ce fue afectada significativamente en los cultivares de Pima 32 (11,82 mmol m-2s-1), Siokra L23 (12,09 mmol m-2s-1), DP0912 (28,40mmol m-2s-1) y T1521 (19,62 mmol m-2s-1) en comparación con el control que mostró valores más altos (55,63 mmol m-2s-1; 157,43 mmol m-2s-1; 136,15 mmol m-2s-1 y 114,89 mmol m-2s-1). En el presente trabajo la interacción entre tratamiento y genotipos demostró que la respuesta de la Ce en condiciones de estrés hídrico fue similar entre genotipos, con valor mínimo y máximo de 2,32 y 11,55 mmol m-2s-1, respectivamente; sin embargo en buenas condiciones de humedad, se observó mayor variabilidad (mínimo y máximo de 12,28 y 269,25 mmol m-2 s-1, respectivamente (tabla 5). Estos resultados sugieren que para detectar respuestas diferenciadas o variabilidad genética disponible en la Ce en los genotipos bajo condiciones de estrés hídrico, habría que llevar el tratamiento a un nivel algo mayor de humedad, es decir, un estrés más leve, ya que con estrés intenso las características genéticas se uniforman en su respuesta. Harris (1973), Bielorai y Hopmans (1975) también informaron, para experimentos en macetas, que la Ce fue significativamente disminuida en condiciones de déficit hídrico; otros investigadores han reportado cierre estomático por esta causa en algodón y otros cultivos en macetas (Boyer, 1970). Los experimentos de campo han demostrado que la Ce del algodón se adapta al estrés hídrico; Paytas (2009) halló asociación en la disminución de Ce con el aumento de déficit hídrico al estudiar el efecto temprano del estrés en el crecimiento, desarrollo y rendimiento en algodón de alta retención de cápsulas a campo y Ackerson et al. (1977) reportaron que la Ce en algodón cultivado en el campo es ligeramente afectada ya que los estomas de las hojas no se cerraron completamente, incluso bajo potenciales hídricos muy bajos.
Coincidiendo con lo anteriormente expuesto, la heredabilidad en sentido amplio para la Ce fue baja en condiciones de estrés hídrico, es decir, el 3,5% de la variación fenotípica se debió a diferencias entre genotipos y el 96,5% a efectos ambientales. Distinta fue la respuesta para condiciones sin estrés donde el 32% de la variación fenotípica observada se debió a la existencia de diferencias entre los genotipos y el 68% atribuido a las variaciones del ambiente. La herencia de la Ce fue estudiada en la variedad de algodón Pima por Percy et al. (1996), quienes demostraron que es un tipo de herencia compleja que incluye desde un simple modelo aditivo-dominante a un modelo donde se presentan interacción epistática/digénica. Estos mismos autores reportaron estimaciones de heredabilidad en sentido amplio para Ce que variaron desde 0,16 hasta 0,44. En poblaciones interespecíficas obtenidas por la cruza de G. hirsutum (americano) x G. barbadense (Pima o Tangüis), Ulloa et al. (2000) demostraron la presencia de efectos aditivos, como así también de dominancia para la Ce en estudios efectuados a través de QTLs. Los alelos de los marcadores dominantes de los padres de tipo algodón americano contribuyeron a valores medios más altos de Ce y esto sugirió, además, que los genes de algodón americano podrían contribuir al aumento de Ce en líneas de Pima en programas de mejoramiento avanzados. Además, la Ce en el algodón está determinada genéticamente y se ha demostrado que se asocia con la resistencia al calor y rendimientos más altos. En general, el estrés por altas temperaturas reduce la Ce y la variabilidad genética disponible (Rahman, 2005). Del mismo modo podría comportarse ante el déficit hídrico debido a que no existe un mecanismo de resistencia al estrés abiótico unificado para la sequía a nivel de toda la planta o a nivel de gen individual (Blum, 2004).
Con respecto al CAR, la disminución en sus valores en respuesta a la sequía ha sido observada en una amplia variedad de especies. Así lo han demostrado Nayyar y Grupta (2006) trabajando en trigo y maíz, y Jamal et al. (2014), en algodón arbóreo, entre otros. Investigaciones previas (Kaiser, 1987; Robinson., 1988; Cornic et al., 1989) han indicado que el estrés hídrico comienza a inducir restricciones a nivel de mesófilo, disminuyendo la fotosíntesis cuando el CAR en tejido de la hoja alcanza entre el 50 y 70%. Al mismo tiempo se considera a los genotipos tolerantes aquellos que pueden mantener el CAR alto en comparación con los sensibles (Ananthi et al. 2013). Los resultados mostraron menor valor promedio de CAR en los genotipos bajo estrés hídrico (44,3%) contrario a un alto valor promedio sin estrés (81,8%). Comportamiento similar encontraron Jamal et al. (2014) cuando estudiaron el efecto del estrés por sequía sobre el crecimiento y la fisiología en G. arboreum registrando menor CAR en las plantas que crecieron en condiciones de estrés hídrico (44,3%) en comparación con las que lo hicieron sin estrés hídrico (70,2%). La interacción aquí hallada entre tratamiento principal y genotipos indicó que estos se comportaron de manera diferente según la condición de humedad del suelo en que crecieron. Los valores de CAR obtenidos para los genotipos en condiciones de buena disponibilidad hídrica en el suelo variaron entre 68,4 y 90,2% y en condiciones de estrés hídrico entre 30,9 y 52,8%. Es interesante mencionar respecto al CAR y en relación con el tipo de hoja que el genotipo de origen australiano BGSP 514, denominado Siokra, de hojas muy lobuladas, presentó un valor de CAR alto (52,6%) y bajos valores de Ce (2,32 mmol m-2s-1) en condiciones de estrés, respecto a los demás genotipos de hojas normales. Pettigrew et al. (1993) encontraron que las plantas de hoja okra y súper okra tenían valores de Ce más bajos que las isolíneas de hojas normales a potenciales altos de agua, y esto se atribuyó a la menor densidad de estomas presentes en la cara abaxial de los genotipos de hoja okra (Wellsy Meredith Jr., 1986). Resultados similares fueron reportados por Karami et al. (1980) y Nepomuceno et al. (1998), quienes también informaron que los genotipos de algodón de hojas súper okra fueron capaces de mantener alta turgencia en las hojas a potenciales osmóticos más bajos en comparación con las plantas de hojas normales. También las plantas de hoja tipo okra y súper okra exhibieron mayores tasas fotosintéticas a potenciales hídricos bajos en comparación con las plantas de hoja tipo normales en experimentos de invernadero y de campo (Karami et al., 1980; Nepomuceno et al., 1998; Pettigrew, 2004). Para determinar la existencia de un comportamiento diferente entre los genotipos en la variable CAR, se estimaron los valores de H2 encontrándose que estos fueron bajos en ambas condiciones de humedad. La variación de los fenotipos en condiciones de estrés fue determinada por las variaciones del ambiente en un 91,9% y tan solo un 8,1% por las diferencias entre los genotipos. Las mediciones de temperatura foliar (T) y las temperaturas del dosel se han establecido como buenos indicadores de la tolerancia de las plantas a la sequía y su utilización permite cuantificar el déficit de la planta (Ko y Piccinni, 2009). En el presente trabajo no hubo diferencias significativas para tratamientos ni interacción, sin embargo las diferencias entre los genotipos sí fueron significativas. Las T más altas fueron observadas en BGSP 715, BGSP 716, BGSP 67 y BGSP 750 y las más bajas en BGSP 43 y BGSP 52. No obstante, Pettigrew (2004) encontró diferencias significativas en la temperatura del dosel cuando evaluó las consecuencias fisiológicas del estrés hídrico en algodón a campo con riego y sin riego sobre ocho genotipos en el sudoeste de EE. UU.; los resultados mostraron que en las plantas que crecieron en secano las temperaturas registradas fueron mayores (35,2 ºC) que las que crecieron bajo riego (30,7 ºC).
El ACP para el conjunto de datos presentó alta correlación entre Ce y CAR representada por la CP1, explicando ambas variables el 57,11% de la variabilidad total (figura 1). Asimismo, Quisenberry et al. (1982) encontraron una correlación significativa entre el CAR, el cierre de estomas y tasas de crecimiento promedio de los genotipos de algodón en condiciones de estrés hídrico a campo. Los resultados descriptos para CAR fueron similares a los informados para la acerola o cereza de Barbados, donde Nogueira (1997) propuso el potencial hídrico foliar como indicador de tolerancia a la sequía; esta variable también fue considerada para la selección de variedades de maní (Nogueira et al., 1998). También, Millar et al. (1971) enfatizaron que se ha dado preferencia a las determinaciones del potencial total del agua en la planta, porque esta influía más directamente en los procesos metabólicos que cualquier otro parámetro de evaluación del déficit hídrico. Por su parte, Clark y Hiler (1973) constataron que el potencial del agua en la hoja resultaba ser mejor indicador del estado hídrico de la planta que la resistencia difusiva estomática o temperatura foliar. Sin embargo, Acevedo et al. (1998) relataron que las mediciones del potencial hídrico, aisladamente, no dan información suficiente sobre el impacto del estrés hídrico en los procesos fisiológicos mediados por el contenido de agua de los tejidos. Por el contrario, Ananthi et al. (2013) sostienen que los genotipos tolerantes mantienen en sus hojas un alto CAR y actividad fotosintética con respecto a los sensibles. La temperatura definió la CP2 y explicó el 29,7% de la variabilidad total. Según Armani et al. (1996) la Ce tiene una relación directa sobre el enfriamiento por transpiración y existe una fuerte relación entre la Ce y la T, por lo tanto ambos se ven afectados por muchos de los mismos factores ambientales y fisiológicos (Reynolds et al., 2012). El esfuerzo de la planta para conservar el agua también podría conducir a una mayor temperatura foliar (Carmo-Silva et al., 2012; Pettigrew, 2004; Shahenshah y Isoda, 2010), viéndose disminuida la capacidad de enfriamiento de la hoja por evaporación (Radin et al., 1994); sin embargo en el presente estudio no se pudo determinar tales relaciones. Se pudo comprobar mediante un análisis de significancia que las coordenadas de los tratamientos con estrés y sin estrés fueron significativamente diferentes en relación con las variables CAR y Ce (figura 1), presentando el grupo sin estrés mayores valores promedios de CAR y Ce en relación con el grupo con estrés hídrico, reforzando lo anteriormente explicitado de que en condiciones hídricas óptimas hay mayor contenido hídrico en hoja y apertura de estomas; además en condiciones de buena disponibilidad de agua, la regulación de la Ce mantiene un nivel óptimo de las concentraciones de CO2 interno lo cual promueve la fotosíntesis. Al contrario, la reducción del CAR es una pérdida de turgencia de las células que conlleva al cierre de estomas y la reducción de la tasa fotosintética (Lv et al., 2007; Kramer y Boyer, 1995). Además, el cierre de estomas es debido a una señalización del ácido abscísico en cascada que provoca reducción en la turgencia que guardan las células. Esta es una respuesta fisiológica primaria que la planta de algodón provoca ante el estrés por sequía (Ackerson, 1980), con la consiguiente disminución de la Ce para minimizar la pérdida transpiracional de agua (Chaves et al., 2003).
Para discriminar con mayor detalle las características evaluadas de los genotipos en el tratamiento de estrés hídrico, se utilizó el método de agrupamiento o dendograma, empleado por Sokal y Sneath (1963), conocido hoy por método de agrupación jerárquica o partición en grupos (Husson et al. 2010). Él dividió a los genotipos en tres agrupamientos (figura 2): el grupo uno se caracterizó por tener un CAR menor (38,72%) a la media general (44,32%), las del grupo dos un CAR mayor (48,6%) a la media general (44,32%) y las del grupo tres una T menor (28,32 °C) a la media general (29,83 °C) (tabla 6). Además, los tres grupos fueron conformados en función a los componentes principales 1 y 2, presentando el grupo uno menores valores de CAR y Ce, el grupo dos valores mayores de CAR y Ce, y por último el grupo tres menor T. Los genotipos más deseables por su desempeño en condiciones de estrés hídrico por presentar mayor CAR y Ce serían los pertenecientes al grupo dos: BGSP 756, BGSP 463, BGSP 804, BGSP 735, BGSP 803, BGSP 514, BGSP 67, BGSP 475, BGSP 507 y SP 48114.
Estos resultados lograron obtener la caracterización de los 20 genotipos evaluados pertenecientes al Banco de Germoplasma de Algodón de la EEA Sáenz Peña de INTA (Chaco, Argentina) por su tolerancia al estrés hídrico en etapa de crecimiento vegetativo del cultivo. Se considera que el trabajo realizado es un primer paso en la contribución para la obtención de líneas o variedades más adaptadas a esta condición ambiental. Como perspectiva a futuro se pretende evaluar estos genotipos a campo en distintos ambientes para mejorar las estimaciones de las relaciones genéticas.
AGRADECIMIENTOS
A INTA EEA Sáenz Peña, INTA EEA Las Breñas, Facultad de Ciencias Agrarias (UNR), proyectos REDGEN1137021, PNIND-1108082.
BIBLIOGRAFÍA
1. ACEVEDO, E.; SILVA, H.; SILVA, P. 1998. Tendencias actuales de la investigación en la resistencia al estrés hídrico de las plantas cultivadas. Boletín Técnico Facultad de Ciencias Agrarias y Forestales, Universidad de Chile. 49:1–29.
2. ACKERSON, R.C. 1980. Stomatal response of cotton to water stress and abscisic acid as affected by water stress history. Plant Phystol 65, 455–459.
3. ACKERSON, R.C.; KRIEG, D.R.; HARING, C.L.; CHANG, N. 1977. Effects of plant water status on stomatal activity, photosynthesis, and nitrate reductase activity of field grown cotton. Crop Sci. 17:81–84.
4. ANANTHI, K.; VIJAYARAGHAVAN, H.; KARUPPAIYA, M.; ANAND, T. 2013. Drought-induced Changes in Chlorophyll Stability Index, Relative Water Content and Yield of Cotton Genotypes. Insight Botany 3, 1–5.
5. ARMANI, I.; FHISCHER, R.; REYNOLS, M. 1996. Evaluation of canopy temperature as a screening tool heat tolerance in spring wheat. Journal of Agronomy and Crop Science 176, 119–129.
6. ARTURI, M.J. 1984. El Algodón. Mejoramiento Genético y Técnicas de su cultivo 1.º ed. Editorial Hemisferio Sur S.A. Buenos Aires, Argentina, 179 p. [ Links ]
7. BASAL, H.; BEBELI, P.; SMITH, C.W.; THAXTON, P. 2003. Root growth parameters of converted race stocks of upland cotton and two BC2F2 populations. Crop Sci.43:1983–1988.
8. BLUM, A. 2004. The physiological foundation of crop breeding for stress environments. Proc. World Rice Research Conf., Tsukuba, Japan. Manila. The Philippines: International Rice Research Institute. 456–458 pp.
9. BIELORAI, H.; HOPMANS, P.A.M. 1975. Recovery of leaf water potential, transpiration, and photosynthesis of cotton during irrigation cycles. Agron. J. 67:629–632.
10. BOYER, J.S. 1970. Leaf enlargement and metabolic rates in corn, soybean, and sunflower at various leaf water potentials. Plant Physiol. 46:233–235.
11. BRUBAKER, C.L.; WENDEL, J.F. 1994. Reevaluating the origin of domesticated cotton (Gossypium hirsutum; Malvaceae) using nuclear restriction fragment length polymorphisms (RFLPs). American Journal of Botany 81, 1309–1326.
12. BRUBAKER, C.L.; BOURLAND, F.M.; WENDEL, J.F. 1999. The origin and domestication of cotton. En: SMITH, C.W.; COTHREN, J.T. (Eds.). Cotton. Origin, history, technology, and production. John Wiley & Sons, Nueva York. 3–31 pp.
13. CARMO-SILVA, A.; GORE, M.; ANDRADE-SANCHEZ, P.; FRENCH, A.; HUNSAKER, D.; SALVUCCI, M. 2012. Decreased CO2 availability and inactivation of Rubisco limit photosynthesis in cotton plants under heat and drought stress in the field. Environmental and Experimental Botany 83, 1–11.
14. CARTER, T. 1989. Breeding for drought tolerance in Soybean: Where do we stand? World Research Conference iv. Associacion Argentina of the Soybean, Buenos Aires Argentina. [ Links ]
15. CHAVES, M.M.; MAROCO, P.P.; PEREIRA, J.S. 2003. Understanding plant responses to drought-from genes to the whole plant. Funct. Pl. Biol., 30, 239–64.
16. CHU, C.C.; HENNEBERRY, T.J.; AKEY, D.H; NARANJO, S.E.; PERKINS, H.H; PRABHAKER, N.; ANDMACKEY, B.E. 1995. Silverleaf whitefly: Development of an action threshold for chemical control on cotton. En: HERBER, D.J.; RICHTER, D.A. (Ed.). Proc. Beltwide Cotton Conf., San Antonio, TX. 4–7. Natl. Cotton Council Am., Memphis, TN. 873–874 pp.
17. CLARK, R.N.; HILER, E.A. 1973. Plant measurements as indicators of crop water deficits. Crop Science 13, 466–469.
18. CORNIC, G.; GOUALLEC, J.; BRIANTAIS, J.; HODGES, M. 1989. Effect of dehydratation and high light on photosynthesis of two C3 plants (Phaseoulus vulgaris L. and Elatpstema repens (Lour) Hall f.). Planta 177, 84–90.
19. DELSSIN, E. 2015. Pronóstico de estabilidad en la producción mundial de algodón. INTA, Argentina. (Disponible: http://inta.gob.ar/documentos/pronostico-de-estabilidad-en-la-produccion-mundial-de-algodon verificado: 2015). [ Links ]
20. DI RIENZO, J.A.; CASANOVES, F.; BALZARINI, M.G.; GONZÁLEZ, L.; TABLADA, M.; ROBLEDO, C.W. 2014. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. (Disponible: http://www.infostat.com.ar verificado: 2014). [ Links ]
21. EHLERINGER, J.R.; COOPER, T.A. 1992. On the role of orientation in reducing photoinhibitory damage in photosynthetic-twig desert shrubs. Plant, Cell and Environment 15, 301–306.
22. EVANS, L.T. 1983. Fisiología de los cultivos. Editorial Hemisferio Sur, Buenos Aires, Argentina. 402 p. [ Links ]
23. FALCONER, D.S.1981. Introduction to quantitative genetics. 2.a ed. Longmans, Londres. 340 p. [ Links ]
24. FAMBRINI, M.; VERNIERI, P.; TONCELLI, M.L; ROSSI, V.D.; PUGLIESI, C. 1995. Characterization of a wilty sunflowe (Helianthus annuus L.) mutant. iii. Phenotypic interaction in reciprocal grafts from wilty mutant and wild-type plants. J. Exp. Bot. 46, 525–530.
25. FRANCA, M.G.C.; THI, A.T.P.; PIMENTAL, C.; ROSSIELLO, R.O.P.; FODIL, Y.Z.; LAFFARY, D. 2000. Differences in growth and water relations among Phaseolus vulgaris cultivars in response to induced drought stress. Environ. Exp. Bot. 43, 227–237.
26. GARDNER, W.R.; GARDNER, H.R. 1983. Principles of water management under drought conditions. Agric. Water Manage 7,143–155.
27. GÓMEZ, G. 2007. Estimación de la diversidad genética mediante marcadores Microsatélites en entradas de Algodón (Gossypium hirsutum L.) del Banco de germoplasma del INTA. [Tésis Magister] Universidad Nacional de Rosario, Argentina, 80 p. [ Links ]
28. GRIMES, D.W.; EL-ZIK, K.M. 1990. Cotton. En: STEWART, B.A.; NIELSEN, D.R. (Eds.). Irrigation of Agricultural Crops. Agronomy series n.o 30. ASA-CSSA-SSSA, Madison, Wisconsin. 741–773.
29. HARRIS, D.G. 1973. Photosynthesis, diffusion resistance and relative plant water content of cotton as influenced by induced water stress. Crop Sci. 13:570–572
30. HUSSON, F.; JOSSE, J.; PAGES, J. 2010. Principal component methods – hierarchical clustering - partitional clustering: why would we need to choose for visualizing data? Technical Report Agrocampus. (Disponible: www.agrocampus-ouest.fr/math/ verificado: 2016).
31. IQBAL, K.; AZHAR, F.M.; KHAN, I.A.; ULLAH, E. 2010. Assessment of cotton (Gossypium hirsutum L.) germplasm under water stress condition. Int. J. Agric. Biol.12, 251–255.
32. JAMAL, A.; SHAHID, M.; AFTAB, B.; RASHID, B.; SARWAR, M.; MOHAMED, B.; HASSAN, S.; HUSNAIN, T. 2014. Water stress mediated changes in morphology and physiology of Gossypium arboreum (var FDH-786) Journal of Plant Sciences 2 (5), 179-186. [ Links ]
33. KAISER, W. 1987. Effect of water stress on photosynthesis capacity. Physiol. Plant. 71, 142-149. [ Links ]
34. KARAMI, E.; KRIEG, D.R.; QUISENBERRY, J.E. 1980. Water relations and carbon-14 assimilation of cotton with different leaf morphology. Crop Sci. 20, 421-426. [ Links ]
35. KO, J.; PICCINNI, G. 2009. Corn yield responses under crop evapotranspiration-based irrigation management. Agric. Water Manage 96, 799-808. [ Links ]
36. KRAMER, P.J. 1983. Water deficits and plant growth. En: KRAMER, P.J. (Ed.). Water Relations of Plants. Academic Press, Nueva York, EUA. 342-389 pp. [ Links ]
37. KRAMER, J.K.; BOYER, J.S. 1995. Water Relations of Plants and Soils. Academic Press, California, 495 p. [ Links ]
38. LEWITT, J. 1980. Responses of plants to environmental stress. Vol. ii. Water, Radiation, Salt and Others. Academic Press, Nueva York. 395-434 pp. [ Links ]
39. LOOMIS, R.S.; CONNOR, D.J. 1992. Crop Ecology: Productivity and management in agricultural systems. Cambridge University Press, Nueva York, 538 p. [ Links ]
40. LV, S.; YANG, A.; ZHANG, K.; WANG, L.; ZHANG, J. 2007. Increase of glycinebetaine synthesis improves drought tolerance in cotton. Mol. Breed. 20, 233-248. [ Links ]
41. MARIOTTI, J.A. 1986. Fundamentos de genética biometría. Aplicaciones al mejoramiento genético vegetal, 152 p. [ Links ]
42. MILLAR, A.A.; GARDNER, W.R.; GOLTZ, S.M. 1971. Internal water status and water transport in seed onion plants. Agronomy Journal 63, 779-784. [ Links ]
43. MÖLLER, M.; ALCHANATIS, V.; MERON, M.; TSIPRIS, J.; NAOR, A.; OSTROVSKY, V.; SPRINTSIN, M.; CHOEN, S. 2007. Use of thermal and visible imagery for estimating crop water status of irrigated grapevine. J Exp. Bot. 827-838. [ Links ]
44. NAYYAR, H.; GUPTA, D. 2006. Differential sensitivity of C3 and C4 plants to water deficit stress: association with oxidative stress and antioxidants. Environ. Exp. Bot. 58, 106-113. [ Links ]
45. NEPOMUCENO, A.L.; OOSTERHUIS, D.M.; STEWART, J.M. 1998. Physiological responses of cotton leaves and roots to water deficit induced by polyethylene glycol. Env. Exp. Bot. 40, 29-41. [ Links ]
46. NOGUEIRA, R.J.M.C. 1997. Expressões fisiológicas da aceroleira (Malpighia emarginata D.C.) em condições adversas. [Tese Doutorado], UFSCar, São Carlos, SP. 207 p. [ Links ]
47. NOGUEIRA, R.J.M.C.; SANTOS, R.C.; BEZERRA NETO, E.; SANTOS, V.F. 1998. Comportamento fisiológico de duas cultivares de amendoim submetidas a diferentes regimes hídricos. Pesquisa Agropecuária Brasileira 33 (12), 1963-1969. [ Links ]
48. PARKHI, V.; KUMAR, V.; SUNILKUMAR G.; CAMPBELL, L.M.; RATHORE, K.S. 2009. Expression of apoplastically secreted tobacco osmotin in cotton confers drought tolerance. Springer Science 23, 625-639. [ Links ]
49. PAYTAS, M.; MIERES, L.; LONGHI, T.; AGRETTI, S.; DEYKE, F.; GREGORET, O. 2014. Evaluación de diferentes estrategias de de riego y su efecto en los componentes de rendimiento de algodón. Publicación anual APPA N.°14, 30-33. [ Links ]
50. PAYTAS, M. 2009. Early water stress on growth, development and yield of high retention cattan. [PhD thesis]. The University of Queensland, Australia. [ Links ]
51. PERCY, R.G.; LU, Z.; RADIN, J.W.; TURCOTTE, E.L.; ZEIGER, E. 1996. Inheritance of stomatal conductance in cotton (Gossypium barbadense L.). Physiol. Plant. 96, 389-394. [ Links ]
52. PETTIGREW, W.T.; HEITHOLT, J.J.; VAUGHN, K.C. 1993. Gas exchange differences and comparative anatomy among cotton leaf-type isolines. Crop Sci. 33:1295-1299. [ Links ]
53. PETTIGREW, W. 2004. Physiological consequences of moisture deficit stress in cotton. Crop Sci. 44,1265-1272. [ Links ]
54. PILON, C.; OOSTERHUIS, D.; LOKA, D. 2012. Effect of Water- Deficit Stress on Photosystem ii Thermosensitivity in Cotton. En: OOSTERHUIS, D.M. (Ed.) Summaries of Arkansas Cotton Research. Arkansas Agricultural Experiment Station, University of Arkansas System, Division of Agriculture. Arkansas. 31-35 pp. [ Links ]
55. QUISENBERRY, J.; ROARK, B.; CMICHAEL, B. 1982. Use of transpiration decline curves to identify drought-tolerant cotton germplasm. Crop Sci. 22, 918-922. [ Links ]
56. R, DEVELOPMENT CORE TEAM. 2011. R: a language and environment for statistical computing. R Foundation for Statistical Computing. (Disponible: http://www.R-project.org/ verificado: abril de 2011). [ Links ]
57. RADIN, J.W.; LU, Z.; PERCY, R.G.; ZEIGER, E. 1994. Genetic variability for stomatal conductance in Pima cotton and its relation to improvements of heat adaptation. Proceedings of the National Academy of Science, EUA. 91, 7217-7221. [ Links ]
58. RAHMAN, H. 2005. Genetic analysis of stomatal conductance in upland cotton (Gossypium hirsutum L.) under contrasting temperature regimes. The Journal of Agricultural Science 143 (2-3), 161-168. [ Links ]
59. REYNOLDS, M.; PASK, A.; MULLAN, D.; CHAVEZ, Y.; DULANTO, P. 2012. Fitomejoramiento Fisiológico i: Enfoque interdisciplinarios para mejorar la adaptación del cultivo. México, D.F., CIMMYT, 174 p. [ Links ]
60. ROARK, B.; QUISENBERRY, J.E. 1977. Evaluation of cotton germplasm for drought resistance. Beltwide cotton production and research conference, National Cotton Council of America, Memphis, TN, EUA, 49-50. [ Links ]
61. ROBINSON, J. 1988. Does O2 production occur within chloroplasts in vivo? Physiol. Plant 72, 666-680. [ Links ]
62. ROFMAN, A. 1999. Economías regionales. Modernización productiva y exclusión social en las economías regionales. Revista Realidad Económica 162, 107-136. [ Links ]
63. SALISBURY, F.; ROSS, C. 1985. Plant Physiology. 3th Ed. Wadsworth. California, EUA, 540 p. [ Links ]
64. SCHONFELD, M.; JOHNSON, R.; CARVER, B. 1988. Water relations in winter wheat as drought resistance indicators. Crop Sci 28, 526-553. [ Links ]
65. SHAHENSHAH; ISODA, A. 2010. Effects of water stress on leaf temperature and chlorophyll fluorescence parameters in cotton and peanut, Plant Prod. Sci. (3): 269-278. [ Links ]
66. SIVUKAMAR, M.; SHAW, R. 1978. Relative evaluation of water stress indicators of soybeans. Agron. J. 70, 619-623. [ Links ]
67. SOKAL, R.; SNEATH, P. 1963. Principles of Numerical Taxonomy. WH Freeman & Co. 359 p. [ Links ]
68. ULLOA, M.; CANTRELL R. G., PERCY R. G, ZEIGER E., LU Z. 2000. QTL Analysis of Stomatal Conductance and Relationship to Lint Yield in an Interspecific Cotton. Journal of Cotton Science 4:10-18 [ Links ] Helvetica, sans-serif">69. WELLS, R.; MEREDITH Jr, W.R. 1986. Okra leaf normal leaf yield interactions. ii. Analysis of vegetative and reproductive growth. Crop Sci 26, 219-228. [ Links ]














