Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista veterinaria
versión On-line ISSN 1669-6840
Rev. vet. vol.30 no.1 Corrientes jun. 2019
http://dx.doi.org/10.30972/vet.3013891
TRABAJO DE INVESTIGACIÓN
Efecto protector de la vitamina C sobre el estrés oxidativo y daño al ADN en ratas con diabetes mellitus
Mendoza, C.; Flores, C.; Melendez, C.; Marquez, Y.C.; Matheus, N.
Unidad de Investigación en Ciencias Funcionales “Dr. Haity Moussatché”, Fac. Cs. Veterinarias, Universidad Centroccidental “Lisandro Alvarado”, Barquisimeto, Venezuela. E-mail: carmenmendoza@ucla.edu.ve
DOI: http://dx.doi.org/10.30972/vet.3013891
Resumen
La diabetes mellitas (DM) es una enfermedad metabólica de origen endocrino, cuya principal característica bioquímica es la hiperglucemia crónica. Desencadena procesos bioquímicos graves para el organismo como el estrés oxidativo (EO). El objetivo de este estudio fue evaluar el efecto protector de la vitamina C (VitC) sobre el EO en ratas Sprague-Dawley con DM inducida por Streptozotocina (STZ). Se utilizaron 16 ratas (100 ± 20 g), divididas en 4 grupos: 1) control, 2) STZ (diabéticas), 3) VitC + STZ, 4) VitC. En homogenizado de hígado se determinó la concentración de malondiahaldehido, dienos conjugados y proteínas totales. Por otra parte se determinaron las actividades de superóxido dismutasa y catalasa. También se midió el daño al ADN hepático por ensayo cometa. Los resultados se analizaron estadísticamente mediante programa SPSS versión 17.0 para Windows. Se aplicó un Anova y una prueba de comparación múltiple DMS (p<0,05). Se pudo evidenciar que en el grupo de animales tratados con VitC disminuyeron los niveles de glucosa y la generación de EO; también hubo menor daño del ADN por radicales libres. Estos datos permiten inferir que la VitC ejerce una efectiva acción antioxidante y protectora del hígado ante la permanente producción de radicales libres; además de ser efectiva en la reparación y conservación del ADN.
Palabras clave: rata, diabetes mellitus inducida, vitamina C, daño al ADN.
Abstract
Diabetes mellitus (DM) is a metabolic disease of endocrine origin, which main biochemical characteristic is chronic hyperglycemia. The aim of this study was to measure the protective effect of vitamin C (VitC) on oxidative stress in Sprague-Dawley rats with DM induced by Streptozotocin (STZ). We used 16 rats (100 ± 20g), divided into 4 groups: 1) control, 2) STZ (diabetics), 3) VitC + STZ, 4) VitC. In liver homogenate, the concentration of malondiahaldehido, conjugated dienes, and total proteins were determined, as well as the activity of superoxide dismutase and catalase. The ADN damage was measured by comet assay. The results were statistically analyzed using SPSS software version 17.0 for Windows. An Anova test and a multiple DMS comparison (p<0.05) were applied. In the group of animals treated with VitC a decrease in glucose levels was evidenced, as well as in the generation of oxidative stress. Less ADN damage induced by free radicals was also determined. It can be infered that VitC is an effective antioxidant and is a liver protector against to the permanent production of free radicals by diverse sources and that it is also effective in the repair and conservation of ADN.
Key words: rat, induced diabetes mellitus, vitamin C, ADN damage.
Recibido: 16 de febrero de 2018
Aceptado: 22 de junio de 2018
INTRODUCCIÓN
La diabetes mellitus (DM) comprende un grupo de trastornos metabólicos caracterizados por una concentración elevada de glucosa en sangre. Además de la hiperglucemia, el cuadro clínico incluye glucosuria, cetosis y acidosis, entre otros daños. Existen varios tipos de DM los cuales se deben a una compleja interacción entre genética, factores ambientales y estilos de vida. Los de mayor incidencia son los tipos I y II 13. En la DM tipo I ocurre destrucción de las células beta del páncreas, lo cual conlleva a una deficiencia reelativa o absoluta de insulina. Esta clase se conoce como diabetes inmunomediada y representa del 5 al 10% de los casos. La DM tipo II abarca el 90-95% de los casos y se caracteriza por grados variables de resistencia a la insulina, trastornos en la secreción de la misma y aumento de la producción de glucosa 13.
El riesgo de desarrollar DM tipo II aumenta con la edad, la obesidad y la falta de actividad física 1. La enfermedad, al estar asociada a un incremento en el riesgo de padecer patologías cardiovasculares, predispone a una muerte prematura. Asimismo, eleva la posibilidad de sufrir ceguera, insuficiencia renal y amputaciones de miembros 23.
Debido a la gran proliferación de este trastorno, para el año 2025 el número de personas con DM en el continente americano será aproximadamente de 64 millones y el 62% de los casos ocurrirán en América Latina y el Caribe 3. En Venezuela, el número de personas con diabetes varía entre 460.000 y 1.000.000 2.
Debido al aumento de su prevalencia, la DM es considerada un problema de salud pública a nivel mundial, tanto en países desarrollados como en vías de desarrollo. Su prevalencia actual es de 3,5 a 4,5%. La incidencia más alta corresponde a Finlandia, donde la prevalencia abarca entre 35 y 40 personas/100.000 habitantes, casi el doble del índice de Estados Unidos, según fue señalado en 2003. Si se tiene en cuenta el sub-registro de DM, ella alcanzaría el 6%, del cual 85% correspondería a la DM tipo II. En Venezuela, más de un millón de personas la padecen, de las cuales la mitad se encuentra sin diagnóstico 9.
El estrés oxidativo (EO) se ha relacionado con la patogénesis de la diabetes mellitus. El aumento de los radicales libres (RL) agrava la acción de la insulina a nivel periférico, contribuye a la disfunción de la célula beta pancreática 10, 19, 21 y está implicado en el desarrollo de las complicaciones crónicas 11, 12.
El organismo mantiene un balance de óxido-reducción constante, preservando el equilibrio entre la producción de pro-oxidantes que se generan como resultado del metabolismo celular y los sistemas de defensa antioxidantes. La pérdida de tal balance lleva a un estado de estrés oxidativo, el cual se caracteriza por un aumento en los niveles de RL y especies reactivas de oxígeno, que no alcanza a ser compensado por los sistemas de defensa antioxidante, causando daño y muerte celular.
Esto ocurre en patologías degenerativas de tipo infeccioso, inmune e inflamatorio, como la DM. La alteración del balance entre pro-oxidantes y antioxidantes, puede tener diversos grados de magnitud. En estados graves provoca alteraciones en el metabolismo celular, como destrucción de ADN, daño a los transportadores de iones y proteínas a través de membranas y peroxidación de lípidos 8.
En pacientes diabéticos existe un desequilibrio entre los mecanismos antioxidantes y oxidantes, habiéndose demostrado una disminución de los niveles plasmáticos de enzimas antioxidantes, de glutatión y de vitaminas antioxidantes.
Por otro lado, en estos enfermos existe evidencia de un aumento de la peroxidación lipídica mediada por radicales libres. Los antioxidantes de la dieta juegan un papel importante en la defensa frente al envejecimiento y las enfermedades crónicas como la DM, el cáncer y la enfermedad cardiovascular. Estas sustancias inactivan los RL implicados en el EO e impiden su propagación. La suplementación con antioxidantes podría tener un efecto beneficioso al mejorar la morbimortalidad de los pacientes diabéticos 5, 6, 7, de tal forma que podrían prevenir y retrasar el desarrollo de las complicaciones crónicas de la diabetes 6.
En esta investigación de corte longitudinal nos planteamos determinar el efecto protector de la vitamina C (VitC) sobre el EO en la DM experimental.
MATERIAL Y MÉTODOS
Se utilizaron 16 ratas hembras Sprague-Dawley pertenecientes a la población del Bioterio Central de la Universidad Centroccidental de Barquisimeto (Venezuela). El peso promedio de las ratas fue de 100 g. Se mantuvieron en jaulas individuales, con libre acceso al agua y una dieta comercial estándar, bajo ciclos de luz de 12 horas.
Las ratas fueron divididas en cuatro grupos: 1 = control, grupo 2 = diabéticas (inyectadas con streptozotocina (STZ) a dosis de 60 mg/kg de peso, grupo 3 = VitC + STZ (tratados con VitC 700 mg/kg via oral + STZ) y grupo 4 = tratados con VitC).
En el día 1 del experimento, a todos los animales se les extrajo una muestra de sangre (sin someterlos a ayuno), por medio de una punción cardiaca. La sangre se centrifugó a 3500 revoluciones por minuto, durante 15 minutos, a 15°C en una centrífuga Eppendorf 5402 (Westburry, NY, USA).
En el plasma se determinó el nivel de glucosa por el método enzimático de Trinder (1969) 20 mediante kit Qualitest. Estos análisis sanguíneos se repitieron el día del sacrificio. A las ratas de los grupos 2 y 3 se les indujo diabetes por administración de una inyección intraperitoneal de STZ (60 mg/kg por cada 1000 g de peso corporal) diluida en buffer citrato de sodio.
A los grupos experimentales 3 y 4 se les administró el tratamiento con VitC (700 mg/kg en el agua de bebida, durante 6 días), a partir del quinto día de la inducción de diabetes. Luego de un ayuno de 12 h las ratas se sacrificaron bajo ligera eterización y se disecó el hígado para obtener un homogeneizado del tejido, registrándose su aspecto macroscópico.
El homogenizado fue mantenido en hielo y en el sobrenadante se determinaron los niveles de las concentraciones de malondialdehido (MDA) por el test para sustancias reaccionantes con el ácido 2-tiobarbitúrico (técnica de Ohkawa 1979), dienos conjugados (DC) por el método descrito por Wallin (1993) 22 y proteínas totales mediante el kit BioRad Richmond, basado en el método de Bradford (1976) 4.
Se utilizó como estándar una solución madre de 1,41 mg/ml de albúmina sérica bovina y luego un trozo del hígado se homogenizó con sacarosa 0,25 M y se diluyó al 10% p/v para centrifugarse a 12.000 rpm a 4°C durante 10 minutos. Se separó el sobrenadante con pipeta Pasteur y en él se determinó la actividad de la superóxido dismutasa (SOD) mediante un kit comercial (Calbiochem).
Otro trozo de tejido hepático fue homogenizado con la solución buffer provista por el kit Calbiochem y en el sobrenadante se determinó la actividad de la catalasa (CAT) mediante el protocolo de Aebi. Para medir el daño al ADN hepático en ratas ocasionado por la DM, se realizó una electroforesis en células individuales (“ensayo cometa”), técnica basada en la capacidad de los fragmentos de ADN para ser embebidos en un gel de agarosa y responder a un campo eléctrico. La corrida del extendido de ADN depende directamente del daño del ADN presente en las células.
Es importante mencionar que las lesiones al ADN consisten en rotura de las cadenas después del tratamiento con álcali o sin éste, e incluso de la combinación con ciertas enzimas, lo cual incrementa la migración de ADN. Esta técnica permite detectar daños en el ADN de una célula en condiciones experimentales de pH alcalino, y permite revelar la presencia de rompimiento en una hebra simple o doble del ADN en los sitios lábiles a la alcalinidad.
Así, las células en estudio son colocadas en agarosa, lisadas y luego sometidas a electroforesis bajo condiciones específicas. En la lisis, las células pierden sus proteínas y no son capaces de reparar el ADN dañado. Durante la electroforesis, el ADN dañado y fragmentado migra dentro del gel desde el núcleo hacia la dirección del ánodo. La cantidad de ADN migrado constituye una medida de la extensión del daño.
La observación del ADN se realizó a través de la tinción con el colorante bromuro de etidium, siendo examinado por fluorescencia de emisión con un filtro de excitación de 515 nm y emisión de 560 nm. Las células que contienen ADN dañado aparecen después de la electroforesis con una apariencia de cometa, con una cabeza brillante y una cola. Por el contrario, las células que contienen ADN sin lesión, aparecen con un núcleo intacto y sin cola 18.
Los resultados fueron analizados estadísticamente mediante el programa SPSS versión 17.0 para Windows, aplicándose una prueba Anova y otra de comparación múltiple con diferencia mínima significativa-DMS (p<0,05).
RESULTADOS Y DISCUSIÓN
El estudio realizado evidenció un aumento de los niveles de glucosa sanguínea en las ratas tratadas con STZ. Los datos confirmaron el efecto diabetogénico provocado por este compuesto, el cual se manifiesta hasta los 7 días post-inducción (Figura 1). Este resultado coincide con el obtenido por otros investigadores, quienes señalan que la STZ genera un efecto diabetogénico en los animales de laboratorio 10, 16.
También se ha demostrado que la administración de altas dosis de STZ en animales de laboratorio causa la muerte de las células beta de los islotes de Langerhans del páncreas en 24 h y su administración en dosis baja permite realizar el estudio citotóxico de este compuesto 14.
El incremento de la concentración de glucosa ocasiona aumento proporcional de productos de la glicosilación no enzimática, que pueden ser escasamente dañinos si se logra un buen control metabólico, pero en caso contrario generan productos finales de la glicosilación avanzada, con degradación oxidativa y liberación de RL que dañan la estructura y funcionalidad de las proteínas 17.
El desbalance entre la producción de RL y antioxidantes genera estrés oxidativo, el EO leve puede llevar a la célula a tener más resistencia para injurias posteriores en una buena regulación de los sistemas de defensa antioxidante. Por el contrario, si el EO es muy intenso, afectaría a todos los componentes de la célula (ADN, lípidos y proteínas) 15.
Además del característico cuadro hiperglucemiante crónico, la DM es responsable de este tipo de complicaciones, por lo que a lo largo de los años se han buscado alternativas terapéuticas para mejorar la calidad de vida de pacientes diabéticos, como es el caso de la VitC, la cual -por sus beneficios- ha sido utilizada como antioxidante.
En esta investigación se midió el efecto protector de la VitC ante la generación de estrés oxidativo y daño al ADN en ratas con diabetes experimental. En cuanto al grado de EO, se pudo apreciar un efecto hepatoprotector de la VitC, evidenciado por una disminución muy significativa (p<0,05) de los niveles de MDA (nmoles/ mg de proteínas) en el grupo de diabéticos tratados con VitC, al compararlo con el grupo control (Figura 2). En el caso de los DC, productos iniciales del proceso de lipoperoxidación, se observó una disminución de los mismos en los animales tratados con el antioxidante respecto al control (Figura 3).
Al medir la enzima SOD se observó (Figura 4) un aumento significativo de su actividad (p<0,05) expresada en U/ml en el grupo de animales tratados con VitC, al compararlo con el grupo control. En forma similar, se obtuvo un aumento significativo en la actividad de CAT (Figura 5).
Existe evidencia experimental que indica que el EO puede determinar el comienzo y la progresión de las complicaciones tardías de la DM; sin embargo hay controversia respecto a si su aumento es asociativo o causal de esta enfermedad. Se ha demostrado que existe aumento de RL acompañado de una disminución de agentes antioxidantes en pacientes diabéticos 6 .
Los radicales libres son átomos o moléculas que en su último orbital tienen un electrón no apareado; al tratar de obtener su estabilidad, puede afectarse la fisiología de las células al oxidar a los lípidos de membrana, a los carbohidratos, a las proteínas o al ADN, lo cual sería un daño causado por el EO 8. En esta investigación se midió el efecto de la VitC sobre la posible alteración en el ADN causado por el EO.
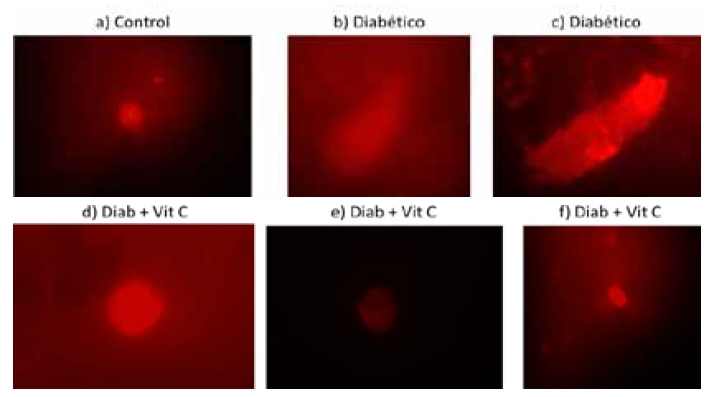
En la Figura 6 se puede observar la migración del ADN, al formarse una imagen nítida de la “cola del cometa”, obtenida en los animales diabéticos. Por el contrario, la imagen proveniente del grupo control no revela migración, ni formación de la cola, mientras que en las provenientes del grupo tratado con VitC se observó una leve migración y -en algunos casos- imágenes muy similares al grupo control. Ello permite inferir que la VitC previene daños en el ADN, característicos en los pacientes con diabetes.
En conclusión, surge que la vitamina C constituye un efectivo antioxidante y un importante protector del hígado, ante la producción permanente de radicales libres por diversas fuentes, además de ser efectiva en la reparación y conservación del ADN.
Agradecimientos. Este trabajo fue financiado por el Consejo de Desarrollo Científico, Humanístico y Tecnológico (CDCHT) de la Universidad Centroccidental Lisandro Alvarado (Venezuela), a través del proyecto de Código 014-VE-2012.
Figura 1. Efecto de la vitamina C sobre la glucemia de ratas controles y experimentales con diabetes (X±DS). Asterisco indica diferencia significativa (*p<0,05).
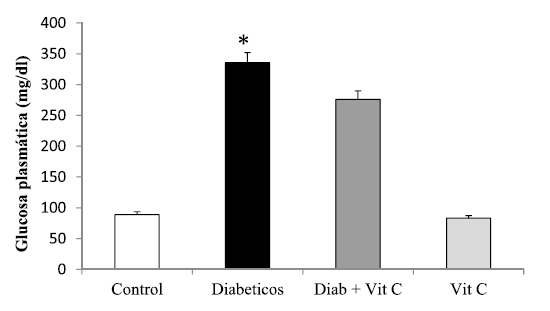
Figura 2. Efecto de la vitamina C sobre la concentración hepática de malon-dialdehido en ratas controles y experimentales (X±DS). Asterisco indica *p<0,05.
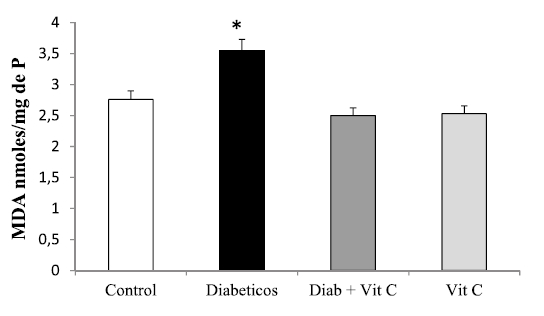
Figura 3. Efecto de la vitamina C sobre la concentración hepática de dienos conjugados en ratas controles y experimentales (X±DS). Asterisco indica *p<0,05.
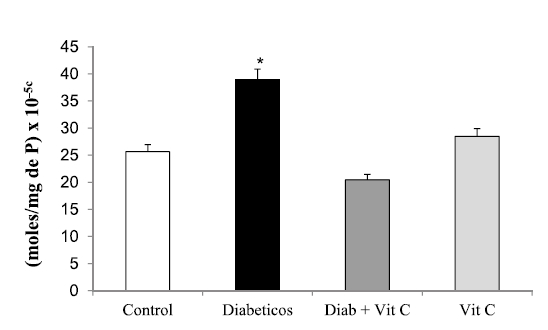
Figura 4. Efecto de la vitamina C sobre la concentración hepática de superóxido dismutasa en ratas controles y experimentales (X±DS). Asterisco indica *p<0,05.
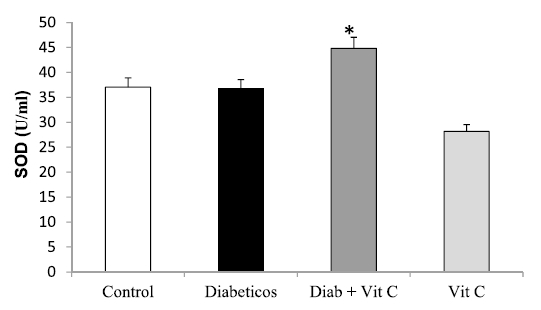
Figura 5. Efecto de la vitamina C sobre la concentración hepática de catalasa en ratas controles y experimentales (X±DS). Asterisco indica *p<0,05.
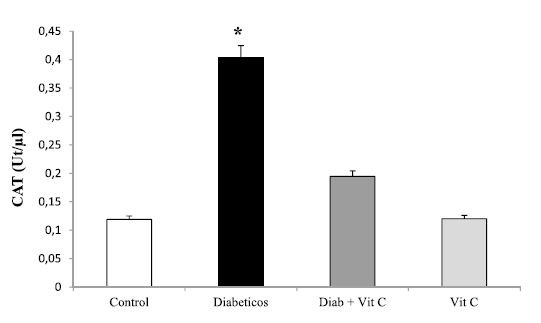
Figura 6. Electroforesis en células individuales (ensayo cometa). Imágenes de cometas encontrados en las muestras hepáticas con y sin tratamiento de vitamina C (Vit C) en ratas con diabetes experimental (Diab). 40X.
REFERENCIAS
1. American Diabetes Association. 2012. Diagnosis and classification of diabetes mellitus. URL: http://www.diabetes.org/diabetes-basics/diagnosis/
2. Avilán J. 2004. Epidemiología de la diabetes en Venezuela. Gaceta Méd Caracas, 112: 3-65. [ Links ]
3. Barceló A, Rajpathak S. 2001. Incidence and prevalence of diabetes mellitus in the Americas. Rev Panam Salud Púb 10: 5. [ Links ]
4. Bradford MM. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem 72: 248-254. [ Links ]
5. Brown AA, Hu FB. 2001. Dietary modulation on endothelial function: implications for cardiovascular disease. Am J Clin Nutr 71: 673-686. [ Links ]
6. Ceriello A, Motz E. 2004. Is oxidative stress the pathogenic mechanism underlying insulin resistance, diabetes and cardiovascular disease? The common soil hypothesis revisited. Arterioscler Thromb Vasc Biol 24: 816-823. [ Links ]
7. Ceriello A, Testa R. 2009. Antioxidant anti-inflammatory treatment in type 2 diabetes. Diabetes Care 32: 32-36. [ Links ]
8. Chacín L. 1999. Diabetes en Venezuela. http://www.diabetes. al.dia.com/diabetes_en_venezuela.htm#scene_1 [Consulta: 2002, Mayo 27]. [ Links ]
9. Dorado CM, Rugerio CV, Rivas SA. 2003 Estrés oxidativo y neurodegeneración. Rev Fac Med UNAM 6: 46. [ Links ]
10. Evans JL, Goldfine IP, Maddus BA, Grodsky GM. 2003. Are oxidative stress-activated signaling pathways mediators of insulin resistance and beta-cell dysfunction? Diabetes 52: 1-8. [ Links ]
11. Forbes JM, Coughlan MT, Cooper ME. 2008. Oxidative stress as a major culprit in kidney disease in diabetes. Diabetes 57:1446-1454. [ Links ]
12. Giugliano D, Ceriello A, Paolisso G. 1996. Oxidative stress and diabetic vascular complications. Diabetes Care 19: 257-267. [ Links ]
13. Harrison T. 2006. Principios de Medicina Interna, 16 ed., Mc Graw Hill, Méjico, p. 2367. [ Links ]
14. Hugues B, Rodríguez J, García J. 2001. Animales de laboratorio en la endocrinología: biomodelos de la diabetes mellitus tipo 1. Rev Cubana Endocrinol 12: 168-177. [ Links ]
15. Kawada J. 1992. New hypotheses for the mechanisms of streptozotocin and alloxan inducing diabetes mellitus. Yakugaku Zasshi 112: 773-791. [ Links ]
16. Ohkawa H, Ohishi N, Yagi K. 1979. Assay for lipid peroxidation in animal tissues by thiobarbituric acid reaction. Ann Biochem 95: 351-358. [ Links ]
17. Organización Mundial de la Salud. 2001. Boletín Epidemiológico 22: 2. URL: http://www.paho.org/spanish/sha/be_v22n2-diabetes.html [ Links ]
18. Patton W, Chakravarthy U, Davies J, Archer D. 1999. Comet assay of UV-induced DNA damage in retinal pigment epithelial cells. Invest Ophthalmol & Visual Sci 40: 3268-3275. [ Links ]
19. Robertson R, Harmon J, Oanh P, Poitout V. 2004. Beta cell glucose toxicity, lipotoxicity and chronic oxidative stress in type 2 diabetes. Diabetes 53: 119-124. [ Links ]
20. Trinder P. 1969. Determination of blood glucose using an oxidase-peroxidase system with a non-carcinogenic chromogen. J Clin Path 22: 158-161. [ Links ]
21. Venereo JR. 2002. Daño oxidativo, radicales libres y antioxidantes. Rev Cubana Med Milit 31: 126-133. [ Links ]
22. Wallin B, Rosengren B, Shertzer H, Camejo G. 1993. Lipoprotein oxidation and measurement of thiobarbituric acid reacting substances formation in a single microtiter plate: Its use for evaluation of antioxidants. Analyt Biochem 208: 10-15. [ Links ]
23. Wen Y, Skidmore JC, Porter MM, Rea CA, Khokher MA, Singh BM. 2002. Relationship of glycation, antioxidant status and oxidative stress to vascular endothelial damage in diabetes. Diabetes Obes Metab 45: 305-308. [ Links ]














