Introducción
El comportamiento de los peces es tan diverso como su morfología23. Esta diversidad se ve también reflejada en las diferentes estructuras gonadales, las estrategias reproductivas y los modos de cuidado parental encontrados en este grupo2,22. A pesar de la gran variabilidad de estrategias reproductivas presentes, la organización básica del ovario de los peces está notablemente conservada20,25.
En la gran mayoría de los Teleósteos, los ovarios son uniformes con forma sacular, ubicado longitudinal y dorsalmente a la cavidad celómica, unidos a la pared del cuerpo a través del mesovario8,9) . La cavidad ovárica es continua con oviductos que se unen caudalmente y terminan en la papila urogenital7,10.
Las células madre de la línea germinal persisten toda la vida y se dividen continuamente dando lugar a las ovogonias que entran en la ovogénesis. La ovogénesis es el proceso por el cual las ovogonias se convierten en ovocitos capaces de ser fecundados. Por lo tanto no hay límite en el número de ovocitos que se pueden producir31.
Después de la diferenciación sexual y al comienzo de cada ciclo reproductivo, las células germinales se dividen varias veces por mitosis 30. Por lo tanto, se autrenuevan y/o se diferencian en ovogonias, que se juntan en racimos o nidos. En los nidos entran en meiosis dando lugar a ovocitos que avanzan a la profase de la primera división y la misma se detiene en diploteno12,13.
Las células epiteliales prefoliculares que se originan en las laminillas ovígeras, envuelven al ovocito en diploteno aislándolo y sintetizando gradualmente la membrana basal. Posteriormente los ovocitos abandonan los nidos pero permanecen conectados al epitelio germinal12,13,16. Desde el tejido conectivo circundante, las células pretecales se disponen alrededor del folículo en formación, sobre la membrana basal recién sintetizada, y dan lugar a tecas. Esto completa la formación del complejo folicular12. Posteriormente comienza el desarrollo primario y secundario de dicho folículo.
El inicio y la terminación de la vitelogénesis ocurren durante el crecimiento de los ovocitos secundarios. En el proceso, la vitelogenina, sintetizada y secretada por el hígado, llega a la superficie de los folículos en crecimiento a través de la circulación, y se difunde a través de la membrana basal que separa las células tecales de las células foliculares, a través de espacios intercelulares en el epitelio folicular 10,15.
El conocimiento sobre la morfología ovárica y la foliculogénesis en peces está limitado a unas pocas especies utilizadas en investigación básica y/o biotecnología de acuacultura (por ejemplo: bagre, bacalao, anguila, lebistes, medaka, salmón, tilapia, trucha y pez cebra)27. La morfología de las gónadas ha sido estudiada para identificar el ciclo anual reproductivo y la extensión de las estaciones de cría.
Gymnotus carapo es conocida vulgarmente como “morena”. Está incluida en el orden Gymnotiformes y posee una amplia distribución que incluye las cuencas de los ríos Paraná, Paraguay, Uruguay y Río de la Plata1 . Es una especie de hábitos nocturnos que durante el día permanece debajo de camalotes u otra vegetación flotante4.
Estudios sobre la biología reproductiva de Gymnotus sp han sido abordados por diversos autores3,6,10,17,32. Sin embargo, información detallada sobre los aspectos histológicos del proceso de foliculogénesis durante todo el ciclo reproductivo, no están disponibles.
Por lo antes expuesto, el objetivo del presente trabajo fue estudiar la morfología ovárica y la foliculogénesis de Gymnotus carapo, a partir del análisis morfológico e histoquímico, con el fin de aportar información sobre su biología reproductiva y su utilidad en el manejo de dicha especie como recurso pesquero.
Material y métodos
Área de estudio
Los muestreos fueron realizados quincenalmente entre los meses de febrero y diciembre del 2019 en cuerpos de aguas lénticos en cercanías a la ciudad de Corrientes, 10 km en dirección NE (Paraje Perichón: 27° 26’ 36.6” S58° 45’ 14.0”W). Fitogeográficamente, el sitio de muestreo se ubica en el Chaco Húmedo. El clima es subtropical o mesotermal5, con un gradiente de temperatura media anual que oscila de norte a sur entre los 21°C y 19.5°C, siendo enero el mes más cálido (media anual, 27°C) y julio el mes más frío (media anual, 14°C).
Metodología de captura y procesamiento del material
Se efectuó la captura manual de un total de 40 hembras de Gymnotus carapo. Para el sexado se siguió la metodología propuesta para este género29. Los animales fueron traslados al laboratorio en bolsas plásticas y posteriormente se procedió a la eutanasia de los ejemplares con sobredosis de lidocaína al 0,2%, siguiendo el protocolo establecido en la Guía para la eutanasia animal propuesta por la IACUC (The Institutional Animal Care and Use Committee) bajo las normas del comité de ética de la Facultad de Ciencias Veterinarias-UNNE.
Análisis morfológico
Para el análisis macroscópico de los ovarios se procedió a la disección de los ejemplares y posterior observación bajo microscopio estereoscópico y aislamiento del sistema reproductor. Los ovarios fueron fijados en formol con pH 7,4 al 10%. Fueron observados y fotografiados bajo lupa estereoscópica.
Análisis histológico
Con los ovarios previamente fijados en formol al 10% con pH 7,4, se elaboraron preparados histológicos siguiendo la técnica convencional de deshidratación, inclusión en parafina y coloración. La deshidratación se realizó en concentraciones crecientes de alcohol etílico (70, 80, 96 y 100%), el aclaramiento se realizó con xilol. Se llevó a cabo la inclusión en xilol-parafina (50% y 50%) durante 12 h y 3 baños de parafina de 2 h cada uno. Finalmente se confeccionaron tacos orientando las muestras para la obtención de secciones transversales o longitudinales de 5 a 7 ^. Estas fueron obtenidas con micrótomo rotatorio tipo Spencer manual. Las muestras fueron coloreadas con Hematoxilina-Eosina (H-E) y Tricrómica de Gomori para la caracterización citológica e histológica general y la reacción histoquímica de PAS-H (Periodic Acid-Schiff-Hematoxilina) para la detección de glicosaminoglicanos ácidos primariamente carboxilados19 . Los preparados fueron observados y fotografiados con un sistema compuesto por un microscopio trinocular marca LEICA, modelo DME 500, perteneciente al Departamento de Biología de la Facultad de Ciencias Exactas y Naturales y Agrimensura-UNNE.
Resultados
Estructura ovárica
El ovario de G. carapo es un órgano alargado, impar y bilobulado hacia la región anterior. Dependiendo del estadio en el que se encuentre, se lo puede observar de color naranja con bordes irregulares por la presencia de los folículos vitelogénicos y con gran vascularización (Figura 1 A), mientras que si el estado en el que se lo observa es el de post-desove, el ovario se ve translúcido con pocos ovocitos atrésicos y grandes vasos (Figura 1 B).
Debido a la posición del poro urogenital, ubicado justo debajo de la cabeza, cerca de la abertura del opérculo, el ovario tiene su porción craneal en una posición posterior y el caudal está en una posición anterior, en relación con el cuerpo del animal.
Se encuentra envuelto por una cápsula de tejido conjuntivo, la túnica albugínea, la cual emite septos hacia el interior del ovario constituyendo las lamelas ovuligeras, que delimitan el lumen ovárico, el epitelio germinativo de las lamelas se encuentra constituido por células de la línea germinativa y por células somáticas (Figura 1.
C) Los ovarios se continúan con dos oviductos, los cuales son estructuras pares, que parten de cada lóbulo de la porción anterior del ovario (Figura 1 B). Los conductos están ubicados anteriormente en la cavidad celomática y conectan el órgano a la papila urogenital.
Foliculogénesis
Las ovogonias de G. carapo sufren varias mitosis, y las que no continúan el ciclo, se renuevan y permanecen como células madre (Figura 2 A). Las células que han sido reclutadas para la reproducción continúan dividiéndose por mitosis y forman nidos, que tienen células prefoliculares en su periferia (Figura 2 B). El nido puede estar compuesto por varios grupos de células germinales, que pueden estar en diferentes etapas de desarrollo.
Las ovogonias entran en la meiosis, originando los ovocitos. En la profase de la primera división meiótica (en paquitene), los cromosomas homólogos se emparejan seguidos de su condensación (Figura 2 C), y luego los ovocitos entran en diplotene, entre el final del paquitene y al comienzo del diplotene los ovocitos comienzan a cubrirse por células epiteliales prefoliculares y dejan los nidos (Figura 2 D).
Los ovocitos diploténicos iniciales tienen un núcleo redondo y un citoplasma ligeramente basófilo (Figura 2 E) debido al comienzo de la acumulación de ARN. Con la amplificación nucleolar el núcleo de los ovocitos comienza a contener múltiples nucléolos periféricos (Figura 2.
F) Antes del final de la formación del folículo, comienza el crecimiento primario. El folículo formado está constituido por el ovocito diploténico inicial rodeado por la zona radiada (en formación), células foliculares y membrana basal. Una vez que la teca está organizada, finaliza la formación del complejo folicular.
Desarrollo folicular
En el crecimiento primario y la síntesis de componentes citoplasmáticos, los orgánulos membranosos en el ovocito son intensos, lo cual hace que éste tenga un aumento significativo de volumen al final del proceso; también se hace visible el cuerpo de Balbiani (Figura 3A).

Figura 1: A) Detalle macroscópico del ovario maduro de Gymnotus carapo. B) Detalle macroscópico del ovario post-desove de Gymnotus carapo. C) Corte transversal del ovario con detalle del lumen y lamelas ovulígeras con el epitelio germinal (coloración: hematoxilina-eosina H-E). Referencias : punta de flecha: túnica albugínea. Ov: ovario. Ovi: oviducto. Líneas de puntos: epitelio germinal. Lu: lumen.
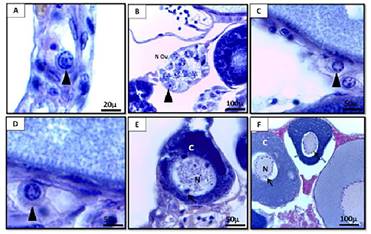
Figura 2: A) Corte transversal del ovario de Gymnotus carapo con detalle de un ovogonio (coloración: H-E). B) Detalle de los nidos germinales de ovogonios en el ovario de Gymnotus carapo (coloración: H-E). Detalle de ovocito en paquitene (coloración: H-E). Detalle de ovocito en diplotene (coloración: PAS- H). E) Detalle de folículo en crecimiento (coloración: H-E) F) Detalle de folículo con nucléolos peri nucleolares (coloración: H-E). Referencias: punta de flecha: ovocitos en distintas fases de la meiosis. N Ov: nio de ovogonios. N: núcleo. C: citoplasma. Flecha: nucléolos.
Poco a poco el citoplasma se vuelve más basófilo y los orgánulos se dispersan formando surcos por todo el citoplasma. El núcleo, que inicialmente tiene un contorno regular, se vuelve irregular y los alvéolos corticales comienzan su formación, lo cual caracteriza al ovocito en el estadio alvéolo-cortical (Figura 3.
B) Al comienzo de la deposición de los alvéolos corticales en el ovocito, estos son dispersados por el citoplasma en vesículas más pequeñas, que con el desarrollo del ovocito se vuelven progresivamente más grandes y constituyen las grandes vesículas, que en esta etapa se ubican en el región cercana al núcleo (Figura 3.
C) Concomitante con el desarrollo folicular, se produce la deposición de la membrana basal, que se deposita en capas, y se espesa con el desarrollo del folículo, haciéndolo muy visible en microscopía óptica (Figura 3D). Las células foliculares forman una sola capa.
En crecimiento secundario, el ovocito tiene un núcleo de forma irregular y múltiples nucléolos ubicados por debajo de la envoltura nuclear (Figura 3 D). Poco a poco el ovocito incorpora vitelogenina, producida por el hígado, que alcanza al ovocito por endocitosis. Las vesículas formadas se fusionan y forman gránulos de vitelo, que se tiñen fuertemente con PAS, para indicar la presencia de glicoproteínas (Figura 3.
E) Con la creciente acumulación de vitelo, el ovocito aumenta de tamaño y los alvéolos corticales recién formados se mueven a una posición más periférica (Figura 3 F). Durante el período de vitelogénesis, los polisacáridos ácidos y neutros se producen e incorporan en los alvéolos (Figura 4 A). La monocapa de células foliculares cambia de plana a cúbica (Figura 4 B). Alrededor del folículo, en una distribución discontinua, es posible observar la presencia de células de la teca (Figura 4 B).

Figura 3: A) Detalle de folículo pre-vitelogénico en crecimiento, presencia del cuerpo de Balbiani (Coloración H-E). B) Detalle de folículo en crecimiento primario con alvéolos corticales (Coloración H-E). C) Corte transversal del ovario de Gymnotus carapo con folículos en distintas fases del crecimiento, con tamaños variables de los alvéolos corticales (Coloración: H-E). D) Detalle de la membrana basal y células foliculares y tecales del folículo (Coloración: H-E). Detalle de los alvéolos corticales del folículo en crecimiento (Coloración: PAS-H-E). F) Detalle de los folículos con la presencia de los alvéolos corticales de gran tamaño y periféricos (Coloración: H-E). Referencias: punta de flecha folículos pre-vitelogénicos. N: núcleo. C: citoplasma. CB: cuerpo de Balbiani. MB: membrana basal. CF: células foliculares. T: células tecales. AC: alveolos corticales. GV: gránulos de vitelo.
En la etapa de maduración, los ovocitos muestran el citoplasma lleno de yema con gránulos y alvéolos corticales de diferentes tamaños (Figura 4C). Las células de la capa folicular toman una forma columnar con un núcleo redondo en la base y numerosos vesículas en el citoplasma. Las células de la capa de la teca muestran la misma forma, y se destaca de la capa folicular por la membrana basal.
Otro tipo de folículos que pueden observarse en el ovario son los folículos atrésicos y cuerpos residuales con lipofucsina, los cuales son comunes en los ovarios post-desove (Figura 4 D).
Discusión
El estudio de la ovogénesis en peces es un paso básico para mejorar la comprensión de las siguientes fases del desarrollo, como lo referente al hecho que los ovocitos pueden entrar en crecimiento primario y continuar el proceso. La descripción de la foliculogénesis en G. carapo permite una comprensión detallada del proceso inicial de ovogénesis, como la proliferación mitótica de estas células, dando lugar a nidos y racimos de ovogonias, así como ovocitos en desarrollo de la profase hasta alcanzar la fase de diplotene, que implica la formación de folículos ováricos.

Figura 4: A) Detalle de los alveolos corticales en folículos en crecimiento secundario de Gymnotus carapo (Coloración: tricrómica de Gómori). B) Detalle de los folículos en crecimiento secundario y células foliculares y tecales (Coloración: H-E). C) Detalle de los folículos en fase de vitelogénesis (Coloración: H-E). D)Detalle de folículos atrésicos y cuerpos residuales. Referencias: GV: gránulos de vitelo. MB: membrana basal. CF: células foliculares. AC: alveolos corticales. Fvit: folículos vitelogénicos. FAtr: folículo atrésico. CR: cuerpos residuales
Para la mayoría de los Teleosteos, las gónadas están localizadas longitudinal y dorsalmente a la cavidad celomática, unida a la pared del cuerpo por el mesovario23,28,32. La orientación de Gymnotus carapo en la cavidad celomática difiere del encontrado para la mayoría de Teleosteos, ya que se encuentra en una posición similar a la de los Pleuronectiformes (Solea senegalensis), que también tiene la papila urogenital en la región anterior11. El patrón más comúnmente observado es incluso ovarios saculiformes ubicados longitudinal y dorsalmente a la cavidad celomática, adheridos a la pared corporal por el mesovario. A diferencia de los mamíferos, son cavidades con el compartimiento germinal en forma de laminilla que se proyectan desde la cápsula hacia la luz del órgano.
La cavidad ovárica es continua con los oviductos que se unen caudalmente y terminan en la papila urogenital7, 21 Internamente ambos ovarios de G. carapo tienen las mismas características, son órganos cavitarios, cubiertos externamente por la túnica albugínea, que emiten tabiques en el órgano que constituye el soporte de las laminillas ovígeras.
Los diferentes tipos de ovogonias observados en el epitelio germinal de G.carapo también se observaron en otros grupos de peces, como Siluriformes Pimelodus maculatus (26 lo que demuestra que es una característica bien conservada en los peces.
En G. carapo el epitelio de la laminilla ovígera está formado por células epiteliales y ovogonias, que proliferan por mitosis. Cuando se describió el epitelio de la línea germinal femenina de Centropomus undecimalis, se observó que la producción ilimitada de ovocitos en las hembras de Teleosteos se debe a la constante proliferación de ovogonias situadas de manera discontinuas entre las células epiteliales de la laminilla ovárica13,18. Las ovogonias pueden evolucionar individualmente hacia la meiosis, o pueden entrar simultáneamente en la meiosis formando nidos de ovocitos13,15,16.
Las ovogonias solas o en grupos nunca hacen contacto directo con células ováricas, es decir, siempre están rodeadas de células epiteliales. Cuando no están completamente envueltas, las ovogonias se asientan directamente sobre la membrana basal, y en proliferación forman agregados celulares por encima de la membrana basal. Las células derivadas del epitelio, emiten procesos citoplasmáticos que involucran e individualizan a las ovogonias, formando grupos más pequeños15.
Las células de la teca resultan de la diferenciación de las células mesenquimales presentes en el estroma13,16, que rodean el folículo excepto en la región que comparte con el epitelio16. En Ilyodon whitei, una especie vivípara perteneciente a la familia Goodeidae, es posible observar que en realidad los nidos de ovocitos y posteriormente los ovocitos individuales, permanecen conectados a la epitelio, con el que comparten una cierta extensión de la membrana basal16.
La participación de las células somáticas en la formación del folículo ovárico para diferenciarse en células foliculares fue descrita por primera vez como una característica comúnmente observada en Teleosteos16. Esta condición también se describe para G. carapo. Lo que se pudo evidenciar en el presente trabajo es la forma como los ovocitos se aíslan tras el alargamiento de las células prefoliculares, proceso que comienza en la etapa tardía del paquitene.
El crecimiento primario en G. carapo comienza antes de la formación completa del folículo o antes de que el ovocito esté completamente rodeado por el complejo folicular. El mismo se inicia cuando la meiosis se detiene en diplotene24. Durante el crecimiento primario de los ovocitos, se genera una síntesis intensa de ARN, resultando en una basofilia citoplasmática15,33.
En G. carapo el desarrollo de los ovocitos en sí se dividió en tres etapas: crecimiento primario, crecimiento secundario y maduración. Durante el desarrollo de los ovocitos perciformes, orden que ha sido referencia para determinar las etapas del desarrollo de los ovocitos en teleósteos, en el crecimiento primario ocurre la deposición de gotas de lípidos alrededor del núcleo, y en la maduración, las gotas de lípidos se fusionan en una sola gota, los gránulos de vitelo se fusionan y las proteínas de la yema se hidrolizan14,15,16,24.
A diferencia de las especies de perciformes marinos, ninguna de las características mencionadas anteriormente fue observada en los ovocitos de G. carapo, excepto que hay una fusión de los gránulos parciales de vitelo que se producen durante la maduración.
Como se pudo evidenciar a partir de este análisis, el ovario y los ovocitos de G. carapo experimentan diferentes etapas de desarrollo: crecimiento primario, secundario, vitelogénesis y maduración durante el ciclo reproductivo, información que sienta base para estudios futuros sobre biología reproductiva.
La información brindada en el presente trabajo aporta un estudio histológico detallado que describe la morfología ovárica y foliculogénesis en G. carapo y contribuye a la gestión y planificación de conservación de especies que son de importancia para el recurso pesquero.














