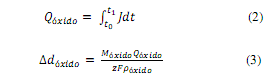Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Anales (Asociación Física Argentina)
versión impresa ISSN 0327-358Xversión On-line ISSN 1850-1168
An. AFA vol.28 no.2 Tandil jun. 2017
MATERIA CONDENSADA
Evaluación de las propiedades semiconductoras de la película de óxido de titanio sobre el sustrato vidrio/Ti/TiO2 en una solución ácida diluida
Semiconductor properties OG titaniun oxide formed on glass/Ti/TiO2 substrates in diluted acid solution
F.A. Filippina, E. Santosb, L.B. Avalleb
a Departamento de Física. Facultad de Ciencias Exactas y Naturales. Universidad Nacional de Catamarca Av. Belgrano 300 – (4700) Catamarca – Argentina
b Instituto de Física Enrique Gaviola de Córdoba. CONICET-UNC. Medina Allende, Ciudad Universitaria, X5000HUA Córdoba – Argentina
e-mail: filippin18@hotmail.com
Recibido
El titanio (Ti) es un material termodinámicamente estable ante la corrosión, debido a la presencia de una película de óxido pasiva sobre su superficie formada espontáneamente. La película de óxido pasiva está compuesta de dióxido de titanio (TiO2) que puede ser formada por oxidación térmica o por anodización; estas presentan características de un semiconductor. Las propiedades semiconductoras de películas de óxido formadas anódicamente, han sido interpretadas por representaciones gráficas de Mott-Schottky. En esta presentación se utilizó el modelo de Mott-Schottky para calcular las propiedades electrónicas de la superficie semiconductora de un sustrato vidrio/Ti/TiO2 crecido potenciodinámicamente, a un potencial de formación de la película de óxido anódico de Ef = 1,85 V vs ENH (electrodo normal de hidrógeno) en 0,01M HClO4. Bajo las condiciones experimentales descritas en este trabajo el electrodo vidrio/Ti/TiO2 presenta un comportamiento de un semiconductor tipo-n y una concentración de vacantes de oxígeno del orden de 1022 cm-3. Finalmente, el óxido anódico formado sobre el sustrato vidrio/Ti/TiO2 fue estable antes y después de los ensayos realizados.
Palabras clave: Dióxido de titanio; Anodización; Mott-Schottky.
Abstract
The spontaneously formed TiO2 film on titanium metal confers high resistance properties to corrosion in different environments. Titanium oxide films can be formed by thermal and electrochemical external perturbations up to different thicknesses, these present characteristics of a semiconductor. The semiconductor properties of anodically formed oxide films have been interpreted by graphic representations of Mott-Schottky. In this report, the TiO2 growth was carried out using potentiodynamic conditions, where the highest positive potential limit Ef was 1.85 V vs NHE (Normal Hydrogen Electrode) in 0.01 M HClO4. The oxide formed was stable in the potential region studied in this report. By Mott-Schottky analysis the electrode glass/Ti/TiO2 has a concentration of oxygen vacancies of the order of 1022 cm-3. From this result the oxide films have proved to have n-type semiconductor characteristics.
Keywords: Titanium dioxide; Anodization; Mott-Schottky.
Recibido: 02/04/17;
Aceptado: 09/05/17
I. INTRODUCCIÓN
Los óxidos metálicos presentan estructuras electrónicas que van desde aislantes a semiconductores, metales y superconductores. En una estructura aislante típica un band gap de energía se encuentra entre la banda de valencia (ocupada), formada principalmente por estados de oxígeno y la banda de conducción (vacía), compuesta por estados metálicos. Un band gap grande indica una estabilización alta de los niveles de oxígeno y una desestabilización de los niveles metálicos que corresponde a materiales inertes, tradicionalmente, (MgO, SiO2, Al2O3). Por el contrario, el band gap pequeño está asociado con una reactividad alta, los niveles de oxígeno en la banda de valencia se encuentran desestabilizados y los niveles metálicos están estabilizados (TiO2, SnO2, V2O5). Los sistemas más reactivos como TiO2 y SnO2 (dióxido de estaño) son óxidos semiconductores, con un band gap aproximadamente de 3 eV, que pueden ganar o perder oxígeno. En otras palabras, tienen una deficiencia de oxígeno ajustable debido a las vacantes del mismo1, 2,3.
El titanio (Ti) es un material termodinámicamente estable ante la corrosión, debido a la presencia de una película de óxido pasiva sobre su superficie formada espontáneamente. La película de óxido pasiva está compuesta de TiO2 que puede ser formada por oxidación térmica o por anodización. Cuando las películas de óxido son formadas por anodización sobre un sustrato de Ti, éstas presentan características de un semiconductor tipo n, producido por una alta concentración de vacancias de oxígeno, las cuales son especies donoras de electrones4, 5,6.
Las propiedades semiconductoras de películas de óxido formadas anódicamente, han sido interpretadas por representaciones gráficas de Mott-Schottky7, 8,9. En el caso de un semiconductor tipo n, cuando el nivel donador está situado entre el nivel de Fermi y la banda de conducción, el modelo de Mott-Schottky puede ser usado para calcular las propiedades electrónicas de la superficie semiconductora del electrodo vidrio/Ti/TiO2, así como el potencial de banda plana y la densidad de donores10. La aproximación implica determinar la capacidad del semiconductor (CSC) en la región de carga espacial (distribución de las cargas dentro de la región del semiconductor a una distancia aproximadamente del orden de 20 a 30 Å), como una función del potencial del electrodo aplicado11 (E) (ver ecuación 1).
Donde NA es el número de Avogrado (6,02x1023 mol-1), ND es la densidad de donores (concentración de las vacancias de oxígeno), F la constante de Faraday (96485 Cmol-1), εr es la permitividad relativa para el óxido de Ti (εr = 56)12, ɛo es la permitividad del vacío (8,854x10-14 Fcm-1), E es el potencial medido al cual se realiza la determinación, Efb es el potencial de banda plana (valor del potencial en el cual el nivel de Fermi del semiconductor es igual al de la solución y no hay doblamiento de bandas), R la constante de los gases (8,314 JK-1 mol-1) y T la temperatura absoluta en Kelvin, en este caso la temperatura ambiente (298 K).
Los datos en literatura muestran que las propiedades electrónicas son dependientes del potencial de formación de la película, del espesor de la película formada sobre el sustrato, la velocidad de barrido, el potencial aplicado y el pre-tratamiento de la superficie sobre la cual se crece el óxido anódico4.
En el presente trabajo se evalúan, por medio de técnicas electroquímicas, las propiedades semiconductoras de la película de óxido formada anódicamente sobre un sustrato de Ti en una solución ácida diluida.
II. PARTE EXPERIMENTAL
Para los experimentos electroquímicos se utilizó una celda de tres electrodos, siendo el electrodo de trabajo un rectángulo de vidrio recubierto con una lámina delgada de Ti de 2 µm de espesor con una pureza de 99,8%, suministrado por la compañía Mateck cuyas dimensiones son 10X30X1 mm. Con el fin de conseguir una superficie limpia y reproducible, el electrodo de trabajo ha sido lavado con abundante agua Milli-Q y acetona-etanol a temperatura ambiente. Los rectángulos de vidrio/Ti fueron cubiertos en un soporte de teflón dejando expuesta sólo su área geométrica de trabajo de 1 cm2. Se utilizó un electrodo auxiliar de alambre de Pt, y el electrodo de referencia fue el Ag/AgCl saturado en KCl (EAg/AgCl = +0,229V vs ENH). Todos los potenciales de los electrodos hacen referencia a escala de ENH.
La película de óxido anódico fue formada potenciodinámicamente en una solución de 0,01M HClO4 (pH = 2) en un intervalo de potencial entre Ei = -0,35 V y Ef = 1,5 V vs Ag/AgCl (KCl saturado) con una velocidad de barrido de v = 50 mVs-1 (electrodos vidrio/Ti/TiO2). La velocidad de barrido se inició en sentido negativo y se estabilizó la respuesta J-E, sosteniendo el potencial de electrodo 15 minutos en el valor correspondiente al potencial final Ef. Los experimentos de voltamperometría cíclica (CV) se realizaron con un Potenciostato – Galvanostato Metrohm- Autolab, modelo PGSTAT302/302N controlado por computadora.
Los valores de la capacidad fueron obtenidos a través del comando Mott-Schottky del programa NOVA-AUTOLOAB13, con un circuito equivalente RS-CCS. Donde RS es la resistencia en la solución y CCS la capacidad de la capa del óxido que describe el comportamiento de la película de óxido crecida electroquímicamente, utilizando una conexión en serie de los análogos eléctricos.
En cada experimento, la solución fue desoxigenada mediante burbujeo continuo de nitrógeno gaseoso de alta pureza (99,999%, AGA) y a temperatura ambiente.
III RESULTADOS Y DISCUSIÓN
Formación de la película de óxido anódico de Ti
El sustrato vidrio/Ti fue oxidado anódicamente en 0,01M HClO4 bajo condiciones potenciodinámicas. La figura 1 muestra el voltamograma cíclico (VC) obtenido para el electrodo vidrio/Ti/TiO2 en un intervalo de potencial entre 0 V y 1,85 V vs ENH, empleando una velocidad de barrido de potencial de 50 mVs-1.
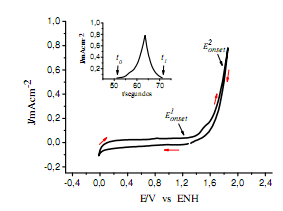
Figura 1: VC del electrodo vidrio/Ti/TiO2 en 0,01M HClO4 saturado con N2; = 50 mVs-1 25°#. El inset muestra un perfil de J vs t. Área geométrica del electrodo 1cm2.
La medición de VC se inició a partir de 1,3 V vs ENH en una dirección de barrido hacia potenciales (E) positivos decrecientes, donde la densidad de corriente (J) aumenta lentamente hasta alcanzar el límite inferior catódico en 0 V vs ENH. A continuación, se invierte el sentido del barrido hacia la dirección de valores de E positivos crecientes. En el intervalo desde 0,34 V hasta 1,24 V la J es baja y se observa la región de la doble capa, donde solamente toman lugar los procesos capacitivos. Luego, J asciende abruptamente hacia valores positivos donde tiene lugar el crecimiento del óxido anódico. Una vez alcanzado el límite superior anódico en 1,85 V vs ENH, la dirección del barrido se invierte. En el barrido inverso J disminuye con un comportamiento que es típico de los metales válvula14. El óxido se forma irreversiblemente donde, en una primera etapa, hay una rápida disminución de J seguida de un descenso lento hasta llegar a un valor cercano a cero. Las flechas rojas de la figura 1 indican la dirección del barrido de potencial.
Del análisis de la figura 1 se observan los diferentes parámetros electroquímicos como lo son, el potencial en que empieza a crecer la película de óxido ![]() y el potencial de inicio de la reacción de desprendimiento de oxígeno
y el potencial de inicio de la reacción de desprendimiento de oxígeno ![]() . A potenciales por encima de
. A potenciales por encima de ![]() la J aumenta rápidamente con una pequeña contribución de la corriente debida a la formación del óxido potenciodinámico. No se observa una reducción del óxido anódico, crecido potenciodinámicamente, en el intervalo del potencial entre 0 y 1,3 V vs ENH.
la J aumenta rápidamente con una pequeña contribución de la corriente debida a la formación del óxido potenciodinámico. No se observa una reducción del óxido anódico, crecido potenciodinámicamente, en el intervalo del potencial entre 0 y 1,3 V vs ENH.
La tabla 1 muestra los valores de los parámetros mencionados, además del potencial de circuito abierto EOCP. Estos valores de potenciales son utilizados para la determinación del estado inicial del sistema y el estudio de inicio de los procesos electroquímicos en los diferentes materiales de electrodo.
TABLA 1: Parámetros electroquímicos de la interfase vidrio/Ti/TiO2 en 0,01M HClO4.
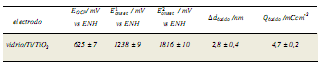
Suponiendo la formación del óxido anódico con una eficiencia de la corriente del 100%, se puede estimar el valor del espesor del óxido anódico ∆dóxido desde el VC de la figura 1 por las siguientes ecuaciones15:
Donde Qóxido es la densidad de carga eléctrica (Ccm-2), J es la densidad de corriente (Acm-2), t es el tiempo (segundos), Móxido es la masa molar del óxido (79,87 gmol-1), z es el número de electrones, F es la constante de Faraday y Póxido representa la densidad del óxido16 (3,44 ± 0,30) gcm-3.
La Qóxido fue calculada por la integración numérica del perfil de J vs t, desde el inicio del crecimiento del óxido anódico en t0 hasta el momento cuando se completa el crecimiento del mismo en t1, ver inset en la figura 1. Asimismo, la carga asociada a los procesos capacitivos de la doble capa fue sustraída del valor de Qóxido y la carga debida al desprendimiento del oxígeno es despreciable. Finalmente, el espesor fue calculado suponiendo una perfecta estequiometria y 4-electrones15.
El valor del espesor de la película de óxido anódico ∆óxido obtenido de la ecuación (3) y la carga del óxido anódico Qóxido se muestran en la tabla 1.
El valor del EOCP fue determinado luego de estabilizar el electrodo vidrio/Ti, inmerso en una solución de 0,01M HClO4, durante 60 segundos y antes de crecer el óxido potenciodinámicamente. Los parámetros EOCP, ![]() ,
, ![]() y el valor de Qóxido informado en la tabla 1 corresponden al mejor valor de una serie de experimentos realizados y su incerteza fue estimada por la desviación absoluta de los ensayos efectuados bajo las condiciones dadas en la figura 1. Por otra parte, la incerteza de ∆óxido fue calculada por la propagación de la incertidumbre de Qóxido y de Póxido en la ecuación (3), usando un valor de 2,07x10-4 gC-1 para el factor M/zF.
y el valor de Qóxido informado en la tabla 1 corresponden al mejor valor de una serie de experimentos realizados y su incerteza fue estimada por la desviación absoluta de los ensayos efectuados bajo las condiciones dadas en la figura 1. Por otra parte, la incerteza de ∆óxido fue calculada por la propagación de la incertidumbre de Qóxido y de Póxido en la ecuación (3), usando un valor de 2,07x10-4 gC-1 para el factor M/zF.
El espesor de la película de óxido puede variar desde unos pocos nanómetros a más de un micrómetro, esto es, de películas formadas espontáneamente sobre sustratos de Ti a películas formadas galvanostáticamente con valores altos de Ef17.
J. Pouilleau et al18 estudiaron la estructura y composición de películas de TiO2 crecidas en el modo galvanostático, de un disco de Ti pulido mecánicamente en una solución de 0,5M H2SO2. Ellos encontraron espesores de entre 23 y 62 nm, conforme aumenta el potencial Ef de 5 a 20 V aplicado al electrodo.
En literatura encontramos que la formación electroquímica de películas de TiO2 en soluciones acuosas, ocurre principalmente en electrolitos altamente concentrados (> 0,1M). Los estudios en este trabajo están orientados hacia la formación y caracterización de películas delgadas de TiO2 en soluciones de HClO4 de baja concentración, lo cual apunta al desarrollo deóxidos altamente hidratados y formados en soluciones con baja concentración de impurezas.
En un trabajo publicado por Filippin et al16 se estudiaron películas de óxido de Ti formadas potenciodinámicamente sobre una lámina de Ti y un sustrato vidrio/Ti en 0,010M HClO4 a 50mVs-1. Ellos encontraron que el espesor del óxido espontáneo d0 es independiente del sustrato y depende principalmente del Ti metálico y del pre-tratamiento del electrodo, con y sin control atmosférico. Del análisis de los parámetros electroquímicos de la tabla 1, realizados en este trabajo, con los valores presentados en16 se verifica la afinidad electroquímica en el electrodo de vidrio/Ti/TiO2, bajo las mismas condiciones experimentales y pre-tratamiento del sustrato. Finalmente, el espesor de la capa de óxido absoluto d, puede ser calculado por:
A partir de la ecuación (4) el valor d estimado fue (4,5 ± 1,0) nm, considerando el espesor del óxido espontáneo16 y el espesor de la película de óxido anódico para un valor de Ef = 1,85 V vs ENH.
El valor d determinado, bajo las condiciones experimentales y pre-tratamiento del electrodo vidrio/Ti/TiO2 realizados en este trabajo, se consideró para la evaluación de las propiedades semiconductoras de la película de óxido sobre el electrodo vidrio/Ti/TiO2.
Luego del crecimiento del óxido anódico, la película fue estabilizada manteniendo el potencial del electrodo durante 15 minutos al valor correspondiente del Ef. Posteriormente se realizó un ciclo potenciodinámico a 50 mVs-1 entre 0 y 1,85 V vs ENH, en solución saturada con N2. La figura 2 permite ver el crecimiento (línea negra) y estabilización del óxido anódico (línea roja). De esta manera, se encuentra que el comportamiento electroquímico del electrodo formado potenciodinámicamente permaneció sin cambios.

Figura 2: VC del electrodo vidrio/Ti/TiO2 en 0,01M HClO4 saturado con N2; = 50 mVs-1 a 25°C. Área geométrica del electrodo 1cm2. Crecimiento del óxido anódico de Ti (primer barrido de potencial, línea negra) y VC registrado luego de la estabilización durante 15 minutos (línea roja) un Ef = 1,85 V vs ENH.
El procedimiento de estabilización no modifica apreciablemente el espesor total de la capa de óxido d formada bajo las condiciones experimentales antes descritas. La figura 3 confirma la estabilización de la película de óxido formada potenciodinámicamente antes y después de realizar los experimentos electroquímicos.
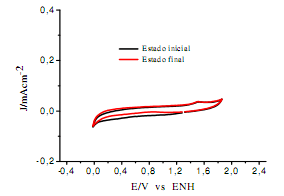
Figura 3: VC del electrodo vidrio/Ti/TiO2 en 0,01M HClO4 saturado con N2; = 50 mVs-1 a 25°C. Área geométrica del electrodo 1cm2. Estado inicial y estado final.
Evaluación de las propiedades semiconductoras del electrodo vidrio/Ti/TiO2
La figura 4 muestra una representación de Mott-Schottky para un electrodo de vidrio/Ti/TiO2 obtenido a un potencial de formación de la película de óxido anódico Ef = 1,85 V vs ENH en 0,01M HClO4, con burbujeo continuo de N2 luego del procedimiento de estabilización del óxido.

Figura 4.6: Gráfico de Mott-Schottky de la capa de óxido formada a Ef = 1,85 V vs ENH.
Para el cálculo de Efb y ND se ha realizado un ajuste lineal en la zona de potenciales entre 0 y 0,8 V vs ENH, por medio de la ecuación (1), donde la contribución del tercer término dentro del paréntesis es igual 0,026 V a temperatura ambiente. Los valores de la ordenada al origen y la pendiente de la recta son 2,69x106 cm4F-2 y 130,36x106 Vcm4 C-2 respectivamente, con un valor de 0,99 para el coeficiente de correlación lineal de la recta.
El Efb fue determinado de la intersección de la recta con el eje de las abscisas y ND fue calculado a partir de la siguiente ecuación:
Donde α es la pendiente de la recta. Los valores de Efb y ND estimados mediante las ecuaciones (1) y (5) son (-0,047 ± 0,005) V vs ENH y (1,93 ± 0,03) x1022 cm-3 respectivamente. La incertidumbre asociada a Efb y ND fue estimada a partir de las desviaciones entre los puntos experimentales y el ajuste de la recta por el método de cuadrados mínimos lineales.
Para valores de E > Efb, el gráfico lineal tiene una pendiente positiva, confirmando que la película crecida anódicamente se comporta como un semiconductortipo n en el intervalo de potencial estudiado en este trabajo.
La concentración de vacancias de oxígeno determinada a partir de la regresión lineal se encuentra en el intervalo de los reportados en la literatura (entre 1018 y 1023 cm-3)19, 20,21. M. Schneider et al15 informaron que la densidad de donores ND depende fuertemente del espesor de la capa de óxido y disminuye desde 6,50 x 1019 cm-3 para un espesor del óxido de 8 nm a 2,54 x 1018 cm-3 para un espesor de 29 nm, de modo similar, el Efb disminuye de -0,59 a -0,52 V vs Ag/AgCl (KCl saturado) cuando aumenta el espesor del óxido.
Por otro lado, S. Kudelka et al22 también encontraron que ND es dependiente del espesor de la película delóxido, así como, ND ≈ 1020 cm-3 para un espesor de 6,5 nm y ND ≈ 1019 cm-3 para un espesor del óxido de 10 nm. Un comportamiento similar muestran A. M. Schmidt et al4 donde Efb y ND de las películas anódicas formadas sobre el electrodo de Ti en soluciones reguladoras de pH son dependientes del potencial de formación de la película, del espesor del óxido y del pH del electrolito. Los defectos más comunes en la película de óxido de Ti son vacancias de oxígeno que provienen de un ión O2- faltante. Estos defectos, que se encuentran energéticamente muy por debajo de la banda de conducción, ceden electrones a la capa de conducción y son, por lo tanto, defectos donores23.
IV CONCLUSIONES
El óxido anódico formado sobre el sustrato vidrio/Ti resultó ser estable y no mostró modificaciones al comparar la respuesta electroquímica antes y después de los experimentos. El espesor de la capa de óxido pudo ser estimado y controlado considerando el valor del óxido espontáneo y el valor del espesor del óxido anódico para un valor de Ef = 1,85 V vs ENH. Basándose en el análisis de Mott-Schottky se demostró que el óxido de Ti se comporta como un semiconductor tipo n con un número de vacancias de oxígeno del orden de 1022 cm-3, con un número elevado de sitios activos. Finalmente, el procedimiento llevado a cabo en este trabajo sobre el electrodo vidrio/Ti/TiO2 determina las condiciones de trabajo para el estudio electroquímico.
V AGRADECIMIENTOS
Los autores agradecen al programa de desarrollo científico y tecnológico 2011. Universidad Nacional de Catamarca, Secretaria de Ciencia y Tecnología, Consejo de Investigación. Código 02/G405. ANPCyT 171/2008. PICT-2008-00088, Res. 304/10
1. E. Santos and W. Schmickler, Electrocatalysis: From Fundamental Aspects to Fuell Cells, Wiley, Hoboken, New Yersey, (2011). Cap. 11. [ Links ]
2. V. E. Henrich, Metal-oxide surfaces. Progress in Surface Science. Vol. 50. Nos 1-4 (1995) pp. 77-90. [ Links ]
3. V. E. Henrich; P. A. Cox, The Surface Science of Metal Oxides; Cambridge University Press: Cambridge, (1994). [ Links ]
4. A.M. Schmidt, D.S. Azambuja, E.M.A. Martini, Semiconductive properties of titanium anodic oxide films in McIlvaine buffer solution. Corr. Sci., (2006); 48 (10): 2901-2912. [ Links ]
5. C. Fonseca, M.A. Barbosa, Corros. Sci. 43 (2001) 547. [ Links ]
6. E.N. Paleolog, A.Z. Fedotova, O.G. Derjagina, N.D. Tomashov, Anodic Process Kinetics on the Passive Surfaces of Titanium, Nickel, and Titanium‐Nickel Alloys. J. Electrochem. Soc. 125 (1978) 1410. [ Links ]
7. D. Devilliers, E. Mahé, Modified titanium electrodes: Application to Ti/TiO2/PbO2 dimensionally stable anodes. Electrochimica Acta 55 (2010) 8207–8214.
8. A. J. Bard, L. R. Faulkner, Electrochemical Methods. Fundamentals and Applications. 2nd Ed. John Wiley & Sons, New York. (2001). P. 751. [ Links ]
9. K. Azumi, M. Seo, Changes in electrochemical properties of the anodic oxide film formed on titanium during potential sweep. Corros. Sci. 43 (2001) 533. [ Links ]
10. C. Fonseca, S. Boudin, M.C. Belo, Characterisation of titanium passivation films by in situ ac impedance measurements and XPS analysis. Journal of Electroanalytical Chemistry 379 (1994) 173-180. [ Links ]
11. Shin-ichi Tanaka, Y. Fukushima, I. Nakamura, T. Tanaki, and G. Jerkiewicz, ACS Appl. Mater. Interfaces 5 (2013) 3340−3347.
12. T. Hurlen, S. Hjornkol, Anodic growth of passive films on titanium. Electrochim. Acta 36 (1991) 189. [ Links ]
13. Software NOVA versión 1.7.7. Compañía Metrohm Autolab BV. [ Links ]
14. O.E. Linarez Pérez, V.C. Fuertes, M.A. Pérez, M. López Teijelo. Characterization of the anodic growth and dissolution of oxide films on valve metals. ScienceDirect. Electrochemistry Communications 10 (2008) 433–437.
15. M. Schneider, S. Schroth, J. Schilm, A. Michaelis. Micro-EIS of anodic thin oxide films on titanium for capacitor applications. Electrochimica Acta 54 (2009) 2663–2671.
16. F.A. Filippin, O.E. Linarez Pérez, M. López Teijelo, R.D. Bonetto, J. Trincavelli, L.B. Avalle, Thickness determination of electrochemical titanium oxide (Ti/TiO2) formed in HClO4. Electrochimica Acta 129 (2014) 266 - 275. [ Links ]
17. J. Pan, D. Thierry, C. Leygraf, Electrochemical impedance spectroscopy study of the passive oxide film on titanium for implant application. Electrochim. Acta 41 (1996) 1143. [ Links ]
18. J. Pouilleau, D. Devilliers, F. Garrido, S. Durand-Vidal, E. Mahé, Structure and composition of passive titanium oxide films. Materials Science and Engineering B 47 (1997) 235 - 243. [ Links ]
19. F. Y. Oliva, L. B. Avalle, E. Santos, O. R. Cámara, Photoelectrochemical Characterization of Nanocrystalline TiO2 Films on Titanium Substrates. Journal of Photochemistry And Photobiology A-Chemistry; vol. 146 (2002) p. 175 – 188.
20. P. Acevedo-Peña, G. Vázquez, D. Laverde, J. E. Pedraza-Rosas, I. González, Influence of structural transformations over the electrochemical behavior of Ti anodic films grown in 0.1 M NaOH. J. Solid State Electrochem. 14 (2010) 757. [ Links ]
21 - K. Azumi, T. Ohtsuka, N. Sato, Mott‐Schottky Plot of the Passive Film Formed on Iron in Neutral Borate and Phosphate Solutions. Journal of the Electrochemical Society, Vol 134 (6) (1987), p. 1352-1357. [ Links ]
22- S. Kudelka, A. Michaelis, J.W. Schultze, Electrochim. Acta 51 (1996) 863. [ Links ]
23 - H.M. Villullas, E.A. Ticianelli, V.A. Macagno, E.R González, Electroquímica. Fundamentos y aplicaciones en un enfoque interdisciplinario. Editorial Universidad Nacional de Córdoba, Argentina, (1999). p.187. [ Links ]