Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Anales (Asociación Física Argentina)
versión impresa ISSN 0327-358Xversión On-line ISSN 1850-1168
An. AFA vol.28 no.3 Tandil set. 2017
ÓPTICA Y FOTOFÍSICA
Bio-Speckle para el monitoreo del crecimiento de microalgas en bio-ensayos a escala de laboratorio
Bio-Speckle for microalgae growth monitoring in laboratory scale photobioreactor
G.G. Romeroa,b*, A.C. Monaldia,b, D.O. Dominguezc, A.V. Blanca,b, L.Morañad
a Universidad Nacional de Salta- Facultad de Ciencias Exactas, Grupo de Óptica Láser
b INENCO-CONICET
c Universidad Nacional de Salta- Facultad de Ciencias Exactas, Grupo de Óptica Láser
d Universidad Nacional de Salta- Facultad de Ciencias Naturales, Laboratorio de calidad de aguas Av. Bolivia 5150 (A4408FVY) Salta - Argentina
email: romeropelayog@gmail.com
Resumen
Las microalgas son ampliamente utilizadas en las industrias farmacéutica, cosmética, en aquellas relacionadas con la prevención de la contaminación, acuacultura y especialmente en biocombustibles. Debido a su amplio rango de aplicaciones existe un gran interés en su producción a gran escala. Las técnicas estándar para la producción de biomasa algal requieren del cultivo en medios nutritivos y parámetros externos bien definidos tales como condiciones controladas de iluminación, temperatura y aireación. La producción comercial de microalgas es costosa y la adición de nutrientes a los medios de cultivos contribuye a aumentar el costo. La evaluación de la calidad de medios de cultivos usando aguas residuales o residuos agroindustriales puede resultar en una vía para reducir costos. Este trabajo tiene por objetivo el desarrollo de un método no invasivo para monitorear la eficiencia de residuos agroindustriales, previamente tratados, como posibles medios de cultivos a través del monitoreo diario del crecimiento poblacional de las microalgas. Hemos encontrado que es posible detectar el crecimiento de los microorganismos usando cumulantes estadísticos como una aproximación numérica para analizar la actividad de patrones de speckle dinámico producidos por muestras de algas ChlrorellaVulgaris cultivadas en medio basal Bold y vinaza(subproducto líquido de la destilación del mosto en la fermentación del etanol) pre tratada para mejorar su efectividad.
Palabras clave: Biospleckle; Crecimiento de micro algas; Actividad de speckle; Función de autocorrelación; Densidad óptica.
Abstract
Microalgae are widely used in different industries – pharmaceutical, cosmetic, in those dealing with pollution prevention, aquaculture and especially biofuels. Because of the wide range of use, there is an active interest in microalgae large-scale cultivation. Standard techniques for algae biomass production requires cultivation in nutritious culture media, and well-defined external parameters, such as controlled conditions of light intensity, temperature and aeration gas. Commercial production of microalgae is expensive, and the addition of nutrients in culture media contributes to its high cost. The evaluation of the quality of culture media using wastewater effluents or agro-industrial waste can be a way to reduce algal cultures costs. This research aims to develop a noninvasive method for the testing of effectiveness of agro-industrial waste, previously treated, as culture media through daily monitoring of population increase microalgae. We found that it is possible to detect the growth of the microorganisms by using statistical cumulants as numerical approaches for analyzing the dynamic speckle patterns produced by samples of Chlrorella Vulgaris algae cultivated in bold basal culture medium and in vinasse,(byproduct of the sugar industry) pre-treated to improve its effectiveness.
Keywords: Biospleckle; Microalgae growing; Speckle activity; Autocorrelation function; Optical density.
Recibido: 18/05/17;
aceptado: 15/09/17
I. INTRODUCCIÓN
Cuando se ilumina con un láser un objeto que presenta cierta actividad, como los materiales biológicos, la luz dispersada exhibe el conocido fenómeno denominado speckle dinámico. La luz dispersada se desplaza en frecuencia (Doppler) debido a movimientos internos propios de las muestras iluminadas dando lugar a un patrón de speckle cuya apariencia visual es similar a la de una superficie de líquido en ebullición. Por esta razón se lo suele denominar speckle hirviente o por la naturaleza de su origen también se lo conoce como bio-speckle. Los patrones de speckle dinámicos han sido ampliamente estudiados y como resultado de numerosos proyectos de investigación en óptica aplicada, se han definido una gran variedad de parámetros y metodologías para medir su actividad y relacionarla con alguna propiedad o característica de la muestra que los produce. En la literatura se encuentra un gran número de aplicaciones que van desde aplicaciones industriales como seguimiento del secado de pinturas1-3 hasta medida de la actividad fisiológica de objetos vivos tales como flujo sanguíneo, latidos de corazón, viabilidad de semillas, maduración y golpes en frutos entre otras4-10. Los usos metrológicos de la actividad de patrones de speckle dinámico11 sugieren que esta herramientano invasiva, puede utilizarse para monitorear el cultivo de microalgas en fotobiorreactores a escala de laboratorio.
Las microalgas son microorganismos que utilizan la luz solar, varios nutrientes y CO2 para sintetizar biomasa, biomoléculas y metabolitos de importancia económica como fuente de alimentos, medicamentos, forrajes, fertilizantes y biocombustibles12-16. En virtud de la amplia gama de su uso, existe un interés activo en su cultivo a gran escala. La producción comercial de algas es costosa y la adición de nutrientes en los medios de cultivo contribuye a aumentar el costo. La evaluación de la calidad de los medios de cultivo que utilizan efluentes de aguas residuales o residuos agroindustriales se ha convertido actualmente en una vía para reducir costos además de contribuir al cuidado del medio ambiente. En este sentido, los bioensayos en laboratorio o de campo son importantes a los fines de monitorear la producción de biomasa microalgal usando nuevos medios de cultivos resultantes del tratamiento de residuos agroindustriales17.
En general, la técnica utilizada en un laboratorio de biología para investigar la eficiencia de nuevos medios de cultivo, consiste en el cultivo de los microrganismos en fotobioreactores y del monitoreo diario del aumento poblacional, en muestras extraídas al azar de los fotobioreactores. El crecimiento de los cultivos se expresa en términos del aumento de biomasa calculado en un periodo de tiempo o en una fase de crecimiento específica18. Este aumento se puede estimar por diferentes métodos, tales como el recuento celular en microsocopio, la determinación de cambios en el cultivo por densidad óptica (DO) medida en espectrofotómetro o la cuantificación del peso de la biomasa seca, total u orgánica. De todos los métodos, el recuento celular es el más utilizado por ser el más simple y de menor costo19. La desventaja de éste método es que requiere de grandes períodos de tiempo observando al microscopio, tarea que debe ser además realizada por técnicos entrenados. Por lo tanto, es de gran importancia investigar metodologías alternativas para monitorear el crecimiento de los cultivos a gran escala de manera más simple y rápida.
En este trabajo interdisciplinario, se propone el uso de las técnicas de bio-speckle, como punto de partida para el desarrollo de un sensor no invasivo, que permita el control del crecimiento poblacional de las microalgas“in situ”, esto es sin la necesidad de extraer las muestras de los bioreactores facilitando el monitoreo diario.
Con el objeto de calibrar el método, se realizaron ensayos de seguimiento del crecimiento poblacional en muestras de algas ClorellaVulgaris cultivadas en un medio Basal de Bold (MBB)20. Esta cepa autóctona de algas, puede ser utilizada como suplemento alimenticio, para la acuacultura, purificador de aguas residuales en biorremediación, entre otras tantas aplicaciones, por lo que el estudio y evaluación de medios de cultivos que favorezcan su rápido crecimiento es el principal foco de interés. Se presentan los resultados obtenidos a partir de la Historia Temporal de los Patrones de Speckle (HTPS)5 utilizando cumulantes estadísticos23 como parámetro para caracterizar la actividad y relacionarla con el crecimiento poblacional de los individuos. Los datos se comparan con las mediciones realizadas en el laboratorio de biología, utilizando un espectrofotómetro para medir la DO.
Una vez puesta a punto la técnica de medición se realizó un primer ensayo utilizando un medio de cultivo preparado ad hoc a partir de vinaza, desecho agroindustrial subproducto líquido de la destilación del mosto (zumo de uva o caña de azúcar) en la fermentación del etanol. Se presentan los resultados obtenidos y una discusión sobre las bondades y limitaciones de la técnica.
II. MÉTODOS
Técnicas de Bio-speckle
En la figura 1 se muestra un esquema del dispositivo óptico utilizado para el registro de las fluctuaciones de intensidad de los patrones de speckle dinámicos. La muestras se colocan en celdas prismáticas de 1 cm de espesor con un lado, el enfrentado con la cámara CCD, despulido y se iluminan con un láser de Ar-Kr sintonizable.

Figura 1. Dispositivo experimental para la adquisición de las HTPS. a) Aspecto de un patrón instantáneo de speckle, b) Imágen de una HTPS.
La cámara CCD campura las imágenes de los patrones de speckle a una velocidad de 25 cuadros por segundo. Para cada estado del fenómeno bajo estudio, se adquieren 512 imágenes sucesivas del patrón de speckle, dinámico como el que se muestra en la Figura 1 a) y se almacena una columna fija de cada imagen (por ejemplo la columna central) y con estas 512 columnas se contruye una imagen de 512x512 pixeles digitalizada a 256 niveles de gris. Esta imagen resultante es la que se denomina Historia Temporal de los Patrones de Speckle, en la que cada fila representa las fluctuaciones temporales de la intensidad de la luz en un dado punto del campo de speckle. A modo ilustrativo en la Figura 1 b) se muestra una HTPS típica.
La muestras se iluminan con cuatro longitudes de onda 483, 514, 647 y 676 nm, con el fin de investigar la dependencia de la actividad del speckle con la longitud de onda y para comparar con los datos de DO medida en el laboratorio de biología. La elección de estas longitudes de onda particulares, además de la disponibilidad, se basó en las propiedades de la interacción de la luz con los tejidos biológicos. En nuestro caso particular, debido al alto contenido de clorofila de las algas, las longitudes onda rojas (647 y 676) son altamente absorbidas en oposición con la verde (λ = 514 nm) que es altamente reflejada. Mientras que la longitud de onda λ = 483 nm es muy próxima al pico de absorción de la clorofila b y de otros importantes componentes como los carotenoides.
Como el propósito de esta investigación es encontrar una medida óptima de la actividad de los patrones de speckle que pueda ser correlacionada con el incremento de las cepas, se ensayaron diferentes aproximaciones numéricastales como: el momento de inercia de la matriz de coocurrencia, el contraste, ancho del rectángulo equivalente y cumulantes estadísticos. Los resultados muestran que el cumulante de primer orden resulta adecuado para caracterizar el aumento poblacional presentando menos dispersión y mejor correlación con la medida de la DO.
Esta herramienta numérica consiste en la aproximación de las funciones de autocorrelaciónde cada fila de la HTPS por medio de cumulantes estadísticos. Usando la definición de autocorrelación dada por:
donde τ es el tiempo de retardo y los bracket representan el promedio, se calcularon las 512 autocorrelaciones correspondientes a las HTPS medidas diariamente y se promediaron para obtener la función de autocorrelación correspondiente para cada día. La actividad del patrón de speckle se mide ajustando esta función de autocorrelación promedio mediante:
donde los coeficientes bi se asocian a los cumulantes estadísticos10 y se utilizan como parámetro para monitorear el seguimiento diario del aumento poblacional.
Los bio ensayos
Una imagen del sistema experimental usado para el cultivo de las microalgas se muestra en la Figura 2. Básicamente consiste de fotobiorrecatores (frascos de agitación) cada uno de 600 ml de capacidad.

Figura 2. Fotobiorrectores a escala de laboratorio.
Para el caso de las muestras usadas en la calibración, de la técnica, en cada fotobiorrector se siembra ChlorellaVulgaris en 500 ml de medio basal (MBB) hasta obtener una concentración inicial de 5000 ind/ml. Se realizan tres replicasy se las coloca aleatoriamente en los estantes de la cámara de cultivo, bajo iluminación constante con lámparas fluorescentes de 72 W, temperatura 24 ± 1 °C y aireación constante.
Los datos de concentración celular diarios, se obtienen midiendo la DO en un espectrofotómetro HACH DR 5000. En general se registra un barrido en todo el rango espectral para detectar picos de absortancia de clorofilas y pigmentos características de la especie bajo estudio. A los fines de comparación con las técnicas de biospecklese registran separadamente los datos de DO para las longitudes de onda de interés.
Una vez calibrado el método, re realizó un ensayo utilizando como medio de cultivo vinaza, desecho agroindustrial subproducto líquido de la destilación del mosto (zumo de uva o caña de azúcar) en la fermentación del etanol. En este caso previo al sembrado de ChlorellaVulgaris, se realiza un tratamiento a la vinaza ya que se sospecha que su alta carga orgánica es difícil de aprovechar por parte de las algas. Este tratamiento consiste en hacer crecer en concentraciones de vinaza al 5, 10 y 25% el hongo SacharomycesCereviciae con el objeto de degradar los compuestos de la vinaza y verificar si los productos de la degradación resultan más favorables para el crecimiento de las algas. Después que este hongo estuvo creciendo por tres semanas recién entonces se siembran las algas siguiendo el mismo procedimiento descripto para el caso del sembrado en MBB.
III. RESULTADOS
Experimento de calibración
En este estudio y con el propósito de calibrar la metodología de medición usando técnicas de biospeckle, se monitorea diariamente el crecimiento de las microalgasChlorellaVulgaris sembradas en MBB en las tres réplicas.
A modo ilustrativo, en la Figura 3 se muestran las curvas de DO en función del tiempo para λ = 483 nm medidas en el laboratorio de biología, usando el espectrofotómetro.Como puede observarse, existe un dispersión en el valor de la DO diaria de cada muestra, excepto para el primer día en el que el número de algas es aproximadamente el mismo en todos los fotobiorreactores. La dispersión es consistente con el inevitable hecho de que los parámetros externos tales como iluminación o aireación varían ligeramente de un fotobiorreactor a otro.
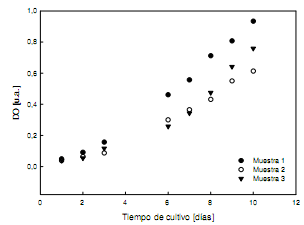
Figura 3. Variación diaria de la densidad óptica medida con espectrofotómetro para cada muestra aλ = 483 nm.
Para cada día se calcula el promedio de las DO medidas y su evolución temporal se muestra en la Figura 4, para cada una de las longitudes de onda de interés.

Figura 4. Densidad óptica promedio a las distintas longitudes de onda.
El comportamiento de estas mediciones en función del tiempo muestra una tendencia similar para las cuatro longitudes de onda; sin embargo, los valores son más altos y similares para λ= 483 nm and λ = 676 nm, como era de esperarse, por ser estas longitudes de onda muy próximas a los picos de absorción de la clorofila.
Simultáneamente, para cada muestra se registraron también las HTPS del speckle producido iluminando las muestras con láser sintonizado en las longitudes de onda seleccionadas, y se calcularon las autocorrelaciones promedio. A modo de ejemplo, y para dar una idea de las formas de las funciones de autocorrelación,en la Figura 5 se las representa para las tres muestras. En este caso las mismas corresponden al tercer día y para la longitud de onda de 483 nm. Cabe resaltar que las unidades de la abscisa corresponden al tiempo que le toma al procesador de imágenes construir las HTPS, que este caso corresponde a 20,5 s aproximadamente.En la Figura 5 también se ha representado la función de autocorrelación promedio para la muestra del medio decultivo sin algas usada como referencia en las determinaciones de DO en el espectrofotómetro. Como los primeros puntos de la función de auto correlación contienen la información del tiempo de vida media de los granos de speckle11, sólo se han representado los 15 primeros puntos. Como se esperaba, para la muestra de referencia la función de autocorrelación tiende a la función de autocorrelación de una función rectángulo ya que los patrones de speckle no cambian en el tiempo.
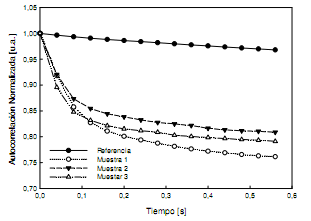
Figura 5. Funciones de autocorrealción normalizada para cada muestra y paraλ = 483 nm.
Una vez calculadas las funciones de autocorrelación para las tres muestras a las cuatro longitudes de onda, se procedió a ajustarlas de acuerdo a la ecuación 2. Del ajuste surge que el coeficiente b1 es superior en variosórdenes de magnitud (>108)que los otros de la serie. A los fines de comparación con las medidas obtenidas por DO, en la Figura 6, se representan los datos obtenidos diariamente para el caso de iluminar con λ = 483 nm. Se obtienen idénticos resultados para todas las longitudes de onda, lo que se evidencia en la Figura 7 donde se ha representado el coeficiente b1 en función del tiempo de cultivo para cada longitud de onda.
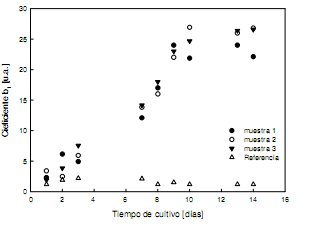
Figura 6. Evolución diaria del coeficiente b1 para cada muestra y λ = 483 nm

Figura 7. Evolución diaria del coeficiente b1 promedio para todas las muestra a las distintas longitudes de onda.
Comparando las Figuras 3 y 6 se puede notar que las variaciones diarias del coeficiente b1 y de DO tienen un comportamiento similar.Otra cuestión notable en la Figura 6 es que la actividad del bio-speckle de la muestra de referencia, aunque tiene valores diarios muy pequeños,presenta variaciones con el tiempo de cultivo. Esto tiene su explicación en el hecho de que las técnicas de speckle dinámico dan una medida global del comportamiento de los dispersores en el interior de la muestra.En este caso, puesto que el medio de cultivo BBM es un compuesto que contiene sales, la actividad detectada pone de manifiesto que el método puede detectar la presencia de pequeños cristales en suspensión.
A los fines de establecer una comparación entre el método propuesto y el método convencional empleado en los laboratorios de biología, en la Figura 8 se comparan los valores del coeficiente b1 y los correspondientes valores de DO obtenidos por el método convencional, observándose un alto grado de correlación entre ellos(R2>0.989).

Figura 8. Correlación entre las medidas de actividad de bio-speckle y DO para todas las longitudes de onda
Como se puede observar de esta figura, por un lado, los resultados para λ = 483 nm y λ = 676 nm exhiben una mejor correlación, según lo esperado, por ser estas longitudes de onda muy próximas a los picos de absorción de la clorofila. Por otro lado, la menor correlación se obtuvo para λ = 514 nm, en concordancia con el hecho de que la luz verde es altamente reflejada por las algas. Sin embargo esta diferencia no es lo suficientemente importante como para descartar el uso de esta longitud de onda en las medidas de actividad del speckle.
Ensayo con Vinaza como medio de cultivo
Una vez calibrada la técnica, se planteó su utilización para estudiar la efectividadde una vinaza, pre tratada como se indicó en la sección II, como posible medio de cultivo.
Las muestras fueron colocadas en el dispositivo óptico y se registraron las historias temporales y las funciones de autocorrelación promedio. Se determinaron los coeficientes b1 y se obtuvieron los resultados que se muestran en la Figura 9. Para entender la variación de la actividad de la muestras expresadas por el coeficiente b1 es necesario destacar que, a diferencia del medio de cultivo BBM que es transparente, la vinasapretratada con el hongo es una sustancia amarronada, por lo que absorbe mayor cantidad de luz. Por otro lado la presencia del hongo se vio reflejada en la variación de b1 a λ = 483 nm, mostrando que la actividad del mismo disminuyó con el tiempo. Esta suposición pudo ser verificada por observaciones al microscopio, en las que se corroboró que el aumento poblacional de las microalgas fue muy bajo y su tamaño muy pequeño. La mayor actividad de speckle se observó en el día 8 y posteriormente disminuyó por la mortandad de las mismas de acuerdo al análisis realizado por los biólogos especializados.

Figura 9. Evolución diaria del coeficiente b1 promedio para vinaza pretratada con sacaromisis cerviceae a las distintas longitudes de onda.
Se debe destacar que las mediciones de DO realizadas en espectrofotómetro no resultaron alentadoras puesto que las mismas se llevan a cabo para detectar los picos de absorción de la clorofila y otros componentes de interés, lo que en este caso no arrojó resultados aceptables. Sin embargo, las mediciones con técnicas de bio-speckle demuestran que el método permitió distinguir la evolución de las microalgas, y sacar conclusiones sobre la calidad del medio de cultivo propuesto. Así, la información provista por la actividad speckle puede asimismo ser de utilidad para modificar la metodología del pre tratado a fin de mejor su eficiencia.
IV. CONCLUSIONES
En este estudio se demostró experimentalmente que la técnica de bio-speckle es apta para monitorear el crecimiento poblacional de algas. Se encontró que la actividad del bio-speckle aumenta en función del tiempo de cultivo de la misma manera que la medida convencional de Densidad Óptica determinada con un espectrofotómetro convencional.
Los resultados obtenidos, sustentados por las correlaciones obtenidas entre los datos medidos con ambas metodologías, y la simplicidad del método son alentadores y constituyen un punto de partida para el desarrollo de un sensor no invasivo y de bajo costo que permita la determinación “in situ”. El objetivo último de esta investigación es disponer de una metodología que facilite el monitoreo diario sin la extracción de las muestras de los fotobioreactores contribuyendo al desarrollo de biorectores óptimos para la producción de microalgas a gran escala.
V. AGRACECIMIENTOS
Este trabajo ha sido financiado por ANPCyT-PME,1392/2 y el Consejo de Investigación de la Universidad Nacional de Salta, Proyecto no. 2161.
1. H. Rabal, M. Trivi, R. Arizaga, N. Cap, G. Romero, E. Alanís. Transient phenomena analysis using dynamic speckle patterns. Opt. Eng. 38(1), 57-62 (1996). [ Links ]
2. G. Romero, E. Alanís, H. Rabal. Statistics of the dynamic speckle produced by a rotating diffuser and its application to the assessment of paint drying. Opt. Eng. 39(6), 1652-1658 (2000). [ Links ]
3. I. Yamaguchi, M. Yokota, T. Ida, M. Sunaga, K. Kobayashi. Op. Rew. 14 (6) 362-364 (2007). [ Links ]
4. Y. Aizu, T. Asakura, Opt. Laser Technol. 23, 205-219 (1991). [ Links ]
5. A. Oulomara, G. Tribillon, J. Douvernoy.J. Mod Opt. 36, 165-179 (1985). [ Links ]
6. A. Kurenda, A. Adamiak, A. Zdunek. Temperature effect on apple biospeckle activity evaluated with different indices Postharvest Biol. Technol. 67, 118-123 (2012). [ Links ]
7. B. Ruth. Int. J. Microcirc. Clin. Exo. 9, 21-5 (1990). [ Links ]
8. M. Pajuelo, G. Baldwin, H. Rabal, N. Cap, R. Arizaga, M. Trivi. Bio-speckle assessment of bruising in fruits Opt. Las. Eng. 40, 13-24, (2003). [ Links ]
9. G. F. Rabelo, A. Machado Enes, R. A. Braga Jr, I. M. Dal Fabbro. Frequency response of biospeckle laser images of bean seeds contaminated by fungi Biosystems Engineering 110(3), 297-301(2011). [ Links ]
10. G. G. Romero, C. C. Martinez, E. E. Alanís, G. A Salazar, G. V. Broglia, L Alvarez. Bio-speckle activity applied to the assessment of tomato fruit ripening. Biosystems Engineering, 103, 116-119 (2009) [ Links ]
11. H. J. Rabal, R. A. Braga Jr eds, “Dynamic Laser Speckle and Applications”. CRS Press, J. Taylor and Francis Publisher. (Boca Ratón, FL, USA) (2009).
12. M. A. Borowitzka. Commercial production of microalgae: ponds, tanks, tubes and fermenters. J. Biotech. 70, 313–321(1999).
13. P. Vishwanath, T. Kallqvist, E. Olsen, G. Vogt, H. R. Fatty acid composition of 12 microalgae for possible use in aquaculture feed. Gislerod.AquacultInt 15, 1–9 (2007).
14. V. Makarevičienė, V. Andrulevičiūtė, V. Skorupskaitė, J. Kasperovičienė. Env. Res. Eng. and Management, 3(57), 21 – 27 (2011).
15. N. Munir, A. Imtiaz, N. Sharif, S. Optimization of growth conditions of different algal strains and determination of their lipid contents. Naz. J. An. & Plant Sc., 25(2), 546-553 (2015). [ Links ]
16. A. M. Sharma, P. K. Sahoo, S. Singhal, A. Patel. Impact of various media and organic carbon sources on biofuel production potential from Chlorella spp. 3 Biotech 6:116, doi: 10.1007/s13205-016-0434-6 (2016). [ Links ]
17. D. E. Marchello, A. T. Lombardi, M. J. Dellamano-Oliveira, C. W. O.De Souza. Microalgae population dynamics in photobioreactors with secondary sewage effluent as culture medium. Braz J Microbiol. 46(1), 75–84 (2015).
18. B.O. Arredondo Vega, B. Cordero Esquivel, C. Herrero, J. Abalde.CISESE, Universidad de la Coruña, España (1997). [ Links ]
19. B.O. Arredondo Vega, D. Voltolina, Eds. CIBNOR. (2007). [ Links ]
20. H. W. Bischoff, H. C. Bold. “Phycological Studies. IV. Some Algae from Enchanted Rock and Related Algae Species”. University of Texas Publications (1963).
21. R. A. Braga Jr., B. O. Silva, G. Rabelo, R. M. Costa, R. M. Enesa, N. Cap, H. J. Rabal, R. Arizaga, M. Trivi, G. Horgand. Reliability of biospeckle image analysis. Opt. Laser Eng. 45 (2007) 390-395. [ Links ]
22. R. Kruger, W. Thompson, A. F. Turner. IEEE Transc, Sys., Man Cybern, 4, 40-50 (1974). 11008-11019 (2007). [ Links ]
23. G. Rabelo, R. Braga Jr, I. Fabbro, M. Trivi, H. Rabal, R. Arizaga. Laser speckle techniques in quality evaluation of orange fruits. Revista Brasileira de Engenharia Agrícola e Ambiental, 9(4), 570-575 (2005). [ Links ]














