Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Anales (Asociación Física Argentina)
versión impresa ISSN 0327-358Xversión On-line ISSN 1850-1168
An. AFA vol.29 no.4 Buenos Aires oct. 2018
MATERIA CONDENSADA BLANDA
Bacterias de suelo: transporte en medios porosos bidimensionales
Soil bacteria: transport in bidimensional porous media
S. Montagna*1, A. R. Lodeiro2, and V. I. Marconi1
1 IFEG (UNC - CONICET), Facultad de Matemática, Astronomía, Física y Computación, Universidad Nacional de Córdoba (X5000HUA). Córdoba - Argentina
2 Instituto de Biotecnología y Biología Molecular (IBBM). Facultad de Ciencias Exactas, Universidad Nacional de La Plata y CCT-La Plata, CONICET (B1900GGD). La Plata - Argentina
* smontagna@unc.edu.ar
Recibido: 08/11/18;
aceptado: 05/12/18
Bradyrhizobium diazoefficiens es una bacteria de suelo muy utilizada como inoculante para la fijación simbiótica de nitrógeno en soja. Para que se produzca la simbiosis, estas bacterias deben desplazarse hasta los sitios de infección en las raíces, por lo cual la comprensión de su movilidad en el suelo es muy relevante. En este trabajo se presenta un estudio numérico de las propiedades de transporte de poblaciones bacterianas con dinámica de Langevin, en medios porosos bidimensionales, con obstáculos circulares. Se estudia el coeficiente de difusión traslacional variando la densidad y el radio de los defectos. Se encontró una dependencia de la difusión con el radio de los defectos, a mayor radio, menor difusión a una misma densidad de defectos. Estos resultados ayudan a la comprensión de la difusión de bacterias en medios porosos y puede contribuir al mejor diseño de dispositivos de microfluídica para su estudio en el laboratorio.
Palabras Clave: Bacteria; Transporte; Poros; Biotecnología.
Bradyrhizobium diazoefficiens is a soil bacteria used as inoculant for fixing nitrogen in symbiosis with soybean. Bacteria should move close to the roots for infection. Therefore, its motility properties into soil is crucial to be understood. In this work we present a numerical study of bacteria transport properties in 2D porous media using Langevin dynamics. We use solid disks as obstacles. Translational dffusion coefficient is studied as a function of obstacles density and radius. At constant density, we find that diffusion decays while radius increases. These results may help to understand bacteria diffusion in porous media and to improve the design of microfluidics devices for studies in laboratory.
Keywords: Bacteria; Transport; Porous; Biotechnology.
INTRODUCCIóN
Desde hace mucho tiempo ha surgido la necesidad de aplicar fertilizantes a los cultivos. A partir de esta necesidad a mediados del siglo XIX se desarrolló la industria de diversos tipos de fertilizantes. A finales del siglo XIX se registró la primer patente para inocular plantas con bacterias del género Rhizobium spp.,1 con el fin de aprovechar su capacidad simbiótica de nitrógeno, y de este modo, obtener este importante nutriente desde la atmósfera, sin afectar la fertilidad del suelo. Las Bradyrhizobium diazoefficiens2 son bacterias de suelo que se utilizan como biofertilizantes de la soja. Llevan a cabo un proceso simbiótico con las raíces que les permite reproducirse rápidamente y a la vez la planta puede fijar el nitrógeno atmosférico, mejorando así la calidad del grano. Se sabe que el rendimiento de los cultivos de soja en los que se aplican biofertilizantes es de un 5% más que en los no inoculados.3 Sin embargo en los suelos pampeanos el aporte de nitrógeno por inoculación no es suficiente para sostener los altos rendimientos esperados de los cultivos, los cuales, dada su alta demanda de nitrógeno, pueden convertirse en expoliadores del nitrógeno del suelo.
El uso de los biofertilizantes es generalizado, alrededor del 94% de los productores argentinos afirman aplicarlos1 y hay diversos productos en el mercado. Una de las ventajas, además de ser fertilizantes más sustentables que los químicos, es que son muy económicos. Sin embargo existen muchos desafíos biotecnológicos para mejorarlos, ya que su eficiencia es muy baja en comparación a los fertilizantes nitrogenados. Un aspecto importante es que las bacterias deben entrar en contacto con las raíces para producir la infección que da origen al proceso simbiótico. Para ello deben desplazarse en el suelo utilizando su aparato locomotor, el cual es un proceso que normalmente posee baja eficiencia.1 Por estas razones es relevante entender y conocer cómo es la dinámica de las B. diazoefficiens y sus propiedades de transporte en diversos tipos de suelo, para mejorar la calidad de los biofertilizantes y así lograr una agricultura nacional más sustentable. Los avances tecnológicos en nano y microfabricación y en la microfluídica han abierto muchas puertas a la microbiología y a las ciencias de la salud, ya que se ha logrado una mejor visualización, manipulación y análisis de los sistemas de estudio en la microescala. Por ejemplo el diseño de dispositivos con direccionamiento geométrico es ampliamente utilizado. Con esta técnica se ha logrado la separación de bacterias por velocidad,4 por tamaño5 y por estrategia de nado,6, 7 la concentración de espermatozoides8 y la generación de distribuciones homogéneas de espermatozoides que mejoran los análisis de fertilidad.9
En particular la dinámica de bacterias en sistemas porosos ha sido estudiada experimental y numéricamente. En la literatura se encuentran estudios sobre Escherichia coli y Pseudomonas putida en columnas de arena,10, 11 y en menor cantidad estudios en medios artificiales cuasi bidimensionales,12, 13 línea en la cual aportaremos con este trabajo.
Dado que el seguimiento individual de bacterias en el suelo es muy dificultoso con las técnicas experimentales actuales, el diseño de dispositivos que imiten la porosidad y tortuosidad de los canales del suelo y al mismo tiempo sean transparentes y biocompatibles puede contribuir a una mejor comprensión de la movilidad bacteriana en un laboratorio. La movilidad en el suelo no puede ser extrapolada de las observaciones en medios acuosos homogéneos. Con esta motivación, y con el fin de contribuir a esta problemática desde el modelado y simulaciones del problema, estudiamos numéricamente las propiedades de transporte de poblaciones bacterianas en sistemas bidimensionales que imiten un suelo. Cabe destacar que el enfoque, trabajo y objetivo se encuentran fuertemente ligados a los experimentos, por ejemplo, todos los parámetros usados en los modelos que se proponen para la dinámica bacteriana son datos medidos por colegas experimentales y analizados en este trabajo.14 Nuestro objetivo es modelar la física del sistema biológico de la forma más realista posible. En este trabajo se presenta una mejora del modelo previoy, introduciendo la heterogeneidad de las estrategias de nado en una población de bacterias y se estudian las propiedades de transporte en medios bidimensionales, con obstáculos circulares. Se calcula el coeficiente de difusión traslacional de una población para diferentes densidades y radios de los defectos, contribuyendo al entendimiento de la difusión de bacterias de suelo en función de las características geométricas del medio.
Movilidad de las bacterias B. diazoefficiens
Las B. diazoefficiens poseen dos sistemas flagelares, el subpolar y el lateral, presentados en la Fig. 1. El sistema subpolar o primario consta de un único flagelo, grueso y constitutivo que se encuentra en uno de los extremos de la bacteria. El sistema lateral consta de varios flagelos, más finos y largos que el subpolar. Hay diversas cepas de esta bacteria, carentes de alguno de los dos sistemas flagelares. En este trabajo se estudia la cepa salvaje, que presenta los dos tipos de flagelos.
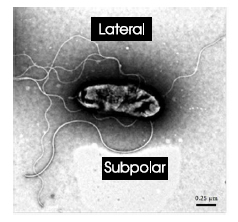
Figura 1: Imagen obtenida por micrografía electrónica de transmisión (TEM). Imagen extraída de Ref.[14] y modificada con permiso de los autores. Escala: 0.25_m.
Recientemente se han reportado los parámetros de movilidad de estas bacterias.14 Las estrategias de nado son muy heterogéneas. Por este motivo deben ser analizadas en detalle para poder reproducir de manera realista la dinámica de una población. Entre ellas se encuentran trayectorias tipo run and reverse (RR) y run, reverse and flick15, 16 (RRF), que se pueden ver en las Fig. 2(a) y Fig. 2(b) respectivamente, y trayectorias circulares, curvas y lineales. Las primeras dos, son un caso particular del típico run and tumble17 (RT), que consiste en una sucesión de corridas rectas de velocidad constante y tumbos, es decir cambios de dirección. En este trabajo nos centramos en las trayectorias de las bacterias que se encuentran en el seno del dispositivo o bulk. La proporción de estrategias de nado utilizada se presenta en la Fig. 2(c).

Figura 2: (a)estrategia de nado run and reverse en la cual la bacteria tiene un cambio abrupto de dirección, cercano a 180o, (b) run, reverse and flick en la cual tiene dos cambios de dirección muy cercanos en el tiempo, uno para volver hacia atrás y otro para retomar su corrida, con un ángulo de 90o15, 16 y (c) Diagrama de la proporción vista de cada estrategia de nado, según los datos de Ref.[14].
MODELO Y METODOLOGíA
Modelo fenomenológico A partir de modelos previos,6, 7, 18, 19 se construyó un modelo fenomenológico más cercano a las observaciones que describe la dinámica de N bacterias de suelo B. diazoefficiens del tipo salvaje con estrategia de nado tipo run and tumble en dos dimensiones.20 El modelo es más completo ya que se tiene en cuenta la heterogeneidad de las estrategias de nado. El sistema de estudio está compuesto por N bacterias diluídas en un medio acuoso. Cada bacteria es representada con un disco de radio Rb y se estudia su movimiento en una caja de Lx Ly con condiciones periódicas de contorno. De esta manera la densidad de micronadadores es constante y no hay paredes confinantes en las direcciones x e y. El problema está descripto por las ecuaciones de evolución de la velocidad (módulo y ángulo), que se explicarán con detenimiento a continuación. Dado que la dinámica está gobernada por el régimen de bajo número de Reynolds,21 la ecuación de movimiento a resolver para la bacteria i es:
![]()
donde es la constante de amortiguamiento del medio. La Ec. (1) es la ecuación de evolución de microorganismos autopropulsados en un fluido newtoniano sin flujo externo. El lado derecho es la suma de las fuerzas, elegidas fenomenológicamente como las dominantes que actúan sobre la bacteria. La fuerza del motor j ~FM i j j~vMj, es la fuerza de autopropulsión. La fuerza de interacción entre el nadador y las paredes u obstáculos ~Fsw i es la suma de las fuerzas ejercidas por las paredes cercanas y en particular para la pared k:
![]()
donde fsw es la máxima intensidad de la fuerza, ~rik es la distancia entre el centro de masa de la bacteria y el centro de la pared k, ^nk es el vector normal a la k-esima pared, a es la suma del radio de la bacteria y el semiancho de la pared y =0.1, es la función escalón. Un esquema de las distancias involucradas se puede ver en la Fig. 3.1. en Ref.[20]. Esta es una fuerza de interacción blanda. La fuerza de interacción entre nadadores, ~Fss i , es la suma de las interacciones con los otros nadadores cercanos. La interacción entre la bacteria i y k es:
![]()
donde fss es la máxima intensidad de la fuerza, rik es la distancia entre las bacterias, Rb es el radio de la bacteria, =0.1, es la función escalón, y ~rik = ~ri ~rk es el vector que une a las dos bacterias. El término ~FM i es muy relevante para la descripción del problema, las características de la estrategia de nado están tenidas en cuenta en ese término, es decir contiene las propiedades biológicas particulares de la movilidad de las bacterias. En nuestro caso, la interacción entre nadadores no es predominante ya que trabajamos con sistemas de bacterias muy diluídas, es decir con una densidad de bacterias menor a 0.1 bacterias/ m2. La posición de cada bacteria en el plano xy está dada por el vector ~ri y cuando nada libremente la dirección de movimiento forma un ángulo _ con el eje x, es decir ~vi = j~vij[cos( )^{ + sin( )^|] y coincide con la dirección de la fuerza del motor, . Para cada bacteria, si está libre, el módulo de su velocidad j~vij = j~vMj es constante, y la distribución de velocidades de la población corresponde a una gaussiana con media v y ancho v. Las bacterias modifican la dirección de la fuerza del motor = (t0) (t), en un paso temporal t = t0 t, por los cambios de dirección (ángulo entre la dirección de movimiento previa y la nueva) cada un cierto tiempo característico y por el ruido intrínseco de su motor, que está dado por el coeficiente de difusión rotacional Dr y está presente en cada paso temporal. La evolución en el tiempo del ángulo de la fuerza del motor con el eje x, se puede expresar en forma discreta como:
![]()
donde es una variable de estado, que vale 0 o 1. es una variable gaussiana centrada en el valor medio del módulo del cambio de dirección , que por simplicidad llamaremos , con ancho , y se fija la misma probabilidad de girar hacia la derecha o a la izquierda. A este ángulo medio se lo conoce como la persistencia de la bacteria.22 Para valores grandes del ángulo, la bacteria es poco persistente, en cambio para ángulos menores mantiene más tiempo su dirección de movimiento. El ruido del motor es p 2Dr y es una variable gaussiana elegida al azar, con media 0 y desviación estándar 1. En resumen, nuestro modelo considera dos fuentes de aleatoriedad, los cambios de dirección, a un dado característico y el ruido del motor, que está presente en cada instante. El ruido del motor es aplicado en cada , que es la discretización numérica del tiempo. Si la difusión rotacional es nula, Dr = 0, los tramos entre cambios de dirección son totalmente rectos. Los cambios de dirección suceden cada un cierto que corresponde a una variable exponencial con media , que determina el valor de. De esta manera, el parámetro es el tiempo característico de cambio de dirección. Para poder aplicar el modelo son necesarios los parámetros de la movilidad, que se obtienen de las observaciones experimentales14 y se presentan en la Tabla 1.
Tabla 1: Parámetros de la movilidad utilizados en las simulaciones. Velocidad media, v, tiempo característico de cambio de dirección, y angulo de persistencia, medidos y coeficiente de difusión rotacional, Dr, estimado.

Es importante resaltar que el único parámetro de la movilidad que difiere según la estrategia de nado es el ángulo medio de cambio de dirección, que en el caso de las trayectorias lineales es 25o, en cambio para RR-RRF es 95o y con una dispersión del orden de correspondiente a trayectorias tipo lineales. Gran parte de los micronadodores se encuentran en medios reducidos y su movilidad se ve afectada por obstáculos. Este es el caso de las bacterias de suelo. La diversidad de suelos y condiciones ambientales, como ser la cantidad de agua, el tamañoo y distribución de los poros, los diferentes materiales presentes, muestran la complejidad de su análisis. En busca de poder estudiar en el laboratorio las propiedades de transporte en su medio natural, en este trabajo se diseñan microdispositivos numéricamente, que intentan imitar un suelo poroso. En ellos hay un confinamiento en la dirección z, es decir las bacterias tienen disponible un espacio de profundidad del orden de algunos pocos cuerpos, logrando un medio cuasi bidimensional. Con esta idea, se estudió una geometría 2D muy simple, que consiste en obstáculos circulares, todos con el mismo radio. Un parámetro importante para caracterizar cada suelo es la densidad de defectos, esto es la fracción de área que ocupan los obstáculos en el medio, en relación al área total:

Realizamos simulaciones con condiciones periódicas de contorno en x e y, con una celda de simulación cuadrada de Lx = 100 m, Ly = 100 m, con una población de N = 500 bacterias de radio Rb =0.5 m, para diferentes geo. La configuración de los obstáculos circulares es aleatoria. Las posiciones iniciales (t = 0) de las bacterias se eligieron también de forma aleatoria, uniformemente distribuidas en el espacio libre de la celda. A su vez, las velocidades iniciales se eligieron aleatoriamente de acuerdo a una distribución gaussiana con media v y ancho v de la Tabla 1. A partir de dichas condiciones iniciales, se resolvieron las ecuaciones Ec. (1) y Ec. (4) usando Runge-Kutta 4 y Euler, con un paso temporal t=0.0001s, y la duración temporal de las simulaciones en todos los casos fue de 1 h.
Cantidades calculadas
Es de interés caracterizar las propiedades difusivas de poblaciones bacterianas en medios porosos similares al suelo, las cuales se explican al igual que en el caso de un sistema de partículas por el desplazamiento cuadrático medio (MSD por sus siglas en inglés). El coeficiente de difusión traslacional, D, está relacionado con el MSD por la ecuación:
![]()
donde d es la dimensión del problema, en este caso d = 2, y es el exponente que caracteriza la evolución temporal del MSD. Para < 1 el proceso es subdifusivo, para =1 es difusivo y =2 es balístico. Se calcularon las trayectorias de cada partícula para todo tiempo, es decir las coordenadas (x(t); y(t)) de cada bacteria. De esta manera, se calculó el MSD en cada tiempo y las trayectorias de las bacterias, es decir sus posiciones en cada paso de tiempo. En todos los casos, a partir del MSD y la Ec. (6) se determinó el coeficiente de difusión traslacional, D. Este valor fue promediado en 20 realizaciones en configuración de defectos, es decir en medios con la misma porosidad, geo, pero diferentes posiciones de los defectos y condiciones iniciales (posición y velocidad) de las partículas elegidas de forma aleatoria.
RESULTADOS
Simulamos la dinámica bacteriana de poblaciones de la cepa salvaje, para diversos tipo de medio. En cuanto al radio de los defectos, los variamos en el rango R = 5 - 20m, con paso de 1m, usando una densidad de defectos geo =0.1-0.5. En la Fig. 3 se presentan algunas trayectorias a modo de ejemplo. Esta es una cantidad microscópica que nos permite verificar que el modelo aplicado reproduce las principales características de las estrategias de nado, la cual fue previamente analizada en una espacio sin obstáculos y comparada con las observaciones de Ref.[14]. De esta manera, podemos decir que nuestro modelo compuesto por las Ec.(1-4) es un modelo fenomenológico adecuado para reproducir las observaciones experimentales de poblaciones sin confinar, lo cual nos permite continuar con el estudio de la movilidad de las bacterias en diferentes medios porosos.

Figura 3: Cuatro trayectorias ilustrativas de 500 simuladas. Espacio graficado 150_150_m2.
Con el fín de estudiar las propiedades de transporte de una población de bacterias, nos centramos en comprender las características de la difusión. En la Fig. 4 se muestra el desplazamiento cuadrático medio en función del tiempo, para medios con obstáculos de radio R = 15 m Rb=0.5_m, con diferentes densidades de defectos. Se observan dos regímenes claramente diferenciados. A tiempos cortos, t < 1 s, la dinámica es balística, es decir el exponente de la Ec. (6) es = 2, como se puede ver en la Fig. 4. La velocidad media es v 30m/s, con lo cual la distancia de un cuerpo es recorrida en el orden de 0.03 s. Corresponde a tiempos menores que el tiempo característico de cambio de dirección 2s, tiempo en el que la bacteria realiza un movimiento cuasi recto a velocidad constante, como en un movimiento balístico. En este régimen predomina la velocidad media de las bacterias. A tiempos largos la dinámica es difusiva, ya que el exponente es =1. En este caso predomina la estrategia de nado, es decir el conjunto de parámetros de la movilidad: velocidad media v, y el ángulo de persistencia. Como es de esperar, a menor densidad de defectos la población difunde más, con lo cual la curva superior de la Fig. 4 corresponde a la de menor geo.

Figura 4: Desplazamiento cuadrático medio en función del tiempo. Medio con defectos de radio R=15_m, con diferentes densidades de defectos, geo=0.07-0.45.
A partir de las curvas del desplazamiento cuadrático medio obtuvimos el coeficiente de difusión traslacional, D, de la Ec. (6). En la Fig. 5 se presentan los resultados de D en función de la densidad de defectos geo para los diferentes radios usados. Se puede ver que decae monótonamente en función de geo. Es notable que el error asociado a cada coeficiente disminuye conforme la densidad de defectos geo aumenta, independientemente del radio de los defectos. Esto se debe a que a mayor densidad el espacio de configuraciones de defectos es menor. Para densidades bajas, geo 0.1 el error es del orden de 50 m2/s, en cambio para densidades altas, geo 0.5, es del orden de 25 m2/s, con lo cual disminuye un 50 %.
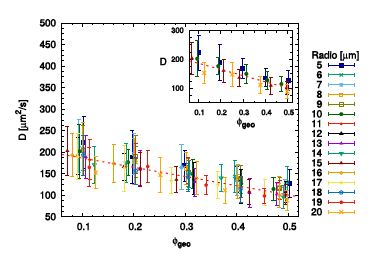
Figura 5: Coeficiente de difusión en función de la densidad de defectos, geo, para radios R =5-20 m. La línea roja punteada es como guía del decaimiento, una función lineal, a geo +b con a =-214 m2/s y b =208 m2/s. Inset: para mayor claridad, los datos correspondientes a R =5, 10, 15, 20 m.
Es importante resaltar que cuando una bacteria se encuentra en las inmediaciones de un obstáculo sólido, tiende a nadar a lo largo de la superficie. La bacteria se puede alejar del obstáculo, ya sea por un cambio de dirección, que sucede cada cierto tiempo característico, o por el ruido, es decir por la difusión rotacional. Esta interacción con los obstáculos será diferente según su radio. Analizamos cuál es la influencia del radio de los obstáculos en las propiedades de transporte. En la Fig. 6 se presenta el coeficiente de difusión traslacional en función del radio de los defectos para las densidades extremas en las que se realizaron las simulaciones, geo 0.1 y geo 0.5. Se observa un decaimiento lineal con el radio de los defectos para ambas densidades. Se realizó un ajuste lineal, de la forma a geo + b, y para geo 0.1 se obtuvo a=(-2.9 0.6) m2=s y b=(229 8) m2=s, y para geo 0.5, a=(-2.0 0.3) m2=s y b=(135 4) m2=s.

Figura 6: Coeficiente de difusión del radio de los defectos, para dos densidades particulares, geo 0.1 y geo 0.5. Las lineas corresponden a los ajustes lineales correspondientes.
DISCUSIóN
En este trabajo se modeló fenomenológicamente la movilidad de las bacterias de suelo Bradyrhizobium diazoefficiens del tipo salvaje, reproduciendo teóricamente las características de nado de la cepa salvaje recientemente reportadas en experimentos. Luego de constatar que el modelo propuesto reproduce de manera realista las particularidades de la movilidad bacteriana libre, caracterizamos las propiedades de transporte de poblaciones en diferentes medios con obstáculos. La difusión traslacional disminuye al aumentar la densidad de defectos, es decir que los obstáculos dificultan el desplazamiento de la población. Es importante notar que a medida que aumenta geo el tiempo medio de cambio de dirección de la bacteria se reduce por los sucesivos encuentros con los defectos, es decir por el efecto de confinamiento, con su consecuente modificación de las propiedades de transporte. Se realizó un análisis exhaustivo de la difusión traslacional para diferentes radios de defectos. Encontramos una relación entre la difusión traslacional de la población de bacterias y el radio de los defectos. Esta relación depende de la densidad. Si bien para todas las densidades de defectos estudiadas la difusión decae con el radio, para densidades bajas de defectos, geo 0.1, este decaimiento es más notorio que para densidades altas. Esto se debe a cómo está distribuida el área ocupada por los defectos, y la relación del tamaño de la bacteria con el de los defectos. En la Fig. 3 se puede ver esta diferencia. Cuando interactúan con los defectos más grandes, las bacterias permanecen más tiempo en sus inmediaciones, modificando así su movilidad localmente. En cambio, cuando interactúan con los defectos más pequeños, de tamaño del orden de su cuerpo, no modifican considerablemente su dinámica. A tiempos largos esta distinción redunda en una modificación de las propiedades de transporte.
Las conclusiones de este trabajo aportan a entender las propiedades de transporte de bacterias de suelo utilizadas como biofertilizantes. Estos avances pueden ayudar a mejorar la calidad de dichos fertilizantes y así lograr una agronomía más sustentable.
AGRADECIMIENTOS
Financiamiento de CONICET, SeCyT-UNC y PICT2015-0735. Agradecemos especialmente a nuestros colegas M.L. Cordero, A.J. Banchio y a los integrantes del laboratorio de Interacciones entre rizobios y soja liderado por A.R. Loreiro por las fructíferas discusiones y al GTMC-FaMAF-UNC por los recursos del clúster.
* Agradecemos a H. N. Moyano Cortéz y M. Brito por el código desarrollado.
REFERENCIAS
1. Microbiología Agrícola: Un aporte de la investigación en Argentina. Magna Publicaciones, 2013. [ Links ]
2. J.R.M. Delamuta, R.A. Ribeiro, E. Ormeno-Orrillo, I. Soares Melo, E. Martínez-Romero, and M. Hungria. Polyphasic evidence supporting the reclassification of Bradyrhizobium japonicum group Ia strains as Bradyrhizobium diazoefficiens sp. nov. Int. J. Syst. Evol. Microbiol., 63:3342, 2013. [ Links ]
3. F. Salvagiotti, J. Capurro, and J.M. Enrico. El manejo de la nutrición nitrogenada en soja. INTA, 2009. [ Links ]
4. P. Galajda, J. Keymer, P. Chaikin, and R. Austin. A wall of funnels concentrates swimming bacteria. J. Bacteriol., 189(23):8704, 2007. [ Links ]
5. S.E. Hulme, W.R. DiLuzio, S.S. Shevkoplyas, L. Turner, M. Mayer, H.C. Berg, and G.M. Whitesides. Using ratchets and sorters to fractionate motile cells of Escherichia coli by length. Lab on a Chip, 8:1888, 2008. [ Links ]
6. I. Berdakin, Y. Jeyaram, V.V. Moshchalkov, L. Venken, S. Dierckx, S.J. Vanderleyden, A.V. Silhanek, C.A. Condat, and V.I. Marconi. Inuence of swimming strategy on microorganism separation by asymmetric obstacles. Phys. Rev. E, 87:0527021, 2013. [ Links ]
7. I. Berdakin, A.V. Silhanek, H.N. Moyano Cortez, V.I. Marconi, and C.A. Condat. Quantifying the sorting efficiency of self-propelled run-and-tumble swimmers by geometrical ratchets. Cent.Eur. J. Phys., 11(12), 2013. [ Links ]
8. A. Guidobaldi, Y. Jeyaram, I. Berdakin, V.V. Moshchalkov, C.A. Condat, V.I. Marconi, L. Giojalas, and A.V. Silhanek. Geometrical guidance and trapping transition of human sperm cells. Phys. Rev. E., 89:0327201, 2014. [ Links ]
9. H.A. Guidobaldi, Y. Jeyaram, C.A. Condat, M. Oviedo, I. Berdakin, V.V. Moshchalkov, L.C. Giojalas, A.V. Silhanek, and V.I. Marconi. Disrupting the wall accumulation of human sperm cells by artificial corrugation. Biomicrofluidics, 9(2):024122, 2015. [ Links ]
10. J.W. Barton and R.M. Ford. Determination of effective coefficients for bacterial migration in sand columns. Appl. Environ. Microbiol., 61(9):3329, 1995. [ Links ]
11. J. Liu, R.M. Ford, and J.A. Smith. Idling Time of Motile Bacteria Contributes to Retardation and Dispersion in Sand Porous Medium. Environ. Sci. Technol., 45:3945, 2011. [ Links ]
12. J.E. Sosa-Hernández, M. Santillán, and J. Santana-Solano. Motility of Escherichia coli in a quasi-two-dimensional porous medium. Phys. Rev. E, 95, 2017. [ Links ]
13. S. Rismani Yazi, N. Nosrati, C.A. Stevens, D. Vogel, and C. Escobedo. Migration of magnetotactic bacteria in porous media. Biomicrouidics, 12:011101, 2018. [ Links ]
14. J.I. Quelas, M.J. Althabegoiti, C. Jimenez-Sanchez, A.A. Melgarejo, V.I. Marconi, E.J. Mongiardini, S.A. Trejo, F. Mengucci, J.J. Ortega-Calvo, and A.R. Lodeiro. Swimming performance of Bradyrhizobium diazoefficiens is an emergent property of its two agellar systems. Sci. Rep., 6:23841, 2016. [ Links ]
15. L. Xie, S. Chattopadhyay, and X.L Wun. Bacterial agellum as a propeller and as a rudder for efficient chemotaxis . PNAS, 108:2246, 2011. [ Links ]
16. K. Son, J.S. Guasto, and R. Stocker. Bacteria can exploit a agellar buckling instability to change direction. Nat. Phys., 9:494, 2013. [ Links ]
17. H.C. Berg and D.A. Brown. Chemotaxis in escherichia coli analysed by three dimensional tracking. Nature, 239:500, 1972. [ Links ]
18. H.N. Moyano Cortéz. Dinámica bacteriana en sustratos micro-diseñados, 2014. Trabajo especial de la Lic. en Física. FaMAF-UNC. [ Links ]
19. I. Berdakin. Dinámica de micronadadores: optimización y control. PhD thesis, FaMAF-UNC, 2015. [ Links ]
20. S. Montagna. Dinámica de bacterias de suelo, 2018. Trabajo especial de la Lic. en Física. FaMAF-UNC. [ Links ]
21. E. M. Purcell. Life at low Reynolds number. Am. J. Phys., 45(1):3, 1977. [ Links ]
22. H. C. Berg. E. Coli in Motion. Springer, 2004. [ Links ]














