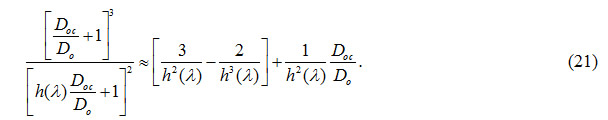Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Anales (Asociación Física Argentina)
versión impresa ISSN 0327-358Xversión On-line ISSN 1850-1168
An. AFA vol.31 no.3 Buenos Aires nov. 2020
https://doi.org/10.31527/analesafa.2020.31.3.107
TECNOLOGÍA
Actividad fotocatalítica de barros de Dióxido de Titanio de alta concentración a pH neutro
Photocatalytic activity of high-concentration Titanium Dioxide slurries at neutral pH
L. del C. Cid1,2, C. M. C. Vera1, P. A. Sorichetti*2
1 Departamento de Química, Facultad de Ingeniería. Universidad de Buenos Aires, Av. Paseo Colón 850 5to Piso (C1063ACV), Buenos Aires, Argentina.
2 GLOMAE . Departamento de Física. Facultad de Ingeniería Universidad de Buenos Aires, Av. Paseo Colón 850 2do Piso (C1063ACV), Buenos Aires, Argentina.
Autor para correspondencia: email: lcid@fi.uba.ar
Recibido: 07/02/2020
Aceptado: 03/06/2020
Resumen:
Se estudiaron las propiedades de los barros ("slurries") de alta concentración de dióxido de titanio bajo irradiación UV para la oxidación fotocatalítica de contaminantes. Se usaron nanopartículas de TiO2 de origen comercial (Evonik AeroxideÒ P25) a concentraciones de 0.5, 1, 1.5, 2 y 2.5 g L-1, irradiadas por una lámpara de mercurio (254 nm). A pH neutro, dentro del rango de concentraciones estudiado, las nanopartículas forman aglomerados de algunas decenas de micrones. Su tamaño, determinado mediante microscopía óptica, aumenta linealmente con la concentración de catalizador. La longitud de atenuación de la radiación UV se determinó mediante un espectrofotómetro con esfera integradora. Los resultados concuerdan con un modelo simple basado en la aproximación de óptica geométrica. La concentración de contaminante modelo (Orange II) se determinó por espectrofotometría a intervalos de 20 minutos durante el tiempo de irradiación (6 horas). Los valores obtenidos ajustan bien a una cinética de pseudo primer orden. Para concentraciones de catalizador de 1 g L-1 y superiores, la constante cinética es de (8.1 ± 0.5) × 10-3 min-1. Esto se explica por la disminución de la longitud de atenuación y el incremento simultáneo de la superficie total expuesta al aumentar la concentración de catalizador.
Palabras clave: aglomeración, barro de alta concentración, Orange II, fotocatálisis, dióxido de titanio.
Abstract:
The properties of high-concentration titanium dioxide slurries under UV irradiation were studied for photocatalytic oxidation of contaminants. Commercial nanoparticles of TiO2 (Evonik AeroxideÒ P25) at concentrations of 0.5, 1, 1.5, 2 and 2.5 g L-1 were irradiated by a mercury lamp (254 nm). At neutral pH, within the studied concentration range, nanoparticles form agglomerates of tens of micrometers. Their size, measured by optical microscopy, increases linearly with catalyst concentration. The attenuation length of the UV radiation was measured by a spectrophotometer with an integrating sphere. The concentration of the model contaminant (Orange II) was determined by spectrophotometry at intervals of 20 minutes, during the irradiation time (6 hours). The measured values fit satisfactorily to a pseudo first order kinetics. At catalyst concentrations of 1 g L-1 and higher, the kinetic constant is (8.1 ± 0.5) × 10-3 min-1. This is explained by the diminution of the attenuation length and the simultaneous increase of the total exposed surface at higher catalyst concentrations.
Keywords: agglomeration, high-concentration slurry, Orange II, photocatalysis, titanium dioxide.
I. INTRODUCCIÓN
Los usuarios urbanos e industriales generan grandes cantidades de aguas residuales las cuales, si son dispuestas sin tratamiento adecuado tienen un gran impacto en el ambiente. Por lo tanto, es necesario purificar eficientemente las aguas residuales para cumplir con los requerimientos de calidad establecidos por las regulaciones de muchos países. Impulsados por legislación crecientemente más estricta así como por la creciente preocupación sobre los problemas ambientales, los Procesos Avanzados de Oxidación y Reducción (PAORs) se han desarrollado en las últimas décadas. Estos procesos inducen cambios en la estructura química de los contaminantes resistentes a los procesos convencionales. Estos PAORs han sido propuestos para degradar contaminantes biorecalcitrantes, tóxicos y carcinogénicos, y también para los denominados contaminantes emergentes.1–3 Estos últimos, tales como los efluentes de la producción farmacéutica, son de interés debido a su persistencia e impacto en el entorno acuático aún a bajas concentraciones.4 El uso de los PAORs como pretratamiento mejora la biodegradabilidad del agua residual, incrementando la eficiencia del proceso de tratamiento mientras que reduce los costos operativos.1 Entre los PAORs la fotocatálisis heterogénea es de gran interés. El propósito de este trabajo es estudiar las propiedades de los barros ("slurries") de alta concentración de dióxido de titanio para la oxidación fotocatalítica bajo irradiación UV. Cuando las nanopartículas de este semiconductor son irradiadas con radiación electromagnética cuyos fotones tienen energía mayor que el ancho de la banda prohibida ("band gap"), se generan pares electrón-hueco. En nanopartículas es posible que los electrones y huecos lleguen a la superficie de la misma antes de recombinarse, dando origen a especies reactivas tales como radicales hidroxilo (OH![]() ) e iones superóxido (O
) e iones superóxido (O![]() ), produciendo entonces reacciones de óxido-reducción, por ejemplo la oxidación de materia orgánica a dióxido de carbono, y agua.1,5 En este trabajo se usaron nanopartículas de TiO2 de origen comercial (Evonik AeroxideÒ P25) pues son muy estables, no tóxicas y de bajo costo.6 Su estructura cristalina está compuesta por 80% de anatasa y 20% de rutilo. Cabe destacar que la estructura cristalina del P25 es importante para la eficiencia fotocatalítica. En general, la anatasa tiene mayor eficiencia cuántica fotocatalítica5,7 debido a su baja adsorción de oxígeno y más alto grado de hidroxilación (número de grupos hidroxilo sobre la superficie).7 Aunque en principio la anatasa parece ser más eficiente, experimentalmente se encontró que un cierto porcentaje de rutilo en las nanopartículas (como en el caso del Evonik P25) incrementa la eficiencia, como se informa en la bibliografía.8 El "band gap" efectivo es 3.2 eV, el cual corresponde a una longitud de onda de corte
), produciendo entonces reacciones de óxido-reducción, por ejemplo la oxidación de materia orgánica a dióxido de carbono, y agua.1,5 En este trabajo se usaron nanopartículas de TiO2 de origen comercial (Evonik AeroxideÒ P25) pues son muy estables, no tóxicas y de bajo costo.6 Su estructura cristalina está compuesta por 80% de anatasa y 20% de rutilo. Cabe destacar que la estructura cristalina del P25 es importante para la eficiencia fotocatalítica. En general, la anatasa tiene mayor eficiencia cuántica fotocatalítica5,7 debido a su baja adsorción de oxígeno y más alto grado de hidroxilación (número de grupos hidroxilo sobre la superficie).7 Aunque en principio la anatasa parece ser más eficiente, experimentalmente se encontró que un cierto porcentaje de rutilo en las nanopartículas (como en el caso del Evonik P25) incrementa la eficiencia, como se informa en la bibliografía.8 El "band gap" efectivo es 3.2 eV, el cual corresponde a una longitud de onda de corte ![]() , de 388 nm.9
, de 388 nm.9
Por otra parte, se sabe que las nanopartículas de TiO2 en suspensiones acuosas a altas concentraciones forman aglomerados.10 El grado de aglomeración disminuye para valores de pH lejanos al punto de carga cero (pzc).11 Para TiO2 Evonik P25 el pzc es 6.8;12 por consiguiente a pH 7, TiO2 tiende a aglomerarse formando agregados del tamaño de micrones.10 Aunque la operación a pH ácido conduce a menor aglomeración, para aplicaciones industriales la acidificación del agua residual puede no resultar práctica ni económica dado que hace necesario dos pasos subsiguientes: (i) alcalinización para alcanzar el valor límite de pH para descarga en el cuerpo de agua receptor y (ii) una etapa de filtración más costosa para remover los aglomerados más pequeños. Por estas razones, en este trabajo estudiamos los efectos de la aglomeración en la degradación fotocatalítica de Orange II a concentraciones de TiO2 desde 0.5 g L-1 hasta 2.5 g L-1 a pH 7.
La estimación de los efectos de la aglomeración sobre las propiedades del "slurry" es de interés para el diseño y la validación del modelo de los fotoreactores. En nuestro conocimiento, se encontraron comparativamente menos trabajos en este rango de condiciones de operación.13–18
Para el estudio de la actividad fotocatalítica empleamos Orange II como contaminante modelo. El Orange II es un colorante sintético fenilazonaftólico potencialmente carcinogénico y no biodegradable19,20 frecuentemente usado en las industrias textiles y de teñido y ha sido estudiado exhaustivamente.20 Su fórmula molecular es C16H11N2NaO4S. En la oxidación fotocatalítica de Orange II, la mineralización del contaminante produce especies tales como: CO2, H2O, SO![]() , NO
, NO![]() , NH
, NH![]() .18,21,22
.18,21,22
Esta molécula posee un enlace azo (¯N = N¯) el cual origina un pico de absorbancia a 484 nm. Esto permite que su concentración pueda ser determinada fácilmente por espectrofotometría UV-visible.
II. EXPERIMENTAL
Reactor
Las mediciones se realizaron en un reactor cilíndrico discontinuo ("batch"), cuyas dimensiones geométricas se presentan en la Fig. 1. Se utilizó burbujeo de aire y agitación magnética. Se verificó experimentalmente que, desde el punto de vista fluidodinámico, el mezclado puede considerarse completo.

FIG. 1: Esquema del reactor indicando sus parámetros geométricos: L: longitud de la lámpara UV, H: altura de la fase líquida en el reactor, D: diámetro interno del reactor y d: diámetro externo del tubo de cuarzo.
La radiación fue provista por una lámpara ultravioleta UVC (Philips, potencia eléctrica 6 W, 254 nm) protegida por un tubo de cuarzo con un diámetro externo de 0.02 m y ubicada a lo largo del eje del reactor. La lámpara de descarga de vapor de mercurio de baja presión irradia luz prácticamente monocromática de 254 nm. Esta lámpara tiene una potencia radiante de 1.7 W de acuerdo con el fabricante, correspondiente a un flujo de fotones de 3.6 μmol s-1. Este valor fue comprobado por actinometría con ferrioxalato.23 Para evitar la influencia de luces externas el reactor fue envuelto con papel de aluminio.
III. MATERIALES Y MÉTODOS
Productos químicos
El fotocatalizador usado fue una muestra en polvo de dióxido de titanio (TiO2) P25 suministrada por su fabricante (Evonik). El catalizador se utilizó tal como se recibió. Se preparó una solución madre del contaminante modelo con una concentración de 250 mg L-1 utilizando Orange II (Merck, Pro Analisis). En este trabajo se empleó, en todos los casos, agua deionizada (18 MΩ cm-1).
Métodos
A los efectos de determinar el tamaño de los agregados para cada concentración de catalizador deseada (0.5, 1, 1.5, 2 y 2.5 g L-1) se prepararon suspensiones con la cantidad apropiada de TiO2 P25 y agua deionizada y se sonicaron durante 30 min. Se tomó una muestra del "slurry" de cada una de dichas suspensiones y se analizó el tamaño de los agregados por microscopía óptica a 80X.
En un experimento típico de fotocatálisis, para cada concentración de catalizador se introdujeron en el reactor las cantidades apropiadas de suspensiones de TiO2 sonicadas durante 30 minutos y el volumen correspondiente de solución madre de colorante para alcanzar en todos los experimentos una concentración inicial de Orange de 20 mg L-1 en un volumen final de solución de 3 L. El reactor se mantuvo en oscuridad durante 60 min previo al comienzo de la irradiación UV para alcanzar el equilibrio de adsorción. Además se operó el reactor bajo burbujeo de aire y agitación magnética durante todo el experimento. En todos los experimentos el pH se ajustó continuamente a 7 con hidróxido de sodio 0.1 M (grado analítico).
Se tomaron muestras del reactor cada 20 minutos y se las filtró a través de filtros de jeringa (MiniSart) de tamaño de poro 0.2 μm a fin de remover las partículas de fotocatalizador antes del análisis.
Las concentraciones de colorante fueron determinadas por una técnica colorimétrica usando un espectrofotómetro (UV-VIS Shimadzu UV2401 PC). Previamente se obtuvo una curva de calibración a partir de soluciones de concentraciones conocidas de Orange II.
Se realizaron mediciones a una longitud de onda de 484 nm, dado que, de acuerdo con la bibliografía15 este valor está relacionado con el enlace azo que se destruye cuando el colorante es degradado. Se analizaron los datos experimentales usando un método de cuadrados mínimos no lineal (Levenberg- Marquardt).
Las mediciones de absorbancia difusa del "slurry" se realizaron en el mismo espectrofotómetro usado para las mediciones de concentración del colorante usando una esfera integradora.
IV. RESULTADOS Y DISCUSIÓN
Microscopía óptica. Tamaño de los aglomerados
Las imágenes de microscopía óptica fueron analizadas con el software Global Lab Image (Data Translation Inc.). Para cada concentración de TiO2, ![]() , se determinó el radio equivalente promedio de los aglomerados,
, se determinó el radio equivalente promedio de los aglomerados, ![]() . Para fines ilustrativos, se muestra una micrografía en la Fig. 2 para
. Para fines ilustrativos, se muestra una micrografía en la Fig. 2 para ![]() = 0.5 g L-1.
= 0.5 g L-1.

FIG. 2: Imagen de microscopía óptica del "slurry" (iluminación con luz blanca, 80X) para ![]() = 0.5 g L-1.
= 0.5 g L-1.
En la Fig. 3 se ha graficado el radio promedio equivalente como función de la concentración de catalizador.
Se encontró una dependencia lineal del radio promedio equivalente de los aglomerados, ![]() , con la concentración de TiO2,
, con la concentración de TiO2, ![]() . Por lo tanto,
. Por lo tanto,
Los parámetros de ajuste de esta ecuación con sus incertezas (una desviación standard) se presentan en la Tabla 1. El coeficiente de correlación del ajuste, R2, es 0.96.

FIG. 3: Radio equivalente promedio de los aglomerados (![]() ) como función de la concentración de catalizador (
) como función de la concentración de catalizador (![]() ).
).
TABLA 1: Parámetros de la estimación lineal del radio promedio equivalente de los aglomerados de TiO2 como función de la concentración del catalizador, Ec. (1 ).

En el rango de condiciones de operación estudiados en este trabajo el tamaño de los aglomerados está en el orden de varios micrómetros. Por lo tanto, se justifica la validez de la Óptica Geométrica para analizar la absorción y "scattering" de la radiación UV (![]() ) como se indica en la bibliografía.9
) como se indica en la bibliografía.9
Efectos de la aglomeración sobre la superficie expuesta del catalizador
A partir de la suposición de una relación lineal entre el radio de los aglomerados, ![]() , y la concentración de catalizador,
, y la concentración de catalizador, ![]() , Ec. (1), la superficie expuesta de un aglomerado,
, Ec. (1), la superficie expuesta de un aglomerado, ![]() , podría ser aproximada a
, podría ser aproximada a
La masa total del catalizador,![]() , se puede escribir como
, se puede escribir como
Si ![]() es la masa de un aglomerado y
es la masa de un aglomerado y ![]() es el número de aglomerados en un reactor de volumen
es el número de aglomerados en un reactor de volumen ![]() , el número de aglomerados (supuestos esféricos) es
, el número de aglomerados (supuestos esféricos) es
donde ![]() es la densidad aparente del catalizador en un aglomerado. En este trabajo se supone el valor de
es la densidad aparente del catalizador en un aglomerado. En este trabajo se supone el valor de ![]() igual a la "tapped density" dada por el fabricante, 130 kg m-3.24 Por lo tanto, la superficie total expuesta del catalizador,
igual a la "tapped density" dada por el fabricante, 130 kg m-3.24 Por lo tanto, la superficie total expuesta del catalizador, ![]() , se puede escribir como
, se puede escribir como
Reemplazando las Ecs. (2) y (4) en (5):
Podemos definir la concentración de catalizador característica, ![]() :
:
Por lo tanto, la Ec. (6) puede ser escrita como
Cuando ![]() el área total expuesta,
el área total expuesta, ![]() , es proporcional a la concentración inicial de catalizador; por el contrario, cuando
, es proporcional a la concentración inicial de catalizador; por el contrario, cuando ![]() ,
, ![]() tiende al valor asintótico
tiende al valor asintótico
Puede verse que, debido a la aglomeración, al aumentar la concentración de catalizador por encima de ![]() , la superficie disponible total expuesta crece cada vez más lentamente. A partir de la Ec. (8) se deduce que, cuando la concentración de catalizador es
, la superficie disponible total expuesta crece cada vez más lentamente. A partir de la Ec. (8) se deduce que, cuando la concentración de catalizador es ![]() , la superficie disponible,
, la superficie disponible, ![]() , es el 50% de
, es el 50% de ![]() . Debe destacarse que ambas
. Debe destacarse que ambas ![]() y
y ![]() dependen de las propiedades de la agregación del "slurry" y, por lo tanto, pueden variar al cambiar las condiciones de operación, particularmente el pH. A partir de los parámetros de la Tabla 1,
dependen de las propiedades de la agregación del "slurry" y, por lo tanto, pueden variar al cambiar las condiciones de operación, particularmente el pH. A partir de los parámetros de la Tabla 1, ![]() es (3.7
es (3.7 ![]() 0.6) g L-1 y
0.6) g L-1 y ![]() es
es ![]() m-1. Por consiguiente, se tiene
m-1. Por consiguiente, se tiene ![]() aun a la máxima concentración inicial de catalizador estudiada en este trabajo, 2.5 g L-1.
aun a la máxima concentración inicial de catalizador estudiada en este trabajo, 2.5 g L-1.
Efecto de la aglomeración sobre la longitud de atenuación
Se midieron las absorbancias de los "slurries" de TiO2 para distintas concentraciones de catalizador usando un espectrofotómetro UV-VIS Shimadzu con una esfera integradora en el rango de longitudes de onda de 350 hasta 800 nm (Fig. 3).
Se puede definir la absorbancia ("profundidad óptica"), ![]() , como
, como
donde ![]() es la transmitancia,
es la transmitancia, ![]() es el paso óptico de la celda de medición (en este experimento es 1 cm) y
es el paso óptico de la celda de medición (en este experimento es 1 cm) y ![]() es la longitud de atenuación.
es la longitud de atenuación.
Como puede verse en la Fig. 4 la absorbancia se incrementa notablemente para longitudes de onda menores que la longitud de onda de corte, ![]() (388 nm), correspondientes a la energía del ancho de banda prohibida del dióxido de titanio.
(388 nm), correspondientes a la energía del ancho de banda prohibida del dióxido de titanio.
En analogía con la Ley de Lambert-Beer se puede estimar la longitud de atenuación, ![]() , a partir del número de aglomerados por unidad de volumen de reactor,
, a partir del número de aglomerados por unidad de volumen de reactor, ![]() , y la sección transversal efectiva de un aglomerado para la interacción con la radiación,
, y la sección transversal efectiva de un aglomerado para la interacción con la radiación, ![]() ,
,
Por lo tanto, a partir de las Ecs. (4) y (11), se puede escribir ![]() como
como

FIG. 4: Absorbancia como función de la longitud de onda para diferentes concentraciones de catalizador, ![]() .
.
Como se explicó arriba en este trabajo, el tamaño de los aglomerados es del orden de varias decenas de micrómetros, entonces se puede estimar ![]() utilizando la aproximación de la Óptica Geométrica en el límite de longitudes de onda cortas (
utilizando la aproximación de la Óptica Geométrica en el límite de longitudes de onda cortas (![]() ).9 La sección transversal en el límite de óptica geométrica es
).9 La sección transversal en el límite de óptica geométrica es
Sin embargo, en la estimación de la sección transversal efectiva de un aglomerado para la interacción con la radiación es necesario tener en cuenta los efectos de dependencia con la longitud de onda, originada por la forma no esférica de los agregados, la dispersión "scattering" de la radiación y los efectos de la absorción (es decir el aumento en el área efectiva debido a la absorción de fotones, para longitudes de onda menores que la de corte, ![]() ).
).
Por consiguiente, en este trabajo suponemos que el radio óptico efectivo de los aglomerados, ![]() se puede escribir como
se puede escribir como
donde los factores de corrección ![]() y
y ![]() tienen en cuenta los efectos de la dependencia con la longitud de onda.
tienen en cuenta los efectos de la dependencia con la longitud de onda.
Claramente, los factores ![]() y
y ![]() tienden a la unidad cuando la longitud de onda de radiación disminuye (límite de Óptica Geométrica) y, por lo tanto, el radio óptico efectivo
tienden a la unidad cuando la longitud de onda de radiación disminuye (límite de Óptica Geométrica) y, por lo tanto, el radio óptico efectivo ![]() se aproxima al radio equivalente de los aglomerados,
se aproxima al radio equivalente de los aglomerados, ![]() dado por la Ec. (1). De la Ec. (14),
dado por la Ec. (1). De la Ec. (14), ![]() puede escribirse como
puede escribirse como
Reemplazando las Ecs. (4) y (15) en Ec. (12), ![]() puede escribirse como
puede escribirse como
Reemplazando en la Ec. (14) la concentración característica de catalizador, ![]() , Ec. (7),
, Ec. (7),
Resulta conveniente definir
y
Por lo tanto,
Expandiendo la Ec. (20) en fracciones parciales, y considerando los dos primeros términos en ![]() , se tiene
, se tiene
Donde en la Ec. (21) se desprecian dos términos, de orden  y
y  respectivamente, siendo ésta una aproximación válida para el rango de valores de
respectivamente, siendo ésta una aproximación válida para el rango de valores de ![]() estudiado en este trabajo, si
estudiado en este trabajo, si ![]() . Por consiguiente, reemplazando la aproximación de segundo orden dada por la Ec. (21) en la Ec. (20) y, luego de cierto trabajo algebraico, se puede entonces aproximar adecuadamente la dependencia de la longitud de atenuación con la concentración, a una dada longitud de onda, como
. Por consiguiente, reemplazando la aproximación de segundo orden dada por la Ec. (21) en la Ec. (20) y, luego de cierto trabajo algebraico, se puede entonces aproximar adecuadamente la dependencia de la longitud de atenuación con la concentración, a una dada longitud de onda, como
donde
y
En la Ec. (22), ![]() es la longitud de atenuación asintótica (para
es la longitud de atenuación asintótica (para ![]() ) y
) y ![]() es el valor de concentración donde
es el valor de concentración donde ![]() es 50% de
es 50% de ![]() .
.
A diferentes longitudes de onda se midió la longitud de atenuación como función de la concentración de catalizador, y se ajustaron ![]() y
y ![]() a los valores experimentales. A cada longitud de onda, el acuerdo es bueno, como se muestra en el gráfico de la Fig. 5.
a los valores experimentales. A cada longitud de onda, el acuerdo es bueno, como se muestra en el gráfico de la Fig. 5.
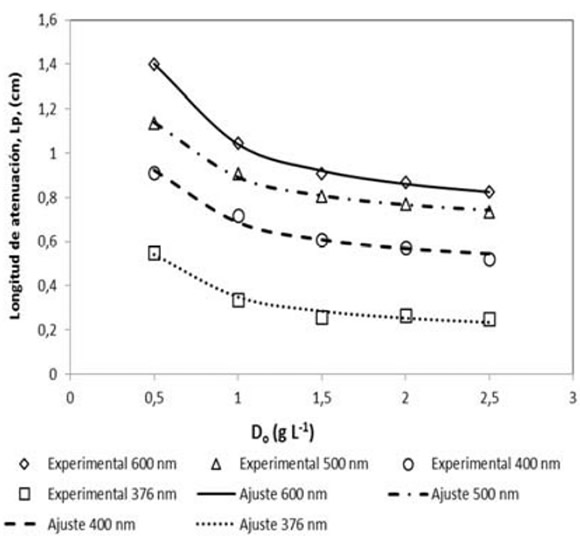
FIG. 5: Longitud de atenuación vs. concentración de catalizador a diferentes longitudes de onda. Símbolos: valores experimentales a 600 nm (![]() ), 500 nm (
), 500 nm (![]() ), 400 nm (
), 400 nm (![]() ) y 376 nm (
) y 376 nm (![]() ).
).
Líneas: ajuste a Ec. (22).
A 376 nm el efecto de la absorción de fotones es bastante notable. Debe tenerse en cuenta que, a longitudes de onda de 400 nm y más largas la atenuación es debida solamente al "scattering". Los valores ajustados y calculados para la Ec. (22) se muestran en la Tabla 2. Como puede verse en la tabla, ![]() para todas las longitudes de onda, y por lo tanto, de la Ec. (23), se deduce que
para todas las longitudes de onda, y por lo tanto, de la Ec. (23), se deduce que ![]() en todos los casos.
en todos los casos.
TABLA 2: Parámetros de ajuste para la Ec. (22 ) a varias longitudes de onda.

Para energías mayores que el "band gap" del TiO2 (3.2 eV), es decir, ![]() nm, se supone que la absorción es comparable o más alta que el "scattering" dado que es un "slurry" de alta densidad. Los valores de
nm, se supone que la absorción es comparable o más alta que el "scattering" dado que es un "slurry" de alta densidad. Los valores de ![]() en la Tabla 2 muestran claramente la diferencia para longitudes de onda por encima y por debajo de 388 nm. En el último caso, la absorción predomina sobre el "scattering". A medida que se reduce la longitud de onda, los valores de
en la Tabla 2 muestran claramente la diferencia para longitudes de onda por encima y por debajo de 388 nm. En el último caso, la absorción predomina sobre el "scattering". A medida que se reduce la longitud de onda, los valores de ![]() y
y ![]() tienden a sus valores de Óptica Geométrica (dado que
tienden a sus valores de Óptica Geométrica (dado que ![]() y
y ![]() ambos tienden a la unidad).
ambos tienden a la unidad).
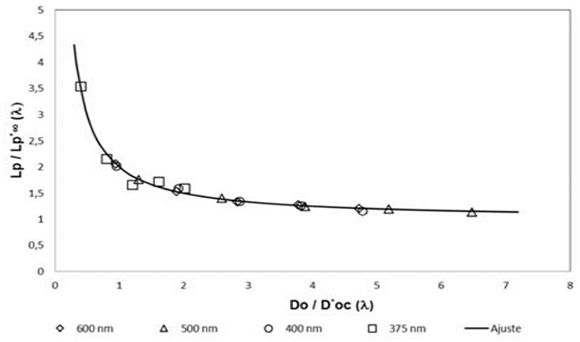
FIG. 6: Resultados experimentales ajustados a la Ec. (22) con los parámetros de la Tabla 2. Símbolos: valores experimentales a 600 nm (![]() ), 500 nm (
), 500 nm (![]() ), 400 nm (
), 400 nm (![]() ) y 376 nm (
) y 376 nm (![]() ).
).
Línea: ajuste a Ec. (22).
Los resultados experimentales para todas las longitudes de onda se grafican en forma conjunta en la Fig. 6, usando en la Ec. (22) los valores de ajuste de la Tabla 2 para cada longitud de onda. Por otra parte, para chequear el modelo en las experiencias de fotocatálisis, en este trabajo la irradiación se efectuó a una longitud de onda mucho más corta, de 254 nm.
Para el reactor cilíndrico usado en este trabajo, la irradiación del fotocatalizador, ![]() , decrece exponencialmente con una longitud característica
, decrece exponencialmente con una longitud característica ![]() , esto es,
, esto es, ![]() . La distancia radial
. La distancia radial ![]() es la profundidad de irradiación medido a partir del radio externo del tubo de cuarzo que rodea la lámpara UV. Por lo tanto, la irradiación del catalizador es prácticamente despreciable para
es la profundidad de irradiación medido a partir del radio externo del tubo de cuarzo que rodea la lámpara UV. Por lo tanto, la irradiación del catalizador es prácticamente despreciable para ![]() mayores que alrededor de
mayores que alrededor de ![]() . En síntesis, el reactor se puede dividir en dos zonas: en la primera región alrededor del tubo de cuarzo que encierra la lámpara UV ocurre la fotocatálisis. Rodeando esta región, el resto del volumen del reactor, puede ser considerado como una zona de mezclado.
. En síntesis, el reactor se puede dividir en dos zonas: en la primera región alrededor del tubo de cuarzo que encierra la lámpara UV ocurre la fotocatálisis. Rodeando esta región, el resto del volumen del reactor, puede ser considerado como una zona de mezclado.
Una vez elegida la longitud de onda de trabajo, (![]() nm), se pueden entonces determinar los parámetros
nm), se pueden entonces determinar los parámetros ![]() y
y ![]() a partir de las mediciones de absorbancia difusa en el rango deseado de concentraciones de catalizador. Tal como se describió en la Sec. Métodos, en este trabajo esto fue realizado con un espectrofotómetro con una esfera integradora. A partir de los valores ajustados de
a partir de las mediciones de absorbancia difusa en el rango deseado de concentraciones de catalizador. Tal como se describió en la Sec. Métodos, en este trabajo esto fue realizado con un espectrofotómetro con una esfera integradora. A partir de los valores ajustados de ![]() y
y ![]() se obtiene la longitud de atenuación como función de la concentración de catalizador,
se obtiene la longitud de atenuación como función de la concentración de catalizador, ![]() , a partir de la Ec. (22).
, a partir de la Ec. (22).
En suma, la longitud de atenuación conjuntamente con las dimensiones del reactor permiten describir adecuadamente la irradiación del catalizador para los propósitos de modelado y optimización.
Degradación fotocatalítica de Orange II
Las experiencias de degradación de Orange II se realizaron en un reactor "batch" usando el método espectrofotométrico previamente descripto. Se debe resaltar que en un experimento de fotólisis directa se verificó que, en ausencia de TiO2, la degradación de Orange II bajo irradiación UV es despreciable, aún después de 110 min de irradiación. En un experimento típico de fotocatálisis, el "slurry" fue mantenido en oscuridad durante 60 min antes de la irradiación a fin de alcanzar el equilibrio inicial de adsorción. El pH durante el experimento se ajustó a 7 con hidróxido de sodio 0.1 M (grado reactivo analítico). A partir de los datos experimentales se calculó el porcentaje de conversión ![]() según
según
donde ![]() es la concentración inicial de Orange II medida después de 60 min en oscuridad (previo a la irradiación UV) y
es la concentración inicial de Orange II medida después de 60 min en oscuridad (previo a la irradiación UV) y ![]() la concentración de Orange II medida a un tiempo de irradiación de 360 min.
la concentración de Orange II medida a un tiempo de irradiación de 360 min.
De acuerdo con el modelo de Langmuir-Hinshelwood,2,5,25,26 se consideraron tres etapas:
En las Ecs. (29) a (31), se definen las siguientes concentraciones molares (todas referidas al volumen del reactor, V):
![]() : Concentración de sitios de adsorción disponibles (proporcional a
: Concentración de sitios de adsorción disponibles (proporcional a ![]() ).
).
![]() : Concentración de sitios de adsorción vacíos.
: Concentración de sitios de adsorción vacíos.
![]() : Concentración de contaminante.
: Concentración de contaminante.
![]() : Concentración de sitios ocupados.
: Concentración de sitios ocupados.
![]() : densidad volumétrica de fotones (moles /m3).
: densidad volumétrica de fotones (moles /m3).
Las ecuaciones cinéticas para la variación de la concentración de ![]() y de la concentración de sitios ocupados
y de la concentración de sitios ocupados ![]() son
son
El balance para la concentración de sitios de adsorción disponibles es
Antes de comenzar la irradiación (![]() ), luego de un tiempo inferior a una hora, se alcanza el equilibrio de adsorción entre las concentraciones de sitios de adsorción disponibles, las de sitios ocupados y las de contaminante. En esas condiciones, a partir de la Ec. (29) se define la constante de equilibrio de adsorción, que relaciona las concentraciones de contaminante, sitios libres y sitios ocupados
), luego de un tiempo inferior a una hora, se alcanza el equilibrio de adsorción entre las concentraciones de sitios de adsorción disponibles, las de sitios ocupados y las de contaminante. En esas condiciones, a partir de la Ec. (29) se define la constante de equilibrio de adsorción, que relaciona las concentraciones de contaminante, sitios libres y sitios ocupados
Al comenzar la irradiación (![]() ), se considerará válida la aproximación de estado estacionario27 para la concentración de sitios ocupados, Ec. (33), es decir que
), se considerará válida la aproximación de estado estacionario27 para la concentración de sitios ocupados, Ec. (33), es decir que ![]() permanece constante:
permanece constante:
En otras palabras, la velocidad con que se ocupan los sitios de adsorción en el catalizador, Ec. (26), iguala a la de desocupación (debida tanto a la desorción, Ec. (27) como a la reacción de fotocatálisis, Ec. (28)). Esta aproximación es válida en tanto la densidad volumétrica de fotones sea tal que
Entonces, aplicando la Ec. (33) en la Ec. (30), la concentración de sitios ocupados es
Reemplazando esta última ecuación en la Ec. (29), e introduciendo la constante de equilibrio de adsorción, Ec.(32), se tiene
De la condición de balance de sitios, Ec. (31), y teniendo en cuenta la aproximación de estado estacionario, Ec. (33), se sigue que ![]() es prácticamente constante.
es prácticamente constante.
Por lo tanto, a partir de la Ec. (36) se puede afirmar que la cinética de reacción es de pseudo primer orden con respecto a la concentración de contaminante. Por consiguiente, la ecuación cinética propuesta es
donde ![]() es la concentración de colorante (mg L-1) y
es la concentración de colorante (mg L-1) y ![]() es la constante cinética aparente (min-1), cuyo valor es proporcional a la densidad volumétrica de fotones
es la constante cinética aparente (min-1), cuyo valor es proporcional a la densidad volumétrica de fotones
Los valores medidos de ![]() como función del tiempo se graficaron en la Fig. 7 para concentraciones de TiO2 de 0.5, 1, 1.5, 2 y 2.5 g L-1, junto con los ajustes a la Ec. (37), usando los valores de parámetros de la Tabla 3.
como función del tiempo se graficaron en la Fig. 7 para concentraciones de TiO2 de 0.5, 1, 1.5, 2 y 2.5 g L-1, junto con los ajustes a la Ec. (37), usando los valores de parámetros de la Tabla 3.
Para concentración inicial de catalizador hasta 2 g L-1 los valores ajustados de la concentración inicial de equilibrio de adsorción en oscuridad ![]() difieren menos que
difieren menos que ![]() mg L-1 del valor promedio de 17.7 mg L-1, y hay un muy buen acuerdo con el ajuste (R2 > 0.99).
mg L-1 del valor promedio de 17.7 mg L-1, y hay un muy buen acuerdo con el ajuste (R2 > 0.99).

FIG. 7: Dependencia temporal de la concentración de Orange II para diferentes concentraciones de TiO2. Símbolos: Valores experimentales ![]()
Líneas: ajustes exponenciales.
Sin embargo, para 2.5 g L-1 (la concentración de catalizador más alta estudiada) el valor de R2 es menor (0.986) y los valores ajustados de ![]() y
y ![]() difieren ligeramente (alrededor de 6.5% y 17.4% respectivamente). Estos resultados para
difieren ligeramente (alrededor de 6.5% y 17.4% respectivamente). Estos resultados para ![]() 2.5 g/L se pueden explicar considerando que el mezclado en el reactor no es tan bueno como a concentraciones más bajas.
2.5 g/L se pueden explicar considerando que el mezclado en el reactor no es tan bueno como a concentraciones más bajas.
El porcentaje de conversión, ![]() y los valores ajustados de
y los valores ajustados de ![]() y
y ![]() en la Ec. (26) se presentan en la Tabla 3, en función de la concentración de catalizador.
en la Ec. (26) se presentan en la Tabla 3, en función de la concentración de catalizador.
Es interesante notar que a partir de los valores ajustados de la Tabla 3 se sigue que a concentraciones de catalizador de 1 g L-1 y mayores, la constante cinética aparente, ![]() , puede ser considerada constante, con un valor de (8.1
, puede ser considerada constante, con un valor de (8.1 ![]() 0.5)
0.5)![]() min-1, como se muestra en la Fig. 8. Esto puede ser explicado de la siguiente manera. En una primera aproximación, se puede suponer que
min-1, como se muestra en la Fig. 8. Esto puede ser explicado de la siguiente manera. En una primera aproximación, se puede suponer que ![]() es proporcional a la superficie total expuesta del catalizador,
es proporcional a la superficie total expuesta del catalizador, ![]() , que crece con
, que crece con ![]() , y al volumen de la zona irradiada del reactor. El último es a su vez proporcional a la longitud de atenuación
, y al volumen de la zona irradiada del reactor. El último es a su vez proporcional a la longitud de atenuación ![]() . Por consiguiente,
. Por consiguiente, ![]() decrece al disminuir
decrece al disminuir ![]() . Por lo tanto, la independencia de la constante cinética aparente,
. Por lo tanto, la independencia de la constante cinética aparente, ![]() , con la concentración inicial de catalizador,
, con la concentración inicial de catalizador, ![]() , puede ser atribuida a la combinación de dos efectos: (i) la longitud de atenuación
, puede ser atribuida a la combinación de dos efectos: (i) la longitud de atenuación ![]() disminuye cuando la concentración de TiO2,
disminuye cuando la concentración de TiO2, ![]() , se incrementa, Ec. (22) y, (ii) la superficie total expuesta,
, se incrementa, Ec. (22) y, (ii) la superficie total expuesta, ![]() , aumenta cuando sube la concentración
, aumenta cuando sube la concentración ![]() (Ec. (8)).
(Ec. (8)).

FIG. 8: Constante cinética aparente (![]() ) como función de la concentración inicial de TiO2.
) como función de la concentración inicial de TiO2.
TABLA 3: Valores medidos de ![]() , valores ajustados de
, valores ajustados de ![]() ,
, ![]() y R2 como función de
y R2 como función de ![]() .
.

En el límite de longitudes de onda cortas, las dependencias con ![]() de
de ![]() y
y ![]() , y por consiguiente las de
, y por consiguiente las de ![]() y
y ![]() , son entonces inversas entre sí. Por lo tanto de la Ec. (38) se sigue que
, son entonces inversas entre sí. Por lo tanto de la Ec. (38) se sigue que ![]() , tiende a una constante.
, tiende a una constante.
V. CONCLUSIONES
En este artículo se ha estudiado la actividad fotocatalítica de barros ("slurries") de nanopartículas de dióxido de titanio (Evonik P25) en alta concentración (0.5 hasta 2.5 g L-1) a pH 7. En estas condiciones, las nanopartículas forman aglomerados con tamaños de varias decenas de micrómetros. Se determinó el radio promedio equivalente de los aglomerados, ![]() , por microscopía óptica. En el rango de concentraciones estudiado, se encontró una dependencia lineal de
, por microscopía óptica. En el rango de concentraciones estudiado, se encontró una dependencia lineal de ![]() con la concentración de catalizador,
con la concentración de catalizador, ![]() . Los valores de
. Los valores de ![]() , aumentan desde 32 μm (
, aumentan desde 32 μm (![]() 0.5 g L-1), hasta 46 μm (
0.5 g L-1), hasta 46 μm (![]() 2.5 g L-1). Considerando que los aglomerados son aproximadamente esféricos, un modelo simple predice que, a bajas concentraciones de catalizador, el área expuesta total del catalizador,
2.5 g L-1). Considerando que los aglomerados son aproximadamente esféricos, un modelo simple predice que, a bajas concentraciones de catalizador, el área expuesta total del catalizador, ![]() , es proporcional a
, es proporcional a ![]() , y tiende a un valor asintótico a medida que se incrementa
, y tiende a un valor asintótico a medida que se incrementa ![]() . El entrecruzamiento está dado por la concentración característica,
. El entrecruzamiento está dado por la concentración característica, ![]() , que es calculada a partir de los parámetros de ajuste de la dependencia lineal de
, que es calculada a partir de los parámetros de ajuste de la dependencia lineal de ![]() con
con ![]() . A partir de los resultados experimentales, la concentración característica,
. A partir de los resultados experimentales, la concentración característica, ![]() , es (3.7
, es (3.7 ![]() 0.6) g/L. Se realizaron mediciones espectrofotométricas de absorbancia usando una esfera integradora a diferentes concentraciones de catalizador, para obtener la longitud de atenuación óptica en el "slurry", como función de la concentración de catalizador y la longitud de onda.
0.6) g/L. Se realizaron mediciones espectrofotométricas de absorbancia usando una esfera integradora a diferentes concentraciones de catalizador, para obtener la longitud de atenuación óptica en el "slurry", como función de la concentración de catalizador y la longitud de onda.
Se propone un modelo simple basado en la Óptica Geométrica para calcular la longitud de atenuación de la radiación, ![]() , como función de
, como función de ![]() y la longitud de onda,
y la longitud de onda, ![]() . Esto es razonable dado que, para el rango de valores de
. Esto es razonable dado que, para el rango de valores de ![]() estudiado en este trabajo, el tamaño de los aglomerados es de varias decenas de micrómetros. A bajas concentraciones de catalizador, es inversamente proporcional a
estudiado en este trabajo, el tamaño de los aglomerados es de varias decenas de micrómetros. A bajas concentraciones de catalizador, es inversamente proporcional a ![]() , y al aumentar la concentración de catalizador por encima de la concentración característica
, y al aumentar la concentración de catalizador por encima de la concentración característica ![]() ,
, ![]() tiende a un valor límite asintótico,
tiende a un valor límite asintótico, ![]() . A partir de los resultados experimentales, se determinaron
. A partir de los resultados experimentales, se determinaron ![]() y
y ![]() a longitudes de onda desde 600 nm hasta 376 nm. A longitudes de onda más largas, con energías de fotón más pequeñas que el "bandgap" del TiO2 (3.2 eV), no hay absorción y
a longitudes de onda desde 600 nm hasta 376 nm. A longitudes de onda más largas, con energías de fotón más pequeñas que el "bandgap" del TiO2 (3.2 eV), no hay absorción y ![]() crece gradualmente desde
crece gradualmente desde ![]() m para
m para ![]() = 400 nm hasta
= 400 nm hasta ![]() m a
m a ![]() = 600 nm. A energías de fotón por encima de 3.2 eV el efecto de la absorción de es bastante notable y la longitud de atenuación decrece hasta
= 600 nm. A energías de fotón por encima de 3.2 eV el efecto de la absorción de es bastante notable y la longitud de atenuación decrece hasta ![]() m a 376 nm. A partir de estos resultados, para propósitos de modelado es posible dividir el reactor estudiado en este trabajo en dos zonas. En la primera región, rodeando la lámpara y con un espesor de alrededor de tres veces la longitud de atenuación, ocurre la fotocatálisis, y fuera de esta región, el resto del volumen del reactor puede considerarse como zona de mezclado.
m a 376 nm. A partir de estos resultados, para propósitos de modelado es posible dividir el reactor estudiado en este trabajo en dos zonas. En la primera región, rodeando la lámpara y con un espesor de alrededor de tres veces la longitud de atenuación, ocurre la fotocatálisis, y fuera de esta región, el resto del volumen del reactor puede considerarse como zona de mezclado.
Para validar el modelo en el límite de longitudes de onda cortas, se estudió la degradación fotocatalítica de Orange II bajo irradiación UV a 254 nm. Esta longitud de onda asegura que la Óptica Geométrica es una muy buena aproximación, dado que ![]() a todas las concentraciones en este trabajo. Se obtuvieron conversiones de 81%, 89%, 92%, 92% y 73%, para concentraciones de TiO2 de 0.5, 1, 1.5, 2 y 2.5 g L-1, fue 360 min. La cinética observada es de primer orden con respecto a la concentración de Orange II, y la constante cinética aparente,
a todas las concentraciones en este trabajo. Se obtuvieron conversiones de 81%, 89%, 92%, 92% y 73%, para concentraciones de TiO2 de 0.5, 1, 1.5, 2 y 2.5 g L-1, fue 360 min. La cinética observada es de primer orden con respecto a la concentración de Orange II, y la constante cinética aparente, ![]() ajusta muy bien a un valor constante de (8.1
ajusta muy bien a un valor constante de (8.1 ![]() 0.5)
0.5)![]() min-1 para valores de
min-1 para valores de ![]() de 1 g L-1 y mayores. Esto puede explicarse por la disminución de la longitud de atenuación
de 1 g L-1 y mayores. Esto puede explicarse por la disminución de la longitud de atenuación ![]() y el incremento simultáneo de la superficie total expuesta,
y el incremento simultáneo de la superficie total expuesta, ![]() , cuando se incrementa la concentración de catalizador,
, cuando se incrementa la concentración de catalizador, ![]() .
.
En resumen, una vez elegida la longitud de onda de irradiación, los resultados presentados en este trabajo permiten estimar los parámetros de diseño relevantes para reactores fotocatalíticos como función de la concentración de catalizador: el área de superficie total de catalizador y la longitud de atenuación para la radiación en el "slurry".
1. X. Domènech, W. F. Jardim y M. I. Litter. Procesos Avanzados de Oxidación para la eliminación de contaminantes. En: Blesa M.A. (ed), "Eliminación de Contaminantes por Fotocatálisis Heterogénea" (Texto de la red CYTED, La Plata, Buenos Aires, Argentina, 2001). [ Links ]
2. M. Pera-Titus, V. García-Molina, M. A. Baños, J. Jiménez y S. Esplugas. Degradation of chlorophenols by means of advanced oxidation processes: a general review. Appl. Catal. B. 47, 219-256 (2004). [ Links ]
3. T. Deblonde, C. Cossu Leguille y P. Hartemann. Emerging pollutants in wastewater: A review of the literature. Int. J. Hyg. Environ. Health 214, 442-448 (2011). [ Links ]
4. M. Klavarioti, D. Mantzavinos y D. Kassinos. Removal of residual pharmaceuticals from aqueous systems by advanced oxidation processes. Environ. Int. 35, 402-417 (2009). [ Links ]
5. M. R. Hoffmann, S. T. Martin, W. Choi y D. W. Bahnemann. Environmental Applications of Semiconductor Photocatalysis. Chem. Rev. 95, 69-96 (1995). [ Links ]
6. P. Pichat Ed. Photocatalysis and Water Purification. From Fundamentals to Recent Applications (Wiley-VCH Verlag GmbH & Co., Germany, 2013). [ Links ]
7. A. L. Linsebigler, G. Q. Lu y J. T. Yates. Photocatalysis on TiO2 Surfaces: Principles, Mechanisms, and Selected Results. Chem. Rev. 95, 735-758 (1995). [ Links ]
8. D. C. Hurum, A. G. Agrios, K. A. Gray, T. Rajh y M. C. Thurnauer. Explaining the Enhanced Photocatalytic Activity of Degussa P25 Mixed-Phase TiO2 Using EPR. J. Phys. Chem. B 107, 4545-4549 (2003). [ Links ]
9. M. Born y E. Wolf. Principles of Optics (Cambridge University Press. Chapter 13, 1999). [ Links ]
10. G. Li, L. Lv, H. Fan, J. Ma, Y. Li, Y. Y. Wan y X. S. Zao. Effect of the agglomeration of TiO2 nanoparticles on their hotocatalytic performance in the aqueous phase. J. Colloid Interface Sci. 348, 342-347 (2010). [ Links ]
11. R. A. French, A. R. Jacobson, B. Kim, S. L. Isley, R. L. Penn y P. C. Baveye. Influence of Ionic Strength, pH, and Cation Valence on Aggregation Kinetics of Titanium Dioxide Nanoparticles. Environ. Sci. Technol. 43, 1354-1359 (2009). [ Links ]
12. M. K. Ridley, V. A. Hackley y M. L. Machesky. Characterization and Surface-Reactivity of Nanocrystalline Anatase in Aqueous Solutions. Langmuir 22, 10972-10982 (2006). [ Links ]
13. J. Fernández, J. Kiwi, C. Lizama, J. Freer, J. Baeza y H. D. Mansilla. Factorial experimental design of Orange II photocatalytic discolouration. J. Photoch. Photobio. A. 151, 213-219 (2002). [ Links ]
14. J. Fernández, J. Kiwi, J. Baeza, J. Freer, C. Lizama y H. D. Mansilla. Orange II photocatalysis on immobilised TiO2, Effect of the pH and H2O2. Appl. Catal. B. 48, 205-211 (2004). [ Links ]
15. Y. Mu, H. Yu, J. C. Zheng y S. J. Zhang. TiO2-mediated photocatalytic degradation of Orange II with the presence of Mn2+ in solution. J. Photoch. Photobio. A 163, 311-316 (2004). [ Links ]
16. I. K. Konstantinou y T. A. Albanis. TiO2-assisted photocatalytic degradation of azo dyes in aqueous solution: kinetic and mechanistic investigations. A review. Appl. Catal. B 49, 1-14 (2004). [ Links ]
17. K. Rajeshwar, M. E. Osugi, W. Chanmanee, C. R. Chenthamarakshan, M. V. B. Zanoni, P. Kajitvichyanukul y R. Krishnan-Ayer. Heterogeneous photocatalytic treatment of organic dyes in air and aqueous media. J. Photochem. Photobiol. C 9, 171-192 (2008). [ Links ]
18. G. Djaneye-Boundjou, E. Amouzou, T. Kodom, I. Tchakala, K. Anodi y L. M. Bawa. Photocatalytic Degradation Of Orange II Using Mesoporous TiO2 (P25) And Fenton Reactive (Fe2+/H2O2). Management and Engineering Research 1, 91-96 (2012). [ Links ]
19. K. Golka, S. Kopps y Z.W. Myslak. Carcinogenicity of azo colorants: influence of solubility and bioavailability. Toxicol. Lett. 151, 203-210 (2004). [ Links ]
20. M. L. Satuf, M. J. Pierrestegui, L. Rossini, R. J. Brandi y O. M. Alfano. Kinetic modeling of azo dyes photocatalytic degradation in aqueous TiO2 suspensions. Toxicity and biodegradability evaluation. Catal. Today 161, 121-126 (2011). [ Links ]
21. P. Pichat y M. Lu. Photocatalysis and water purification: From fundamentals to recent applications (Wiley-VCH Weinheim, Alemania, 2013). [ Links ]
22. H. Lachheb, E. Puzenat, A. Houas, M. Ksibi, E. Elaloui, C. Guillard y J.-M. Herrmann. Photocatalytic degradation of various types of dyes (Alizarin S, Crocein Orange G, Methyl Red, Congo Red, Methylene Blue) in water by UV-irradiated titania. Appl. Catal. B 39, 75-90 (2002). [ Links ]
23. A. Braun, M. T. Maurette y E. Oliveros. Technologie photochimique (Presses Polytechniques romandes, Paris, France, 1986). [ Links ]
24. Technical Information of Evonik Degussa 1243. https://www.aerosil.com/sites/lists/RE/DocumentsSI/TI- 1243-Titanium- Dioxide- as- Photocatalyst-EN.pdf. Accedido 7 de febrero de 2020. [ Links ]
25. S. Malato, P. Fernández-Ibáñez, M. I. Maldonado, J. Blanco y W. Gernjak. Decontamination and disinfection of water by solar photocatalysis: Recent overview and trends. Catalysis today 147, 1-59 (2009). [ Links ]
26. V. Augugliaro, M. Bellardita, V. Loddo, G. Palmisano, L. Palmisano y S. Yurdakal. Overview on oxidation mechanisms of organic compounds by TiO2 in heterogeneous photocatalysis. J. of Photochem. And Photobiol. C Photochem. Rev. 13, 224-245 (2012). [ Links ]
27. I. N. Levine. Physical Chemistry, 5th Ed. (McGraw-Hill Companies, Inc. USA, 2002). [ Links ]