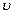I. INTRODUCCIÓN
El control dimensional y morfológico en la síntesis de nuevos materiales ha sido un reto importante para el desarrollo de diversas áreas científicas y tecnológicas, particularmente en el campo de la nanotecnología. Los estudios se han dirigido al desarrollo de nuevas rutas de síntesis que permitan el control de forma y tamaño durante el crecimiento de las nanoestructuras, implementando nuevas técnicas que puedan ofrecer mayor información de sus propiedades y características estructurales y morfológicas, así como creando nuevos sistemas basados en estos materiales que permitan mejorar o desarrollar nuevas capacidades tecnológicas.1-7 Algunos de los aspectos fundamentales que se deben tener en cuenta son; la cinética de reacciones electroquímicas, así como las propiedades electrocatalíticas.
El comportamiento de electrodos nanoestructurados de metales nobles depende prioritariamente de las características de la superficie expuesta, en particular de la magnitud de su área y su configuración cristalográfica. Por lo tanto, una adecuada caracterización superficial no puede ser desestimada.8,9
En las últimas décadas, los métodos electroquímicos han permitido desarrollar técnicas de caracterización superficial cada vez más adecuadas, en particular se destacan aquellas empleadas para electrodos constituidos de metales nobles.8,9 Es sabido que este tipo de electrodos metálicos muestran gran afinidad hacia la electroadsorción de hidrógeno y oxígeno, lo que ha permitido su caracterización mediante estos procesos.8,9 El presente trabajo tiene como objetivo mostrar los resultados obtenidos en la estimación del área real de los electrodos diseñados con nanoestructuras de Au sobre HOPG a diferentes tiempos de deposición utilizando la electroreducción de especies oxigenadas.
II. MÉTODOS
Para obtener los electrodos de Au/HOPG se utilizó como sustrato un electrodo de HOPG, que consistió en una hoja de SPI-3 ( mm), y como precursor 10 mM de HAuCl
mm), y como precursor 10 mM de HAuCl (Sigma Aldrich) disuelta en H
(Sigma Aldrich) disuelta en H O a un pH de 2.6. Se depositó Au utilizando como técnica la deposición autocatalítica (deposición espontánea) a circuito abierto,10 esto es, se sumerge el sustrato en las soluciones que contienen el precursor disuelto durante 1 s, 10 s, 90 s y 180 s. Una vez finalizada la deposición, el sustrato con los depósitos se lava varias veces con agua ultra pura para asegurar así que no haya quedado exceso de la solución precursora.
O a un pH de 2.6. Se depositó Au utilizando como técnica la deposición autocatalítica (deposición espontánea) a circuito abierto,10 esto es, se sumerge el sustrato en las soluciones que contienen el precursor disuelto durante 1 s, 10 s, 90 s y 180 s. Una vez finalizada la deposición, el sustrato con los depósitos se lava varias veces con agua ultra pura para asegurar así que no haya quedado exceso de la solución precursora.
El electrodo de Au policristalino ha sido empleado como electrodo de trabajo con el fin de comparar los procesos electroquímicos frente a los electrodos en estudio. Dicho electrodo fue preparado a partir de alambre de Au con una pureza del 99.99 suministrado por la compañía Mateck y un área geométrica de trabajo de 0.75 cm2. Se ha realizado un tratamiento a la llama para conseguir superficies limpias y reproducibles.11 La caracterización electroquímica se llevó a cabo por voltamperometría cíclica (VC). Las medidas fueron realizadas utilizando un Potenciostato - Galvanostato Metrohm- Autolab, modelo PGSTAT302/302N controlado por computadora y equipado con el módulo Staircase y SCAN-GEN que utiliza el software Nova 2.1.4 Build 6899 Copyriht 2018 de la misma compañía. Todos los experimentos fueron realizados a temperatura ambiente (25
suministrado por la compañía Mateck y un área geométrica de trabajo de 0.75 cm2. Se ha realizado un tratamiento a la llama para conseguir superficies limpias y reproducibles.11 La caracterización electroquímica se llevó a cabo por voltamperometría cíclica (VC). Las medidas fueron realizadas utilizando un Potenciostato - Galvanostato Metrohm- Autolab, modelo PGSTAT302/302N controlado por computadora y equipado con el módulo Staircase y SCAN-GEN que utiliza el software Nova 2.1.4 Build 6899 Copyriht 2018 de la misma compañía. Todos los experimentos fueron realizados a temperatura ambiente (25 1
1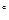 C).
C).
La celda utilizada, con capacidad de 50 ml, presenta cinco entradas y una salida. De las entradas de la celda, tres fueron asignadas a los electrodos de trabajo, referencia (electrodo de hidrógeno) y contra-electrodo (electrodo de Pt). Las dos entradas restantes son empleadas para el llenado de la celda con electrolito soporte, y entrada de flujo de N al sistema para mantener una atmosfera inerte durante los experimentos. Con el fin de lograr una superficie limpia y reproducible el electrodo de trabajo se lavó con agua ultrapura (18 M
al sistema para mantener una atmosfera inerte durante los experimentos. Con el fin de lograr una superficie limpia y reproducible el electrodo de trabajo se lavó con agua ultrapura (18 M cm) varias veces.
cm) varias veces.
En una segunda etapa los sistemas obtenidos se caracterizaron a través de la Microscopía Electrónica de barrido SEM FEG/CARL ZEIZZ-Sigma y además se realizó Microsonda de electrones/Microanálisis de Rayos X Dispersivos en Energía (EPMA/EDS), ya que con esta técnica es posible cuantificar los elementos presentes si su concentración es mayor que el 1 . Este análisis da un resultado semi-cuantitativo de los componentes presentes. Por último, también se caracterizó, HOPG y Au policristalino en las mismas condiciones de trabajo para luego utilizarlo como control o referencia y realizar una comparación de los resultados obtenidos.
. Este análisis da un resultado semi-cuantitativo de los componentes presentes. Por último, también se caracterizó, HOPG y Au policristalino en las mismas condiciones de trabajo para luego utilizarlo como control o referencia y realizar una comparación de los resultados obtenidos.
III. RESULTADOS
Deposición Espontánea de Au sobre HOPG
La deposición espontánea de partículas de Au sobre HOPG fue seguida a través de la dependencia del potencial de circuito abierto (E ) con respecto al tiempo, el que se puede observar en la Fig. 1, (E
) con respecto al tiempo, el que se puede observar en la Fig. 1, (E = 0.733 V). Todos los experimentos llevados a cabo indican que el potencial de circuito abierto siempre estaba comprendido entre 0.70
= 0.733 V). Todos los experimentos llevados a cabo indican que el potencial de circuito abierto siempre estaba comprendido entre 0.70  E
E /V
/V  0.80, siendo aproximadamente constante en el tiempo. Estos valores son menores que los calculados a través de la ecuación de Nerst para las diferentes cuplas AuCl
0.80, siendo aproximadamente constante en el tiempo. Estos valores son menores que los calculados a través de la ecuación de Nerst para las diferentes cuplas AuCl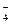 /AuCl
/AuCl , AuCl
, AuCl /Au y AuCl
/Au y AuCl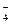 /Au (1.014 V, 1.154V, 1.041V vs ERH) en función de los potenciales estándar para la semi-reacción,12 teniendo en cuenta las concentraciones del complejo utilizando como precursor (10 mM) y el electrolito soporte ( H
/Au (1.014 V, 1.154V, 1.041V vs ERH) en función de los potenciales estándar para la semi-reacción,12 teniendo en cuenta las concentraciones del complejo utilizando como precursor (10 mM) y el electrolito soporte ( H O).
O).
Sin embargo, tenemos que tener en cuenta que los valores termodinámicos de potencial dados para la segunda etapa, implica la formación de Au metálico masivo y no se considera la interacción con otro substrato diferente al Au. En nuestro caso, la deposición ocurre sobre la superficie de HOPG. De acuerdo a los cálculos teóricos realizados en colaboración con la Universidad de Ulm13 el proceso espontáneo de deposición es mucho más complejo. Es probable, tal como también lo proponen diversos grupos de investigación en el tema,3,14 que la deposición ocurra sobre defectos ya que los electrones libres de los grupos funcionales oxigenados (aldehídos y/o cetonas) en la superficie grafítica son los que permiten la reducción del Au.
Sin embargo, en la interacción Ec. (1) Ec. (2)con el substrato aparecen diversos procesos de relajación del sistema como la distorsión del escalón y del alambre formado, la remoción de los grupos funcionales, por mencionar algunos. Todos estos procesos implican un costo energético lo que explica el alto sobrepotencial observado.
Por lo que se podría decir que el proceso de reducción del AuCl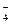 a Au (0) ocurre en la superficie del HOPG, no en la solución. Conjeturando que la reducción de Au no es completa, si no que ocurre en dos etapas:
a Au (0) ocurre en la superficie del HOPG, no en la solución. Conjeturando que la reducción de Au no es completa, si no que ocurre en dos etapas:
Caracterización electroquímica de depósitos de Au/HOPG
Se caracterizaron electroquímicamente los electrodos obtenidos a través de voltamperometría cíclica con un sistema de tres electrodos: electrodo de trabajo de área expuesta 0.20 cm , contra-electrodo (electrodo de Pt) y referencia (ERH). Las mediciones fueron realizadas en un intervalo de potencial entre
, contra-electrodo (electrodo de Pt) y referencia (ERH). Las mediciones fueron realizadas en un intervalo de potencial entre  vs ERH siempre a una velocidad de barrido de 0.100 V/s y temperatura de C. Las mediciones de VC se iniciaron a partir de 0.20 V vs ERH en dirección de barrido hacia potenciales (E) negativos. Luego de 5 ciclos el sistema se estabiliza y no se observan diferencias con ciclos sucesivos. Los ensayos se realizaron en atmósfera controlada burbujeando N
vs ERH siempre a una velocidad de barrido de 0.100 V/s y temperatura de C. Las mediciones de VC se iniciaron a partir de 0.20 V vs ERH en dirección de barrido hacia potenciales (E) negativos. Luego de 5 ciclos el sistema se estabiliza y no se observan diferencias con ciclos sucesivos. Los ensayos se realizaron en atmósfera controlada burbujeando N con el fin de eliminar el O
con el fin de eliminar el O atmosférico solubilizado. En la Fig. 2 se muestran los voltamogramas correspondientes Au/HOPG (tiempos de depósito: 1 s, 10 s, 90 s, 180 s) y HOPG teniendo en cuenta solamente la región donde ocurren los procesos de adsorción y desorción de las especies oxigenadas, trabajando en las mismas condiciones que para el Au (policristalino).
atmosférico solubilizado. En la Fig. 2 se muestran los voltamogramas correspondientes Au/HOPG (tiempos de depósito: 1 s, 10 s, 90 s, 180 s) y HOPG teniendo en cuenta solamente la región donde ocurren los procesos de adsorción y desorción de las especies oxigenadas, trabajando en las mismas condiciones que para el Au (policristalino).
La respuesta I vs V (corriente vs potencial) correspondiente al electrodo de HOPG como substrato es la típica de un proceso interfacial pseudo capacitivo,15 siendo las corrientes observadas mucho menores que las correspondientes a electrodos Au/HOPG.
En el voltamograma correspondiente al Au/HOPG a un tiempo de deposición de 1s (Fig. 2), se puede ver cómo los procesos de adsorción de las especies oxigenadas inician a un potencial cercano 0.75 V. Observando en la zona de corriente anódica un hombro a potenciales 0.91 V, pasando por un mínimo a 1.12 V, y luego vuelve a incrementarse. En el caso de los demás electrodos el proceso de adsorción de oxígeno en las nanopartículas de Au se inicia a potenciales más positivos, esto podría deberse a la morfología que presentan las nanopartículas en esos tiempos. A diferencia del voltamograma obtenido para el Au (policristalino) (Fig. 3), en la región de adsorción de especies oxigenadas, la corriente es constante y próxima a cero antes de iniciar la subida de corriente catódica a 0.75 V hasta lograr su máximo a 0.7 V. Esto no ocurre en los depósitos de Au/HOPG (Fig. 2), cuya proceso de adsorción se inicia antes de los 0.75 V apreciándose un solo pico, por lo que se podría suponer que solo una especie oxigenada de oro se genera. Desde los trabajos de Hieking16 se ha mostrado que la carga involucrada en la adsorción de oxígeno, y antes de que ocurra el desprendimiento del mismo, la relación más coherente es Au/O de 2/3 dada la estabilidad de la especie en la región de potencial de formación de monocapa.
Resultados similares fueron obtenidos por Gotti et al.17 cuando electrodepositaron Au sobre carbón vítreo. Lo mismo observó Laffont et al.18 al modificar carbón vítreo con nanopartículas de Au utilizando voltamperometría de extracción anódica de onda cuadrada incluyendo un paso de desorción de cloruro para la detección de trazas de mercurio (II). En cambio, no ocurrió lo mismo cuando Herrero-Calvillo et al.19 obtuvieron nanopartículas de oro sobre carbón vítreo utilizando la química verde, esto es extracto de hoja de Loeselia mexicana.
En la zona de corriente catódica se observa, en todos los voltamogramas para los distintos tiempos de deposición, una modificación del perfil electroquímico, al presentar un pico en la región de desorción de especies oxigenadas. Iniciando a 0.78V y desde ahí aumenta hasta lograr un máximo de reducción a potenciales cercanos a 0.70 V (Fig. 2), el cual es coincidente con los resultados obtenidos para el electrodo policristalino de Au (Fig. 3).
La corriente correspondiente a este pico se incrementa con el tiempo de depósito siendo máxima para un tiempo de deposición de 180 s. Estos resultados corroboran la existencia de depósitos de Au sobre HOPG. Mientras que, si se analizan los voltamogramas de HOPG limpio y exfoliado, y se compara con los obtenidos para las diferentes deposiciones, se observa que en esa región no ocurren estos procesos de electroreducción como se puede observar en la Fig. 4.
Diferentes autores17-20 obtuvieron resultados similares a los nuestros cuando estudiaron la estabilidad de nanopartículas de oro sobre soportes carbonosos. La forma característica de los voltamogramas de oro se vuelve más definido a un tiempo de deposición de 180 s, esto podría estar relacionado con la reconstrucción de las nanopartículas a geometrías más estables.

TABLA 1: Valores de cargas experimentales, áreas reales y áreas relativas de las nanoestructuras de Au/HOPG a diferentes tiempos.
Debido a que el pico de reducción de oxígeno de los depósitos se encuentra en el mismo intervalo de potencial que el electrodo de Au (policristalino), se podría suponer que el óxido formado en los depósitos es de Au O
O . Y si además consideramos que las nanoestructuras de Au generadas presentan un comportamiento similar al Au policristalino, donde varias orientaciones cristalinas están expuestas al electrolito, se puede estimar el área de igual forma que se determinó para Au (policristalino).16,21,22
. Y si además consideramos que las nanoestructuras de Au generadas presentan un comportamiento similar al Au policristalino, donde varias orientaciones cristalinas están expuestas al electrolito, se puede estimar el área de igual forma que se determinó para Au (policristalino).16,21,22
Para poder estimar el área real de las nanoestructuras de Au se tiene en cuenta la zona de reducción de óxidos. La carga se calculó con la integración numérica de las curvas de reducción de óxido usando una línea de base constante entre los dos potenciales en los que se observa el proceso de desorción.
De los compuestos oxigenados de Au el más estable es Au O
O . Así el área real de electrodos constituidos por nanoestructuras de Au sobre HOPG se puede determinar en Ec. (3)base a la estequiometría AuO de 2/3 y utilizando la siguiente ecuación:22
. Así el área real de electrodos constituidos por nanoestructuras de Au sobre HOPG se puede determinar en Ec. (3)base a la estequiometría AuO de 2/3 y utilizando la siguiente ecuación:22
donde 𝑞 𝑑𝑒𝑠 𝐴𝑢:𝑂 𝜇C es la carga experimental integrada del perfil potenciodinámico catódico entre los intervalos de potencial apropiados y 400 𝜇Ccm-2 es el estándar convencional de carga para electrodo de Au22-26 y considerando un proceso que intercambia tres electrones por átomo superficial de Au.
Los valores obtenidos de las cargas experimentales ( 𝑞 𝐴 𝑢 𝐻 𝑂𝑃𝐺 ), el valor del área real ( 𝐴 𝑟 ) y área relativa ( 𝐴 𝑟𝑒 𝑀 𝐻 𝑂𝑃𝐺 ) se informan en la Tabla . El 𝐴 𝑟𝑒 𝑀 𝐻 𝑂𝑃𝐺 se determinó teniendo en cuenta el área real en función el área geométrica del sustrato ya que este nos brinda una idea de la cantidad de nanopartículas de Au depositadas sobre el HOPG.
Sabiendo que el área expuesta (área geométrica) de los electrodos de trabajo es de 0.20 cm2, se observa que los valores de 𝐴 𝑟𝑁𝐴𝑢 estimados son mucho menores a las geométricos. Si se comparan las 𝐴 𝑟𝑁𝐴𝑢 obtenidas entre las nanopartículas, se observa que la que posee mayor área real es a un tiempo de deposición de 180 s, aproximadamente cinco veces mayor con respecto a las otras deposiciones. También se observa claramente que el crecimiento de las nanoestructuras de Au con el tiempo de deposición no es monótono. Mukouyama et al.27 fabricaron nanopartículas de oro (AuNP) sobre carbón vítreo (GC) como cátodo mediante una electrólisis galvanostática empleando un alambre Au como ánodo. Ellos obtuvieron áreas activas mayores a nuestro trabajo, pero observaron que estas aumentaban monótonamente a medida que aumentaba la corriente aplicada.
Es de destacarse que el área relativa 𝐴 𝑟𝑒 𝑁𝐴 𝑢 𝐻 𝑂𝑃𝐺 definida como el cociente entre el área real y el área geométrica del sustrato muestra valores menores a uno. Se debe tener en cuenta que este parámetro es diferente a lo que normalmente se calcula como rugosidad de un electrodo metálico. En nuestro caso nos aporta una idea de que la cantidad de Au expuesto al electrolito es muy pequeña, aun considerando la rugosidad de las nanoestructuras en sí mismas. Solamente una pequeña fracción del sustrato se cubre con el depósito metálico. El área real estimada y el área relativa no aumentan linealmente con el tiempo de deposición. La cantidad de Au depositado depende estrictamente del tipo de defectos del HOPG utilizado, y del modo en que se han nucleado y crecido las nanopartículas de Au sobre el HOPG.
Estudio por SEM de depósitos de Au sobre HOPG
A partir de las imágenes obtenidas a través de SEM después de la inmersión del substrato HOPG en la solución de ácido tetracloroáurico se observa que los átomos que llegan a la superficie se depositan preferentemente en posiciones de energía potencial mínima donde la energía de enlace con el substrato es más elevada, esto es, a lo largo de los bordes de los escalones y/o defectos del HOPG (Fig. 5a).

FIG. 5: Micrografías SEM mostrando la influencia del tiempo en la deposición de catalizadores de Au sobre HOPG. a) 1 s; b) 10 s; c) 90 s; d) 180 s.
Su distribución no es uniforme, donde el tamaño varía entre 9nm a 50 nm. A medida que aumenta el tiempo de deposición (10 s) las partículas de Au comienzan a agruparse provocando un crecimiento de los núcleos y dando lugar a la formación de racimos en forma de nanoalambres (NW) (Fig. 5b). La longitud de NW está comprendida entre 50nm y 600 nm aproximadamente. Cuando mayor es el tiempo de deposición (90 s) se observa que la formación de islas o aglomerados atómicos es más favorable obteniéndose así estructuras nanométricas del tipo “nanoflor”, depositándose estas sobre los defectos del substrato (Fig. 5c) con un tamaño aproximado que oscilan entre 150 nm y 300 nm. En la deposición de 180 s se observa que las nanoflores generadas (300 nm) comienzan a aglomerarse (Fig. 5d), obteniéndose nanoalambres mucho más compactos en comparación a los obtenidos a 10 s (Fig. 5b) y de mayor longitud que oscilan entre 1.5  m y 2
m y 2  m.
m.
De acuerdo a las Ecs. (1) y (2) analizadas anteriormente, se podría presumir que la presencia de H O e iones Cl
O e iones Cl en la superficie de las nanopartículas puede aumentar la movilidad de esta en la superficie28,29 generando estructuras dendríticas (nanoflor) como la que obtuvimos en este trabajo (Fig. 5b).
en la superficie de las nanopartículas puede aumentar la movilidad de esta en la superficie28,29 generando estructuras dendríticas (nanoflor) como la que obtuvimos en este trabajo (Fig. 5b).
A través del EPMA/EDS se han obtenido espectros de los depósitos de Au a diferentes tiempos de inmersión: 90s (Fig. 6) y 180 s (Fig. 7). Se seleccionó en cada micrografía una región donde se encuentran nanoestructuras de Au y poder así obtener el espectro deseado. En ellos se visualiza además del C (perteneciente a los grafenos del HOPG) y Au (nanoestructuras generadas), la presencia de O (oxígeno). Éste es un indicativo de especies oxigenadas presentes en la superficie del substrato, pudiendo ser grupos carbonilos o cetonas como lo indica Zoval et al.10 El proceso de formación y/o nucleación se inicia en los defectos como también así en los bordes de escalón, favoreciendo el desarrollo de las nanoestructuras. Esto es posible ya que, durante el crecimiento de las nanopartículas de Au, la funcionalización de los defectos se lleva a cabo de forma simultánea. Por lo tanto, carbonilos, éteres o grupos hidroxilos se pueden formar, suministrando los centros reductores necesarios para la deposición del metal.

FIG. 6: Microscopia SEM para depósitos de Au /HOPG y espectros obtenidos a través de EPMA/EDS para un tiempo de deposición de 90 s.

FIG. 7: Microscopia SEM para depósitos de Au /HOPG y espectros obtenidos a través de EPMA/EDS para un tiempo de deposición de 180 s.
McDermott et al.30 obtuvieron nanoalambres de Pt sobre bordes de escalón utilizando deposición física de vapor (PVD) al igual que Cross31 que con la misma técnica obtuvo nanoalambres de Au. En este trabajo se demuestra que se puede obtener NW de Au partiendo de un precursor como es el complejo ácido cloroáurico y utilizando deposición espontánea. Cuando aumenta el tiempo de deposición, es decir a 90 s, mayor cantidad de Au se encuentra en la superficie provocando el inicio del crecimiento de islas sobre las terrazas o en defectos (Fig. 5c). A un tiempo de 180 s las nanoflores se unen generando así nanoalambres de mayor tamaño (Fig. 5d). Nuestro grupo32 ha realizado deposición autocatalítica de Au sobre tela de carbono funcionalizado por sonicado, en una mezcla de ácido HNO /H
/H SO
SO , las nanoflores y los conglomerados.
, las nanoflores y los conglomerados.
IV. CONCLUSIONES
De acuerdo a los resultados obtenidos mediante la síntesis de nanopartículas de Au sobre HOPG a partir de deposición autocatalítica (a circuito abierto) en diferentes tiempos, se considera que este es un método alternativo adecuado para la formación de nanoestructuras y que la utilización de técnicas electroquímicas convencionales y técnicas microscópicas como el SEM ofrecen una visión extremadamente rica en los procesos de deposición/HOPG, para poder así comprender los procesos de adsorción/desorción que tienen lugar sobre la superficie de los electrodos diseñados en este trabajo. Se puede concluir que el HOPG utilizado como substrato presenta radicales oxigenados. Esto fue confirmado por los espectros obtenidos a través de EPMA/EDS que mostró la presencia de oxígeno, lo que indica que funcionalidades tales como carboxilos, éteres, aldehídos o hidroxilos pueden estar presentes en los defectos favoreciendo así la nucleación y crecimiento del Au. El HOPG utilizado como substrato, influye con su topografía, ya que los bordes, escalones y/o defectos se van modificando cada vez que se activan, favoreciendo la formación de las nanoestructuras obtenidas y esto se observó en las micrografías SEM. Las nanopartículas obtenidas por deposición autocatalítica tienen un mecanismo de crecimiento 3D Volmer- Weber, donde se puede describir este proceso mediante un modelo de nucleación progresiva y crecimiento tridimensional bajo control difusional, generando islas o núcleos de nanopartículas de Au, los cuales están sometidos a un rápido proceso de relajación durante su propio crecimiento debido a la difusión superficial de los adátomos. Las técnicas electroquímicas de caracterización mostraron que las nanoestructuras de metales nobles como el Au sobre HOPG pueden alcanzar áreas electroactivas importantes utilizando técnicas de disposición espontanea. Es decir que, a pesar de sus tamaños nanométricos y de la cantidad de nanopartículas depositadas sobre el sustrato, tienen la capacidad de experimentar trasferencia de carga.