I. INTRODUCCIÓN
Actualmente, diferentes patologías neoplásicas a nivel intracraneal pueden ser tratadas eficientemente con radioterapia. Particularmente, la protonterapia consiste en el uso de haces de protones de alta energía, aprovechando su capacidad balística combinando haces de diferente energía para el recubrimiento del target por medio de la técnica conocida como Spread Out Bragg Peak (SOBP).1
Los protones pierden su energía principalmente por interacciones electromagnéticas, aunque una pequeña parte se transfiere a través de colisiones nucleares.2 Dado que su masa es comparable con la de las partículas que conforman el medio en el cual se propagan, sus trayectorias en tejido mantienen su dirección original.3 Además, la transferencia energética por unidad de longitud es relativamente baja y más o menos constante hasta que se alcanza el rango del protón, donde pierde toda la energía restante en una distancia muy corta. El resultado de este proceso es un gran aumento de la dosis absorbida a una determinada profundidad, con una posterior rápida caída de dosis, determinando lo que se conoce como el “pico de Bragg”.1
La región de dosis baja entre la entrada y el pico de Bragg se conoce como “meseta de distribución de dosis”; donde se presenta aproximadamente del 30% al 40% de la dosis máxima. Por ello, se puede considerar que la dosis de entrada de un haz de protones es baja y la dosis de salida es insignificante.4
Además, el rango de los protones en el tejido es finito y dependiente de la energía, por lo que se puede determinar y producir la energía necesaria del haz de protones para penetrar a la profundidad requerida para el tratamiento. Permitiendo así, una liberación más localizada de la radiación y una mayor preservación del tejido sano circundante.5 En protonterapia se utilizan principalmente energías de 60 MeV para el tratamiento de tumores superficiales y de 230 MeV para tumores profundos de hasta 30 cm, aunque energías intermedias pueden ser utilizadas según el caso.6
Al tener la capacidad de modular la energía del haz, es posible superponer varios haces de energías para crear una región de dosis uniforme sobre la profundidad del target aprovechando el efecto de pico de Bragg, logrando lo que se conoce como Spread Out Bragg Peak, (SOBP). Esta región uniforme se genera combinando perfiles de haces con diferente energía inicial, asignando valores de contribución relativa a cada curva de energía empleada tal que satisfaga lo mejor posible la condición de planicidad del SOBP. Los pesos relativos de cada energía incidente se optimizan para minimizar la diferencia entre el SOBP y una distribución ideal, y sus valores generalmente describen un comportamiento exponencial.1,7
El objetivo de este trabajo es reportar sobre una metodología de modelado computacional por medio de simulaciones Monte Carlo con el código FLUKA para describir los procesos físicos en irradiaciones de protonterapia, comprobar su validez por comparación con datos experimentales y describir el procedimiento de generación de SOBP.
II. MÉTODOS Y MATERIALES
Modelado computacional y validación
En primera instancia, se realizó la validación de la metodología de modelado computacional de simulaciones Monte Carlo, con código FLUKA.
FLUKA es un código multipropósito capaz de modelar diferentes situaciones del transporte de partículas y su interacción con la materia. Es una herramienta desarrollada conjuntamente por la Organización Europea de Investigación Nuclear (CERN) y el Instituto Italiano de Física Nuclear (INFN). Cubre un amplio rango de aplicaciones como radioterapia, dosimetría, diseño de detectores y otros, capaz de simular procesos con geometrías complejas con mejor resultado estadístico en regiones de interés que sus análogos. Cuenta con un entorno gráfico (Flair) que permite un desarrollo integrado para todas las etapas de simulación, con la inclusión de variables estándar ya definidas por defecto. FLUKA ha sido testeado y aplicado en muchos campos de investigación, probando ser útil para aplicaciones de física médica y particularmente en protonterapia.2,8
Se simularon distintas energías terapéuticas correspondientes a irradiación con protones en configraciones representativas de irradiaciones intracraneales, en el rango de 81.56 MeV hasta 228.57 MeV, puntualmente, las utilizadas fueron: la energía más baja de 81.56 MeV, una energía media de 147.69 MeV y la energía más alta de 228.57 MeV. La simulación consiste de un fantoma, agua equivalente, cúbico de 40 cm de lado centrado en el origen y la fuente del haz de protones posicionada en el eje Z negativo a una distancia de 100 cm del fantoma (Fig. 1). Posteriormente, se compararon los resultados obtenidos con datos de mediciones experimentales por medio de cámara de ionización calibrada.
Conformación del Spread Out Bragg Peak
Para la conformación del pico de Bragg extendido, o SOBP por sus siglas en inglés, con código MC FLUKA se simuló el proceso de irradiación con haces de protones de distintas energías a un fantoma cúbico agua equivalente de 40 cm de lado, en cuyo interior hay un PTV (Planning Target Volume) cúbico de tejido adiposo, ambos centrados en el origen, para un campo de disribución gaussiana y una SSD de 100 cm. Se realizaron simulaciones para distintos tamaños de PTV, uno menor de 1cm de lado, uno intermedio de 3 cm de lado y uno mayor de 7cm de lado (Fig. 2).
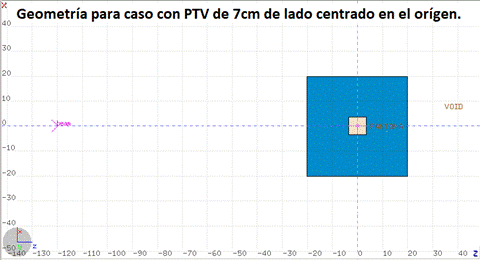
FIG. 2: Ejemplo de fantoma agua-equivalente (azul) con PTV (claro en zona central), de 7 cm de lado. Se agrega, esquemáticamente, al haz primario (flecha).
Las energías correspondientes para generar un SOBP apropiado para cada PTV se eligieron con un espaciado aproximado al 1% de sus valores, y de manera tal que la máxima entrega de dosis ocurra dentro del volumen del PTV. Con el propósito de apreciar el comportamiento de cada haz monoenergético, se graficaron los picos de Bragg correspondientes y posteriormente se asignaron valores de contribución relativa 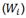 de cada curva que forma el pico de Bragg
de cada curva que forma el pico de Bragg 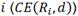 al SOBP, de modo que se satisfaga la condición de planicidad del mismo lo mejor posible proponiendo estimar los pesos relativos por medio de la ecuación1
al SOBP, de modo que se satisfaga la condición de planicidad del mismo lo mejor posible proponiendo estimar los pesos relativos por medio de la ecuación1
Donde los  deben minimizar la diferencia entre el SOBP y una distribución ideal presumiblemente uniforme. De acuerdo con el formalismo propuesto (expresión (1)), los pesos máximos caen exponencialmente desde la curva a mayor profundidad hacia las curvas más próximas a la superficie de entrada de la radiación.1
deben minimizar la diferencia entre el SOBP y una distribución ideal presumiblemente uniforme. De acuerdo con el formalismo propuesto (expresión (1)), los pesos máximos caen exponencialmente desde la curva a mayor profundidad hacia las curvas más próximas a la superficie de entrada de la radiación.1
III. RESULTADOS Y DISCUSIÓN
Validación del modelado computacional
Para la etapa de validación del modelado computacional se obtuvieron los tres resultados por simulación reportados en las Figs. 3, 4 y 5 según ordenamiento creciente en energía, y fueron comparados con los datos de mediciones experimentales en rojo (datos aportados por el equipo de física médica del Centro Nacional de Hadronterapia Oncológica de Pavía, Italia, a quienes se agradece).
FIG. 3: Comparación de curvas de dosis en profundidad de resultados obtenidos por simulación con datos experimentales para energía de 81.56 MeV, zona del pico de Bragg ampliada.
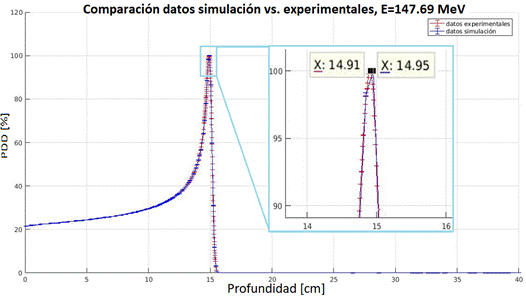
FIG. 4: Comparación de curvas de dosis en profundidad de resultados obtenidos por simulación con datos experimentales para energía de 147.69 MeV, zona del pico de Bragg ampliada.

FIG. 5: Comparación de curvas de dosis en profundidad de resultados obtenidos por simulación con datos experimentales para energía de 228.57 MeV, zona del pico de Bragg ampliada.
Entre los valores obtenidos por simulación y los datos experimentales se presentaron diferencias que varían desde 0.035 cm hasta 0.05 cm. Considerando que el modelo propuesto y presentado es una aproximación a la construcción del SOBP, se permite para este trabajo una tolerancia de variación de 0.1 cm por cada píxel en representación gráfica, por lo que es posible afirmar que los valores simulados y los valores de los datos experimentales son indistinguibles entre sí, bajo el mencionado criterio, demostrando de esta manera la validez de la metodología de modelado computacional con código de simulación MC FLUKA para protones como partículas primarias.
Cabe indicar explícitamente, que en caso de requerir diferencias menores, se deberían complejizar las simulaciones incorporando las geometrías correspondientes a los elementos utilizados para la medición experimental como, por ejemplo, una cámara de ionización.
Conformación del Spread Out Bragg Peak
Para las energías que resultaron apropiadas para que el pico de Bragg se produzca dentro de la zona del PTV se graficó la PDD en función de la profundidad del fantoma sobre el eje Z. Al conformar el SOBP, la metodología desarrollada propone asignar los pesos a cada curva (correspondiente a cada energía inicial) según una distribución exponencial del tipo:
donde el mayor peso se asigna a la curva cuyo pico de Bragg ocurre a mayor profundidad en fantoma, y  corresponde a la profundidad en la cual se produce el pico de Bragg para cada curva de energía en el interior del PTV.
corresponde a la profundidad en la cual se produce el pico de Bragg para cada curva de energía en el interior del PTV.
La conformación del SOBP, en azul, a partir de las curvas de energía pesadas junto con el respectivo ajuste exponencial de pesos asignados a cada curva para los casos de PTV de 1 cm, 3 cm y 7 cm se pueden observar en la Fig. 6.
Una distribución ideal se conformaría donde, para toda la extensión del SOBP se tenga una PDD del 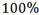 , sin embargo, en la práctica, para radioterapia convencional, es aceptable una variación entre el
, sin embargo, en la práctica, para radioterapia convencional, es aceptable una variación entre el  y el
y el 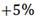 de uniformidad dosimétrica en el valor prescrito.2,9
de uniformidad dosimétrica en el valor prescrito.2,9
Los resultados reportados presentan una variación máxima del 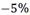 , siendo el caso planteado para el PTV de 7 cm de lado, el que presenta las mayores variaciones.
, siendo el caso planteado para el PTV de 7 cm de lado, el que presenta las mayores variaciones.

FIG. 6: SOBP conformado en azul (izq.) y su respectivo ajuste exponencial de pesos asignados (der.).
Sin embargo, es oportuno indicar que la uniformidad de la zona de plateau del PTV puede mejorarse significativamente complejizando el formalismo propuesto inicialmente para la asignación de pesos relativos, incorporando un procedimiento de optimización, o bien -como se procede en otros contextos de radioterapia- combinando campos.10 Por lo cual, los resultados preliminares pueden considerarse aceptables.
Además, cabe remarcar que fuera de la zona del PTV la dosis percibida es menor que en el interior del mismo previo al SOBP e insignificante luego de este, por lo que al poder modular las energías, se verifica que la técnica permite un mejor y adecuado recubrimiento como es requerido, en líneas generales, para un aceptable control al momento del tratamiento.
IV. CONCLUSIONES
En este trabajo se realizó la validación de la metodología de modelado computacional, con código Monte Carlo FLUKA, mediante comparación exitosa con datos experimentales y se realizó el proceso de conformación del Spread Out Bragg Peak (SOBP) para aplicaciones representativas de irradiaciones intracraneales. En primera instancia, los resultados obtenidos por simulación resultaron en buen acuerdo y validados con los datos experimentales para el rendimiento dosimétrico en profundidad. El procedimiento de generación del SOBP, a pesar de la simplicidad del formalismo que facilita significativamente el cálculo dosimétrico, demostró un comportamiento promisorio para la concentración de dosis y uniformidad en el PTV, lo que proporcionaría alta efectividad de control local y protección de zonas a riesgo para dichas aplicaciones.
En resumen, la metodología desarrollada y aplicada representa mecanismos de potencial relevancia clínica, especialmente en la planificación y aplicación de irradiaciones representativas de protonterapia intracraneal.

















