Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista argentina de neurocirugía
On-line version ISSN 1850-1532
Rev. argent. neurocir. vol.21 no.4 Ciudad Autónoma de Buenos Aires Oct./Dec. 2007
La circulación cerebral en condiciones normales y patológicas. Parte III: el flujo sanguíneo en los vasos de la base
Horacio Fontana, Héctor Belziti, Flavio Requejo, Sebastián Buratti, Mario Recchia
Correspondencia: hojofontana@yahoo.com.ar
Recibido: agosto 2007;
aceptado: octubre 2007
RESUMEN
La circulación en tubos muy ramificados y con curvas es compleja. El flujo laminar y el turbulento son extremos infrecuentes de distintos tipos de circulación que se denominan flujo alterado. La pulsatilidad también contribuye a la alteración del flujo. Estos tipos de flujo requieren de un mayor gasto de energía, que en parte es absorbida por la pared arterial. La velocidad, la densidad de la sangre y el diámetro del vaso favorecen un flujo ordenado, mientras que la viscosidad actúa inversamente.
La íntima reacciona al stress de deslizamiento o cizallamiento formando almohadillas que refuerzan la pared en las caras laterales de las bifurcaciones y menos a menudo en el vértice.
Las fuerzas hemodinámicas que se ponen en juego en el vértice son la presión lateral que se transforma en tensión, la presión hemodinámica, que suma a la lateral, la energía cinética de la sangre, y la tensión de cizallamiento.
Las bifurcaciones de los vasos cerebrales tienen puntos débiles en el vértice y las caras laterales que se caracterizan por ausencia de la capa muscular de la media, quedando la pared constituida por tejido conectivo de la adventicia, la capa elástica interna y la íntima. Estas debilidades de la media pueden aparecer desde el nacimiento, pero su número y tamaño aumentan a lo largo de la vida y son más amplias en pacientes portadores de aneurismas, o con factores de riesgo, como hipertensión y poliquistosis renal. Los aneurismas se forman en los vértices de las ramificaciones o bifurcaciones por efecto del stress de deslizamiento y la presión hemodinámica, en vasos con alteración de la geometría de la bifurcación por envejecimiento. La degeneración de la elástica parece necesaria, y se debe al efecto de estas fuerzas. Aumentos de la presión transmural de diferentes causas, y de los requerimientos hemodinámicos por asimetría del polígono, serían condiciones necesarias para su desarrollo.
Como la aterosclerosis, los aneurismas saculares cerebrales podrían ser considerados una enfermedad degenerativa de la pared arterial, pero por exceso de demanda de flujo, contrariamente a la primera.
Palabras clave: Circulación en las arterias de base; Origen de los aneurismas cerebrales.
SUMMARY
Circulation in elastic, branching, curved tubes is complex. Laminar and turbulent flow are extreme and infrequent forms of different circulation types named disturbed flow. Pulsatility also contributes to it. Those types of flow produce enrgy loss, transferred in part, to the arterial wall. Velocity, density and diameter of the vessel favor a tidy flow, viscosity instead, acts inversely. The intima reacts to the low shear stress generating pads thar reinforce the lateral faces of bifurcations and less in the vertex, where the strss is maximal.
The hemodynamic forces that act upon the vertex are lateral pressure, hemodynamic pressure, that sums to the lateral, the kinetic energy of blood, and the shear stress.
The bifurcations of cerebral vessels have weak points at the vertex and lateral faces, characterized by absence of the muscle coat of the media. At this point, the wall is compound of the connective tissue of adventicia, the elastica interna, and the intima. These weak points can be found from birth, but grow in number and width with age, and are larger in patients with aneurysms, or with risk factors such as hypertension or policystic kidneys.
Aneurysms grow at the vertex of bifurcations or branchings by the effect of shear stress and hemodynamic pressure, in vessels with change of the geometry of the bifurcation because of aging. Degeneration of the internal elastic lamina seems necessary, and is the consequence of the effect of those forces. Increase of the transmural pressure from different causes, and increase of the hemodinamic requirement by assymetries of the polygon of Willis could be necessary conditions to its growth. Aneurysms would develope because of the impairement of the capacity to damp the pulsatility of the cerebral circulation because of the progressive enhancing of the rigidity of the cerebral vessels and the decline of the other mechanisms of "closed box" of the skull.
As atherosclerosis, cerebral berry aneurysms could be considered a degenerative disease of the arterial wall, but in this case for excessive requirement of flow, the opposite to the first.
Key words: Circulation of the basal brain arteries; Origin of the crebral aneurysms.
INTRODUCCIÓN
Siguiendo con nuestro análisis de la circulación en los vasos de la base del cerebro, nos ocupamos ahora de los aspectos dinámicos de la misma, entendiendo que lo que aquí se expone, está basado en un conocimiento muy elemental de la física de los fluidos y que está sin duda, destinado a ser mejorado, en la medida de nuestro progresivo acceso a ese conocimiento.
MASA, DENSIDAD, PESO ESPECÍFICO Y VISCOSIDAD
Masa es un término difícil de definir, pero que tiene que ver con la cantidad de materia que un cuerpo tiene. La masa se experimenta, y dos son las experiencias que nos acercan a su conocimiento. Una, la más simple es el peso, cuando tratamos de levantar un cuerpo, por ejemplo. El peso es la fuerza con que es atraído un cuerpo hacia el centro de la tierra. Los cuerpos son atraídos por la tierra con la misma aceleración, así que la diferente sensación de peso que sentimos con cada uno de ellos, que se mide con una balanza, se debe a la masa, que recibe en este caso, el nombre de masa gravitacional. La otra experiencia es el intento de mover un cuerpo que está en reposo. Mover es imprimir una aceleración, o sea aplicar una fuerza. De acuerdo a la fuerza que se aplique, el movimiento será más o menos veloz. La constante de proporcionalidad de esos movimientos de acuerdo a la fuerza que se aplique, es la masa. En este caso, masa inercial. Las masas gravitacional e inercial de un cuerpo coinciden, tema que parece que preocupó bastante a la física durante algún tiempo1. La masa se experimenta entonces como una resistencia al movimiento opuesta por un cuerpo o sustancia.
La densidad es la cantidad de masa en la unidad de volumen y el peso específico es el peso de la unidad de volumen de una sustancia. Vemos que es el mismo concepto de masa el que está implícito en estos dos parámetros físicos.
El movimiento de un líquido o un gas en un conducto se denomina flujo.
La viscosidad es también un término de difícil explicación. Tiene que ver con la forma e intensidad con que se atraen las moléculas de una sustancia líquida. Igual que la masa, la viscosidad se manifiesta también como una resistencia al movimiento (rozamiento) y a la deformación (desgarro o cizallamiento) de un fluido.
La sangre tiene masa, por lo tanto se puede medir su densidad y su peso específico, que variarán según composición y temperatura. La sangre presenta un tipo de viscosidad que varía de acuerdo a las condiciones en que fluye, por ejemplo, al pasar por un capilar, disminuye (fenómeno de Farhaeus- Lindqvist), por eso se dice que es un fluido tixotrópico2. Por su masa, la sangre tiene inercia, se requiere de una fuerza (trabajo del corazón) para hacer que se mueva (flujo), y al moverse adquiere energía cinética, capaz de producir trabajo.
La ley de conservación de la energía
Un líquido circulando a volumen constante mantiene constante su energía ante variaciones del calibre, si no tomamos en cuenta la pérdida por rozamiento3.
Las energías que consideramos son la de la presión lateral y la cinética. Así, si el caudal es constante, en un estrechamiento del conducto la velocidad deberá aumentar, con lo que aumentará la energía cinética, y proporcionalmente disminuirá la presión lateral. Con una dilatación sucederá exactamente lo opuesto (Fig. 1). Este es el principio de Bernouilli y se da solamente en fluidos ideales.
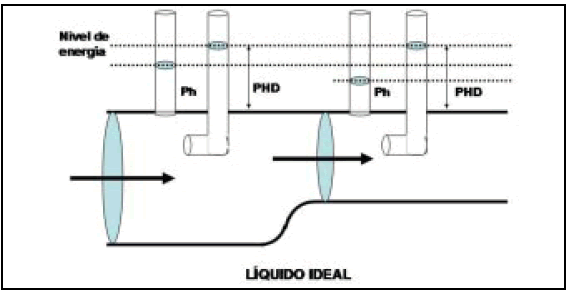
Fig. 1. Esquema tomado de (3) que muestra el principio de "conservación de la energía" de Bernouilli. Si el flujo es constante, en el vaso más grueso la presión hidrostática es más alta y la velocidad es menor. En el vaso más delgado, la presión hidrostática es menor y la velocidad es mayor, por lo que aumenta la presión hidrodinámica. Tengamos en cuenta que estos resultados se dan con fluidos "ideales", es decir, sin pérdida de energía por rozamiento
La pérdida de la energía
En los líquidos reales circulando por tubos no rectilíneos, hay diferentes formas de pérdida de energía. La más conocida es el rozamiento de las moléculas del líquido entre sí y contra las paredes del tubo, debido a la viscosidad, con producción de calor.
La otra es la alteración del flujo.
Flujo laminar, flujo alterado, flujo turbulento
Si el fluido es ideal, al circular por un tubo de paredes lisas y calibre constante, el perfil de velocidades es plano3 (Fig. 2).
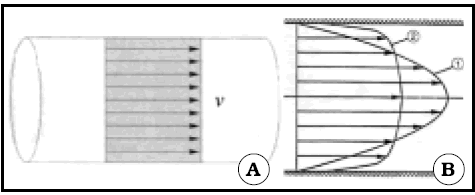
Fig. 2. Perfiles de flujo. A: perfil en un fluido ideal. No existe viscosidad, no hay rozamiento, todas las corrientes tienen la misma velocidad. Tomado de (3). B 1: perfil de flujo de un líquido reopéxico como el agua (viscosidad constante). B 2: Perfil de un fluído tixotrópico como la sangre (viscosidad menor en la periferia, fenómeno de Farhaeus- Lindqvist). Hay poca diferencia de velocidad entre las corrientes axiales y las periféricas, salvo las de la zona limitante. Tomado de (4).
En los fluidos reales, hay rozamiento contra las paredes y entre las moléculas, y entonces el perfil es parabólico. La viscosidad es una resistencia al deslizamiento entre capas adyacentes de un fluido. La mayor resistencia está a nivel de las paredes del tubo, donde se acepta que el fluido no se mueve: es la región de no deslizamiento o no flujo2.
A su lado, existe una zona en que las velocidades aumentan r ápidamente a medida que nos movemos hacia el centro de la corriente. Ésta es la zona limitante2.
En el centro del tubo el flujo es m áximo, formándose de esta manera, el conocido perfil parabólico.
Haciendo visible el flujo mediante el agregado de part ículas al fluido, o colorantes isobáricos o pequeñas burbujas, o midiendo el desplazamiento Doppler de las partículas iluminadas por un haz de luz coherente e isocromo como el producido por un láser, se puede ver que las partículas se disponen en capas perfectamente ordenadas de velocidad creciente de la periferia al centro, llamadas corrientes de deslizamiento (Fig. 2)2. Este es el flujo laminar.
La energ ía que se pierde por el rozamiento en este tipo de flujo es la mínima posible y se denomina tensión de deslizamiento (shear stress en inglés). La cantidad de energía perdida en la unidad de espacio es el coeficiente de viscosidad que, como vimos, es variable en un líquido tixotrópico como la sangre2. Así que aquí, manteniéndose constante la viscosidad, la perdida de energía (resistencia al flujo) se deberá especialmente a la longitud del tubo y a su calibre. Mientras la primera actúa en forma directa, el calibre lo hace en relación a la cuarta potencia del radio, por lo que el calibre del vaso es el mayor generador de resistencia al flujo.
Como la sangre es un fluido tixotrópico, el perfil de las corrientes de deslizamiento tomaría una forma más plana, ya que las capas más periféricas son menos viscosas. Esto podría explicar la paradoja planteada por Kerber (Fig. 3)2. Cuando un líquido comienza a fluir, el perfil de las capas de flujo es más plano, y luego de recorrida una distancia de varios diámetros del tubo, va pasando al perfil parabólico clásico.

Fig. 3. Esquema tomado de Kerber (2). Muestra cómo el perfil de flujo adquiere forma parabólica luego de un trayecto más o menos largo. En la carótida, este trayecto es tan largo, que luego de 20 a 30 diámetros del vaso, todavía el perfil no es parabólico. Posiblemente influyan las características tixotrópicas de la sangre, como afirma Steiger (4) (Ver figura anterior).
Sin embargo, en la car ótida, pasados 20 a 30 diámetros desde su origen en la aorta, aún se mantiene el perfil de "zona de entrada" o "tapón", según se puede observar en estudios Doppler.
Inercia contra viscosidad
Para cada fluido en cada tubo hay un límite de velocidad de flujo por encima del cual, bruscamente, desaparece el orden de las corrientes de deslizamiento y el flujo se hace completamente caótico, deteniéndose prácticamente el avance de la columna líquida, con gran pérdida de energía: flujo turbulento2.
Este límite está dado por el número de Reynolds. El número (no dimensional) es directamente proporcional a la velocidad, densidad (masa) y diámetro del tubo, e inversamente proporcional a la viscosidad. Para el agua, en tubos perfectamente rectilíneos, el número de Reynolds es de 2000. En el centro de la carótida, es de 200. Lo que se mide, sin embargo, es una media. Cerca de la pared, o en bifurcaciones arteriales, donde predominan las fuerzas de la viscosidad, el número puede ser tan bajo como 1 o 2, especialmente al fin de la diástole2. Vemos que mientras la masa es un obstáculo para comenzar el movimiento (inercia), una vez impulsada la sangre por el corazón, la energía cinética favorece el mantenimiento del flujo.
En cambio, la viscosidad se manifiesta como un impedimento constante al flujo, mientras éste ocurre Fig. 4).

Fig. 4. Esquema del juego de energías que actúan durante la circulación en un segmento de arteria cerebral. La presión generada por la contracción cardiaca, genera un gradiente de presión entre los extremos del vaso, que mueve la sangre hacia la derecha en el esquema (presión hidrodinámica). La velocidad que le imprime, produce la energía cinética E= 1/2 d. v2 (d es la densidad). La presión generada por el corazón actúa también sobre las paredes del vaso (presión estática), que interactuando con la presión externa (PIC), genera la tensión longitudinal y transversal a nivel de la pared, manteniendo el calibre vascular. La viscosidad actúa en contra del movimiento de la sangre, por lo que la representamos como dos flechas de bloque, que se van atenuando hacia el centro del vaso, ya que su acción más importante es en las zonas laterales, donde el movimiento es más lento. Está representado un perfil de la columna circulante, y el número de Reynolds con su fórmula donde figuran la densidad (masa) en el numerador y la viscosidad (n) en el denominador. D es el diámetro del vaso y U es la velocidad.
Flujo alterado
En la naturaleza son raros tanto el flujo laminar, como el turbulento2. Imaginemos un vaso arterial, por ejemplo. El calibre del mismo cambia constantemente durante el ciclo cardíaco5 (Fig. 5), por lo que las corrientes de deslizamiento probablemente se alteren levemente.
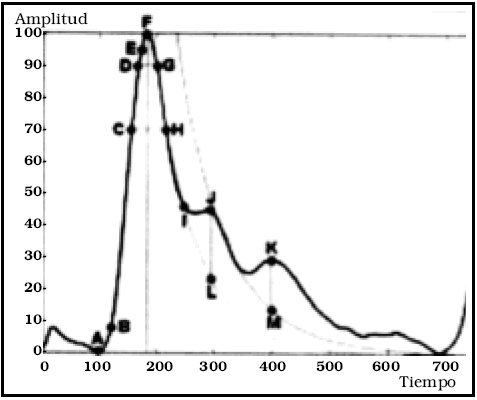
Fig. 5. Variación del diámetro arterial durante el ciclo cardíaco en la arteria radial. Tomado de (5). Obsérvese la similitud con el pletismograma y los registros de PIC, que representan el mismo fenómeno a un nivel algo más periférico.
Hay numerosos estados intermedios entre el flujo laminar y el caos de la turbulencia, que han recibido el nombre de flujo alterado2. En el caso particular de la circulación de la sangre y en especial por el cerebro, las curvaturas y bifurcaciones del árbol arterial son las que con más frecuencia alteran el flujo, generando una pérdida mayor de energía2,4.
En una curva, el eje central de la corriente laminar se desvía hacia la pared de mayor curvatura, y se separa de la de menor curvatura, generándose dos vórtices de diferente sentido, que desaparecerán luego de un recorrido medido en varios diámetros del vaso. En la zona de separación, el flujo es muy lento y puede haber recirculación4,6 (Fig. 6).

Fig. 6. Esquema de la alteración del flujo en una curva vascular tomado de Niimi7. Al penetrar en la zona curva, las corrientes más veloces se acercan a la porción externa de la curva, y se alejan de su porción interna. En la zona de separación puede haber recirculación Luego se generan dos vórtices cuyas corrientes se mueven en sentidos contrarios. Esquemas más sofisticados de estos fenómenos son presentados por Kerber2 y Steiger4.
En una ramificación, si el flujo es lento, la corriente más lateral será desviada hacia el mismo, impactando más sobre la pared distal. A velocidades mayores, otras corrientes más alejadas se incorporarán a las laterales, y aparecerá una zona de separación del flujo en el lugar diametralmente opuesto. En ambas ramas distales se producirán una serie de secuencias de vórtices llamados de von Karman, generadores de ruidos y vibraciones vasculares4 (Fig. 7). El Re para las bifurcaciones y curvas es lógicamente menor que en tubos rectos largos, y disminuye más con un ángulo mayor de bifurcación y con el flujo pulsátil7.
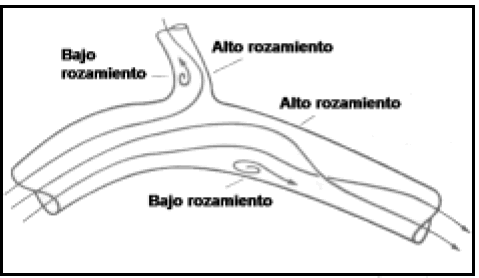
Fig. 7. Flujo en una ramificación según Kerber (2). Obsérvese las zonas de separación del flujo y la formación de vórtices de von Karman.
Estos son los ejemplos m ás comunes de flujo alterado, no turbulento, normales en todo vaso, debido a sus irregularidades. Producen una mayor pérdida de energía, disipada como calor y stress de la pared.
LA CIRCULACIÓN Y LA PARED ARTERIAL. TENSIÓN DE DESLIZAMIENTO O DESGARRO (SHEAR STRESS)
El mismo roce que se produce por deslizamiento entre las corrientes del flujo laminar, se produce en el espesor la pared vascular como resultado de la fuerza tangencial que ejerce el flujo sanguíneo. Esta fuerza se aplica sobre la superficie interna del vaso, por lo que su expresión: F/S, es la misma que para la presión y se mide en las mismas unidades (Pascales). Se puede decir entonces, que es un tipo de tensión, aplicada en forma tangencial, que tenderá a hacer deslizar unas capas de la pared del vaso sobre las otras (cizallamiento o desgarro) como consecuencia de las fuerzas desarrolladas por el flujo sanguíneo2.
Este tipo de tensión depende, en forma directa de la viscosidad, y de la velocidad de la sangre y en forma inversa del radio, en cada determinado punto de la longitud de la pared y, por lo tanto, no se aplica homogéneamente sobre toda la extensión de la misma. El flujo laminar es el que menos tensión de deslizamiento produce sobre la pared arterial, aumentando con el flujo alterado y el turbulento, que como vimos, tiende a producirse en los puntos en que la anatomía vascular se modifica: curvas y ramificaciones4.
En una ramificación o bifurcación, el punto de mayor stress de deslizamiento es el divisor de flujo o carina. Aquí Ferguson8 describe lo que se ha llamado momento por unidad de volumen y flujo. El momento es igual a m.v, es decir una expresión de la energía cinética. El impacto y desvío de las líneas de flujo centrales en el ápex produce la transmisión de un impulso pulsátil a esa zona de la bifurcación, que no ocurre en otra parte, como había demostrado Forbus muchos años antes, aunque con una explicación más casera (ver más adelante)9.
Las menores tensiones se producen en los ángulos laterales, donde la velocidad de la sangre es mínima, o incluso negativa (recirculación).
Alteraciones de la íntima de las bifurcaciones y ramificaciones de las arterias cerebrales
En 1960, Stehbens10 describió en detalle engrosamientos de la íntima en las bifurcaciones de las arterias cerebrales llamados almohadillas. Los cambios comienzan incluso en la vida fetal y lactancia, por lo que estarían relacionados al flujo, y fueron interpretados por este autor como compensaciones de cambios degenerativos de la elástica interna.
Aparecen primero en los ángulos laterales, para pasar luego a las "caras" de la bifurcación, y finalmente hacerlo en el ápex. Van precedidos por un cambio en la elástica interna, con disminución de la coloración de la misma, fragmentación, aparición de rebordes. Estos cambios son los que le hicieron pensar que eran degenerativos.
Las almohadillas están formadas por la proliferación de células musculares y fibras elásticas y son más delgadas en el ápice, pudiendo confluir en una sola estructura, que involucra todo el perímetro de la bifurcación y el ápex.
Stehbens atribuyó el desarrollo de estas almohadillas a la turbulencia generada en las bifurcaciones10,11, "en puntos de estancamiento, donde se producen remolinos" especialmente en los ángulos laterales y ápices. En las caras, la explicación le resultaba más difícil. Estos cambios ya habían sido descriptos para las grandes arterias y se pensaba que precedían a la degeneración aterosclerótica de la pared.
Podríamos decir ahora que se producen en zonas de la íntima con baja tensión de cizallamiento. Sin embargo, el ápex es considerado la zona de mayor stress, como vimos más arriba. Hay un punto del divisor, donde el flujo se detiene (punto de estancamiento)12, pero ocupa un área ínfima de la carina, al menos cuando la bifurcación es en ángulo agudo. En ángulos más abiertos, la alteración del flujo podría ser muy compleja (Fig. 8), pudiendo aparecer más de un punto de estancamiento.

Fig. 8. Levemente modificado de (12). Circulación en una bifurcación de 180‰ a nivel de la comunicante anterior, con un aneurisma incipiente. S: zonas de separación de la corriente. P: puntos de estancamiento. En este tipo de bifurcación, sería esperable encontrar más de un punto de estancamiento, según nuestra opinión. Obsérvense los vórtices de von Karman en ambas A2.
Steiger4 coincide en que los ángulos laterales son zonas de baja tensión de desgarro, mientras que los ápices son zonas de alta tensión (Fig. 9).

Fig. 9. Intensidad del stress de desgarro en ramificaciones o bifurcaciones según Steiger (4). Según este autor los ápices son zona de alta tensión, contrariamente a los ángulos laterales. Esto hace difícil explicar por qué se forman almohadillas en estos puntos, salvo que no fueran debidas a factores hemodinámicos. Sin embargo, compárese con la Fig 7, y se comprenderá que es posible que las zonas de alto y bajo stress puedan variar de localización según la disposición de los vasos.
El stress de cizallamiento para la bifurcaci ón carotídea ha sido calculado por este autor en 5 Pa, mientras que para la unión car-Co post. sería de 12 Pa y para la bifurcación silviana de 22 Pa, teniendo en cuenta la mayor velocidad del flujo y el menor radio del vaso.
LA ETIOLOGÍA DE LOS ANEURISMAS CEREBRALES, DESDE EL PUNTO DE VISTA HEMODINÁMICO
Los aneurismas saculares son una curiosa patología que se da especialmente pero no exclusivamente en los vasos cerebrales. Aunque conocidos desde antaño, hace unos 3/4 de siglo que se considera al factor hemodinámico como la principal causa, aunque las exactas condiciones de su origen, crecimiento y ruptura se desconocen ampliamente. Resumiremos lo expuesto por diferentes autores en forma histórica, en búsqueda de datos que nos permitan hacernos una idea lo más aproximada posible respecto de este paradigma.
WD Forbus (1930)9
Autores alemanes como Busse y Eppinger habían precedido a Forbus esbozando algunas teorías acerca del origen congénito de los aneurismas saculares ya sea por un defecto congénito de la lámina elástica (Eppinger) o por una hipoplasia de la pared arterial en el punto de origen de un vaso que luego se atrofió en el curso del desarrollo (Busse), dando origen a una distensión de la pared, de allí el nombre de "aneurismas por distensión" que este autor les puso (Dehnungsaneurysmen).
Fue Forbus sin embargo, quien con un paciente trabajo, generó a partir de una observación anatomopatológica, una serie de hipótesis que fue comprobando o rechazando ya sea por otras investigaciones anatómicas de los vasos arteriales, o mediante el diseño de experimentos, que le permitieron emitir la primer teoría verdaderamente científica sobre el tema. Esta teoría ha recibido ulteriormente el nombre de "congénita"11,12,18,19, porque el mismo autor en algún momento así parece mencionarlo, pero también debemos tener en cuenta que termina su trabajo diciendo que son "lesiones adquiridas debidas a un factor predisponente en la forma de una imperfección estructural congénita de la arteria, localizada característicamente en los puntos de bifurcación".
Forbus realizó una autopsia de un joven con cinco aneurismas, de los cuales, uno se había roto, provocándole la muerte. Realizó una disección fina de los aneurismas bajo microscopio quirúrgico, y observó que todos estaban ubicados en, o muy próximos a, una bifurcación. Histológicamente, comprobó que los aneurismas no rotos tenían una estructura muy parecida. A nivel del cuello, la capa media y la membrana elástica se detenían, estando la pared del aneurisma constituida por una íntima engrosada en algunos lugares y normal en otros, en donde encontraba fibroblastos y colágeno, La adventicia también podía encontrarse normal o engrosada. En el aneurisma roto, encontró que la pared estaba formada por láminas de tejido hialino que se continuaban con el trombo, y otras zonas de trombo organizado, posiblemente de rupturas previas.
Como le llamó la atención la preferencia por las bifurcaciones, estudió otras arterias que no contenían aneurismas en el mismo sujeto, y observó la presencia de lo que terminó denominando "defectos de la capa media", ubicados en el vértice de las bifurcaciones y en menor grado, en los ángulos laterales de las mismas. Zonas de mayor o menor extensión, en donde la capa media estaba "reemplazada por la adventicia", que aparecía separada de la íntima por la membrana elástica interna.
Extendió su investigación a otros 70 especímenes de arterias cerebrales y de otras zonas de la economía, encontrando defectos similares tanto en sujetos con aneurismas cerebrales como en normales. También encontró estos defectos en recién nacidos y en un feto, de dos que pudo estudiar. Los defectos fueron menos comunes en las coronarias y mesentéricas que examinó.
Preguntándose por la causa del defecto encontrado, estudió la serie embriológica del Instituto Carnegie, llegando a la conclusión que la capa media nace independientemente en el vaso madre y en las ramas, para confluir hacia los puntos de ramificación, en donde esta confluencia puede no ser completa, generando el defecto. Para Forbus, estos defectos constituían un locus minore resistenciae parecido en esto, a los Dehnungsaneurysmen.
Con estos datos, realizó una serie de estudios hidrodinámicos en laboratorio, para probar que la mayor presión durante la circulación, era ejercida sobre el vértice de la bifurcación, en comparación con los ángulos laterales, en réplicas de bifurcaciones de distinto ángulo (Fig. 10). Esto es lógico, de acuerdo a lo visto más arriba, ya que el vértice soporta la presión hidrodinámica más la presión lateral.

Fig. 10. Esquema del experimento de Forbus tomado de su trabajo (8), donde muestra que: "1) El punto de mayor presión es donde la corriente axial choca con la pared del vaso. 2) La diferencia de presión aumenta con la velocidad (energía cinética, momento, presión dinámica). 3) Con presiones de 91 mm Hg en el ápex, la presión lateral es de 68. 4) Con diferencias muy bajas, la generación de remolinos laterales podría revertir la relación." Se han sobreagregado los valores obtenidos por el autor en una 'única experiencia, vertidos en su tabla 4, en cm de H2O.
Finalmente, aunque sus experimentos fueron de circulación continua, supuso que el flujo pulsátil podría ejercer un efecto de "martillo de agua" sobre el ángulo de la bifurcación.
Para terminar con su exhaustivo an álisis del problema, dirigió su atención a la lámina elástica interna, que aparecía con signos de degeneración en un par de aneurismas incipientes que encontró en su investigación de los vértices. Concluyó que la causa de la degeneración, como de la hipertrofia de la íntima en esos casos, eran de origen mecánico. Por el resultado de sus observaciones, opinaba que esta degeneración de la elástica, era posterior al desarrollo del incipiente aneurisma.
Forbus hablaba ya en 1930 de corrientes circulatorias intra aneurismáticas, como causa de los engrosamientos intimales y de remolinos y distorsiones circulatorias en los ángulos laterales de las bifurcaciones. Notó también que el eje principal del aneurisma seguía el eje de la corriente en el vaso madre. Habló también como vimos, del "efecto de martillo de agua" de la corriente pulsante sobre las bifurcaciones.
Todos los autores que se refirieron a este tema después de él mencionan alguno de sus hallazgos poniéndolo o no como referencia.
LE Glynn (1940)13.
Este autor encontró, como Forbus, defectos de la media en pacientes con y sin aneurisma, por lo que le negó trascendencia como factor etiológico. Sometió a porciones del árbol circulatorio cerebral a tensiones muy superiores a las fisiológicas en experimentos agudos, sin que se produjeran dilataciones a nivel de las bifurcaciones, lo que según él, sostenía su opinión. También tomó cuenta de la presencia o no de engrosamientos de la íntima, no encontrando relación con la presencia o tamaño del defecto de la media, y atribuyó erróneamente como sabemos, estos engrosamientos a zonas de mayor stress de la íntima.
Basó su interpretación de la etiología de los aneurismas en una degeneración de la elástica interna, aterosclerótica o no, muy expuesta por su ubicación topográfica tan cercana a la luz, rasgo que diferencia a los vasos cerebrales de los del resto de la economía, que distribuyen el tejido elástico más ampliamente y en donde los aneurismas son mucho más raros.
Walker y Allegre, (1954)14. Cambios en la íntima
Estos autores estudiaron 39 casos del Johns Hopkins recolectados entre 1925 y 1951, de los cuales 35 habían fallecido por causa del aneurisma, ruptura, operación, etc., y 4 por otras causas. Encontraron que el punto de ruptura en tres casos estaba en el cuello. En cuatro casos había infartos debidos en tres de ellos, a clipado quirúrgico de los vasos correspondientes.
Encontraron una hipertrofia intimal en la zona de nacimiento del aneurisma con división en capas de la elástica, que atribuyeron a degeneración aterosclerótica previa al desarrollo del aneurisma, con daño de la elástica interna, y debilitación de la pared. La formación del aneurisma estaría favorecida finalmente en estos casos, por una anomalía del polígono de Willis, o causas generales como la hipertensión arterial, que producirían sobrecarga de la pared así debilitada. La necesidad de concurrencia de varios de estos factores simultáneamente, explicaría la relativa infrecuencia de los aneurismas cerebrales.
T. Crawford (1959)15
Muy ecléctico, este autor sostiene que los aneurismas se desarrollan a partir de defectos de la media, sobre los que actuaría una placa de ateroma, produciendo degeneración de la elástica interna y finalmente, la hipertensión arterial, que es la "fuerza de distensión". Para hacer notar la importancia de la aterosclerosis, comparó cuarenta y nueve de sus 163 casos de autopsia de aneurismas, investigando la presencia de signos de aterosclerosis coronaria y cicatrices de infarto, con una población general de autopsias, y vio que eran más frecuentes en los casos con aneurismas.
Los 163 pacientes habían fallecido por ruptura aneurismática, y encontró que un 2% se habían roto en el cuello, 10% en la porción lateral y el resto en el fondo. En 24% de los casos, no pudo determinar el lugar de ruptura.
La aterosclerosis había sido involucrada por Kerpola9 y Walker y Allegre, como vimos, y también por Carmichael.
R. Carmichael, R. (1960)16
Tiene una opinión muy similar a la de Crawford. Dice que los aneurismas nunca son debidos a una deficiencia del desarrollo o a degeneración arterial sola, sino a una combinación de ambas. Para él, no hay incompatibilidad entre ambos puntos de vista, que pasan así a ser complementarios.
Describe los defectos de la media, y también hipoplasias de esta capa, que pueden afectar el vaso más proximal o distalmente al mismo aneurisma y que pueden favorecer su origen. Los defectos de la media en cuestión requieren además tener un tamaño considerable, acorde con el tamaño del cuello del aneurisma.
Describe degeneración de la íntima (hiperplasia), que sería de origen aterosclerótico y que afectaría a la elástica interna, debilitándola. Esta membrana debe también presentar un defecto lo suficientemente grande para dar lugar a la protrusión del aneurisma.
Describe también degeneración de la media, manifestada en fibrosis y atrofia de la capa muscular. No queda muy claro de sus descripciones, en qué se diferencia esta alteración de la hipoplasia de la media mencionada antes, ya que ambas presentan una disminución del espesor de la capa muscular, y fibrosis.
Dice, como Walker y Allegre, que las alteraciones deben coincidir en la zona de defecto de la media para que se origine el aneurisma, explicando así su baja frecuencia, en relación a la de los defectos. La posición de éstos, explica la localización aneurismática preferente en las bifurcaciones.
M.R. Crompton (1965)17
Este autor realizó los estudios anatomopatológicos de la serie de aneurismas de McKissock en Inglaterra. Coincide con Glynn en que la estructura crucial a ser dañada en la formación del aneurisma es la elástica interna, pero se pregunta acerca de las causas de la frecuencia 5- 6 veces mayor de los aneurismas en la bifurcación silviana que en la carotídea o la del tronco basilar.
Define aneurisma como: "una porción de pared arterial saliente de al menos 2 mm constituido por íntima y adventicia solamente, con una elástica discontinua". Una procidencia de la pared en un defecto de la media, no fue considerada aneurisma si tenía la elástica intacta. Esto diferencia su concepto diametralmente del de Forbus.
Nota que los defectos de la media pueden ser dobles con una isla de tejido muscular entre ambos, lo que explicaría la aparición de un aneurisma levemente desplazado hacia un lado, como había observado ya Stehbens.
Los defectos son notablemente simétricos para este autor, lo que justificaría la aparición de aneurismas en espejo. Si bien se encuentran desde el nacimiento, aumenta su frecuencia y su tamaño con la edad, lo mismo que la presencia de hiperplasias intimales y degeneración de la elástica.
En los pacientes con aneurisma, los defectos serían constantes y más frecuentes, y a una edad más temprana, lo mismo que la gravedad de los cambios en la íntima y elástica. La hipertensión arterial y la poliquistosis renal también incrementan estos cambios.
La edad, pero especialmente la presencia de aneurismas, la hipertensión arterial y la poliquistosis en orden ascendente, aumentan la fibrosis de la capa media, que al ser más rígida, impediría cambios en longitud o diámetro del vaso, generando mayores tensiones a nivel de los defectos en las bifurcaciones.
Una observación interesante de este autor para explicar la mayor frecuencia de aneurismas en la bifurcación silviana, es la distribución de los engrosamientos de la íntima (Fig. 11).
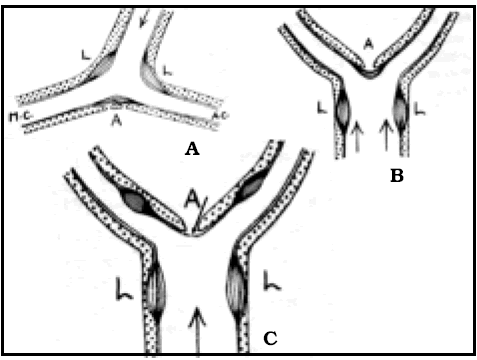
Fig. 11. Distribución de las hiperplasias intimales en distintas bifurcaciones de arterias cerebrales según Crompton17. A: bifurcación carotídea. B: bifurcación del tronco basilar. C: bifurcación de la cerebral media. Obsérvese (flecha) que el vértice no está protegido, lo que favorecería la formación de aneurismas con mayor frecuencia.
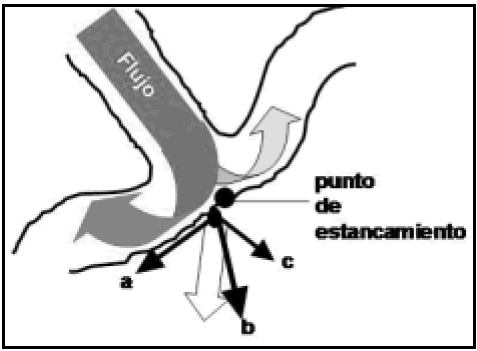
Fig. 12. Esquema que muestra la relación de fuerzas en una bifurcación cuya geometría ha sido alterada por envejecimiento. El flujo en el vaso madre se divide en dos columnas secundarias, que al entrar en sus ramas comienzan a formar los vórtices de von Karman. Posiblemente junto al punto de estancamiento, y dependiendo de la distribución relativa del flujo, aparece un punto de alto stress. Las fuerzas que actúan son a: el cizallamiento, b: presión hemodinámica, c: presión lateral. Componiéndolas, aparece una resultante (flecha de bloque) que con toda evidencia no está en el mismo plano del dibujo, especialmente por el efecto del cizallamiento.
Si estimamos estos hallazgos como ciertos, se deberían producir estancamientos o remolinos de recirculación en las ramas de ángulos de bifurcación silviana abiertos, para explicar la aparición de las almohadillas en esos puntos. Hasta donde sabemos, esta observación no ha sido repetida por otros autores.
W.E. Stehbens18,19
Stehbens pasó toda su vida profesional criticando activamente la hipótesis de Forbus a la que llamó "congénita". Creía que éste estaba equivocado respecto a los "defectos de la media", ya que según su investigación, si bien aparecían en niños, aumentaban con la edad en tamaño y cantidad por lo que consideró a muchos de ellos como adquiridos y les atribuyó una función de inserción de las fibras musculares que traccionarían de esta zona apical en el momento de la vasoconstricción. Prefirió llamarlos "brechas de la media" y más tarde, "rafe", que daría una idea mejor de su función.
Como Glynn, opina, sin embargo, que estos defectos no tienen mayor incidencia en la aparición de los aneurismas, que pocas veces se limitan justo al "rafe" del vértice, sino que están a uno u otro lado de éste, sobre todo en las lesiones "pre aneurismáticas" que este autor describe detalladamente, a saber: 1) dilataciones infundibuliformes en la unión carótida- co. posterior, 2) áreas de adelgazamiento mural en el ápex y 3) microevaginaciones de la región apical, que no pasan más allá de la adventicia. Como Glynn, también cree que la principal alteración para el origen de los aneurismas, consiste en una degeneración de la elástica interna.
En todas estas lesiones preaneurismáticas, la lámina elástica interna está sistemáticamente alterada, fragmentada, insuficiente, etc. Sin embargo, en dos casos de microevaginación, la elástica era normal20 como en el caso descripto por Forbus. Como vimos, casos de preservación de la elástica también fueron observados por Crompton, por lo que al menos en ellos, si es que estaban destinados a originar un aneurisma, la degeneración de la elástica podría haber sido posterior a la formación de la evaginación, como pensaba Forbus.
También Hassler y Saltzman20 estudiando casos de infundíbulos en el origen de la co post. encontraron que la lámina interna estaba afectada sólo en cinco de siete, lo mismo que la media.
Para Stehbens los aneurismas se originan por una degeneración de la pared (atrofia) producida por "fuerzas hemodinámicas", y acentuada por factores coadyuvantes como hipertensión arterial, sobrecarga hemodinámica, como se ven las alteraciones del polígono de Willis, especialmente la prevalencia de una de las A1, las M A-V, o alteraciones del colágeno esporádicas (displasia fibromuscular) o hereditarias (Marfan), coartación de aorta, etc.
Esta frase sintetiza adecuadamente su pensar: "El estudio de la formación temprana de los aneurismas revela que la media está destruida o virtualmente perdida antes de una dilatación significativa".
G. Ferguson (1972)8
Este autor dijo que en las bifurcaciones de vasos cerebrales no hay turbulencia, porque no pudo evidenciar soplos mediante el uso de un microfonocatéter, con el que los exploraba. En estudios experimentales, mostró que de haber turbulencia en una bifurcación, aparece en el tronco principal y no en el ápex y ramas de bifurcación. Esto iba en contra de las ideas de Stehbens que atribuía el daño de la pared, a turbulencias en esas zonas, así que debió cambiar "turbulencia" por "fuerzas hemodinámicas" en sus trabajos sobre fisiopatología de los aneurismas.
Ferguson cree, como Forbus, que las "fuerzas hemodinámicamente generadas por el impacto de la corriente central en el ápex, podrían, ser un factor importante, contribuyente a la degeneración de la membrana elástica interna". Dice que estas zonas soportan tres tipos de fuerza: tensión de desgarro, impulso y presión y son por lo tanto, la zona de mayor stress hemodinámico en un vaso.
El choque de la corriente produce un gradiente de velocidad mayor y por lo tanto, mayor tensión de desgarro en el ápex.
El impulso es igual al cambio de momento (desaceleración) en el instante del choque y su fuerza puede ser mayor debido al corto tiempo de impacto, que hace que esta fuerza se concentre.
La turbulencia dentro del aneurisma sería la causa del debilitamiento de la pared que permitiría su crecimiento. En 12 de 19 aneurismas que exploró con su fonocatéter en vivo, pudo encontrar soplos, lo que confirmaría su opinión.
La turbulencia produce vibraciones en la pared de los vasos, que corresponderían a la frecuencia de resonancia de los mismos. Poéticamente, los soplos escuchados fueron "de cualidad musical y de tono alto", siendo su frecuencia predominante de alrededor de 440 Hz.
Hace interesantes consideraciones sobre la ruptura, que serán discutidas en el próximo número.
DISCUSIÓN
Durante cincuenta años del siglo pasado, se desarrollaron las ideas directrices acerca del origen de los aneurismas, poniendo especial énfasis en la sobrecarga hemodinámica sobre la, de por sí débil, pared de las arterias cerebrales.
Los defectos de la media, observados por Forbus, fueron confirmados por otros autores13,17,18,19,21, aunque la importancia de los mismos para el origen de los aneurismas ha sido puesta en tela de juicio.
Todos los autores coinciden en un mismo punto, que es la degeneración de la capa elástica interna del vaso cerebral.
Nosotros habíamos visto que es a nivel de esa capa que el stress debido a la tensión de la pared del vaso es máximo, por lo que no sería descabellado esperar que en las áreas de mayor stress hemodinámico y de cizallamiento del vaso, que son los ángulos de las bifurcaciones, se desarrollen aneurismas, una vez que la elástica interna degeneró.
Las almohadillas intimales, que podrían ofrecer cierta protección, como opina Crompton, se desarrollan tardíamente en el vértice, por lo que podría haberse desencadenado el proceso de formación del aneurisma antes de que lo haga el pad, que es lo que deja entrever Stehbens que sucedería en las áreas de adelgazamiento de la pared que describió como lesiones preaneurismáticas.
Desde los primeros experimentos de laboratorio de Forbus, se caracterizaron progresivamente las fuerzas y fenómenos físicos que se ponen en juego para el desarrollo y eventual ruptura de los aneurismas.
Las paredes de los vasos están sometidas a tres fuerzas diferentes, pero que se producen simultáneamente durante el proceso circulatorio, que son: la tensión, que sigue la ley de Laplace y similares, que hemos detallado en nuestra "parte II", la presión hemodinámica, que se suma a la tensión en aquellas partes del vaso en las que las corrientes centrales chocan contra su pared, como en las bifurcaciones, y por último el stress de desgarro o cizallamiento, que es la fuerza tangencial a la pared del vaso, que se ejerce por el pasaje de la sangre, y tiende a hacer deslizar unas sobre otras, las capas de la pared. Esta fuerza es máxima a nivel del ángulo de las bifurcaciones, y quizá, asociada a la presión hemodinámica, ya que depende como ésta, de la velocidad de la sangre, sean los factores que producen el daño inicial de la pared, que se transformará luego en aneurisma.
La presión transmural (perpendicular a la pared), la hemodinámica (perpendicular, o casi, en algunas bifurcaciones) y el stress de cizallamiento (tangencial) actúan sinergísticamente componiéndose sus vectores, con una resultante oblicua22. Este vector dará el punto exacto de la pared y la dirección inicial en que las fuerzas hemodinámicas hacen desarrollar el aneurisma. Ésta es comprensiblemente tridimensional, y no puede medirse más que pobremente en una imagen plana, como una angiografía de frente o perfil, como hiciera Steiger4. Por otro lado, esto explicaría por qué la dirección de desarrollo del aneurisma es sólo aproximadamente la del flujo en el vaso madre.
Como vimos, el stress de desgarro es mayor en las ramificaciones y en las curvas. Es lógico pues pensar que cuando se suman ambos factores (bifurcación o ramificación en una curva) el desgarro sea máximo. Esto sucede por ejemplo en la mayoría de los aneurismas silvianos y en los del codo posterior de la carótida4.
El flujo pulsátil, por su lado, podría ser más dañino que el flujo continuo para los tejidos de la pared vascular, especialmente la elástica.
La hipertensión arterial podría favorecer el daño del vaso, por el aumento de la tensión en la pared. Padecimientos que producen hipertensión, como la poliquistosis renal o la coartación de aorta, actuarían a través de este mecanismo. Los notables resultados de los experimentos del grupo de Hashimoto23 en ratas y más recientemente en primates, muestran la importancia del factor hipertensión junto al desequilibrio hemodinámico, en la aparición de aneurismas cerebrales.
El juego de la tensión vs. espesor de la pared aneurismática, estaría en la base del crecimiento o ruptura de la lesión.
Al fin de la década, Sekhar y Heros20, resumieron muchos de los datos aquí expuestos, tratando de reunirlos para dar una explicación holística de la formación, crecimiento y ruptura de los aneurismas.
Sin embargo, ya en la década de los 60, German y Black, mediante el estudio de la geometría de los aneurismas, sacaron algunas conclusiones interesantes acerca de la circulación dentro de la lesión, naciendo toda una "ciencia", que se vio impulsada por el desarrollo de las técnicas endovasculares, que es la hemodinamia del aneurisma y su repercusión en la evolución de la lesión, como así también en sus implicancias terapéuticas. Estos aspectos serán objeto de revisión en la parte IV de nuestro estudio.
El significado de los aneurismas cerebrales Quizá podríamos, con los conocimientos hasta ahora acumulados, preguntarnos acerca del significado de tan enigmáticas alteraciones de las arterias cerebrales como son los aneurismas.
En 1963, Jain publicó un sintético trabajo, titulado "Mecanismo de ruptura de los aneurismas saculares intracraneanos"24.
Hace notar que, por el principio de Bernouilli, al pasar la sangre a un tubo más ancho (porción de la arteria que presenta el aneurisma), la velocidad disminuye, y la presión aumenta por lo que la presión lateral aumentaría considerablemente en la pared del aneurisma. Considera sin embargo, que no es esta presión, sino la tensión, como lo explica la ley de Laplace, la que importa a nivel del aneurisma.
Jain realizó experimentos de circulación pulsátil en un sistema artificial de un material plástico llamado Tygon, posiblemente elástico, en el que insertaba "aneurismas" hechos de látex. Estos aneurismas estaban insertos en sendos pletismógrafos25,26, para poder registrar sus pulsaciones. También podía medir presiones en diferentes puntos del sistema, lo mismo que el flujo.
Notó que las presiones del sistema oscilaban proximalmente a estos aneurismas, pero no lo hacían distalmente a los mismos.
Comprimiendo en forma importante el sistema antes del aneurisma, desaparecían las oscilaciones de presión y el aneurisma dejaba de pulsar, pero el flujo se mantenía todavía constante.
Si colocaba dos aneurismas en serie, el más proximal pulsaba, pero no lo hacía el distal. Al incrementar el flujo oscilante, se rompía el proximal, pero si aumentaba la resistencia periférica, se rompían ambos simultáneamente.
Es decir que el aneurisma parecería actuar absorbiendo parte de la energía pulsátil. Sería posible entonces, de acuerdo a estas observaciones, que un aneurisma se forme, o más bien crezca, cuando el sistema arterial cerebral ha alcanzado una rigidez tal, que le impide amortiguar suficientemente las oscilaciones de la presión arterial durante el ciclo cardíaco.
Clásicamente, se ha considerado al polígono de Willis un punto de reflexión25,26 de las ondas del pulso. Diferentemente de otros puntos de reflexión, como los constituidos por las arteriolas, se trata aquí de los grandes vasos de la base del cerebro, contra los que "chocaría" una onda mucho más enérgica que la que llegaría a las arteriolas, si se lo mira inocentemente.
Sin embargo, si es verdad como estudiamos, que alterando el flujo se disipa buena parte de la energía que la sangre circulante porta, el sistema vascular cerebral cuenta con varios niveles de resistencia antes de llegar al polígono, constituidos por las curvas fisiológicas de los vasos cerebrales en la base del cráneo.
La carótida efectúa al menos cinco marcados cambios de dirección antes de su bifurcación, y la vertebral cuatro, antes de unirse con su homóloga para formar el tronco basilar. Recordemos que el 17% de la resistencia cerebrovascular normal en un paciente normotenso se alcanza entre la aorta y el polígono de Willis27, mientras que en el resto del organismo, hasta las arteriolas, se ha consumido sólo el 11% de la energía circulatoria de la sangre28.
Aún así, por razones no determinadas, pero de las que el envejecimiento arterial no está ajeno, estos amortiguadores fisiológicos podrían no ser suficientes en determinado momento.
Hablamos también, que parte de la amortiguación de la onda de presión que habitualmente hace la pared arterial por su componente elástico, en el endocráneo está reemplazada por el contenido intracraneano, LCR y el parénquima nervioso.
Con el envejecimiento el parénquima tiende a atrofiarse, dejando la tarea de amortiguación a cargo del LCR, alojado en cisternas cada vez más amplias. Es posible que el efecto amortiguador de estos dos componentes sea diferente por la mayor viscosidad del parénquima cerebral. Es un tema que merecería estudiarse.
Por otro lado, la onda pulsátil se modifica con el envejecimiento, aumentando el pico sistólico5,29, por lo que se haría más difícil de amortiguar.
La hipertensión arterial actuaría en el mismo sentido. Como consecuencia se podría producir un aumento de la presión transmural en los vasos cerebrales por estos mecanismos, generadora de un aumento de la tensión en su pared.
Edad y aneurismas
Uno de los principales argumentos en contra de la etiología "congénita" de los aneurismas, es su aparición y ruptura predominante a partir de la cuarta pero especialmente quinta y sexta década.
Además de lo dicho en el párrafo anterior, recordemos que el envejecimiento vascular cerebral produce una disminución de la elastina, con un aumento de rigidez, compensado muchas veces por un adelgazamiento de la pared que permite no sólo una mayor distensibilidad del vaso en el sentido transversal, sino también una elongación del mismo.
Esta elongación entre puntos fijos, produce curvaturas compensadoras de los vasos (Fig. 13) y aumento del ángulo de las bifurcaciones.
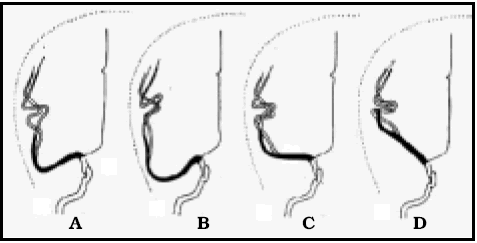
Fig. 13. Variaciones habituales de la cerebral media en la angiografía (algo modificado de 30). A) y B) son mucho más frecuentes de 20 a 70 años. C) y D) son más frecuentes de 0 a 20 años. Obsérvese la elongación de M1 con la edad.
Si es verdad, como piensa Moritake31, que el envejecimiento arterial está completo al principio de la cuarta década, comprenderemos que sea a partir de este momento, y en parte debido a las alteraciones hemodinámicas que se producen en las bifurcaciones exageradas por el envejecimiento vascular, que se desarrollan los aneurismas.
Esto, sin embargo, no va en contra de que sea a nivel de los defectos de la media que la pared cede, en el punto de mayor stress hemodinámico, y cuando el defecto es lo suficientemente grande, como opina Carmichael.
Otro aspecto del envejecimiento que no parece haberse analizado en profundidad, es el comportamiento de la media. ¿Se elonga esta capa en la misma proporción que el resto del vaso? ¿Por qué se agrandan los defectos con la edad? Evidentemente, el comportamiento biológico de esta capa todavía se conoce muy limitadamente.
Discusión general
Estancamiento de la elaboración. Después de los años 80, ha existido un estancamiento de la elaboración científica de paradigmas que expliquen el surgimiento de los aneurismas cerebrales, como ha sido expuesto más arriba, por lo que es el momento de llegar a una máxima síntesis de nuestras concepciones, para arrancar desde allí con una elaboración futura que nos acerque algo más profundamente a las causas de esta extraña patología.
Diferencias entre el hombre y los animales
Estudios comparativos de los vasos cerebrales y sobre la presencia de aneurismas en los mismos, arroja datos interesantes. Los vasos cerebrales de los mamíferos inferiores tienen una capa media más importante y defectos más pequeños en las bifurcaciones32. Por otro lado, salvo excepciones, no se reportan aneurismas en otros mamíferos salvo los primates32,33.
Crompton32 observa que proporcionalmente a su tamaño, el cráneo está mas sometido a la presión atmosférica en los mamíferos inferiores que en el hombre, debido a que los agujeros de la base son proporcionalmente mucho más pequeños en el hombre. Menciona una experiencia de Hassler, que trefinó el cráneo de un conejo joven y observó que la capa media de los vasos cerebrales se hipertrofiaba. Atribuyó esto a la falta de amortiguación del pulso arterial producida por el cráneo cerrado.
Por otro lado, los vasos cortos de cerebros pequeños estarían menos sometidos a deformación longitudinal en un ambiente líquido "poco contenedor" como en el ser humano.
Otros factores propuestos para la diferencia en la incidencia de aneurismas, han sido la diferencia de tamaño de los cerebros, que requiere en el humano de vasos más gruesos y con más demanda de flujo33.
Un factor poco explorado es la inestabilidad del polígono de Willis de primates y ser humano, que estamos investigando actualmente34. Sucintamente, la forma del polígono del hombre y algunos primates es una adquisición filogenética muy reciente, especialmente en su porción anterior, donde la arteria comunicante anterior sólo aparece en forma constante en el hombre y en forma más esporádica en el chimpancé.
Esto explicaría las asimetrías y variedades casi infinitas de la porción anterior del polígono, generando a su vez, diferencias de flujo por vasos homónimos de uno y otro lado.
Un hecho no tratado que podría tener alguna o mucha importancia, es el de la postura vertical del ser humano, que produce un descenso de la presión intracraneana, que se hace negativa en esta posición. Muchos son los mecanismos que se han desarrollados en los mamíferos para permitir alcanzar la bipedestación minimizando las alteraciones del flujo cerebral35, por lo que se podría dar un aumento de la presión transmural en esta posición respecto al decúbito en algunas personas.
Teniendo en cuenta que además, la presión arterial puede aumentar independientemente en condiciones normales, como el ejercicio, o patológicas, como en los hipertensos, la postura del ser humano podría transformarse en un factor coadyuvante de deformación de la pared arterial cerebral.
Teniendo en cuenta que además, la presión arterial puede aumentar independientemente, como en los hipertensos, la postura del ser humano puede transformarse en un factor nada despreciable de deformación de la pared arterial cerebral y de aumento de la incidencia de aneurismas respecto a otras especies.
La experiencia de Hashimoto et al23
Estos autores demostraron que se pueden producir aneurismas en vertebrados inferiores mediante dos mecanismos:
1) Generando asimetría en el polígono (ligadura de una carótida común en el cuello).
2) Produciendo un aumento de la presión transmural (generando una hipertensión arterial nefrógena o por DOCA, mas agregado de sodio a la dieta).
Es decir, acercando la situación del animal, a la del ser humano.
Claro que a diferencia con el hombre, los animalitos así tratados, presentan trastornos más diseminados debido a la severa hipertensión arterial que se les produce.
El "modelado" del polígono por ligadura ya había sido realizado por el grupo de Lazorthes36 en conejos, pero ellos no describieron generación de aneurismas, posiblemente porque no lo acompañaban con la producción de hipertensión arterial.
Es decir que ambas condiciones deberían concurrir para la génesis de aneurismas.
Aneurisma vs. aterosclerosis
Desde antiguo, como hemos visto, se atribuyó un origen aterosclerótico a estos aneurismas por parte de algunos autores. Otros como Stehbens, hablan de "proceso degenerativo", asimilándolo a un proceso parecido a la aterosclerosis.
Sin embargo, actualmente se tiende a pensar que el fenómeno de formación de la placa, se da especialmente en zonas de bajo stress de deslizamiento2,12, mientras que como vimos, los aneurismas tienden a formarse en el vértice, donde el stress de deslizamiento es máximo
Por otro lado, se reconoce desde antiguo que anomalías a nivel del polígono, favorecen la aparición de aneurismas35,36,37 en zonas sometidas a un plus de sobrecarga hemodinámica, como es el caso de los aneurismas de comunicante anterior con hipovalencia de A1 de un lado, apareciendo el aneurisma sobre la unión A1- comunicante del otro lado, ramificación sometida a sobrecarga hemodinámica extra.
Quizá la aparición de aneurismas en el vaso que alimenta a una M A-V, tenga una etiología parecida. Algunos han intentado demostrar experimentalmente que la aterosclerosis puede ser favorecida por una hiperactividad simpática39, por una disminución de la formación y extensión de las placas mediante la simpaticectomía bilateral o la administración de bloqueantes beta en animales sometidos a dieta aterogénica.
Factores aterogénicos como el stress psíquico, el fumar, e incluso la hipertensión arterial, podrían actuar al menos en parte por este mecanismo, que se efectiviza a través de un aumento de la resistencia periférica, es decir resistencia al flujo, situación aparentemente opuesta a la de la aparición de los aneurismas.
Por otro lado, el hipertono simpático tiene efectos reconocidamente contradictorios sobre la circulación cerebral40 pudiendo aumentarla o disminuirla de acuerdo a la presencia o no de determinadas condiciones, no siendo la menor el estado basal de los vasos en el momento de la estimulación simpática.
Así, podríamos suponer que tanto una como otra patología, representarían una degeneración de la pared vascular de causa hemodinámica, pero de signo opuesto (hipertrofia vs. atrofia).
Es posible que factores constitucionales jueguen también su rol20.
Necesidad de un nuevo enfoque
La importancia efectiva de cada una de estas variables es muy difícil de establecer en este momento, debido a que la mayoría de ellas, son de tipo observacional y especulativa, y muy difíciles de controlar a voluntad experimentalmente. Un progreso significativo en este terreno podría alcanzarse quizá con el diseño de modelos teóricos computacionales de los aspectos estáticos y dinámicos de la circulación cerebral, dentro de una caja cerrada, con un contenido de viscosidad variable con distribución topográfica definida, que estudien la influencia de cada uno de estos factores.
CONCLUSIÓN
El stress de cizallamiento y la presión hemodinámica, actuando sobre los defectos de la media de los ápices de bifurcaciones arteriales del polígono especialmente sometidas a sobrecarga hemodinámica, serían los factores que desencadenan la formación de un aneurisma, luego de producir una degeneración de la elástica interna a ese nivel.
Las diferentes formas de aumento de la presión transmural y el envejecimiento vascular, serían condiciones necesarias para liberar la acción efectiva de aquel grupo elemental de factores.
1. Einstein A, Infeld L. La física, aventura del pensamiento. Losada, Buenos Aires, 2002. [ Links ]
2. Kerber CW, Liepsch D. Flow dynamics for radiologists. Basic principles of fluid flow. AJNR, 1994; 15: 1065-75. [ Links ]
3. Rodríguez Maisano E, Herrera RN. Hemorreología: aspectos biofísicos. En: Altman, R (Ed): Trombosis. Tomo 1. Akadia, Buenos Aires, 2005. pp 263- 94. [ Links ]
4. Steiger, HJ. Pathophysiology of development and rupture of cerebral aneurysms. Acta Neurochir Suppli (Wien) 1990; 48: 1-57. [ Links ]
5. Introzzi AR, Passoni LI, Scandurra AG, Meschino GJ, Clara FM. Relación entre el envejecimiento y la morfología de los registros de variación del diámetro arterial: clasificación con redes neuronales artificiales. Rev Arg Cardiol 2005; 73: 352-7. [ Links ]
6. Kerber CW, Liepsch D. Flow dynamics for radiologists. II. Practical considerations in the living human. AJNR 1994; 15: 1076-86. [ Links ]
7. Niimi H, Kawano Y, Sugiyama I. Structure of blood flor through a curved vessel with an aneurysm. Biorheology 1984; 27: 603-15. [ Links ]
8. Ferguson GG. Physical factors in the initiation, growth, and rupture of human intracranial saccular aneurysms. J Neurosurg 1972; 37: 666-77. [ Links ]
9. Forbus WD. On the origin of miliary aneurysms of the superficial cerebral arteries. Bull Johns Hopkins Hosp 1930; 47: 239-84. [ Links ]
10. Stehbens WE. Focal intimal proliferation in the cerebral arteries. Am. J. Pathol., 1960; 36: 289- 295. [ Links ]
11. Stehbens WE. Discussion on vascular flow and turbulence. Neurology (Minneap) 1961; 11: 66-7. [ Links ]
12. Karino T. Microscopic study of disturbed flows in the arterial and venous systems and its implications in the localizations of vascular diseases. Int Angiol 1986; 5: 297-313. [ Links ]
13. Glynn LE. Medial defects in the circle of Willis and their relation to aneurysm formation. J Pathol Bacteriol 1940; 51: 213-22. [ Links ]
14. Walker AE, Allegre GW. The pathology and pathogenesis of cerebral aneurysms. J Neuropathol Exp Neurol 1954; 11: 128-34. [ Links ]
15. Crawford T. Some observations on the pathogenesis and natural history of intracranial aneurysms. J Neurol Neurosurg Psychiat 1959; 22: 259-66. [ Links ]
16. Carmichael R. The pathogenesis of noninflammatory cerebral aneurysms. J Path Bact 1060; 62: 1-19. [ Links ]
17. Crompton MR. The pathogenesis of cerebral aneurysms. Brain 1966; 89: 797-814. [ Links ]
18. Stehbens WE. The pathogenesis of intracranial aneurysms. En: Tindall GT, Cooper PR, Barrow DL (eds).: The practice of neurosurgery, Vol. II, pp 1941- 1952, Williams & Wilkins, Baltimore, 1996. [ Links ]
19. Stehbens, WE. Etiology of intracranial berry aneurysms. J Neurosurg 1989; 70: 823-31. [ Links ]
20. Sekhar LN, Heros RC. Origin, growth, and rupture of saccular aneurysms: a review. Neurosurgery 1981; 8: 248-60. [ Links ]
21. Hassler O. Media defects in human arteries. Angiology 1963; 14: 368-71. [ Links ]
22. Patel, DJ, Vaishnav, RN. Basic hemodynamics and its role in disease process. University Park Press, Baltimore, 1980. [ Links ]
23. Nagata, I, Handa, H, Hashimoto, N, Hazama, F. Experimentally induced cerebral aneurysms in rats: Part VI. Hypertension. Surg Neurol 1980; 14: 477- 9. [ Links ]
24. Jain, KK. Mechanism of rupture of intracranial saccular aneurysms. Surgery 1963; 54: 347-50. [ Links ]
25. Houssay, BA. Fisiología humana. El ateneo. Buenos Aires, 1957. [ Links ]
26. Starling, EH, por Lovatt Evans, Ch. Principios de fisiología humana. Aguilar, Madrid, 1955. [ Links ]
27. Kontos, HA, Wei, EP, Navari, RM, Levasseur, JE, Rosenblum, WI, Patterson, JLJr. Responses of cerebral arteries and arterioles to acute hypotension and hypertension. Am J Physiol 1978; 234: H371-H383. [ Links ]
28. Parisi, M. Temas de biofísica. Dos Santos, Buenos Aires, 1997. [ Links ]
29. Safar, M. Arterial stiffness. A simplified overview in vascular medicine. Adv Cardiol 2007; 44: 1-18. [ Links ]
30. Krayenbühl, HA, Yasargil, MG. Cerebral angiography. Butterworths, London, 1968. [ Links ]
31. Moritake, K, Handa, H, Okumura, A, Nagasawa, S, Naruo, Y, Hayashi, K, Sato, M, Hazama, F. Quantitative análisis of microstructural components of human cerebral arteries. Neurol Res 1981; 3: 67-82. [ Links ]
32. Crompton, MR. The comparative pathology of cerebral aneurysms. Brain 1966; 89: 789-96. [ Links ]
33. Stehbens, WE. Cerebral aneurysms of animals other than man. J Path Bact 1963; 86: 161-8. [ Links ]
34. Fontana, H, Requejo F, Belziti H, Recchia M. Algunos aspectos de la parte anterior del Polígono de Willis (En preparación). [ Links ]
35. Padget, DH. The circle of Willis. Its embryology and anatomy. En: Intracranial aneurysms by W. E. Dandy. Comstock Publishing Co. Inc. Cornell University, Ithaca, 1944. [ Links ]
36. Riggs, HE, Rupp, Ch. Variation in form of circle of willis. Arch Neurol 1963; 8: 8-14. [ Links ]
37. Stehbens, WE. Aneurysms and anatomical variation of cerebral arteries. Arch Pathol 1963; 75: 45-64. [ Links ]
38. Lazorthes G, Gouazé A. Santini JJ, Lazorthes Y, Lafont J. Le modelage du polygone de Willis. Rôle descompressions de voies artérielles d'apport dans le muvements de la colonne cervicale et de l'extrémité céphalic. Neuro-chirurgie 1971; 17: 361-78. [ Links ]
39. Lichtor, T, Davis, HR, Johns, L, Vesselinovitch, D, Wissler, RW, Mullan, S. The sympathetic nervous system and atherosclerosis. J Neurosurg 1987; 67: 906-14. [ Links ]
40. Heistad DD, Kontos HA. Cerebral circulation. Handbook of Physiology, "The cradiovascular system" Chap 5, 137-82, 1983 [ Links ]














