Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de neurocirugía
versión On-line ISSN 1850-1532
Rev. argent. neurocir. v.22 n.2 Ciudad Autónoma de Buenos Aires abr./jun. 2008
La circulación cerebral en condiciones normales y patológicas V. El aneurisma, aspectos dinámicos
Horacio Fontana, Héctor Belziti, Sebastián Buratti
Servicio de Neurocirugía. Hospital Central de San Isidro, San Isidro, Pcia. de Buenos Aires.
Correspondencia: hojofontana@yahoo.com.ar
Recibido: abril 2008;
aceptado: mayo 2008
RESUMEN
Hay cuatro tipos de modelo de aneurisma:1) "in vitro". Permiten estudiar cualitativa y cuantitativamente casos especiales de circulación compleja. 2) "in vivo". Con la creación de distintos modelos en animales de experimentación han permitido profundizar las características de la circulación por los aneurismas y también hacer conjeturas acerca de su formación. 3) Réplicas "in vitro" de aneurismas cerebrales pos mortem, realizadas en material elástico, donde se pueden probar las características de la circulación en aneurismas morfológicamente similares a los humanos. 4) Simulación por computación, de la circulación en réplicas computarizadas 3D de aneurismas de pacientes, denominada dinámica de flujo computarizada. Es la más moderna y ha sido posible por el adelanto en la capacidad de las computadoras y la aparición de nuevos programas, en los últimos cinco años.
Como la relación del aneurisma con el vaso portador es importante en la determinación de su circulación, los aneurismas se han clasificado en: 1) laterales, 2) en el origen de una rama lateral, 3) de bifurcación en el eje del vaso portador; 4) de bifurcación angulados respecto al eje del vaso portador.
En términos simplificados, la circulación es la misma en todos los tipos de aneurisma. Hay una zona de entrada en la parte distal del cuello, habitualmente estrecha, por lo que el ingreso se hace en forma de un chorro que choca contra la pared distal del aneurisma en mayor o menor extensión (zona de impacto), de acuerdo a la relación de éste con el vaso portador, y en los de bifurcación, de acuerdo a la asimetría de la estructura geométrica del sistema, sobre todo para los que están en el eje del vaso portador. El mayor diámetro del cuello aumenta el flujo y lo hace más parecido al descripto. Los cuellos estrechos enlentecen la circulación dentro del saco y la hacen más atípica.
La ruptura de los aneurismas podría atribuirse a la tensión dentro del saco ya sea dinámica en los de alto flujo (cuello amplio, geometría favorable) o estática en los de bajo flujo (cuello estrecho, geometría desfavorable). Como es de esperar, cada modelo tiene sus ventajas y desventajas, y si bien se ha progresado mucho, los detalles de la circulación intra aneurismática y en el vaso portador, todavía se mantienen esquivos a la investigación.
Palabras clave: Aneurisma cerebral; Flujo; Modelos.
SUMMARY
There are four types of aneurysm model: 1) "in vitro". They allow to study qualy and cuantitatively cases of complex circulation. 2) "in vivo". The creation of different models in experimental animals allowed a better knowledge of the circulatory features of aneurysms and to hypothesize about their origin. 3) Post mortem "in vitro" replicas of real human aneurysms on elastic material, allow to analyze the circulation under different conditions in "aneurysms" morphologically similar to human's. 4) Computerized simulation of circulation in virtual 3D replicas of human aneurysms, obtained from different image studies. It is the last developement in the field, and has been achieved through recent advances in the performance of computers and new software.
In respect to the relationship between the sack and parent vessels, aneurysms had been classified as: 1) lateral, 2) at the origin of a colateral vessel, 3) terminal in the same axis of the parent vessel, 4) terminal forming angle with the parent vessel. In simplified terms, the flow remains the same for all types of aneurysm. The inflow enters as a jet at the distal portion of the neck and strikes the distal wall of the sack in variable extension (impact zone), after its relation with the parent vessel and, in the terminal type, after the geometric assimetry of the system, specially for those in the axis of the parent vessel. Major diameter of the neck increase the flow and makes it more similar to the basic description. Narrowness of the neck make the flow sluggish and atypical in the sack.
The rupture of the aneurysm could be ascribed to the tensión in the wall, be it dynamic in the high flow ones (broad neck, favorable geometry) or static, in those of low flow (narrow neck, unfavorable geometry).
As it was to be assumed, each model has advantages and desadvantages and even if the advancemets are remarkable, details of the flow in the sackc as well as the parent vessels remain inaccessible.
Key words: Cerebral aneurysms; Flow; Models.
En la parte IV1 hemos sacado algunas conclusiones prácticas interesantes acerca de los aspectos estáticos del aneurisma, que nos han llevado un poco más lejos del tamaño, para poder caracterizarlo. Habíamos notado, sin embargo, que el solo aspecto de la lesión no es suficiente para este menester, y que las relaciones con el vaso portador y sus ramas deben ser tenidos también en cuenta. Estas relaciones hacen a la circulación de la sangre dentro del saco aneurismático, que termina siendo el aspecto más complejo e investigado actualmente, de la fisiopatología de los aneurismas. Vale la pena pues, intentar asomarnos a este fascinante campo, para tratar de obtener más información, que nos facilite las cosas a la hora de la toma de decisión acerca de un aneurisma no roto.
Modelos de aneurisma
El estudio de la circulación en los aneurismas ha resultado de difícil acceso, y se han ideado una serie de modelos experimentales muy diferentes para realizarlo:
1) Modelos "in vitro" desde aquellos originales que hemos comentado de Forbus2 en que estudiaba la presión en distintos tipos de bifurcación, pasando por modelos aneurismáticos hechos en vidrio o materiales elásticos en los que se hacen circular fluidos de características newtonianas o no newtonianas, utilizando algún método para visualizar el flujo. Estos métodos de visualización pueden ser cualitativos, como cuando se agregan colorantes isobáricos a la corriente circulante, lo que permite estudiar una parte de las corrientes de deslizamiento, o cuando se agregan partículas o pequeñas burbujas a la solución en cuyo caso se tiene una visualización global de la misma. Con el anemómetro de láser Doppler, se pueden realizar determinaciones muy exactas de la velocidad en estos modelos. La condición es que sean perfectamente transparentes a la luz3.
Muchos autores han trabajado en este desarrollo, estudiando distintos aspectos. Uno, realmente interesante por la serie de importantes conclusiones que sugiere, es el Jain4, ya mencionado.
2) Modelos "in vivo" desde las notables contribuciones de German y Black5,6 que generaron el desarrollo de nuevos tipos de modelos experimentales con los que se ha obtenido valiosa información como los de Roach, de Strother et al7, el grupo de Hashimoto8 y más recientemente Ujiie et al9.
3) Réplicas "in vitro". En la década pasada, Kerber et al10,11 presentaron una serie de trabajos en que producían réplicas en Silastic transparente de aneurismas humanos, post mortem, con un método algo engorroso pero que les permitió tener las primeras experiencias de circulación por aneurismas con un formato igual al de los humanos, al someterlos a la prueba circulatoria con flujo constante o pulsado, de fluidos no newtonianos de viscosidad similar a la sangre. Modificando las condiciones hemodinámicas de esos sistemas, pudieron obtener algunos resultados sorprendentes.
4) Simulación por computación. Esta es la más moderna forma de acercarnos al estudio de la circulación en los aneurismas. Comenzó tímidamente en los 80 simulando la circulación en aneurismas laterales o terminales12,13, en dos dimensiones, porque las posibilidades de la computación no permitían otra cosa. A partir del comienzo de siglo se han perfeccionado técnicas para la reconstrucción de los vasos en una red tridimensional bastante exacta, que permite luego los cálculos de flujo mediante la dinámica computacional de flujo.
Estos cálculos se realizan mediante las ecuaciones de Navier Stokes12-14, que describen el movimiento de un fluido aplicando la segunda ley de Newton. La dirección y velocidad del movimiento de una cantidad infinitesimal (de allí que sean ecuaciones diferenciales) de un fluído, su momento, será la resultante de las diferentes fuerzas a las que está sometida: gradientes de presión, fuerzas viscosas, rozamiento, etc. (Magnitudes vectoriales).
Cuando estas ecuaciones son resueltas numéricamente12- 14 (elemento finito) brindan soluciones bastante aproximadas de las tendencias del movimiento y especialmente del vector velocidad en cada punto. La información obtenida sobre un sector del volumen circulante, se denomina campo de flujo o de velocidad. Se asume que partículas teóricas instaladas en estos campos (vecinas), tenderán a moverse con similares características15.
En una sección transversal de un vaso, encontraremos pues, múltiples campos de flujo, variables en el tiempo, sobre todo en el caso de flujo pulsado. Cuanto más detalle en la reconstrucción geométrica del volumen vascular, mayor información tendremos que procesar sobre el flujo, más completos los resultados, pero más pesado el trabajo de computación16.
El volumen vascular es reconstruido a partir de datos bi o tridimensionales de estudios por imagen estándar, del paciente. Estos datos se preprocesan en un paso previo que se llama segmentación, que construye cortes transversales de muy pequeño espesor a partir de las imágenes del paciente, que se integran luego en una imagen volumétrica 3D en forma de una red de tetraedros regulares. En zonas de geometría sencilla, la red puede ser más laxa. Cuando la geometría es compleja, la red es más cerrada16,18 (Fig. 1).
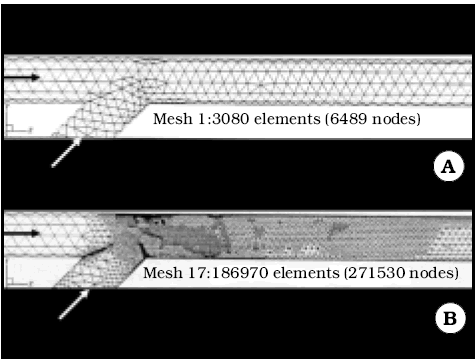
Fig. 1. Ejemplo de desarrollo de una red tridimensional para los cálculos de dinámica computacional de flujo en una anastomosis término lateral en 45o (tomado de 18). A. Red original 3D de tetraedros regulares. B. Red completamente desarrollada. Obsérvese el aumento notable de elementos en zonas donde el flujo es más complejo (anastomosis) y la permanencia de la simplicidad en zonas de flujo laminar (izquierda del dibujo). Las flechas indican la dirección de la corriente.
Como los puntos donde se mide el campo de flujo son los nodos, (vértices en los que coinciden varios tetraedros), la computación del flujo es más costosa en cálculos y tiempo en esas regiones. Un compromiso entre exactitud de reconstrucción y masa de datos a procesar, debe ser pues, alcanzado.
Como el volumen vascular a reconstruir es limitado a una región de interés determinada por el operador, se deben adjudicar valores iniciales de velocidad, presión, viscosidad, peso específico, frecuencia y forma de la onda del pulso, etc., para ser aplicados en la sección de entrada a la red tridimensional, así como valores de salida. Lo ideal sería obtener estos parámetros del paciente, pero lamentablemente, no se cuenta todavía con métodos que nos permitan adquirir siquiera algunos de estos valores de manera sencilla, así que se asumen valores generales, que se aplican sistemáticamente tanto a la entrada como a la salida. Estos parámetros pueden también ser modificados para comprobar cómo varían cuali y cuantitativamente, las condiciones del flujo en el sistema. Otra suposición es que el fluido circulante es newtoniano, que el sistema es rígido y que el flujo de entrada es laminar y de perfil parabólico.
Influencia de las relaciones con el vaso portador my sus ramas
De acuerdo a su forma de inserción en el vaso madre, podemos considerar cuatro tipos de aneurisma3.
1. Aneurisma lateral.
2. Aneurisma de rama colateral
3. Aneurisma terminal en el eje con el vaso madre.
4. Aneurisma terminal en ángulo respecto al eje del vaso madre (Fig 2).
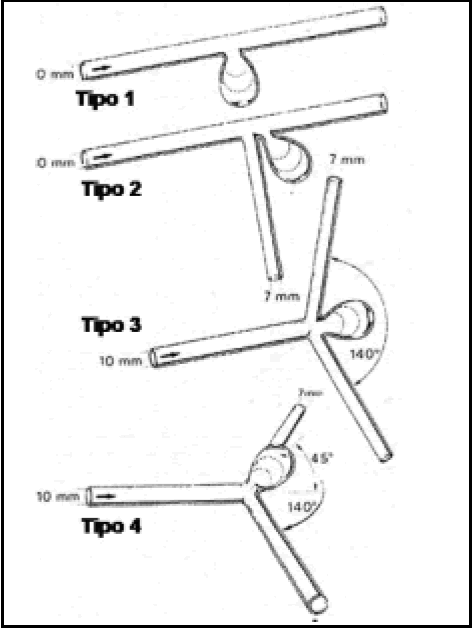
Fig. 2. Tipos de aneurisma experimental "in vitro" según Steiger (3) levemente modificado. Tipo 1: aneurisma lateral. Tipo 2: aneurisma en una ramificación. Tipo 3: Aneurisma de bifurcación siguiendo el eje del vaso portador. Tipo 4: aneurisma de bifurcación que forma un ángulo de 45% en relación al eje del vaso portador.
Aneurisma lateral
Los primeros experimentos con este tipo de aneurisma son los de German y Black19, 20. Estos autores obtuvieron fotografías a una velocidad de 60 imágenes por segundo, a partir de inyecciones angiográficas realizadas en sus aneurismas experimentales, y observaron que "la opacificación en el aneurisma aparecía en la forma de un delgado chorro mientras el contraste alcanzaba la altura del cuello del aneurisma. La opacificación inicial pasaba rápidamente a lo largo de la pared distal del saco, cruzaba el fondo, y volvía por la pared proximal. Esto era seguido por varios remolinos semejantes periféricos, sin que se opacificara todavía la porción central.
Finalmente la opacificación se concentraba en el fondo y desde allí se extendía hacia abajo abarcando todo el aneurisma. La opacificación se mantenía luego que el contraste desapareciera del vaso principal, esfumándose gradualmente. En varias ocasiones parecía haber leves cambios en la forma y tamaño del aneurisma." Midieron la velocidad inicial del chorro entrante y obtuvieron la cifra de 150 cm/seg. Explican la permanencia del contraste por el retardo en el intercambio en el centro y por el "flujo cruzado" a nivel del cuello20.
Observaciones similares realizaron Steiger et al "in vitro" en experimentos con aneurismas laterales con diámetro del cuello similar al del vaso principal3. Si el cuello era romo, la entrada era distal pero el flujo se dirigía en seguida hacia el centro, volviendo al vaso portador por el resto de las paredes. La circulación intraaneurismática era lenta. Si el borde del cuello era más cortante, el comportamiento del flujo era como el descripto por German y Black, aunque la circulación era lenta si el flujo era constante. Con flujo pulsado, la circulación por el fondo aumentaba.
En 1995, Burleson et al14 realizaron un estudio de simulación de flujo por computación, en un modelo de aneurisma lateral en 2D. Diseñaron tres tipos de aneurisma, uno hemisférico, otro esférico, y otro elipsoideo (piriforme) y observaron que el flujo calculado no difería cualitativamente, de las primitivas observaciones de German y Black. Incluso, la disminución del diámetro del cuello, producía una disminución del flujo, como ya habían observado estos autores. Pudieron sin embargo, realizar evaluaciones cuantitativas, y determinaron que la máxima tensión de desgarro estaba a nivel de la pared distal del cuello, y que esta zona se comportaba como un verdadero divisor del flujo, con la máxima presión en el punto de estancamiento. Aumentando la velocidad de la sangre en el vaso madre (el número de Reynolds) la presión y el desgarro disminuían, especialmente en los aneurismas piriformes de cuello pequeño Fig. 3).

Fig. 3. Reproducción de la simulación por computación 2D de un aneurisma lateral según (XXX). Las flechas están concebidas como vectores de velocidad. El tamaño es proporcional a la velocidad. Obsérvese la zona de mayor stress de desgarro en la pared distal, próxima al cuello (flecha).
Concluyeron que el crecimiento del aneurisma se realizaba a expensas de la parte distal del cuello, como en el estudio del grupo de Moret comentado en nuestra parte IV, pero que también la ruptura se iniciaba en esta zona, y luego se extendía al fondo por disección de la pared14. Esto está en clara contradicción con los hallazgos no sólo anatomopatológicos sino con la experiencia quirúrgica de que la zona más segura del aneurisma durante la disección es el cuello. Algunos aneurismas, sin embargo, se rompen en el cuello, según diferentes estudios pos mortem21, 22. ¿Por qué no lo vemos en la operación? Es posible que la hemorragia en este punto sea incoercible y cause rápidamente la muerte. En un estudio por simulación se observó que si el vaso portador es curvo en vez de rectilíneo y el aneurisma se encuentra en la curvatura mayor, las características cualitativas de la circulación descriptas arriba se acentúan, a medida que se acentúa la curvatura23 (Fig. 4).

Fig. 4. Influencia de la curvatura del vaso portador en la circulación aneurismática (23). A. Curva más amplia. La zona de impacto es menor. B. Curva más cerrada, la zona de impacto es mayor. También aumenta la velocidad circulatoria. La disminución de diámetro del cuello actúa en forma inversa.
Cuantitativamente, también aumenta la tensión de desgarro, lo mismo que el área de la pared distal sometida a ella. Esta zona se ha denominado zona de impacto23 siguiendo posiblemente el razonamiento de German y Black que ven como un chorro (jet) la entrada de la sangre por la parte distal del cuello19. Algunos suponen que esto sería la causa del crecimiento y ruptura del aneurisma, por efecto del stress de la íntima, que generaría sustancias vasodilatadoras para aliviar la situación. Lo que no se menciona es que la pared aneurismática no tiene contracción tónica porque no tiene músculo con qué responder al estímulo vasodilatador. Es más probable que, si este mecanismo tuviera alguna influencia, lo haga por remodelamiento de la pared a través del cambio de su composición bioquímica23.
Podemos comprobar aquí cómo la teoría de Moret del origen y crecimiento de los aneurismas, criticada en el capítulo anterior por sus múltiples inconsistencias, debidamente corregida, aparece como más verosímil. Aneurismas de este tipo parecen ser más frecuentes en la región periclinoidea de la carótida. Quizá no en zonas de defectos de la media, ya que el vaso da pocas ramas en este tramo y son muy pequeñas, sino en hipoplasias de la pared como las descriptas por Carmichael24, en una porción del vaso de complejo origen embriológico multisegmentario, como viéramos25.
Cuando nos enfrentamos a formaciones "blister like" de esta zona, característicamente frágiles, deberíamos recordar que posiblemente la porción más débil de la pared, sea su cara distal.
Aneurisma en una ramificación colateral
Steiger3 observó que la circulación de los aneurismas ubicados en el origen de una rama colateral, era parecida a la de los aneurismas laterales. Si el volumen circulatorio de la colateral implicaba menos del 10% del del vaso originario, el flujo en el aneurisma podía asimilarse al de la variedad lateral.
Cuando el flujo en la rama era del 30%, la circulación en el aneurisma era más activa, por la aparición de una zona de separación en la cara opuesta al cuello en el vaso madre y un desplazamiento de la corriente hacia el orificio del saco (Fig. 5).
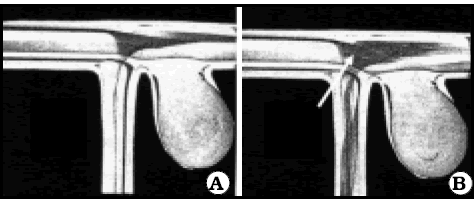
Fig. 5. Modelo "in vitro" de aneurisma en el origen de una rama colateral, mostrando la opacificación de algunas corrientes de flujo, tomado de Steiger (3). A. Rama colateral con escaso flujo. Produce una leve separación de las corrientes en la pared opuesta del vaso portador. B. El flujo de la rama colateral representa el 30% del del vaso portador. La desviación de las corrientes de flujo hacia la rama es mayor y terminan apuntando al orificio del cuello del aneurisma (flecha), factor que aumenta la circulación por éste.
Esta zona de separación es debida a la emergencia de la rama y no al aneurisma, porque se ve en casos sin aneurisma3.
Con flujo pulsante, la circulación era más activa en sístole.
Strother et al 7 en un interesante estudio experimental en perros observaron que el flujo en los aneurismas que ellos llamaron "de bifurcación" (Fig. 6), el relleno era mucho mejor y más rápido que en los aneurismas laterales.

Fig. 6. Esquemas tomados de Strother et al (7) describiendo su modelo experimental "in vivo" en perros. A. Modelo que ellos llaman "de bifurcación". Nótese que el flujo por la rama lateral es el 50% del del vaso portador. B. Su modelo "terminal".
Cuando lo estudiaron con Doppler color, vieron que el ingreso de flujo se hac ía por aquella parte del cuello más cercana al eje del vaso portador ("tronco" en su nomenclatura), es decir en la parte distal y que salía por la parte más cercana al vaso colateral. Al inyectar contraste dentro mismo del aneurisma, se opacificaba solamente el ramo colateral, confirmando su observación previa.
Aneurismas terminales
Steiger diseñó dos modelos de aneurisma terminal. Uno en que el aneurisma continúa exactamente la dirección del vaso portador, y otro cuyo eje forma un ángulo con el plano del vaso portador y sus ramas (ver Fig. 7).

Fig. 7 : modelo de aneurisma terminal en vidrio de Kerber et al (26) Increíblemente, el colorante inyectado en las corrientes centrales no penetra en el aneurisma.
En el primer diseño pudo observar que, sorpresivamente, la circulación dentro del aneurisma era escasa y fluctuante, y dependía de que existiera una asimetría de flujo de salida entre las ramas de bifurcación. La velocidad media en un modelo de aneurisma con un diámetro 1,5 veces el del vaso madre, oscilaba entre el 3 y 15% respecto a la de éste, y el flujo dentro del aneurisma era prácticamente caótico.
Esto coincide con una observaci ón similar realizada por Kerber y Hailman26 en un aneurisma "in vitro", en el que la corriente central opacificada con un colorante, no entraba en el aneurisma. Por este motivo, concluyeron que su modelo no era válido.
Construyeron entonces otro modelo experimental, produciendo una asimetr ía en la colocación del aneurisma, que estaba desplazado levemente hacia una de las ramas, obteniendo relleno y turbulencia dentro del "saco".
As í que para que haya circulación en un aneurisma de este tipo, debe haber asimetría de ubicación del orificio del cuello o asimetría de flujo en los vasos de salida. En este último caso, el ingreso del flujo se hace por la parte del cuello cercana a la rama dominante y la salida, cercana a la de menor flujo. Esta observación parece contradictoria con las realizadas por Strother et al7, que encontraron que el flujo de entrada ocurría cercano al eje del vaso madre y salía por el otro extremo del ostium, para pasar a la rama más cercana a esta salida. Estos autores encontraron que el flujo en estos aneurismas como en los anteriores, era rápido y rotatorio.
En un trabajo sobre aneurismas experimentales "in vivo" realizado hace unos años, tuvimos la oportunidad de observar que en uno de nuestros casos, el aneurisma se rellenaba poco angiográficamente, pero estaba permeable. Una vez llegados a la cavidad aneurismática, la inyección aquí rellenó el saco y ambos vasos de salida en forma levemente asimétrica27 (Fig. 8).
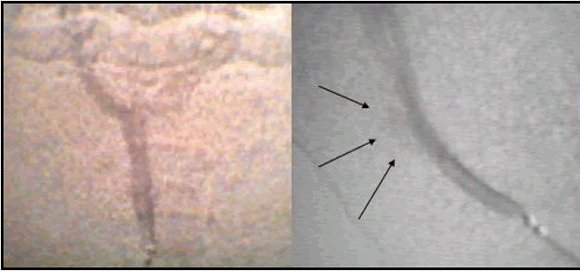
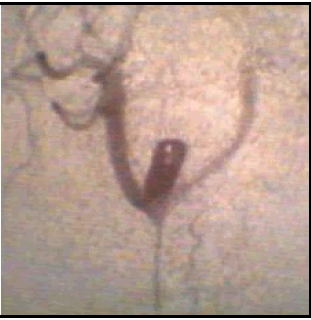
Fig. 8. Aneurisma experimental en una bifurcación artificial creada por anastomosis lateroterminal de las carótidas en el cuello de un conejo (27). Con la inyección angiográfica, tanto de frente como de perfil, el saco aneurismático se rellena poco. Con el catéter dentro del aneurisma el relleno de éste y de las ramas es excelente, aunque se observa una cierta asimetría.
Agreguemos que una estenosis del cuello, produce una disminución de la velocidad circulatoria dentro del aneurisma, lo mismo que una simetría de los vasos de salida3.
En aneurismas terminales con un ángulo respecto al vaso portador, el flujo es más simple, entrando por aquella porción que prolonga el eje del tronco principal y saliendo por el lado opuesto, mostrando una disposición cuasi laminar y las velocidades máximas oscilan entre 50 y 80% de las del vaso madre3. En estos aneurismas, el flujo no parece depender de una asimetría entre los vasos de salida3.
Un modelo experimental "in vivo" de este tipo de aneurismas fue desarrollado por Ujiie et al en 19999. Estos autores implantaban un fondo de saco venoso en la bifurcación aórtica de conejos y, con un despliegue tecnológico notable, realizaron mediciones de velocidad de flujo en diferentes sitios de la pared del aneurisma, como así también en la aorta y sus ramas, además del monitoreo de TA, pulso y otros parámetros. Sus aneurismas eran pequeños, hasta 3 mm, medianos, hasta 5 mm y grandes, más de 5 mm Encontraron que los pequeños se llenaban en sístole y se vaciaban en diástole (como la pared de la arteria), los medianos tenían un flujo como el descripto por Steiger, entrando por la parte posterior y distal del cuello y dispersándose por las paredes del aneurisma, salía por la parte anterior, en un área más extensa que la de entrada (Fig. 9). La velocidad a nivel del cuello, medida con ecografía Doppler era casi nula, por la característica del eco Doppler de promediar las velocidades en determinada sección del vaso.

Fig. 9. Esquemas de aneurismas experimentales de la bifurcación aórtica del conejo según Ujiie et al. A. Aneurisma mediano. B. Aneurisma grande (>5 mm) El tipo circulatorio básico es el mismo, pero en los grandes, una separación de las corrientes de la pared antes de llegar al fondo, genera vórtices secundarios contrarrotatorios y lentos, que producirían daño de la pared. La dificultad de salida, aumenta la presión dentro del saco.
Los aneurismas m ás grandes, mostraban una diferencia. Si bien la entrada del flujo era similar a los medianos, el chorro chocaba contra la pared posterior del aneurisma, y se dirigía más bien hacia el centro que dispersarse por las paredes. Así, a nivel del fondo, aparecía una zona de separación del flujo con el desarrollo de remolinos y un número de Reynolds posiblemente bajo con baja tensión de desgarro (Fig. XX). A este fenómeno, atribuyeron daño de la pared, que podía contribuir a su ruptura. Cuando el flujo era como el de los medianos, o incluso en estos, bastaba con disminuir el diámetro del cuello, para que se transformara en el flujo dañino de los grandes.
Por esto atribuyeron una importancia trascendental al tamaño del cuello y presentaron a la comunidad científica su "relación de aspecto", como etiológicamente significativa en la ruptura aneurismática. Una relación de aspecto menor de 1,3 no tendría riesgo de ruptura, mientras que aí lo tendría una mayor de 1,6.
Estos aneurismas no eran puestos en la carina de la arteria, siguiendo la direcci ón del flujo, sino en su cara anterior.
Nosotros hemos trabajado tambi én en este modelo27, y vimos que los aneurismas en el eje del vaso, producidos resecando la carina, no se rellenaban adecuadamente, mientras que sí lo hacían los de la cara anterior similares a los de Ujiie et al (Fig. 10).
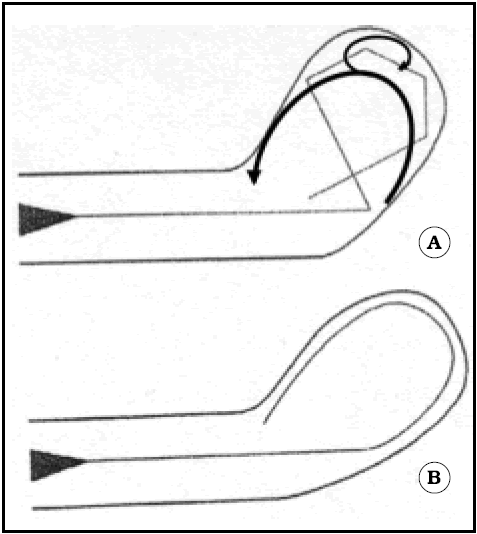
Fig. 10. Esquemas tomados de Steiger, en donde muestra la notable diferencia de flujo que puede presentarse en un aneurisma terminal al modificar su ángulo respecto del vaso portador. A. Ángulo de 45o, el flujo es el "normal". B. Ángulo cercano a los 90o, el flujo es desviado hacia el centro y su dirección se invierte en las paredes. Hemos agregado sobre este esquema, la interpretación de Ujiie, según nuestro parecer.
Estos aneurismas, producidos también mediante la resección de la parte anterior del divisor de flujo (carina), se proyectan francamente hacia delante, por lo que el ángulo que forman con el eje de la aorta, es cercano a 90o. El flujo podría ser reflejado hacia el centro por este motivo, como puede verse en el esquema de Steiger3 que reproducimos modificado (Fig. 11).
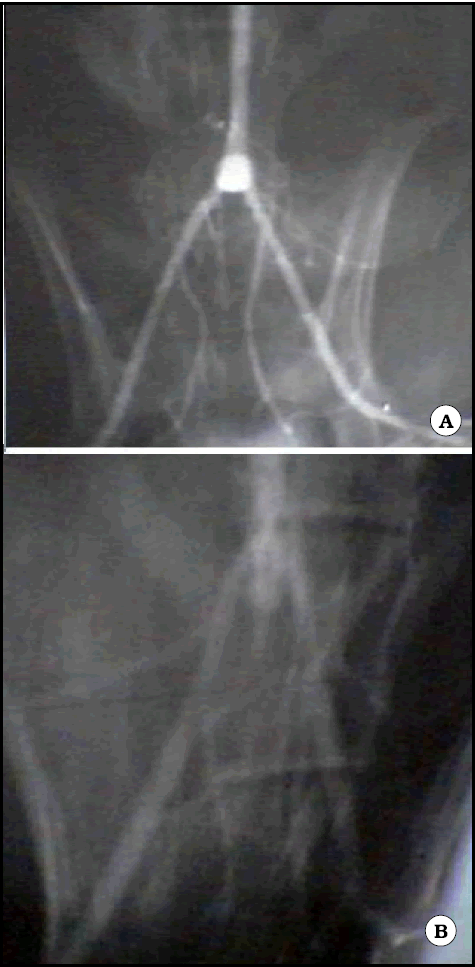
Fig. 11. Angiografías de aneurismas de la bifurcación aórtica producidos por nosotros (27). A. Aneurisma en el eje del vaso portador, producido resecando el divisor de flujo y suturando un fondo de saco venoso. Relleno pobre del aneurisma (conejo). B. Aneurisma suturando el saco venoso en la cara anterior de la bifurcación, luego de resecar el divisor de flujo en esa zona. El aneurisma se rellena bien y parece dirigirse perpendicularmente a la página.
El afinamiento del cuello mediante un clipado parcial, no modifica básicamente el esquema de flujo, sino dificultando la salida y enlenteciéndolo. Lo que hacemos al colocar el saco en esta posición y tan cercano a la perpendicular, es crear un aneurisma "cuasi lateral" de borde romo del cuello, que lógicamente, tendrá un flujo más lento.
La medición de la relación cuello-fondo después de la ruptura aneurismática puede dar un sesgo nada despreciable a estos estudios. Como sabemos, los sacos aneurismáticos pueden verse más grandes unos días después de rotos1.
Modelos personalizados. La dinámica computacional de flujo permite desde 200328, la realización de una "réplica" 3D simulada de la geometría del aneurisma del paciente y sus características circulatorias, como explicamos antes. Lo que inicialmente llevaba días de trabajo de computación, se ha reducido a algunas horas, mediante la modificación del método de segmentación y el aumento de la capacidad de computadoras y programas.
Hassan et al, en 2005, presentaron una clasificaci ón de los aneurismas clínicos estudiados por este método, en cuatro clases29 (Fig. 12): aneurisma lateral: el diámetro del vaso que sigue es de al menos el 90% del flujo del originario, aneurisma lateral con vaso(s) de ramificación, el diámetro del vaso que sigue es de al menos el 90% del vaso originario y aneurismas de pared terminal, de los que reconoce tres tipos: "manos arriba", "manos a 90°" y "manos hacia abajo".

Fig. 12. Clasificación de los aneurismas cerebrales según Hassan et al (29) para su estudio mediante dinámica de flujo computacional.
Entre los primeros cuenta aneurismas de la cava carot ídea o de la cara dorsal de C2, aneurismas silvianos M1-M2, aneurismas del codo posterior de la carótida. Entre los segundos cuenta aneurismas de la cerebral anterior, de la comunicante posterior, de la cerebral media. Ejemplos de aneurismas terminales encuentra entre los del tope de la basilar y los de cerebral media. En todos los casos encuentra un área de tensión de desgarro en la zona de influjo, donde puede formarse una loculación, que es el lugar de ruptura comprobado quirúrgica o anatomopatológicamente.
Los factores de riesgo para el crecimiento y la ruptura son: el tamaño del cuello, la posición del aneurisma respecto al vaso madre, la presencia de un vaso colateral y en los terminales, la disposición de las ramas de bifurcación.
Tamaño del cuello: nos da el flujo a través del aneurisma. Reconoce pues dos tipos: de alto y de bajo flujo. En los de alto flujo, las corrientes circulatorias entran más libremente al saco y se halla siempre un área mayor de tensión de desgarro. Los de cuello pequeño, por otro lado, presentan una presión mayor a nivel de la pared, por tener una dificultad de drenaje del aneurisma. Cuando se encuentra en un aneurisma lateral, el cuello pequeño hace que el bajo flujo de la lesión predisponga a la trombosis, engrosamiento de la pared y crecimiento por estos mecanismos.
Los aneurismas cuyo eje forman un ángulo agudo con respecto al eje del vaso portador, tienen más flujo, un área de tensión de desgarro mayor y son difíciles de tratar por vía endovascular.
La presencia de un vaso colateral o m ás, produce un aumento del flujo en el aneurisma, aumentando el área de tensión de desgarro del influjo.
La disposici ón "manos arriba" en los aneurismas terminales es la que más aumenta el flujo dentro del saco, aumentando la tensión de desgarro y la posibilidad de ruptura.
DISCUSIÓN
La circulación dentro del aneurisma
Según venimos de ver, podemos decir que la circulación intraaneurismática es, en esencia, para todos los casos, la misma: la entrada de la sangre circulante se produce por una zona relativamente pequeña de la porción distal de área total del cuello, de tal forma que la corriente ingresante, tiene forma de chorro. Este chorro choca con la pared distal del saco, denominada zona de impacto, para ser luego distribuido por las paredes, hacia la zona de salida, que es una parte más grande de la porción proximal del área del cuello. Es posible, sin embargo, que el flujo real incluso en aneurismas laterales, no sea tan simple como el descripto30.
El tipo de aneurisma influye significativamente en la intensidad de la circulación a través del mismo. Los aneurismas laterales son los que tienen una dinámica más perezosa. Para que la circulación sea suficiente como para que el saco no se trombose, el cuello debe ser amplio, como ya lo hicieron notar German y Black.
En el caso de la presencia de un aneurisma en una ramificación del vaso principal, la circulación será más activa y la velocidad mayor, cuanto mayor sea el flujo por el vaso colateral. En este caso, la separación del flujo del lado contrario a la emergencia del vaso, hace que más corrientes de deslizamiento apunten hacia el cuello del aneurisma y penetren en él.
En los aneurismas terminales, influye mucho la presencia de una asimetría, que puede ser de dos tipos: lateralización del orificio del cuello hacia una de las ramas, o asimetría del volumen de salida por éstas. Cualquiera de los dos, produce un aumento notable del flujo a través del saco.
Otros factores que influyen en el flujo aneurismático son el tamaño del cuello, como vimos, y la forma. Cuellos de borde cortante actúan como divisores de flujo y la circulación intra aneurismática es más "normal" y activa, acercándose a la descripción dada inicialmente. Los cuellos romos, o más largos pueden alterar notablemente el flujo, haciéndolo más caótico.
Otros factores
Posición del aneurisma
Respecto al vaso principal. Hemos visto que aneurismas laterales incrementan mucho su circulación cuando el eje del saco es menor de 90o respecto del vaso madre, tienen un influjo muy intenso, y son difíciles de tratar por vía endovascular.
Aneurismas de la línea media
Observaciones notables del grupo de Kerber10, 11 en una réplica de aneurisma basilar y otra de aneurisma de comunicante anterior realizadas pos mortem en Silastic transparente, mostraron que en el caso del aneurisma basilar, una asimetría de las vertebrales, a saber, la oclusión de la arteria homolateral al lado del aneurisma, producía una anulación del flujo intraaneurismático. En el caso del comunicante anterior, una simetría absoluta de ambas circulaciones carotídeas, anulaba el flujo por el aneurisma.
Aunque anecdóticas, estas observaciones dejan mucho para elaborar en el tema asimetrías del polígono y origen, mantenimiento, crecimiento y por qué no ruptura del aneurisma. Sobre todo, si desarrollamos la idea de que el polígono no es una estructura estable y definitiva, sino que sufre remodelamientos, quizá varios, durante la vida, y la circulación a través de él puede tener asimetrías transitorias diurnas por variaciones en la posición de la cabeza, por ejemplo, como ha sido descripto31.
Tensión de desgarro vs. Presión intra aneurismática.
¿Por qué se rompe un aneurisma? Según los estudios dinámicos actuales, la tensión de cizallamiento o desgarro tendría gran importancia. Pareciera que los aneurismas se rompen en la zona de mayor tensión de cizallamiento. Pero esto no quiere decir que ella sea la causa. Bien podría ser que la tensión de cizallamiento actúe produciendo un remodelado de la pared, y un cambio de estructura de la matriz conectiva, que haga que la pared ceda a la presión dentro del aneurisma, que es la misma que la tensión arterial a nivel del vaso portador, aunque hay partes de la zona de impacto en donde algunas de las corrientes se detienen y no deslizan: los "puntos de estancamiento", donde el momento es máximo y podría ser este factor dinámico el que provoque la ruptura. Hay que tener en cuenta que la velocidad circulatoria, incluso en aneurismas de alto flujo, es menor que en el vaso originario3,30 y por lo tanto la tensión de desgarro.
1. Fontana, H, Belziti, H, Requejo, F, Buratti, S, Recchia, M. La circulación cerebral en condiciones patológicas IV. El aneurisma. Rev Argent Neuroc 2008, 22: 35- 46. [ Links ]
2. Forbus, WD. On the origin of miliary aneurysms of the superficial cerebral arteries. Bull. Johns Hopkins Hosp., 1930, 47: 239- 284. [ Links ]
3. Steiger, HJ. Pathophysiology of development and rupture of cerebral aneurysms. Acta Neurochir., 1990, supp. 48. [ Links ]
4. Jain, KK. Mechanism of rupture of intracranial saccular aneurysms. Surgery, 1963, 54: 347- 350. [ Links ]
5. German, WJ, Black, SPW. Experimental production of carotid aneurysms. New Eng. J. Med., 1954, 250: 104- 106. [ Links ]
6. Black, SPW, German, WJ. Observations on the relationship between the volume and the size of the orifice of experimental aneurysms. J. Neurosurg., 1960, 17: 984- 990. [ Links ]
7. Strother, CM, Graves, VB, Rappe, A. Aneurysm hemodynamics: an experimental study. AJNR,1992, 13: 1089- 1095. [ Links ]
8. Hashimoto, N, Handa, H, Hazama, f. Experimentally induced cerebral aneurysms in rats. Surg. Neurol., 1978, 10: 3- 8. [ Links ]
9. Ujiie, H, Tachibana, H, Hiramatsu, O, Hazle, AL, Matsumoto, T, Ogasawara, Y, et al. Effects of size and shape (aspect ratio) on the hemodynamics of saccular aneurysms: a posible index for surgical treatement of intracraneal aneurysms. Neurosurgery, 1999, 45: 119- 130. [ Links ]
10. Kerber, CW, Hecht, ST, Knox, K, Buxton, RB, Melzer, HS. Flow dynamics in a fatal aneurysm of the basilar artery. AJNR, 1996, 17: 1417- 1421. [ Links ]
11. Kerber, CW, Imbesi, SG, Knox, K. Flor dynamics in a letal anterior communicating artery aneurysm. AJNR, 1999, 20: 2000- 2003. [ Links ]
12. Perktold, K, Gruber, K, Kenner, T, Florian, H. Calculation of pulsatile flow and particle paths in an aneurysm-model. Basic Res Cardiol, 1984, 79: 253- 261. [ Links ]
13. Perktold, K, Kenner, T, Hilbert, D, Spork, B Florian, H. Numerical blood flow analysis: arterial bifurcation with saccular aneurysm. Basic Res Cardiol, 1988, 83: 24- 31. [ Links ]
14. Burleson AC, Strother, CM, Turitto, VT. Computer modeling of intracraneal saccular and lateral aneurysms for the study of their hemodynamics. Neurosurgery, 1995, 37: 774- 784. [ Links ]
15. Lee, D, Valentino, DJ, Duckweiler, GR, Karplus, WJ. Automatic skeleton generation for visualizing 3D, time dependent flows: application to the virtual aneurysm. En: Westwood, JD et al (eds.) Medicine meets virtual reality. IOS Press, Amsterdam, 2001. [ Links ]
16. Steinmann, DA. Image-based computacional fluid dynamics modeling in realistic arterial geometries. Ann. Biomed Engineering, 2002, 30: 483- 497. [ Links ]
17. Hassan, T, Timofeev, EV, Saito, T, Shimizu, H, Ezura, M, Tominaga, T, et al. Computational replicas : anatomic reconstructions of cerebral vessels as volume numerical grids at three-dimensional angiography. AJNR, 2004, 25: 1356- 1365. [ Links ]
18. Ross Ethier, C, Prakash, S, Steinman DA, Leask, RL, Couch, GG, Ojha, M. Steady flow separation patterns in a 45 degree junction. J. Fluid Mech., 2000, 411: 1- 38. [ Links ]
19. German, WJ, Black, SPW. Intra-aneurysmal hemodynamics.- Jet action. Circ Res, 1955, 3: 463- 468. [ Links ]
20. German, WJ, Black, SPW. Intra-aneurysmal hemodynamics: turbulence. Trans Am Neurol Assoc 1954, 79: 163- 165. [ Links ]
21. Walker,AE, Allegre, GW. The pathology and pathogenesis of cerebral aneurysms. J. Neuropathol. Exp. Neurol., 1954, 11: 128- 134. [ Links ]
22. Crompton, MR. Mechanism of growth and rupture in cerebral berry aneurysms. Brit. Med. J. 1966, 1: 1138- 1142. [ Links ]
23. Hoi, Y, Meng, H, Woodward, SH, Bendok, BR, Hanel, RA, Guterman, LR, et al. Effects of arterial geometry on aneurysm growth: three dimensional computational fluid dynamics study. J. Neurosurg., 2004, 101: 676- 681. [ Links ]
24. Carmichael, R. The pathogenesis of noninflammatory cerebral aneurysms. J. Path. Bact., 62: 1- 19, 1960. [ Links ]
25. Lasjaunias, P, Santoyo Vasquez, A. Segmental agenesis of the internal carotid artery. Angiographic aspects with embryological discusión. Anat. Clin., 1984, 6: 133- 141. [ Links ]
26. Kerber, CW, Heilman, CB. Flow in experimental berry aneurysms: method and model. AJNR 1983 4: 374- 377. [ Links ]
27. Fontana, H, Belziti, H, Requejo, F. Aneurismas experimentales. Revista Argentina de Neurocirugía, 2000, 14: 21- 33 [ Links ]
28. Steinman DA, Milner, JS Norley, CJ, Lowney, SP, Holdsworth, DW. Image-based computational simulation of flow dynamics in a giant intracranial aneurysm. AJNR 2003, 24: 559- 566. [ Links ]
29. Hassan, T, Timofeev, EV, Saito, T, Shimizu, H, Ezura, M, Matsumoto, Y, et al. A proposed parent vessel geometry-based categorization of saccular intracranial aneurysms: computational flow dynamics analysis of the risk factors for lesion rupture. J. Neurosurg., 2005, 103: 662- 680. [ Links ]
30. Mantha, A, Karmonik, C, Benndorf, G, Strother, C, Metcalfe, R. Hemodynamics in a cerebral artery before and after the formation of an aneurysm. AJNR 2006, 27: 1113- 1118. [ Links ]
31. Lazorthes,G, Gouazé, A, Santini, JJ, Lazorthes, Y, Laffont, J. La modelage du polygone de Willis. Role des compressions des voies artérielles d'apport dans les mouvements de la colonne cervicalee et de l'extrémité cephalique. Neuro-Chirurgie 1971, 17 : 361- 377. [ Links ]
32. Fontana, H. La verdad y la evidencia II, Los límites de la ciencia. Rev Arg Neurocir 2008, 22: XII- XIII. (Editorial). [ Links ]
33. Metcalfe, RW. The promise of computational fluid dynamics as a tool for delineating therapeutic options in the treatement of aneurysms. AJNR 2005 103: 553- 554. (Editorial) [ Links ]














