Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de neurocirugía
versión On-line ISSN 1850-1532
Rev. argent. neurocir. v.23 n.3 Ciudad Autónoma de Buenos Aires jul./sep. 2009
Uso de pericardio humano en neurocirugía
Javier González Ramos1, Cristian Cortez1, Oscar Schwint2, Graciela Zúccaro1
1Servicio de Neurocirugía.
2Banco de Tejidos. Hospital Nacional de Pediatria "Juan P. Garrahan", Buenos Aires, Argentina
Correspondencia: jdgonzalezramos@yahoo.com.ar
Recibido: mayo de 2009.
Aceptado: junio de 2009
RESUMEN
Objetivo. Describir y analizar una serie de pacientes operados en nuestro Dervicio por diferentes patologías, en los cuales se utilizó pericardio de donante no vivo para la realización de la duroplastía, obtenido del Banco de Tejidos de nuestro Hospital.
Material y método. Se realizó un análisis retrospectivo de las historias clínicas de 33 pacientes en los cuales se utilizó pericardio humano, operados entre los años 2006 y 2008.
Resultados. La edad de los pacientes fue entre 1 mes y 19 años (promedio: 6,6 años). 17 masculinos, 16 femeninos. Las cirugías en las cuales se utilizó, por diferentes motivos, pericardio humano para el cierre de la duramadre fueron: 7 cirugías por tumores de fosa posterior, 6 por tumores supratentoriales, 5 por traumatismos encefalocraneanos, 3 por malformación de Arnold-Chiari, 3 por hematomas espontáneos, 2 por malformaciones arteriovenosas, 2 por lipomas lumbosacros, 2 por encefaloceles, 1 por cirugía de la epilepsia, 1 por tumor espinal, y 1 por tumor de tronco. Las complicaciones encontradas fueron: 2 pseudomeningoceles y 1 fístula de líquido cefalorraquídeo, las que se resolvieron sin necesidad de nueva intervención quirúrgica. No se presentaron infecciones de la herida quirúrgica ni rechazo del injerto. Follow up: 18,6 meses.
Conclusión. Consideramos que este material se comporta en forma excelente como sustituto de la duramadre, presentando ventajas tales como: ser impermeable, fácil de suturar y manejar, proporcionando un sellado hermético, baja antigenicidad y no inducir reacciones a cuerpo extraño.
Palabra clave: Banco de Tejidos; Duroplastía; Pericardio humano; Sustituto dural.
ABSTRACT
Objective. To describe and to analyze a series of patients operated in our service by different pathologies, in which we used pericardium of alive donor for dural closure, stored at 80°C below cero in our hospital.
Method. A retrospective analysis was designed to evaluate the medical records of 33 patients in which human pericardium were used, in a period of time between 2006 and 2008.
Results. The age of the patients ranged from 1 month to 19 years old (average age: 6.6). 17 were male and 16 female. The surgeries in which we used, by different reasons, human pericardium for dural closure were: 7 posterior fossa tumors, 6 supratentorial tumors, 5 traumatic brain injury (intracranial hypertension), 3 Arnold-Chiari malformations, 3 spontaneous haematomas, 2 arterio-venous malformations, 2 lumbo-sacral lipomas, 2 encephaloceles, 1 surgery for epilepsy, 1 spinal cord tumor, and 1 brainstem tumor. The complications found were: 2 pseudomeningoceles and 1 CSF fistula. There were no systemic allergic reactions or local skin changes or infections. Follow up: 18.6 months.
Conclusion. We considered that human pericardium is an excellent, effective and safe cranial and spinal dural substitute, presenting advantages such as: to be impermeable, easy to suture and to handle, providing hermetic sealing, low antigenicidad and not to induce reactions to strange body.
Key word. Duraplasty; Dural substitute; Bank of human grafts; Pericardium.
INTRODUCCIÓN
La duroplastía es una cirugía reconstructiva de la duramadre, cuando sus bordes no pueden ser afrontados correctamente, que requiere un cierre primario o secundario con otro material o tejido (sustitutos biológicos o sintéticos). Los sustitutos durales comenzaron a emplearse hace más de 100 años y desde entonces se ha experimentado con múltiples materiales1,2.
Hoy día existen numerosos y diferentes tipos de sustitutos, tanto biológicos como sintéticos, todos con características y propiedades dispares, intentando alcanzar el ideal del sustituto dural.
El objetivo de nuestro trabajo es describir y analizar una serie de pacientes operados en nuestro Servicio por diferentes patologías, y comunicar nuestra experiencia sobre duroplastías realizadas con tejidos biológicos homólogos o aloinjertos de cadáveres humanos.
MATERIAL Y MÉTODOS
Se realizó una revisión retrospectiva de las historias clínicas de los pacientes a los cuales se les realizó una plástica de la duramadre, por diferentes razones, utilizando pericardio humano de donante no vivo del Banco de Tejidos de nuestro Hospital. En cada caso la decisión de usar pericardio humano en lugar de autoinjertos (autólogos), fue tomada por el cirujano de acuerdo a sus preferencias y la situación intraoperatoria individual.
Se consignaron los datos de cada paciente en una ficha de registro y se valoraron luego en una base de datos. Se analizaron variables correspondientes a edad, sexo, fecha y motivo de la cirugía inicial, así como la existencia de complicaciones postquirúrgicas relacionadas a la duroplastía.
El procedimiento consta de las siguientes etapas:
a) Procesamiento y conservación. El pericardio humano proviene de donantes seleccionados por el INCUCAI y por el Banco de Tejidos para verificar la ausencia de enfermedades transmisibles y de antecedentes que impliquen riesgo para el receptor3. Un equipo especializado extrae el pericardio en condiciones quirúrgicas estériles para luego ser procesado bajo flujo laminar y material estéril en el Banco. Luego de su acondicionamiento, es descontaminado con antibióticos, envasado en doble bolsa estéril con líquido crioprotector para finalmente ser congelado a -80°C. Se toman cultivos microbiológicos en todos los pasos del proceso para asegurar la esterilidad del tejido.
Cuando este tejido es solicitado, se lo envía al quirófano en contenedor térmico con hielo seco que permite mantener la cadena de frío por 24 horas. (Figs. 1 y 2).

Fig. 1. Contenedor térmico con hielo seco que permite mantener la cadena de frío por 24 horas y facilitar el transporte del pericardio.

Fig. 2. Envase del pericardio para su criopreservación.
b) Técnica de recuperación. Se solicita el sustituto dural al Banco, a fin de retirarlo del freezer como mínimo dos horas antes de la cirugía. Dentro del quirófano se procede al descongelamiento, colocando los pauch que contienen el tejido en un frasco o recipiente lleno con solución fisiológica tibia. Este paso se repite a medida que se van retirando los pauch del envoltorio hasta quedar el pericardio totalmente expuesto. Por último se procede a lavar con abundante solución fisiológica el tejido a utilizar, a fin de retirar por completo el excedente de la solución de criopreservación. (Figs. 3, 4 y 5).

Fig. 3. El pericardio envuelto en doble pauch con su correspondiente identificación.

Fig. 4. Pauch dentro del recipiente con solución tibia para su descongelamiento.

Fig. 5. Lavado abundante del pericardio para retirar el excedente del líquido de criopreservación.
c) Técnica quirúrgica. Una vez decidido el uso del pericardio, se solicita el parche al banco, seleccionando el tamaño más adecuado de acuerdo al defecto dural a reparar. Luego dicho parche es cortado con tijera a fin de moldear y ajustar el tamaño a la forma individual del defecto, dejando margen suficiente para su fijación. Se impone expresar que es un material sumamente maleable, firme y resistente pero fácil de cortar con tijera. Por último se procede a unir los bordes de la duramadre con el pericardio mediante sutura de seda 3.0 o 4.0. Se puede realizar tanto sutura continua como puntos separados (Fig. 6).

Fig. 6. Obsérvese cómo el pericardio es fácilmente cortado
RESULTADOS
Se han operados 33 pacientes con diferentes patologías, en los cuales se ha utilizado pericardio humano del Banco de Tejidos de nuestro Hospital, para la realización de la plástica de duramadre, entre enero del 2006 y diciembre del 2008. Fueron 17 varones y 16 mujeres, con un rango de edad entre 1 mes a 19 años y un promedio de edad de 6,6 años.
Los diagnósticos de los pacientes fueron: tumores de la fosa posterior (n=7), tumores supratentoriales (n=6), traumatismos encefalocraneanos (n=5), síndromes de Arnold-Chiari tipo I (n=3), hematomas espontáneos intraparenquimatosos (n=3), malformaciones arteriovenosas (n=2), lipomas lumbosacro (n=2), encefaloceles (n=2), cirugía de la epilepsia (n=1), tumor espinal (n=1), tumor de tronco (n=1). Las indicaciones principales para la duroplastía fueron: imposibilidad del cierre dural sin tensión, compromiso dural por patología de base, plástica dural programada o esperable por técnica quirúrgica.
Sólo 3 pacientes las presentaron complicaciones: 2 pseudomeningoceles, que fueron tratados mediante punciones evacuadoras y vendaje compresivo, y 1 fístula de líquido cefalorraquídeo (LCR) tratada con puntos de sutura de refuerzo y vendaje compresivo. En dichos casos no fue necesaria una nueva intervención quirúrgica para solucionar el problema. Estas complicaciones fueron asumidas como fallas de técnica de sutura durante la duroplastía. No se han encontrado infecciones de la herida quirúrgica ni rechazos de los injertos colocados, ni reacciones alérgicas sistémicas o locales.
Todos los pacientes han evolucionado en forma favorable. El seguimiento promedio fue de 18,6 meses.
DISCUSIÓN
La integridad de la duramadre es de gran importancia, ya que aísla y ofrece un soporte mecánico al sistema nervioso central (SNC), conteniendo en su interior la aracnoides con el LCR4. En toda cirugía cerebral o espinal es muy importante conseguir un cierre dural hermético para minimizar los riesgos de que aparezcan fístulas de LCR (si se ha abierto la aracnoides), infecciones, hernias cerebrales que podrían causar isquemia por compresión del parénquima herniado a través del defecto dural (Fig. 7) o adherencias entre el cerebro y los tejidos vecinos que pueden producir cicatrices corticales y focos epilépticos.

Fig. 7. TAC de cerebro. Craniectomía descompresiva en paciente con TEC. No se realizó cierre dural. Herniación del tejido cerebral a través del defecto dural.
Por tanto, de lo dicho anteriormente surge la premisa de que en toda neurocirugía debemos reparar el defecto dural con la duramadre original. Pero en incontables ocasiones, el neurocirujano se ve obligado a realizar una duroplastía cuando el cierre primario de la duramadre no puede ser llevado a cabo, debido a una retracción dural, al coagular un punto sangrante de la misma, o por expansión de la unión craneocervical (malformación de Arnold-Chiari), o cuando la duramadre debe ser ampliada para permitir la expansión del cerebro edematizado (craniectomía descompresiva), o cuando se realiza una exéresis dural por compromiso o infiltración neoplásica. Es aquí donde se hace necesaria la utilización de sustitutos durales, ya sean biológicos o sintéticos, para poder cerrar o cubrir el defecto existente en la duramadre.
El sustituto dural ideal debería tener propiedades mecánicas (elasticidad, resistencia y flexibilidad) y biológicas (antigenicidad, reacción tisular) lo más parecidas a las de la duramadre original del paciente1,4,5.
Debería, por tanto:
- no inducir reacciones a cuerpo extraño ni adherencias a la superficie cerebral que pueden producir focos epilépticos;
- ser impermeable y fácil de suturar y manejar, proporcionando un sellado hermético que soporte la presión del LCR y así evitar una fístula;
- integrarse en el tejido del huésped: actuar como soporte sobre el cual el organismo pueda regenerar una neodura2,6;
- tener baja antigenicidad (que no induzca respuesta inmunogénica);
- sin toxicidad tisular (local o sistémica);
- no transmitir enfermedades infecciosas;
- ser barato;
- fácil de retirar si es preciso;
- ser de esterilización fácil y segura.
Muchos materiales sustitutos parecen cumplir con todos estos criterios, por eso han sido usados para el cierre dural durante décadas, pero en contraposición, también muchos de estos han sido desechados por diversas razones, de modo que la búsqueda del sustituto ideal aún continúa.
De forma general, los sustitutos durales empleados en Neurocirugía pueden clasificarse en dos grandes grupos: tejidos biológicos (autólogos, homólogos y heterólogos) y materiales sintéticos (Gráfico 1).

Gráfico 1. Clasificación de los diferentes tipos de sustitutos durales empleados en Neurocirugía
A lo largo de los años se han usado distintos productos biológicos de origen animal, duramadre de cadáver y materiales sintéticos7. En la década del 80 comenzaron a publicarse casos de enfermedades infecciosas transmitidas por injertos de origen humano, tales como la enfermedad de Creutzfeldt-Jacob (ECJ), por lo que en 1990 la OMS recomendó abandonar el uso de injertos durales de cadáver y de origen animal.
Los autoinjertos (autólogos) no tendrían riesgos inmunológicos ni la posibilidad de transmisión de enfermedades infectocontagiosas. Debe agregarse además, la facilidad de obtención de los mismos, como por ejemplo el pericráneo7. Pero en algunas ocasiones estos tejidos pueden estar afectados por la patología de base del paciente u otra enfermedad sistémica, inclusive por el tratamiento oncológico (quimioterapia-radioterapia) que está llevando adelante el paciente, lo que haría difícil la obtención de los mismos8. Otra desventaja sería, tal vez, cuando deben ser cubiertos grandes defectos durales, y no sería suficiente el pericráneo, por tanto, a menudo es necesario recurrir a la fascia lata, lo cual involucra una nueva incisión, con sus complicaciones relacionadas, sin contar con el stress agregado al paciente que se observa con dos incisiones.
Los xenoinjertos (heterólogos) son de origen animal. Se ha utilizado pericardio bovino9,13, pero con el tiempo se dejó de usar por la posibilidad de reacciones inmunológicas y el potencial de transmisión de enfermedades infecciosas tales como la encefalopatía espongiforme bovina. Hoy en día se utilizan los injertos de colágeno o matrices de colágeno (como por ejemplo: Dura Gen), obtenidos a partir de tejidos animales como los tendones, el pericardio, el intestino delgado, etc. Mediante diversos procesos industriales se eliminan las células obteniéndose densas matrices de fibras de colágeno entrelazadas. Estas matrices tienen la ventaja de ser totalmente reemplazadas por el propio tejido del paciente en unos pocos meses. La mayor limitante en su uso es el costo, a veces muy elevado, lo que hace casi imposible la utilización de este material en forma continua.
Los sustitutos durales sintéticos, tales como el Goretex®: (politetrafluoroetileno - PTFE), Neuropatch® (poliéster-uretano alifático, microporoso), Biomesh® (polietileno terephthalato y silicona). Dacron® (parche de poliéster, tejido poco poroso), Ethisorb® (polímero reabsorbible compuesto por filamentos de vicrilo y de polidioxanona), Sylastic®, tienen como principal ventaja la no transmisión de enfermedades infecciosas, lo que los hace seguros y confiables para su utilización. En contraposición algunos tienen una estructura casi rígida, resultando en ocasiones difícil de colocar, moldear y suturar, volviendo incómoda la duroplastía. Asimismo, no siempre el tejido circundante se une correcta y fuertemente al sustituto, por lo que se debe extremar el cuidado a la hora de realizar los puntos de sutura del mismo a la duramadre remanente. Existen numerosas publicaciones que hacen referencia a la asociación de estos materiales con altas tasas de complicaciones causadas por reacciones a cuerpo extraño, generación de adherencias y cicatrices del tejido cerebral subyacente, encapsulación, posibilidades de sangrados como hematomas epidurales o subdurales tardíos, infecciones de herida quirúrgica, y fístulas de liquido cefalorraquídeo6,10,11.
El uso de aloinjertos u homólogos, tales como la duramadre cadavérica, ha sido abandonado en la mayoría de los países (especialmente en los países desarrollados), debido al alto riesgo de transmisión de la encefalopatía espongiforme o enfermedad de Creutzfeld- Jacob. No obstante, no se han podido encontrar publicaciones respecto del uso de pericardio humano de donante no vivo como sustituto de la duramadre. Como se hizo referencia anteriormente, el Banco de Tejidos de nuestro Hospital en conjunto con el INCUCAI (ente regulador), seleccionan los donantes humanos de donde proviene el pericardio, todo enmarcado dentro de la Ley de Trasplante de Órganos y Tejidos, Ley 24.193 -texto actualizado por Ley 26.066-, de manera de confirmar y certificar la ausencia de enfermedades infecciosas transmisibles, y asegurar la no existencia de antecedentes que impliquen algún tipo de riesgo para el posible receptor.
Los hallazgos de este estudio muestran que el pericardio humano puede ser usado en forma segura. En ningún paciente se ha expresado reacción inmunológica o rechazo de injerto, tampoco se ha observado la transmisión de ningún tipo de enfermedad infecciosa. No obstante, se está realizando un seguimiento estricto de todos los pacientes en los que se utilizó este material, a fin de alertar ante cualquier eventualidad.
No se han encontrado dificultades durante el tiempo quirúrgico, ya que este sustituto, al ser una serosa, es sumamente maleable, fácil de moldear y cortar, pero suficientemente firme y resistente, lo que hace factible la realización de puntos de sutura herméticos. (Figs. 8, 9 y 10). Con respecto al tipo de complicaciones encontradas en el trabajo, no difieren a las encontradas por Martinez-Lange et al, quienes utilizan tejido autólogo para la duroplastía. Tampoco se advierte una marcada diferencia en la incidencia de estas complicaciones postquirúrgicas (10%)7. Esta incidencia es menor cuando se la compara con los resultados de los trabajos en donde se han utilizado los sustitutos sintéticos, situándose el porcentaje de complicaciones entre el 12 y el 13%6,12. No debe dejar de mencionarse que la disponibilidad y el bajo costo de este tejido, hacen que el pericardio humano sea una opción válida a la hora de la elección de sustitutos durales en nuestro Hospital.

Fig. 8. Se aprecia el defecto dural y el parche de pericardio que se utilizará para el cierre.
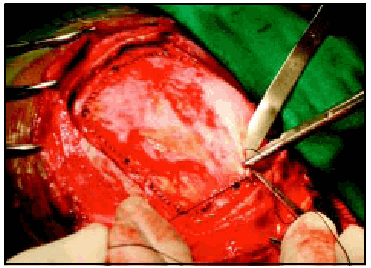
Fig. 9. El sustituto dural es fácilmente suturado con la duramadre remanente.

Fig. 10. Vista final de la duroplastía realizada con pericardio humano.
CONCLUSIÓN
Si bien es el neurocirujano quien debe decidir cuál es el mejor sustituto dural a utilizar en cada caso en particular, consideramos que el pericardio humano de donante no vivo es una óptima alternativa para la realización de la duroplastía, ya que hemos observado en nuestro trabajo múltiples ventajas tales como: baja antigenicidad, no produce reacción a cuerpo extraño, es fácil de moldear, cortar y suturar (proporcionando un sellado hermético), y gran disponibilidad con bajo costo económico.
COMENTARIO
González Ramos y colaboradores presentan su valiosa e inédita experiencia con el uso de pericardio humano proveniente de banco de donantes no vivos para la realización de duroplastía en diversas patologías neuroquirúrgicas.
Los neurocirujanos nos encontramos muchas veces ante la dificultad de un cierre dural sin tensión o, a veces y según la patología, ante la ausencia misma de duramadre. Si el abordaje y la patología lo permiten el material a utilizar debe ser autólogo: pericráneo o aponeurosis-fascia-músculo.
Solamente en situaciones de excepción deberían utilizarse injertos homólogos o heterólogos, como por ejemplo en pacientes con cirugías previas, irradiados o ante la dificultad técnica de obtener tejidos autólogos.
Coincido con los autores en su crítica hacia los injertos sintéticos por su baja elasticidad y comportamiento de cuerpo extraño.
Las matrices de colágeno son una buena opción, pero su uso se ve limitado por su alto costo. Lo mismo sucede con otros materiales biológicos homólogos o heterólogos tratados industrialmente, además del eventual riesgo de transmitir enfermedades como la encefalopatía espongiforme.
Sería interesante lograr que otros centros neuroquirúrgicos pudieran coordinar con el INCUCAI y los bancos de tejidos una mayor difusión de esta técnica de duroplastía y evaluar así resultados a largo plazo con un mayor número de pacientes.
Daniel H. D'Osvaldo
1. Fillipi R, Derdilopoulos A, Heimann A, Krummenauer F, Pemmeczky A, Kempski O. Tightness of duraplasty in rabbits: a comparative study. Neurosurgery 46:1470-1476; 2000. [ Links ]
2. Reddy Schöggl A, Reddy B, Saringer W, Weigel G, Matula C. A clinical study of a fibrinogen-based collagen fleece for dural repair in neurosurgery. Acta Neurochir (Wien) 2002; 144: 265-9. [ Links ]
3. Incucai - Instituto Nacional Central Único Coordinador de Ablación e Implante. Ley de Trasplante de Órganos y Tejidos -texto actualizado por Ley 26.066 http://www.incucai.gov.ar/institucional/ legislacion.jsp. [ Links ]
4. Berjano R, Vinas FC, Dujovny M. A review of dural substitutes used in neurosurgery. Crit Rev Neurosurg 1999; 9: 217-22. [ Links ]
5. Narotam PK Reddy K, Fewer D, Qiao F, Nathoo N. Collagen matrix duraplasty for cranial and spinal surgery: a clinical and imaging study. J Neurosurg 2007; 106: 45-51. [ Links ]
6. Malliti M, Page P, Gury C,Chomette E, Nataf F, Roux F. Comparison of deep wound infection rates using a syntethic dural substitute (neoropatch) or pericranium graft for dural closure: a clinical review of 1 year. J Neurosurg 2004; 54(3): 599-604. [ Links ]
7. Martínez-Lage J, Pérez Espejo MA, Palazón JH, López Hernández F, Puerta P. Autologous tissues for dural grafting in children: a report of 56 cases. Childs Nerv Syst 2006; 22: 139-44. [ Links ]
8. Warren WL, Medary MB, Dureza CD, Bellotte JB, Flannagan PP, Oh MY. Dural repair using acellular human dermis: experience with 200 cases: technique assessement. Neurosurgery 2000; 46: 1391-6. [ Links ]
9. Anson JA, Marchand EP. Bovine pericardium for dural grafts : clinical results in 35 patients. Neurosurgery 29: 785-8. [ Links ]
10. Fontana R, Talamonti G, D'Angelo V, Arena O, Monte V, Colice M. Spontaneous haematoma as unusual complicatin of silastic dural substitute, Report of 2 cases. Acta Neurochir (Wien) 1992; 115: 64-6. [ Links ]
11. Siccardi D, Ventimiglia A. Fibrotic-haemorragic reaction to synthetic dural substitute. Acta Neurochir (Wien) 1995; 132: 148-9. [ Links ]
12. Von Wild KR. Examination of the safety and efficacy of an absorbable dura mater sustitute (Dura Patch) in normal applications in neurosurgery. Surg Neurol 1999; 52: 418-24. [ Links ]
13. Baharuddin A, Go BT, Firdaus MN, Abdullah J. Bovine pericardium for dural grafts : clinical results in 22 patients.Clin Neurol Neurosurg 2002; 104(4): 342-4. [ Links ]














