Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista argentina de neurocirugía
versão On-line ISSN 1850-1532
Rev. argent. neurocir. vol.24 supl.1 Ciudad Autónoma de Buenos Aires ago. 2010
Malformación del desarrollo cortical. Nuestra experiencia acerca de 150 casos
Hugo B. Pomata1,2, Marcelo Bartuluchi1, Fabiana Lubieniecki1, Juan Pociecha1,2, Roberto Caraballo1, Esther Cáceres1, Claudio Vázquez2,4, César Petre2,3, Carlos D'Giano2.
1 Hospital Nacional de Pediatría "Juan P Garrahan", 2FLENI, 3Hospital de Niños "R. Gutiérrez", 4Hospital "Cosme Argerich", Buenos Aires, República Argentina
Correspondencia: hpomata@fibertel.com.ar
RESUMEN
Objetivo Realizar una evaluación retrospectiva de 150 pacientes de una serie de 570 (26.3%), operados por epilepsia refractaria con diagnóstico de algún tipo de malformación del desarrollo cortical (MDC), desde 1988 a noviembre de 2009.
Material y método. 118 niños y 32 adultos; 69 localización temporal (42 niños, 27 adultos) y 81 extratemporal (76 niños y 5 adultos). La evaluación prequirúrgica incluye: características clínico-semiológicas de las crisis epilépticas, EEG de superficie, video EEG, TC y/o RM y evaluación neuropsicológica. Población: varones: 86; mujeres 64; edad, media de 6.7 años (rango: 6 m - 18.9 a) en los niños y media de 31.3 años (rango: 19-59 a) en los adultos. Evolución de epilepsia: media de 4.9 años para los niños (rango: 1 mes a 17 años) y media de 13.8 (rango: 2 meses a 50 años). Aspectos clínicos: tipos de crisis: pudiendo un mismo paciente presentar más de una de ellas, vinculadas a la localización, CPS, ausencias, crisis tónicas, automatismos, crisis versivas, CPC, anopsia transitoria, "drop attacks", "Startle epilepsia", escotoma, automatismos masticatorios, crisis clónicas, fotopsia, desviación ocular, "head attacks". Imágenes: la TC fue normal en 5, y se realizó IRM en todos a partir de 1996. Requirieron electrodos intracraneanos crónicos 20 (13.3%) pacientes, por dificultades en la definición del foco epileptogénico. Procedimientos quirúrgicos: resectivos: lesionectomías 63 (17 fueron ampliadas; en 5 se complementó con transección subpial múltiple (TSM) y en 1 con callosotomía de 2/3 posterior), lobectomía temporal anterior standard (LATS) 37, resección anteromesial de Spencer 9, corticectomías 11 (en 1 + TSM), selectivas 3, hemisferectomía anatómica 1, lobectomía 1, polectomía 4, desconexiones: hemisferectomías functionales (HF) 10, hemisferotomías 4, hemi-hemisferectomía 1, transección subpial múltiple (TSM) 2 y callosotomías 2. Otros procedimientos: estimulador del nervio vago (ENV) 1 y radiocirugía 1. ECoG intra-op se realizó en 54, estimulación cortical 2 (1 niño y 1 adulto) y potenciales evocados somatosensitivos (PESS) en 4. RM intra-op: en 6 pacientes.
Resultados. Hallazgos patológicos: DCF 86 (23 patología dual, asociadas a esclerosis mesial temporal, 2 "triples patologías": DCF, ganglioglioma y EMT, en 1 de ellas además, un componente de alteración parahipocámpica y 4 "patologías asociadas": 3 a tumores de bajo grado [2 gangliogliomas y 1 glioma de bajo grado] y 1 DCF asociada a MAV), de ellas, 3 son displasias corticales adquiridas; doble patología que asocia alteraciones del desarrollo de las estructuras mesiales temporales a EMT son 4 (2 alteraciones de la arquitectura del hipocampo, y 2 alteraciones del núcleo dentado); DNTs: 33; esclerosis tuberosa 12; hemimegalencefalía 10; hamartomas 5. Resultados: Engel clase I: 113 (75.3%), clase II: 17 (11.3%), clase III: 6 (4%), clase IV: 3 (2%) pacientes. No clasificados: con menos de 1 año post-op 2 y no clasificables 9: dos pacientes fallecidos debido a trastornos de la coagulación y pacientes a quienes se realizó procedimientos sin posibilidad de aplicar la clasificación de Engel: 2 callosotomías, 3 ENV y 1 radiocirugía, y 1 paciente fue perdido.
Conclusión. Las MDC representaron el 26.3% (150/570) de pacientes tratados quirurgicamente por epilepsia refractaria. Usualmente presentan un comienzo temprano y una evolución desfavorable de la epilepsia. Sin embargo, la respuesta al tratamiento quirúrgico fue buena con 130/150 (86.6%) en Engel clase I y II. Asimismo, los pacientes con patología doble, triple o "asociadas" todos se encuentran en clase I y II de Engel, es decir muy buenos y buenos resultados. Estos sugieren que la cirugía debería ser considerada como una opción terapéutica temprana en esta patología. Tanto la ECoG como la RM intra-operatorias resultaron herramientas útiles en la estrategia intraoperatoria, incidiendo en la decisión de ampliar la resección, y/ o la complementación con TSM. Se hizo necesario implementar prácticamente todos los procedimientos quirúrgicos de que se dispone actualmente, tanto resectivos como desconexiones. Un desafío particular representó la estrategia para el tratamiento de DCF que asentaban en área central, áreas de la palabra y de la ínsula de Reil.
ABSTRACT
Objective: To evaluate the surgical results in a group of patients with epilepsy associated with cortical development malformations (CDM).
Method: A retrospective study in 150 patients of a series of 570 patients (26.3%) who have undergone surgery for intractable epilepsy with a diagnosis of CDM, since 1988. Clinical features, scalp EEG, video EEG, CT scan, MRI and neuropsychological evaluation were assessed. Population: males: 86 patients, females: 64; mean age, children: 6.7 years (range: 0,5-18.9) and adults: 31.3 years (range: 19-59); mean evolution of epilepsy, children: 4.9 years (range: 1mo-17 yr.), adults: 13.8 years (range: 2mo-50 yr.). Clinical manifestations: CPS, absences, tonic crises, automatisms and versive crises, CPS, transitory anopsia, drop attacks and Startle epilepsy, scotoma, masticatory automatisms, clonic crises, photopsia, eye deviation and head attacks. Imaging: CT scan was normal in 5, and MRI was performed since 1996. Twenty of 150 (13.3%) required chronic intracranial electrodes implantation. Surgical procedures: resectives: lesionectomies 63 (wide lesionectomy, 17 and + MST, 5), standard anterior temporal lobectomies (SATL) 37, anteromesial resections (Spencer) 9, corticectomies 11(+MST, 1),amigdalo-hippocampectomies 3, anatomic hemispherectomy 1, lobectomy 1 and polectomies 4; disconnecting procedures: functional hemispherectomies (FH) 10, hemispherotomy 4, hemi-hemispherectomy 1, multiple subpial transection (MST) 1 and 2 callosotomies. Other procedures: vagus nerve stimulator (VNS) 1, as the first procedure, and radiosurgery 1. Intra-op ECoG was performed in 54 patients, SSEP were in 4 and cortical stimulation in 2. Pathological findings: FCD 86 (includes 23 dual pathology, 2 "triple pathology", 5 "associated pathologies", 4 TMS + abnormal temporal mesial structures and 3 acquired FCD), DNTs 33, tuberous sclerosis 12, hemimegalencephaly 10 and 5 hamartomas. Results according to the Engel classification: class I: 113 (75.3%), class II: 17 (11.#%), class III: 6 (4%) and class IV: 3 (2%) patients. Less than 1 year post-op 2. Not classified, 9 patients: 2 callosotomies, 3 NVS (2 performed as second procedure), 1 radiosurgery, 2 patients died post-op due to a coagulation disorders and 1 lost follow-up.
Conclusions: CDM represented 26.3% (150/570) of patients who underwent surgery for intractable epilepsy. These patients usually present an early onset and unfavorable evolution of epilepsy. However, response to surgical treatment was good with 130/150 (86.6%) in Engel class I and II. The results suggest that surgery should be considered as an early therapeutic option in this pathology. The intra-op ECoG, SSEP and MRI were useful tools for intra-operative strategy, for to enlarge the resections as well as to complement it with MST. All available surgical procedures were necessary to perform the surgical treatment of the CDM. The FCD of the central area, language areas and the insular region were a particular challenge for the surgical team.
INTRODUCCIÓN
Si hay una patología paradigmática de las enfermedades de la corteza cerebral es la que engloba a los trastornos de su desarrollo, agrupados bajo la denominación de Malformaciones del Desarrollo Cortical. Sin ser éste el ámbito para profundizar los diferentes intentos de su clasificación1,2, sí vale la pena recordar las tres etapas clásicas del desarrollo de la corteza humana, a saber: a) etapa de proliferación celular, entre las semanas 4ª - 6ª, b) etapa de migración, semana 6ª a 24ª y c) etapa de organización final de la corteza, a partir de la semana 24. La mayoría de las entidades de potencial resolución quirúrgica se agrupa en la mencionada primera etapa de proliferación celular y son: displasias corticales, hemimegaloencefalias, y las diversas formas de hamartías, siendo de ellas, una de la más clásica, la esclerosis tuberosa o enfermedad de Bourneville.
MATERIAL Y MÉTODO
Se realizó una evaluación retrospectiva de 150 pacientes de una serie de 570 (26.3%), operados por epilepsia refractaria con diagnóstico de algún tipo de malformación del desarrollo cortical (MDC), desde 1988 a noviembre de 2009. De ellos, 118 son niños y 32 adultos; 69 corresponden a localización temporal (42 niños, 27 adultos) y 81 extratemporales (76 niños y 5 adultos).
Los pacientes fueron operados luego de una completa evaluación prequirúrgica, que incluye: características clínico-semiológicas de las crisis epilépticas, EEG de superficie, video EEG, TAC y/o IRM y evaluación neuropsicológica. Las MDC fueron subdivididas en displasia cortical focal (DCF) [con o sin células balonadas y la inclusión de heterotopías y displasias adquiridas], tumores neuroepiteliales disembrioplásicos (DNT), esclerosis tuberosa (ET), hemimegalencefalia y hamartomas hipotalámicos.
Población: varones: 86; mujeres 64; edad, media de 6,7 años (rango: 6 m-18,9 a) en los niños y media de 31,3 años (rango: 19-59 a) en los adultos. Evolución de epilepsia: media de 4,9 años para los niños (rango: 1 mes a 17 años) y media de 13,8 (rango: 2 meses a 50 años).
Aspectos clínicos: las crisis tuvieron las siguientes características, pudiendo un mismo paciente presentar más de una de ellas, vinculadas a la localización, CPS, ausencias, crisis tónicas, automatismos, crisis versivas, CPC, anopsia transitoria, "drop attacks", "Startle epilepsia", escotoma, automatismos masticatorios, crisis clónicas, fotopsia, desviación ocular, "head attacks". Imágenes: la TAC fue normal en 5, y se realizó IRM en todos a partir de 1996.
Evaluación neuropsicológica: se hizo en 65 pacientes, de los cuales 37 correspondieron a Test de Wada, definiendo lateralidad en los casos en que persistían dudas.
Cirugía en 2 tiempos: requirieron implante de electrodos intracraneanos crónicos 20 (13,3%) pacientes, por dificultades en la definición del foco epileptogénico mediante la valoración clínica y la Video-EEG.
Localización de la lesión: temporal 69, frontal 34, hemisférica 13, occipital 7, parietal 6, área central 6, insular 5, hipotálamo 5, difusa 2, frontotemporal 1, temporooccipital 1 y parietooccipital 1 (Tabla 1).
Tabla1. Localización topográfica de la lesión
n= 150

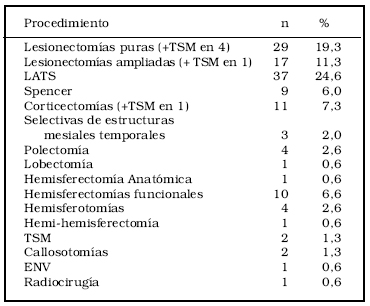
Procedimientos quirúrgicos
Resectivo: lesionectomías 63 (17 fueron ampliadas; en 5 se complementó con transección subpial múltiple (TSM) y en 1 con callosotomía de 2/3 posterior), lobectomía temporal anterior estándar (LATS) 37, resección anteromesial de Spencer 9, corticectomías 11 (en 1 + TSM), selectivas 3, hemisferectomía anatómica 1, lobectomía 1, polectomía 4, desconexiones: hemisferectomías funcionales (HF) 10, Hemisferotomías 4, hemi-hemisferectomía 1, transección subpial múltiple (TSM) 2 y callosotomías 2.
Otros procedimientos: estimulador del nervio vago (ENV) 1 y radiocirugía 1 (Tabla 2).
Monitoreo neurofisiológico intraoperatorio:ECoG intraoperatoria se realizó en 54, estimulación cortical 2 (1 niño y 1 adulto) y potenciales evocados somatosensitivos (PESS) en 4.
IRM intraoperatoria: se realizó cirugía bajo IRM en 6 pacientes, de ellas 4 fueron reoperaciones, 2 DCF de localización insular y 1 en áreas central y de Broca y 1 recidiva de ET frontal ; se utilizó en cirugías, como único procedimiento, en pacientes con DCF, 1 de hipotálamo y otro de la región insular.
Complicaciones: paresia completa transitoria del III par craneano 2, hemiparesia transitoria 4, paresia braquial transitoria 3, hidrocefalia 1 y 1 edema postresección. Reoperaciones: 22 pacientes, de las cuales 18 fueron por epilepsia, realizándose ampliaciones de resecciones y desconexiones en 16, un paciente por recidiva de DNT y 1 implante de ENV en una lesionectomía previa. Las restantes se realizaron para tratamiento de complicaciones quirúrgicas.
Tabla 2. Patología
n= 150

RESULTADOS
Hallazgos patológicos
DCF 86 (23 patología dual, asociadas a esclerosis mesial temporal, 2 "triples patologías" que asocia DCF, ganglioglioma y EMT, en 1 de ellas además hay un componente de alteración parahipocámpica y 4 "patologías asociadas": 3 a tumores de bajo grado [2 gangliogliomas y 1 glioma de bajo grado] y 1 DCF asociada a MAV), de ellas, 3 son displasias corticales adquiridas; doble patología que asocia alteraciones del desarrollo de las estructuras mesiales temporales a EMT son 4 (2 alteraciones de la arquitectura del hipocampo, y 2 alteraciones del núcleo dentado); DNTs: 33; esclerosis tuberosa 12; hemimegalencefalia 10; hamartomas 5 (Tabla 3). De las 86 DCF, 59 corresponden a la población pediátrica, 42 son extratemporales y 17 temporales. En la población adulta, las 27 restantes, 24 son temporales y 3 de localización extratemporal.
Tabla 3. Procedimientos quirúrgicos
n= 150
Resultados: de acuerdo a la clasificación de Engel: están en clase I: 113, clase II: 17, clase III: 6, clase IV: 3 pacientes. No clasificados: con menos de 1 año postoperatorio 2 y no clasificables 9: dos pacientes fallecidos debido a trastorno de la coagulación y pacientes a quienes se realizó procedimientos sin posibilidad de aplicar la clasificación de Engel: 2 callosotomías, 3 ENV y 1 radiocirugía, y 1 paciente cuyo seguimiento fue perdido (Tabla 4). Respecto al grupo de pacientes con DCF, de las 42 de localización extratemporal, 29 (69%) están en clase I, 5 en clase II (11,9%); de los 17 temporales, 12 (70,5%) están en clase I, 3 (17,6%) en clase II y 2 (11.,7%) en clase III. En cuanto a las displasias corticales extratemporales correspondientes a la población adulta, los 3 (100%) están en clase I; de los 24 de localización temporal, 18 (75%) están en clase I y 6 (25%) en clase II. De los 23 pacientes con patología dual, 4 son niños, mientras que la triple patología y las patologías asociadas, todas corresponden a la población pediátrica, son en total 14 pacientes, de ellos 12 (85,7%) están en Engel I y 2 (14,2%) en clase II. Respecto a la población adulta con doble patología, son 19, y se encuentran 14 (73.6%) en clase I y 5 (26.3%) en clase II.
De la correlación de los procedimientos quirúrgicos implementados y la clasificación de Engel, surge lo siguiente: lesionectomías puras: clase I, 36; II, 5; III, 3; fallecido, 1 y 1 paciente con seguimiento perdido; lesionectomías ampliadas: clase I, 16 y 1 no clasificado, reoperación (ENV); corticectomías: Clase I, 9; II, 1; IV, 1; lobectomía: clase I, 1; polectomías: clase I, 4; LATS: clase I, 28; II, 8 y III, 1; Spencer: clase I, 8 y II, 1; selectivas: clase I, 3; hemisferectomía anatómica: IV,1; HF: I, 6; II, 1, III, 1; reoperado (ENV), 1 y fallecido, 1; hemisferotomías: clase I, 3 y clase IV, 1; TSM: clase I, 2 y hemihemisferectomía: clase I,1. No clasificables: 2 callosotomías; 3 ENV, 2 y 1 radiocirugía.
Tabla 4. Resultados. Clasificación de Engel
n= 150

DISCUSIÓN
Desde el trabajo pionero publicado en 19713, por el neuropsiquiatra D. C. Taylor, el neurocirujano M. A. Falconer, del King College Hospital, de Londres, y por los patólogos C. J. Bruton y J. A. N. Corsellis del Runswell Hospital de Essex (Fig. 1), pasando por los intentos, hoy universalmente aceptados, de la clasificación de esta patología por parte de André Palmini y colaboradores a mediado de la década del 902, así como la introducción del concepto de displasia cortical adquirida, como causa de epilepsia, introducido por Miguel Marin-Padilla4 en el comienzo de los 2000, para final-mente llegar al fin de dicha década (año 2009) al concepto de "TORopatías" (siglas en Inglés que significan Target of rapamycin pathway) desarrollado por P. B. Crino5, "caracterizadas por un desorden en la laminación cortical, citomegalia y convulsiones intratables", que echa nuevas luces sobre la patogénesis de estas entidades, más que mucho se ha escrito y publicado al respecto6-9.

Fig 1. Faccímil del trabajo original que reporta las primeras descripciones de displasia cortical focal, de Taylor et al (1971).
Lo real es que los trastornos del desarrollo de la corteza, como causa de la epilepsia, son en el momento actual una etiología "común" de las epilepsias en general. Esto no debe sorprender si se tiene presente la enorme superficie, en metros cuadrados10-12 de la corteza del cerebro humano desplegada y siendo (verdad de perogrullo) una enfermedad de las neuronas que en conjunto e interconectadas la conforman, queda claro el adjetivo de "común" para esta patología. El mismo está, asimismo, avalado por todas las series de las cirugías de las epilepsias publicadas por los más diversos centros del mundo13, incluidos los nuestros14. Desde el punto de vista estadístico las MDC como causa de epilepsia representan no menos del 20% de las etiologías de las epilepsias de resolución quirúrgica. Tassi y col reportan una frecuencia del 45% en la revisión de 243 pacientes operados por epilepsia temporal15.
En este punto, es mandatorio, dejar claramente puntualizado el peso que para el diagnóstico de estas entidades tiene la siempre bien llamada "Revolución de la Imagen"16-19. La revisión de nuestra serie así como la de todos los centros previamente mencionados demuestra con claridad cómo una impresión diagnóstica difícilmente demostrable en la era pre IRM pasó, gracias a la evolución de la misma, a una casi certeza diagnóstica prequirúrgica, confirmada luego por el estudio anatomopatológico de la muestra quirúrgica. Aunque redundante para algunos, sigue siendo necesario para muchos, insistir en que estas entidades no son visibles en las TAC convencionales. Esto tiene enorme importancia en la aplicación neuroclínica cotidiana cuando, desgraciadamente, con frecuencia nos llegan pacientes con años de evolución de epilepsias graves (característica de las MDC) sin una imagen adecuada, que al hacerla, orienta al médico rápidamente al planteo de la posibilidad del tratamiento quirúrgico.
Todo lo expresado previamente no descalifica el valor diagnóstico de los registros electroencefalográficos, claramente planteado por Palmini (1995): que muestran un inusual patrón de descargas epileptogénicas rítmicas, virtualmente continuas pero al mismo tiempo intermitentes en el tejido displásico"20.
En cuanto a nuestra casuística, al igual que en importantes centros del mundo donde se practica la Cirugía de la Epilepsia, la población de pacientes epilépticos refractaria al tratamiento médico, es exhaustivamente estudiada, aplicando las herramientas antes mencionadas, para seleccionar el candidato a cirugía, definiendo el foco epileptogénico y la consiguiente estrategia quirúrgica. Cabe destacar que cuando la Video-EEG con electrodos de superficie no logra definir claramente el foco, se hace necesario realizar una Video-EEG previo implante de electrodos intracraneanos crónicos, en la búsqueda de la congruencia clínica-electroencefalográfica-imagenológica-neuropsicológica.
En algunas ocasiones, cuando la lesión asienta en áreas elocuentes, es necesario completar el estudio con monitoreo mediante estimulación motora, o del lenguaje, aguda (con paciente despierto) o crónica (paciente previamente implantado), que se realiza en la Unidad de Video-EEG. Merece constar que la tendencia actual respecto a esta última función, a nivel mundial, es utilizar cada vez menos la estimulación aguda con el paciente despierto, siendo esto paulatinamente reemplazado por el implante crónico de electrodos subdurales en Broca y/o Wernicke, lo que permite una evaluación con menor margen de error. La IRM funcional es en el momento actual una herramienta que brinda una excelente ayuda, totalmente fiable, en los paradigmas motores21 y de la palabra22-24, sin embargo discutible, de acuerdo a la experiencia de diversos centros25, para la de la memoria.
Aspectos quirúrgicos
Del amplio espectro que conforman las MDC, las DCF constituyen un desafío quirúrgico, no solo para determinar su exacta localización, dada la dificultad de su visualización intraoperatoria, sino también su extensión, ya que con frecuencia se pueden asociar a otras disgenesias no siempre próximas al foco displásico principal. A esto debe agregarse que el foco epiléptico a resecar puede estar compuesto no solo por la displasia sino también por corteza cerebral, anatómicamente normal pero funcionalmente epileptogénica20,26.
De todo lo antedicho se desprende la necesidad de recurrir a herramientas intraoperatorias que nos ayuden a localizar y determinar la extensión del área epileptogénica a resecar. Las mismas van desde la utilización de puntos craneométricos27 convencionales, técnicas estereotácticas, ecografía, la neuronavegación y la IRM intraoperatoria28. Esta es una herramienta valiosa, la más moderna de todas, particularmente útil para guiar la resección de lesiones que asientan en el área central y en el lóbulo de la ínsula de Reil, regiones en las que, en general, los procedimientos quirúrgicos efectuados han sido lesionectomías puras (sin margen agregado). Se utilizó en 3 pacientes en quienes la lesión asentaba en la región insular, en 2 para ampliar lesionectomías previamente operadas con neuronavegación, en quienes la resección había sido insuficiente, no lográndose un adecuado control de las crisis. El único paciente, adulto joven, operado en primera instancia bajo IRM intraoperatoria, en el que se efectuó una insulectomía completa (lesionectomía), está en la actualidad libre de crisis con un seguimiento de 18 meses, lo que habla de la utilidad de esta guía intraoperatoria para patología de difícil visualización.
Comentarios sobre los procedimientos quirúrgicos
Dentro de los procedimientos quirúrgicos para tratar las epilepsias sintomáticas secundarias a lesiones corticales, se puede decir, como concepto general, que las resecciones de las lesiones epileptogénicas (lesionectomías puras), "garantizan" un éxito quirúrgico para el control de las crisis del orden del 70%. No es este el caso, desafortunadamente, de las MDC, debido a consideraciones previamente desarrolladas que podrían resumirse en la dificultad de determinar con exactitud la real extensión del área epileptógena primaria. De ahí que de nuestra serie, al igual que de lo que surge de la literatura específica, se vea que las lesionectomías puras (31,3%) debieron ser complementadas con otros procedimientos, con frecuencia bajo guía electrocorticográfica, que van de las diversas formas de lesionectomías ampliadas (10,6%), las lobectomías (0,6%), polectomías (2,6%), corticectomías (7,3%) y aún, eventualmente, las hemisferectomías anatómicas (0,6%)29, ésta como la máxima expresión de una lesionectomía, Todos estos procedimientos, se sobreentiende, por lo menos engloban a las lesiones epileptogénicas, agregándosele a eso un diverso grado de resección del tejido circundante, que puede ser de aspecto anatómicamente normal, pero que la ECoG muestra que está incorporado al foco epileptógeno.
En el lóbulo temporal, en particular, hay 2 formas clásicas de lobectomías: la estándar (LATS) (24,6%) y la resección anteromesial de Spencer (6%), que respeta T1. Merece recordarse que al margen de esa diferencia, ambas técnicas consisten en que en un mismo tiempo quirúrgico se resecan en un primer paso la neocorteza temporal (4 a 4,5 cm, sea derecho o izquierdo) y en el segundo, la resección de las estructuras mesiales, es decir la formación hipocampal (área enthorinal, amígdala e hipocampo). La extensión de la resección del hipocampo está condicionada a la evaluación neurocognitiva preoperatoria. Podemos sintetizar esto diciendo que las resecciones más extensas se pueden hacer en hipocampos en los que ya asienta una mala memoria, con una buena reserva de la misma del lado contralateral. La extensión de la resección varía entre 2,5 a 4,5 cm como promedio. (Caso 1) Cuando las MDC asientan "estrictamente" en la formación hipocampal y hay certeza de normalidad anatómica (IRM de no menos de 1.5 Tesla y protocolo para epilepsia) y funcional, con una excelente calidad, no sólo técnica sino de interpretación de la Video-EEG, se puede efectuar la resección selectiva de las estructuras mesiales temporales (2%), que en ese caso también equivale a una lesionectomía.

Caso 1. H. A. (m) de 6 años de edad. Epilepsia desde los 11 meses. Foco epileptógeno en la región temporal anterior izquierda, que se corresponde con la lesión. Cirugía (05/05): lesionectomía en T1,T2,T3 y T4 desde el polo hasta 5 cm hacia atrás. ECoG intra-op, con electrodo profundo de 6 contactos, en estructuras mesiales. Registro normal. Por lo que no se las remueve. Patología: esclerosis tuberosa. Engel: 1A. A. IRM preoperatoria, proyección coronal. Muestra extensa lesión en lóbulo temporal izquierdo. Corresponde a la IRM, proyección coronal, postquirúrgica. C. Corresponde a la IRM, proyección coronal, postquirúrgica. Se observan las estructuras mesiales temporales no resecadas, debido al monitoreo con ECoG intraoperatoria, que no mostraba espigas a este nivel.
Todo lo antedicho, obviamente, es aplicable no sólo a las epilepsias secundarias a la MDC, sino a todas las epilepsias temporales.
Dentro de los procedimiento de desconexión, las HF (6,6%) (Clásica de Rasmussen o de Pomata, en la que se reemplaza la resección del lóbulo temporal por su desconexión30) son procedimientos curativos, fueron utilizadas en lesiones extensas que englobaban más de 2 lóbulos, si no todo un hemisferio, con muy buenos resultados. Las hemisferotomías (Delalande, Villemure o Schramm (2.6%)31. Las hemi-hemisferectomías se diferencia de las anteriores desde el punto de vista conceptual por la sección de medio cuerpo calloso, anterior o posterior, y la desconexión de 2 lóbulos (0,6%)32.
Dentro de las desconexiones paliativas debemos ubicar las callosotomías31 (que tienen especial indicación en las epilepsias multifocales bilaterales que suelen presentarse con "head" o "drop attacks". Frecuentemente son epilepsias sindrómicas, siendo el paradigma de ellas, el síndrome de Lennox-Gastaut. Nuestra experiencia nos ha demostrado y demuestra que a través de circuitos aberrantes centroencefálicos la enfermedad puede recidivar en un lapso de 1 a 4 años postoperatorio33, obligándonos al implante de los estimuladores vagales.
Nos queda, dentro de las desconexiones, un breve comentario sobre las TSM, utilizado en las MDC en 2 oportunidades (1,3%), como procedimiento único y en otros seis casos como complemento de otros. Esta circunstancia hace difícil evaluar la efectividad de esta técnica, así como también encuadrarla dentro de procedimientos curativos o paliativos. Si nos remontamos al concepto de su creador, Frank Morrell, década del 8034, el procedimiento, que consiste en la circunscripción del área epileptógena con la transección subpial de las circunvoluciones que conforman la misma, con secciones perpendiculares al eje mayor de las mismas, en vez de su resección, con la idea de impedir la propagación transversal de la descarga epileptógena, este procedimiento debería encuadrarse dentro de los potencialmente curativos.
No por dejarlo para el final, son menos importantes las MDC que asientan en el área central (área sensorial parietal primaria, surco de Rolando y área motora frontal primaria)35 y el lóbulo de la ínsula de Reil. Respecto a las primeras, para su adecuado tratamiento, es indispensable contar con una necesaria evaluación de IRMf preoperatoria así como el pertinente armamentario neurofisiológico intraoperatorio (PESS-Estimulación Cortical-ECoG). El equipo neuroquirúrgico debe, idóneamente, sopesar toda esta información durante el acto quirúrgico y diseñar la mejor táctica para el paciente, que es aquella que permita la resección de la DCF con la menor morbilidad posible (Caso 2).

Respecto a las DCF que asientan en la corteza insular (5%), constituyen el otro gran desafío neuroquirúrgico para tratar con éxito estas epilepsias36. En nuestra serie se asociaron a DCF del opérculo frontal. Esto permitió, como primer paso quirúrgico, la resección del mismo, lo que deja expuesta la vertiente frontal de la ínsula, permitiendo a través de múltiples ojales de la aracnoides del valle, la resección de la corteza insular, "pelando" los vasos silvianos con microaspiración, curetas y pinzas de biopsia, todo bajo microscopio óptico con adecuada magnificación. Particularmente, casi no utilizo (Pomata) coagulación bipolar, reemplazando las mismas con muy pequeños trozos de Spongostán® y/o Surgicel® para cohibir las pequeñas hemorragias, de los múltiples vasos37,38, que acompañan a las resecciones. La paciencia es el mejor aliado que he encontrado (Pomata) para operar esta patología en esta localización, sin complicaciones ni secuelas (Caso 3).

Finalizando los comentarios sobre las técnicas quirúrgicas, queremos puntualizar con firmeza nuestra convicción de que en la cirugía de la epilepsia, en general, pero muy particularmente en el tratamiento de las MDC, las reoperaciones motivadas por aparentes fracasos de primeros procedimientos pueden transformarse en éxitos si el equipo de profesionales abocados al tratamiento de las epilepsias refractarias no baja los brazos, reestudia a los pacientes que padecen ese avatar, insisten en la relocalización de un eventual resto/nuevo foco epileptógeno y una vez logrado ese objetivo, se decide la reoperación.
Neurofisiología intraoperatoria
En ciertas circunstancias, se hace necesario realizar controles intraoperatorios a efectos de asegurar que no quede un foco residual. Para ello se realiza monitoreo electrocorticográfico (ECoG intraoperatoria)39-42 y así, de ser necesario, se amplía la resección a áreas circundantes a la lesión, procedimiento conocido como lesionectomía ampliada43. En nuestra serie hemos recurrido a la ECoG intraoperatoria en 38 (25,3%) pacientes con alguna variedad de MDC, con localización extratemporal (37 niños y 1 adulto, a éste además se le realizó estimulación cortical intraoperatoria para localizar área motora) y en 14 (9,3%) pacientes, con lesiones temporales, (13 niños y 1 adulto). Cuando la MDC se encuentra en el área central se recurre a los potenciales evocados somatosensitivos (PESS) y/o estimulación cortical intraoperatoria, a efectos de evitar el riesgo de complicaciones vinculadas a lesiones quirúrgicas en dicha área. En la presente serie se empleó PESS intraoperatoria en 4 (2,6%) pacientes, todos niños.
Complicaciones
En cuanto a las complicaciones, fueron: paresia completa del III par craneano en 2 pacientes, hemiparesia en 4, todas transitorias, con recuperación entre los 2 y 4 meses postoperatorio, excepto en una paciente que logró su recuperación en 9 meses, quedando como secuela menor, una distrofia, con posible base dispráxica, costo indudablemente menor, en el intento de curar o controlar su epilepsia refractaria. Hubo, además, 1 hidrocefalia y 1 edema postresección. Representan el 5,3%. No hubo secuelas motoras.
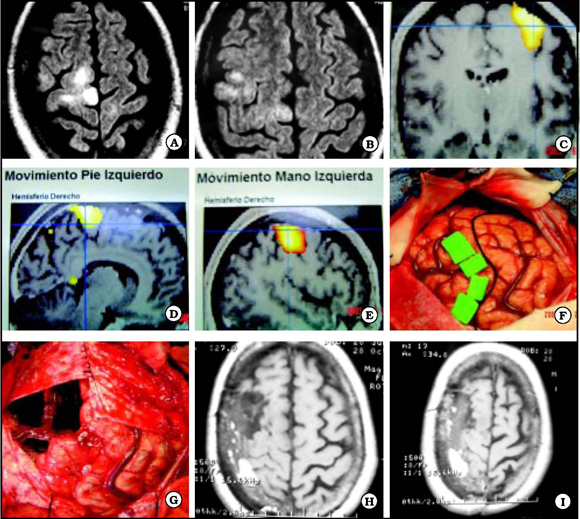
Caso 4. S. C. (f) 59 años. Epilepsia de 9 años de evolución. Crisis jacksonianas y CPC. Cirugía (06/05): lesionectomía + TSM de área central derecha (perirrolándica). Monitoreo ECoG y estimulación cortical de áreas de pie, brazo y mano, intra-op. Engel IA. A y B. Muestran lesión de área central derecha. C, D y E. IRMf que muestra la localización de las áreas de la mano y pie izquierdos. G. Muestra delimitación intraoperatoria de área lesional / epileptógena y Fig 4F. Lodge quirúrgica, con la circulación venosa respetada. H e I. IRM a los 3 meses postoperatoria.
Reoperaciones
Respecto a las re-operaciones, fueron 22, representan el 14.6%. Por epilepsia fueron 18 (12%), realizándose ampliaciones de resecciones y desconexiones en 16 (10.6%); un paciente fue reoperado por recidiva de DNT; se realizaron 2 implantes de ENV, en una lesionectomía y en una HF previas.
Consideraciones anatomopatológicas
Las MDC de esta población representan el 26,3%. La más común fue la DCF, representando el 57,3% (86/ 150), seguida por los DNTs con el 22% (33/150)44,45, las ET en una proporción de 8% (12/150), las hemimegaloencefalias con 6,6% (10/150) y los hamartomas en el orden de 3,3% (5/150). Es importante señalar la relativamente alta frecuencia de doble/ triple patología así como las "patologías asociadas", 19,3% (29/150)46.
Las muestras obtenidas de las cirugías fueron analizadas por los médicos patólogos que, bajo la jefatura de la Dra. Ana Lía Taratuto, se desempeñan en el Hospital de Pediatría Garrahan (ver trabajo de Dra. Lubienieki) y en FLENI, Dr. Gustavo Sevlever.
Resultados. Como ya se ha dicho, los resultados quirúrgicos de los pacientes epilépticos se evalúan aplicando la Clasificación de Engel. De acuerdo a ella, la presente población presenta la siguiente distribución porcentual: clase I, 75,3% (113/150), clase II, 11,3% (17/150), clase III, 4% (6/150), clase IV, 2% (3/150). Se excluyen 7 pacientes no clasificables, debido a que la clasificación de Engel no la hemos aplicado en procedimientos paliativos. También se excluye un paciente cuyo seguimiento fue perdido. No se clasifican 2 pacientes con menos de 1 año postoperatorio. Los resultados obtenidos en la presente serie son similares a los reportados por otros centros35,47,48 .
Respecto al grupo de pacientes con DCF, son 86, correspondiendo 59 a la población pediátrica. De los 42 de localización extratemporal, 29 (69%) están en clase I, 5 en clase II (11,9%); de los 17 de localización temporal, 12 (70,5%) están en clase I, 3 (17,6%) en clase II y 2 (11,7%) en clase III. En cuanto a las displasias corticales extratemporales correspondientes a la población adulta, los 3 (100%) están en clase I; de los 24 de localización temporal, 18 (75%) están en clase I y 6 (25%) en clase II. Kral T y col reportan su casuística de 49 pacientes con DCF que, con una media de 8 años de seguimiento, el 76% está libre de crisis (clase I de Engel) y un subgrupo (47%) está completamente libre de crisis (Engel IA). Concluyendo que el tratamiento quirúrgico de las DCF es exitoso no sólo a corto sino también a largo plazo47. Otros centros reportan datos similares. Benifla et al reportan los resultados obtenidos en 22 niños epilépticos operados por lesiones localizadas en la región rolándica, 13 fueron DCF. Global-mente, los resultados fueron buenos a muy buenos, con el 64% de los pacientes en clase I y 18% en clase II. Por análisis de regresión logística univariado obtuvieron que la edad al momento de la cirugía fue estadísticamente significativa como factor predictivo de los resultados respecto a la epilepsia (p < 0.024)35.
Una consideración especial merece la patología dual, la "triple patología" y las "patologías asociadas". De este grupo, corresponden a la población pediátrica 14 pacientes, de ellos 12 están en Engel I y 2 en Engel II. Respecto a la población adulta, sólo con doble patología, son 19, y se encuentran 14 en clase I y 5 en clase II. Como se observa, los pacientes operados por patología malformativa de la corteza cerebral y de las estructuras mesiales temporales, únicas o asociadas a otras patologías del lóbulo temporal, con distintas técnicas quirúrgicas, tienen buenos o muy buenos resultados, Engel I y II49-51.
Respecto a la correlación entre resultados y procedimientos, teniendo presente que se consideran muy buenos y buenos resultados los pacientes clasificados en las clases I y II de Engel, los porcentajes siguientes corresponden a ambas: las lesionectomías puras son el 88,8%, las lesionectomías ampliadas, por otra parte, están en clase I el 94,1%. Las corticectomías están en el 90,9%, las polectomías 100%, las LATS en el 97,2%, las resecciones anteromesiales de Spencer en el 100%, las selectivas de las estructuras mesiales temporales, el 100% en clase I, las hemisferectomías funcionales en el 70%, las hemisferotomías están en clase I el 75%. La única hemi-hemisferectomía está en clase I y, finalmente, los 2 pacientes con TSM están en clase I (100%). La única hemisferectomía anatómica, implementada en un niño con hemimegaloencefalia, está en clase IV, debido a la anormalidad del hemisferio contralateral, no detectada previamente, posibilidad siempre presente en esta patología. Del análisis se desprende que, los resultados obtenidos no dependieron de las técnicas quirúrgicas utilizadas, siendo expresión de una adecuada planificación estratégica pre e intraoperatoria.
CONCLUSIONES
Las MDC representaron el 26,3% (150/570) de pacientes sometidos a tratamiento quirúrgico por epilepsia refractaria. Estos pacientes usualmente presentan un comienzo temprano y una evolución desfavorable de la epilepsia. Sin embargo, la respuesta al tratamiento quirúrgico fue buena con 130/150 (86,6%) en Engel clase I y II. Asimismo, los pacientes con patología doble, triple o "asociadas" todos se encuentran en clase I y II de Engel, es decir muy buenos y buenos resultados. Esto sugiere que la cirugía debería ser considerada como una temprana opción terapéutica, también en esta patología.
Tanto la ECoG como la IRM intraoperatorias resultaron herramientas útiles en la estrategia intraoperatoria, incidiendo en la decisión de ampliar la resección, y/o la complementación con TSM.
Para el tratamiento quirúrgico se hizo necesario implementar prácticamente todos los procedimientos quirúrgicos de que se dispone actualmente, tanto resectivos como desconexiones. Un desafío particular representó la estrategia para el tratamiento de DCF que asentaban en área central, áreas de la palabra y de la ínsula de Reil.
Agradecimientos
Al Servicio de Neurología y Neurofisiología. Hospital Garrahan.
A los Servicios de Neurología y Neurofisiología, Anatomía Patológica y Neurología Cognitiva del Instituto FLENI.
1. Barkovich AJ, Kuzniecky RI, Dobyn WB, Jackson GD, Becker LE, Evrard P. Classification scheme for malformations of cortical development (Review). Neuropediatrics 1996; 27(2): 59-63. [ Links ]
2. Palmini A, Najm I, Avanzini G, Babb T, Guerrini R, Foldvary-Schaefer N, Jackson G, Lüders HO, Prayson R, Spreafico R, Vinters HV. Terminology and classification of the cortical dysplasias. Nerology 2004; 62(6 Suppl 3): S2-8 Review. [ Links ]
3. Taylor DC, Falconer MA, Bruton JC, Corsellis JAN. Focal dysplasia of the cerebral cortex in epilepsy. J Neurol Neurosurg Psychiatry 1971; 34: 369-87. [ Links ]
4. Marin-Padilla M. Perinatal brain damage post-injury cortical reorganization (acquired cortical dysplasia and epilepsy. Neuropathology and Applied Neurobiology 2001; 27: 1-3. [ Links ]
5. Crino PB. (2009): Focal brain malformations: Seizures, signaling, sequencing. Epilepsia 2009; 50 (Suppl. 9): 3-8. [ Links ]
6. Blümke I, Vinters HV, Armstrong D, Aronica E, Thom M, Spreafico R. (2009). Malformations of cortical development and epilepsies: neuropathological findings with emphasis on focal cortical dysplasia. Epileptic Disord 2009; 11(3): 181-93. [ Links ]
7. Thom M, Sisodiya S. Pathology of neocortical epilepsy. En: Textbook of Epilepsy Surgery 2008; Chapt 142. Pag 1338-1348. Hans O. Lüders, editor. Informa Healthcare. [ Links ]
8. Spreafico R, Becker AJ. Pathology of malformations of cortical development. En: Textbook of Epilepsy Surgery 2008; Chapt 143. Pag 1349-1358. Hans O. Lüders, editor. Informa Healthcare. [ Links ]
9. Olivier A, Andermann F, Palmini A, Robitaille Y. Surgical Treatment of the Cortical Dysplasias. En: Dysplasias of the Cerebral Cortex and Epilepsy. Chap 42. Pag 351-366. Editors: Guerrini R, Andermann F, Canapicchi R, Roger J, Zifkin BG and Pfanner P. Lippincott - Raven. 1996. [ Links ]
10. Nieuwenhuys R, Voogd J, van Huijzen C. The Human Central Nervous System. Fourth Edition. Springer. Berlin - Heidelberg. 2008. Pag 498. [ Links ]
11. Carpenter M. Sutin J. Neuroanatomía Humana. Buenos Aires. El Ateneo. 1990. [ Links ]
12. Zilles K. Architecture of the Human Cerebral Cortex. In The Human Nervous System. Second Edition 2004. Chapter 27 Paxinos G, Mai JK, editors. Elsevier Academic Press, San Diego, CA - London, UK. Elsevier, Inc. [ Links ]
13. Mathern GW. Challenges in the surgical treatment of epilepsy patients with cortical dysplasia. Epilepsia 2009; 50(Suppl 9): 45-50. [ Links ]
14. Pomata HB, González R, Bartuluchi M, Petre C, Ciraolo C, Caraballo R, Cersócimo R, Tenembaum S, Soprano AM, Medina CS, Rabinowicz A, Waisburg H, Taratuto AL, Monges J. Extratemporal Epilepsy in children: candidate selection and surgical treatment. Child's Nerv Syst 2000; 16: 842-50. [ Links ]
15. Tassi L, Meroni A, Deleo F, Villani F, Mai R, Giorgio LR, Colombo N, Avanzini G, Falcone Ch, Bramerio M, Citterio A, Garbelli R, Spreafico R. Temporal lobe epilepsy: neuropathological and clinical correlations in 243 surgically treated patients. Epileptic Disord, 2009;11 (4): 281-92. [ Links ]
16. Colombo N, Salamon N, Raybaud C, Ozcara C, Barkovich AJ. Imaging of malformations of cortical development. Epileptic Disord. 2009; 11(3): 194-205. [ Links ]
17. Madan N, Grant PE. (2009). New directions in clinical imaging of cortical dysplasias. Epilepsia 2009; 50 (Suppl 9): 9-18. [ Links ]
18. Widdess-Walsh P, Diehl B, Najm I. Neuroimaging of focal cortical dysplasia. J Neuroimaging. 2006; 16 (3): 185-96. [ Links ]
19. Baert AL, Krauth M, Sartor K. Presurgical neurofunctional assessment. En: Clinical Functional MRI. Chap. 2007; Pag 175-182. Editor: .... Springer. [ Links ]
20. Palmini A, Gambardella A, Andermann F, Deueau F, Da Costa JC, Olivier A, Tampoeri D, Gloor T, Quesney F, Andermann E, Paglioli E, Paglioli-Neto E, Coutinho L, Leblanc R, Kim H-I Intrinsic epileptogenity of human dysplastic cortex as suggestive by corticography and surgical results. Annals of Neurology 1995; 37: 476-487. [ Links ]
21. Ogg RJ, Laningham FH, Clarke D, Einhaus S, Zou P, Tobias ME, Boop FA. Passive range of motion functional resonance imaging localizing sensorimotor cortex in sedaded children. J Neurosurg Pediatr 2009; 4 (4): 317-22. [ Links ]
22. Duchowny M. Clinical, functional and neurophysiologic assessment of dysplasic cortical networks: Implications for cortical functioning and surgical management. Epilepsia 2009; 50 (9): 19-27. [ Links ]
23. Springer JA, Binder JR, Hammeke TA, Swanson SJ, Frost JA, Bellgowan PS, Brewer CC, Perry HM, Morris GL, Mueller WM. Language dominance in neurologically normal and epilepsy subjects: a functional MRI study. Brain 1999; 122:2033-46. [ Links ]
24. Arora J, Pugh K, Westerveld M, Spencer S, Spencer DD, Todd Constable R. Language lateralization in epilepsy patients: fMRI validated with the Wada procedure. Epilepsia. 2009; 50 (10): 2225-41. [ Links ]
25. Everts R, Harvey AS, Lillywhite L, Wrennall J, Abbott DF, Gonzalez L, Kean M, Jackson GD, Anderson V. (2009) Language lateralization correlates with verbal memory performance in children with focal epilepsy. Epilepsia. 2009 Dec 2. [on line] [ Links ]
26. Aubert S, Wendling F, Regis J, McGonigal A, Figarella-Branger D, Peragut J-C, Girard N, Chauvel P, Bartolomei F. Local and remote epileptogenicity in focal cortical dysplasias and neurodevelopmental tumours. Brain 2009; 132; 3072-86. [ Links ]
27. Sánchez González F, Dimitrovic L, Funes T, Clar F, Carrasco E, Di Masi G. (2009). Planeamiento neuroquirúrgico informático: resultados con su utilización. Rev Argent Neuroc 2009; 23: 9-14. [ Links ]
28. Nimsky C, Ganslandt O, Fahlbusch R. (2004). Functional neuronavigation and intraoperative MRI. Adv Tech Stand Neurosurg 2004; 29: 229-63. [ Links ]
29. Fusco L, Vigevano F. Hemispherectomy in Hemimegalencephaly: a particular type of attack observed after surgery. En: Dysplasias of the Cerebral Cortex and Epilepsy. Chap 42. Pag 351-366. Editors: Guerrini R, Andermann F, Canapicchi R, Roger J, Zifkin BG and Pfanner P. Lippincott - Raven. 1996. [ Links ]
30. Pomata HB. Functional Hemispherectomy Variant. A report of twenty one cases. (2004) Rev Argent Neuroc 2004; 18 (S2): 38-43. [ Links ]
31. Pinard J-M, Delalande O, Dulac O. Hemispherotomy and Callosotomy for Cortical Dysplasia in Children. En: Dysplasias of the Cerebral Cortex and Epilepsy. Chap 44. Pag 375-381. Editors: Guerrini R, Andermann F, Canapicchi R, Roger J, Zifkin BG and Pfanner P. Lippincott - Raven. 1996. [ Links ]
32. Vázquez C, Barrios L, Bartuluchi M, Medina C, Petre C, Pomata H. Hemisferectomías y hemi-hemisferectomías: nuestra experiencia acerca de 49 casos. Rev Argent Neuroc 2008; 22: 131-3. [ Links ]
33. Pressler RM, Binnie CD, Elwes RDC, Polkey CE. Return of generalized siezures and discharges after callosotomy. Chap 19. Pag 171-187. Advances in Neurology. Vol 81. Plasticity in Epilepsy: Dynamic aspects of brain function. Philadelphia. Lippincott Williams & Wilkins. 1999. [ Links ]
34. Morrell F, Whisler WW, Bleck TP. Multiple subpial transection: a new approach to the surgical treatment of focal epilepsy. J Neurosurg. 1989; 70 (2): 231-9. [ Links ]
35. Benifla M, Sala F Jr, Jane J, Otsubo H, Ochi A, Drake J, Weiss S, Donner E, Fujimoto A, Holowka S, Widjaja E, Snead OC 3rd, Smith ML, Tamber MS, Rutka JT. Neurosurgical management of intractable rolandic epilepsy in children: role of resection in eloquent cortex. Clinical article. J Neurosurg Pediatr 2009; 4(3):199-216. [ Links ]
36. von Lehe M, Wellmer J, Urbach H, Schramm J, Elger CE, Clusmann H. Insular lesionectomy for refractory epilepsy: management and outcome. Brain 2009; 132 (Pt 4):1048-56. [ Links ]
37. Ture U, Yasargil MG, Al-Mefty O, Yasargil DC. Arteries of the insula. J Neurosurg 2000; 92(4): 676-687. [ Links ]
38. Tanriover N, Rhoton AL, Kawashima M, Ulm AJ, Yasuda A. Microsurgical anatomy of the insula and sylvian fissure. J Neurosurg 2004; 100(5): 891-922. [ Links ]
39. Davies KG, Weeks RD. Results of cortical resection for intractable epilepsy using intra-operative corticography without chronic intracranial recording. Br J Neurosurg 1995; 9(1): 7-12. [ Links ]
40. Keene DL, Whiting S, Ventureyra EC. Electrocorticography. Epileptic Disord 2000; 2(1): 57-63. [ Links ]
41. Tripathi M, Garg A, Gaikwad S, Bal CS, Chitra S, Prasad K, Dash HH, Sharma BS, Chandra PS. Intra-operative electrocorticography in lesional epilepsy. Epilepsy Res. 2010; Jan 13. [On line] [ Links ]
42. Morales Chacón L, Estupiñan B, Lorigados Pedre L, Trápaga Quincoses O, García Maeso I, Sánchez A, Bender J, García ME, Báez Martín M, Zaldivar M, Gómez A, Orozco S, Rocha Arrieta L. Microscopic mild focal cortical displasia in temporal lobe dual pathology: An electrocorticography study. Seizure 2009; 18: 593-600. [ Links ]
43. Fried I, Cascino GD. Lesional Surgery. En: Surgical Treatment of the Epilepsies. Second Edition 1993; Chapt 41. Pag 501-509. Edited by J. Engel Jr. Raven Press, ; Ltd- New York. [ Links ]
44. Taratuto AL, Pomata H, Sevlever G, Gallo G, Monges J. Dysembryoplastic neuroepithelial tumor: morphological, immunocytochemical, and deoxyribonucleic acid analyses in a pediatric series. Neurosurgery 1995; 36(3): 474-81. [ Links ]
45. Chang EF, Christie C, Sullivan JE, García PA, Tihan T, Gupta N, Berger MS, Barbaro NM. (2010). Seizure control outcomes after resection dysembrioplastic neuroepitelial tumor in 50 patients. J Neurosurgery Pediatr 2010; 5(1): 123-30. [ Links ]
46. Donmez FY, Yildirim M, Erkek N, Karacan CD, Coskun M. Hippocampal abnormalities associated with various congenital malformations. Childs Nerv Syst 2009; 25: 933-9. [ Links ]
47. Kral T, von Lehe M, Podlogar M, Clusmann H, Süssmann P, Kurthen M, Becker A, Urbach H, Schramm J. Focal cortical dysplasia: long term seizure outcome after surgical treatment. J Neurol Neurosurg Psychiatry. 2007; 78(8): 853-6. [ Links ]
48. Lerner JT, Salamon N, Hauptman JS, Velasco TR, Hemb M, Wu JY, Sankar R, Donald Shields W, Engel J Jr, Fried I, Cepeda C, Andre VM, Levine MS, Miyata H, Yong WH, Vinters HV, Mathern GW. Assessment and surgical outcomes for mild type I and severe type II cortical dysplasia: a critical review and the UCLA experience. Epilepsia. 2009; 50(6): 1310-35. [ Links ]
49. Kim DW, Lee SK, Nam H, Chu K, Chung CK, Lee SY, Choe G, Kim HK. (2009) Epilepsy with dual pathology: Surgical treatment of cortical dysplasia accompanied by hippocampal sclerosis. Epilepsia. 2009; Nov 16. [on line] [ Links ]
50. Pomata HB, Bartuluchi M, Cuello M, Vázquez C, Petre C, LIbienieki F. Epilepsia refractaria del lóbulo temporal secundaria a patología dual. Nuestra experiencia acerca de 32 casos. Rev Argent Neuroc 2008; 22(2): 128-30. [ Links ]
51. Maton B, Krsek P, Jayakar P, Resnick T, Koehn M, Morrison G, Ragheb J, Castellano-Sánchez A, Duchowny M. ßMedically intractable epilepsy in Sturge-Weber syndrome is associated with cortical malformations: implications for surgical therapy. Epilepsia 2009; Sep 22 (Abstract). [ Links ]