Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencia del suelo
versión On-line ISSN 1850-2067
Cienc. suelo v.23 n.2 Buenos Aires ago./dic. 2005
TRABAJOS
Emisiones de óxido nitroso en un cultivo de soja [Glycine max (L.) Merrill]: efecto de la inoculación y de la fertilización nitrógenadaIgnacio A Ciampitti, Esteban A Ciarlo & Marta E Conti1
1Cátedra de Edafología de la FAUBA. San Martín 4453 (1417) Capital Federal
ciampitt@agro.uba.ar
Recibido: 01/08/05
Aceptado: 07/11/05
RESUMEN
El óxido nitroso absorbe radiación infrarroja contribuyendo al efecto invernadero; este gas es producido principalmente en el suelo, mediante los procesos de nitrificación y denitrificación. En un estudio a campo, sobre un suelo Argiudol típico, se evaluó el efecto de la fertilización y la inoculación con Bradyrhizobium japonicum en un cultivo de soja [Glycine max (L.) Merrill], sobre las emisiones de óxido nitroso. Los gases se extrajeron de cilindros de PVC y la lectura se realizó con cromatografía gaseosa. Las emisiones presentaron valores crecientes desde la siembra hacia madurez fisiológica del cultivo, para todos los tratamientos; este comportamiento fue concomitante con la evolución presentada por la humedad edáfica. La fertilización nitrogenada aumentó significativamente (P<0.05) las emisiones y la variable inoculación solo presentó efectos con el mayor nivel de fertilización (P=0.09). Los valores más elevados se observaron en los tratamientos fertilizados con mayor dosis e inoculados. La variable que mejor explica las emisiones es el nivel de nitratos del suelo (r2 = 0.1899; P=0.0231).
Palabras Claves. Denitrificación; Nitrificación; Nitrógeno.
Nitrous oxide emission during a soybean [Glycine max (L.) Merril] culture: inoculation and nitrogen fertilization effects
ABSTRACT
Nitrous oxide gas absorbs infrared radiation contributing to the greenhouse effect; this gas is produced mainly in soil, by means of the processes of nitrification and denitrification. In a field study at the FAUBA on a typic Argiudol, we evaluated the effect of fertilization and inoculation with Bradyrhizobium japonicum during a soybean culture [Glycine max (L.) Merrill], on nitrous oxide emisión. Gases were sampled with PVC cylinders and were read with gaseous chromatography. Emissions presented increasing values from seeding towards physiological maturity for all treatments; this behavior was similar to the evolution presented by nitrate level and soil moisture. Nitrogen fertilization significantly increased (P<0.05) nitrous oxide emissions and inoculation only had a significant effect with the highest level of fertilization (P=0.09). Plots fertilized at highest dose and inoculated gave the greatest nitrous oxide emissions. The variable that better explains the emissions is the nitrate level (r2 = 0.1899; P=0.0231).
Keywords. Denitrification; Nitrification; Nitrogen.
INTRODUCCIÓN
El óxido nitroso, N2O, absorbe radiación infrarroja de la atmósfera contribuyendo al efecto invernadero, siendo actualmente el responsable del 5% del calentamiento global y pudiendo llegar hasta valores del 10% en el futuro (Mosier, 1998). En la actualidad, la concentración atmosférica de óxido nitroso se encuentra alrededor de 310 ppb, aumentando a un ritmo de 0,6-0,9 ppb (0,25%) por año (Kaiser et al., 1998). El óxido nitroso no se pierde en la tropósfera: el único mecanismo significativo de eliminación es el transporte hacia la estratosfera, donde es fotolíticamente oxidado a óxido nítrico, el cual reacciona con el ozono estratosférico, destruyéndolo.
El 70% del óxido nitroso emitido desde la biosfera deriva del suelo, a través de los procesos de nitrificación y denitrificación, movilizados por intensas fertilizaciones nitrogenadas en cultivos agrícolas (Rochette, 2004), siendo la denitrificación el principal proceso responsable de la formación de este gas. Los controles de la producción de óxido nitroso son: la humedad, el nitrógeno mineral y el carbono orgánico fácilmente disponible.
La agricultura es considerada responsable de aproximadamente el 20-70% del óxido nitroso antropogénico que es liberado a la atmósfera (Marinho et al., 2004). Los distintos usos y prácticas de manejo agrícola afectan los niveles de producción de óxido nitroso, a través del cambio en los parámetros que regulan este tipo de pérdidas de nitrógeno. La producción con híbridos y variedades de alto rendimiento induce al uso de fertilizantes en forma continua y masiva, fundamentalmente de nitrógeno y fósforo, pudiendo producir cambios en la naturaleza de los suelos. Esta práctica de manejo aumenta el riesgo de contaminación ambiental por lixiviación, emisiones gaseosas o incremento de la concentración de sales de suelos y capas freáticas. Se proyecta que el uso de fertilizantes y la fijación biológica continuarán aumentando durante los próximos 100 años (Mosier et al., 1996). Se ha estimado que alrededor de 1,5 Tg de nitrógeno son inyectados directamente a la atmósfera cada año como óxido nitroso, resultado de aplicaciones de fertilizantes a ecosistemas agrícolas, sin tener en cuenta los abonos animales ni la fijación biológica de nitrógeno (Watson, 1992). Esto representa acerca del 44% de los aportes antropogénicos y alrededor del 13% de los totales. En el año 1997 la mayor fuente de óxido nitroso en los Estados Unidos fue el uso de fertilizantes nitrogenados (EIA, 1998).
El cultivo de soja [Glycine Max (L.) Merrill] es uno de los componentes más importantes de los sistemas agrícolas de Argentina, totalizando 15 millones de hectáreas de superficie ocupada y con una producción de 36.5 millones de toneladas anuales (INDEC, 2004). La introducción de leguminosas al sistema agrícola, incrementa la producción de alimentos y la fijación biológica de nitrógeno, pero puede contribuir a la emisión de óxido nitroso. La presencia de plantas de soja puede afectar las emisiones de numerosas maneras, dependiendo del momento ontogénico, debido al efecto sobre las variables que controlan las emisiones. El cultivo de soja absorbe agua y nitrógeno durante los primeros estadíos del ciclo vegetativo, lo que disminuye las condiciones predisponentes de las emisiones. Hacia la finalización del ciclo, la senescencia y descomposición de los residuos, de baja relación C/N o sea ricos en N, puede generar un incremento de la producción de óxido nitroso (Yang & Cai, 2005). Por otro lado, la bacteria Bradyrhizobium japonicum se asocia al cultivo de soja a través de nódulos radicales, incorporando nitrógeno al suelo. que puede ser perdido en forma gaseosa a través de los procesos de denitrificación y nitrificación. En adición, dichos microorganismos son capaces de denitrificar y producir óxido nitroso (Mosier, 1996). Sin embargo, no hay evidencias en la literatura del efecto de la inoculación con organismos simbiontes de un cultivo de leguminosas sobre las emisiones de óxido nitroso. Actualmente existe un escaso conocimiento de las emisiones de óxido nitroso del cultivo de soja. En este trabajo se pone a prueba la hipótesis que, la inoculación de soja con bacterias fijadoras de nitrógeno y la aplicación simultánea de fertilizante nitrogenado incrementan las emisiones de óxido nitroso. Los objetivos fueron cuantificar los efectos de la fertilización, de la presencia de plantas de soja inoculadas con Bradyrhizobium japonicum y no inoculadas, sobre las emisiones de óxido nitroso durante el ciclo de cultivo de soja analizando los distintos controles de la producción de este gas en un Argiudol típico.
METODOLOGÍA
Ubicación del experimento
Se realizó un experimento en condiciones de campo, en un suelo Argiudol típico correspondiente al predio experimental de la Facultad de Agronomía de la Universidad de Buenos Aires. Al momento inicial del ensayo el suelo presentó valores de N-NO3-= 4,.08 mg kg -1(Carole & Scarigelli, 1971); % Cox= 2,15 (Walkley & Black, Nelson & Sommers, 1982) ; %Nt= 0,20 (Kjeldahl); %HE 23,15; pH en una relación suelo-agua 1:2,5=6.8 (Thomas, 1996) y Pext= 89 mg kg-1 (Bray & Kurtz, 1945). El predio se dividió en parcelas de 2m x 2m, constituyendo las mismas las unidades experimentales y que se asignaron aleatoriamente a los tratamientos específicos, descriptos en el siguiente punto.
Diseño experimental general
El esquema básico de los tratamientos es un diseño completamente aleatorizado (DCA), con arreglo factorial completo de tres por tres (3x3), con los factores inoculación y fertilización:
Niveles de la Inoculación
• Sin cultivo (Control). (P0)
• Cultivo de Soja, inoculado.(Pi)
• Cultivo de Soja, no inoculado. (Pni)
En los tratamientos con cultivo (Pi y Pni), se sembró una soja de segunda, transgénica con el gen RR (Resistencia a Glifosato), perteneciente a la marca comercial "Don Mario" cultivar 4800 (Grupo de Madurez IV, hábito de crecimiento Indeterminado), el 28 de diciembre de 2004, y se cosechó en forma manual el 3 de mayo de 2005, a los 126 días desde la siembra. Las malezas en todas las parcelas fueron controladas con aplicaciones semanales o mensuales del herbicida glifosato. Se realizó a Floración (R1) un conteo de nódulos en las raíces principales y secundarias, para determinar el éxito de la inoculación.
Niveles de fertilización
• Sin fertilización (N0)
• Fertilización de nitrógeno como arrancador (15 kg N ha-1.) en forma de urea líquida. Esta cantidad se aplica por única vez al inicio del experimento (N1).
• Fertilización de nitrógeno como arrancador (30 kg N ha-1) en forma de urea líquida. Esta cantidad se aplica por única vez al inicio del experimento (N2).
Medición de emisiones de Oxido Nitroso (N2O)
Para la realización de las mediciones de óxido nitroso, se utilizó el método de "Cámara Cerrada Estática", mediante cilindros de PVC de 15 cm de largo y 11 cm de diámetro interno (Khera et al., 1999). La parte superior del cilindro se cerró herméticamente con una tapa a rosca, donde se ubicó un septum de goma a través del cual se extrajeron las muestras gaseosas de la atmósfera interna con una jeringa (Figura 1). Los cilindros se enterraron 8 centímetros en el suelo y se sellaron cuidadosamente para impedir la pérdida gaseosa al exterior. Cada medición involucró un día de acumulación de gases en los cilindros. Tres muestras gaseosas adicionales de la atmósfera fueron agregadas para ser usados como blancos para el análisis de gas. Una vez tomadas las muestras, éstas fueron transportadas inmediatamente al laboratorio para ser leídas con cromatografía gaseosa. Las determinaciones se realizaron en Cromatógrafo Gaseoso Agilent 6890 y detector ECD, con columna capilar Carboplot, usando como carrier gas helio; las temperaturas de trabajo fueron de 100°C para el horno e inyector y de 250°C para el detector.
El experimento abarcó todo el ciclo del cultivo de soja, desde el día 28 de diciembre de 2004 hasta el día 3 de mayo de 2005 y su posterior descomposición de rastrojos durante un período de tiempo de 60 días. Las muestras de gases fueron tomadas con intervalos de dos semanas entre muestreos durante el ciclo del cultivo. Los momentos de muestreo se correspondieron con los siguientes estadíos fenológicos del cultivo: Siembra (S), un nudo (V1), tres nudos desarrollados (V3), floración (R1), Comienzo de Formación de vainas-Fructificación (R3), Llenado de Granos (R5.5), Máximo tamaño del grano (R6.5), Madurez fisiológica (R8), 17 días después de Cosecha-Madurez Comercial (MC) y 59 días después de cosecha-Presencia de Rastrojos (R). En caso de producirse precipitaciones, la frecuencia de muestreo fue alterada debido a que el cronograma de muestreo debe incluir estos eventos para obtener medidas confiables (Sexstone et al., 1985).
Pretratamientos y determinaciones químicas
Paralelamente, se extrajeron muestras de las parcelas en los mismos días en que se realizaron las determinaciones de emisiones de óxido nitroso para los distintos tratamientos. Dichas muestras fueron sometidas a los pretratamientos de secado a 40 ºC, tamizado por tamiz de 0,2 milímetros (excepto para la técnica de humedad gravimétrica) y sometido a las siguientes determinaciones básicas:
• pH suelo:agua 1:2,5 (Thomas, 1996)
• Carbono orgánico total (Nelson & Sommers, 1982)
• Carbono orgánico soluble (Mazzarino et al., 1993)
• Humedad gravimétrica.
• Nitratos (Carole & Scarigelli, 1971)
Análisis estadísticos
Se realizaron tres repeticiones por cada tratamiento. Se estudió el cumplimiento de los supuestos de homogeneidad de varianza, y normalidad de las emisiones, Log-transformándolas cuando no cumplieron con este último supuesto. Los análisis de los datos de las emisiones gaseosas, acumuladas totales y por día de muestreo, se realizaron mediante análisis de varianza estándar de dos vías, con procedimientos lineales generales (PROC GLM) del Paquete Estadístico SAS (SAS Institute, 1999), con posterior separación de tratamientos por test de comparaciones múltiples según DUNCAN. Se efectuaron análisis de regresión entre las emisiones acumuladas totales y los valores de las variables edáficas medidas, a través del procedimiento PROC REG del SAS
RESULTADOS
Evolución de las emisiones de N2O
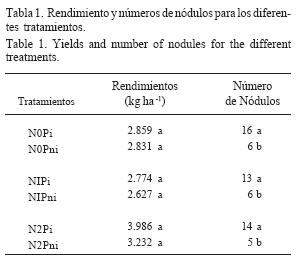
En los tratamientos con presencia de cultivo de soja, los rendimientos no presentaron diferencias significativas con una media de 3.052 kg ha-1, comprobándose visualmente el éxito de la inoculación. En los tratamientos con plantas no inoculadas se observó nodulación de cepas naturalizadas del suelo en las raíces secundarias del cultivo, no observándose presencia de nódulos en la raíz principal. El número de nódulos en los tratamientos con cultivo fue mayor en las parcelas en las cuales se incluyó como tratamiento la práctica de inoculación (Pi), con respecto a los tratamientos no inoculados (Pni) (Tabla 1).
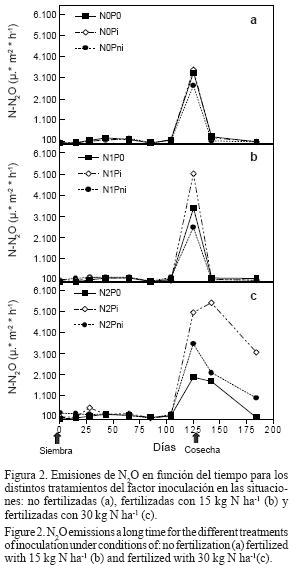
Las emisiones de N2O presentaron una tendencia creciente, desde la siembra hacia la finalización del ciclo del cultivo; la mayor acumulación se produjo durante las etapas fenológicas de Llenado de granos hasta Madurez fisiológica, constituyendo las mismas aproximadamente un 68% de las emisiones totales de óxido nitroso. Luego de la cosecha del cultivo, las emisiones adoptaron una tendencia declinante. Estas tendencias se observaron en todos los tratamientos involucrados en el experimento (Figura 2), y son similares a la evolución de los nitratos y de la humedad del suelo durante un período de 20 días antes y 20 días después de la cosecha (Figura 3c).
Los mayores valores de emisiones de óxido nitroso se observaron en los tratamientos fertilizados con mayores dosis e inoculados con bacterias fijadoras de nitrógeno (N2Pi), durante los últimos intervalos de medición, registrando valores de hasta 5516.10 µg N-N2O m-2 h-1, en el momento de madurez comercial del cultivo, MC-día 142 desde la siembra del cultivo (Figura 2c).
Efecto de la Inoculación y la Fertilización Nitrogenada sobre las emisiones de óxido nitroso
En el análisis de las emisiones acumuladas durante el ciclo del cultivo, se detectaron efectos significativos de las variables fertilización y de la interacción fertilización-inoculación, pero no de la variable inoculación (Tabla 2).


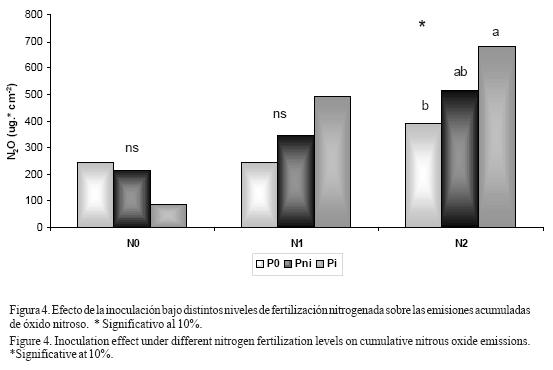
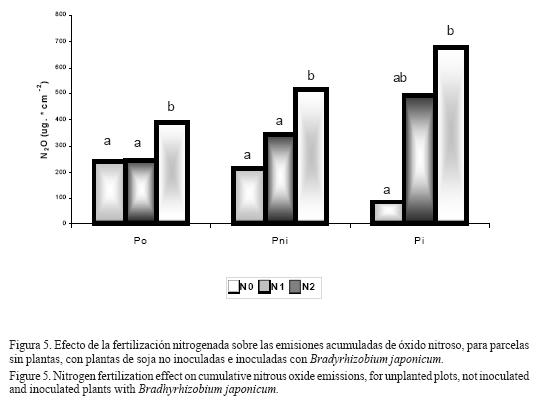
Las emisiones acumuladas de óxido nitroso tendieron a aumentar ante la presencia de plantas de soja, en especial en aquellas inoculadas con microorganismos (Pi>Pni>P0) cuando las parcelas fueron fertilizadas con urea líquida, mientras que cuando no fueron fertilizadas la presencia del cultivo tendió a disminuciones en las emisiones de dicho gas (P0>Pni>Pi) (Figura 4). Sólo en los tratamientos con mayores niveles de fertilización (N2) hubo un ligero efecto significativo del factor inoculación (P=0.09), no manifestándose en los otros tratamientos. Tampoco se observaron efectos del factor inoculación sobre las emisiones gaseosas cuando se realizó el análisis en cada día de medición
La fertilización nitrogenada aumentó significativamente (P<0.05) las emisiones acumuladas de óxido nitroso (Figura 5). Las diferencias en emisiones entre tratamientos de fertilización son mayores en los tratamientos con plantas de soja, especialmente en aquellas inoculadas, aumentando 1,6; 2,4 y 7,8 veces las emisiones ante el agregado de 30 kilogramos de nitrógeno por hectárea en las situaciones sin plantas, con plantas de soja no inoculadas y con plantas inoculadas, respectivamente.
Relación de las Emisiones de N2O con las variables edáficas medidas
Las emisiones de óxido nitroso acumuladas no se relacionaron estadísticamente con el carbono orgánico soluble total, carbono orgánico total, humedad y el pH. La única variable que presentó correlación con las emisiones fue el contenido de nitratos del suelo (r2 = 0,1899; P=0,0231) durante toda la realización del experimento (Figura 6).

DISCUSIÓN
La evolución de los gases en función del tiempo es similar en los tratamientos con plantas de soja con respecto a los sin planta, coincidiendo con hallado por Marinho et al. (2004), en un cultivo de soja de la región de Mississipi. Las emisiones de óxido nitroso presentan una evolución similar a los niveles de nitratos y humedad edáficos, durante el período de mayores pérdidas gaseosas. Este período que comienza a partir del llenado de granos y finaliza hacia la madurez fisiológica del cultivo fue determinante en las emisiones de óxido nitroso durante el cultivo de soja. Los resultados son coincidentes con los hallados por Yang & Cai (2005), quienes encontraron que alrededor del 94% de las emisiones totales se concentraron en dicho período. Por lo tanto se puede considerar a este intervalo de tiempo, como el "Período Crítico de las Emisiones".
Algunos autores sugieren que la fijación biológica de nitrógeno, producto de la colonización de raíces de leguminosas por bacterias simbiontes, nativas o inoculadas, es una importante fuente de óxido nitroso (Mosier et al., 1996; Mosier, 1998). Por el contrario, en el presente trabajo sólo se encontró un ligero efecto significativo (P=0.09) de la presencia del cultivo de soja sobre las emisiones de óxido nitroso en las situaciones con mayor dosis de fertilización, [coincidiendo con lo predicho por Breitenbeck & Bremner (1989). Es probable que a pesar de observar que las bacterias fijadoras simbióticas eran capaces de denitrificar nitratos en condiciones anaeróbicas, la población de este microorganismo sea muy pequeña para tener una influencia de importancia relativa en la tasa de denitrificación de los suelos].
El efecto de la fertilización nitrogenada sobre las emisiones observado en el presente trabajo es coincidente con lo hallado por numerosos autores (Kaiser et al., 1998; MacKenzie et al., 1998; Ghosh et al., 2002). Los mayores valores de emisiones de los tratamientos con plantas de soja y fertilizados, donde los nitratos son adecuados para el proceso denitrificatorio, se deberían a que el cultivo aporta material carbonado fácilmente disponible, producto de la descomposición de raíces durante el final del ciclo de cultivo. En el presente trabajo encontramos evidencia de esta información la en la evolución del carbono soluble, constituido por azúcares y aminoácidos de la solución del suelo, el cual disminuye en el período donde las emisiones de óxido nitroso se incrementan. Esto implica que el carbono más fácilmente disponible para los microorganismos es consumido y utilizado como sustrato elemental para el crecimiento de la flora y fauna microbiana, favoreciendo de esta manera a la totalidad de microorganismos y específicamente a los nitrificadores y denitrificadores del suelo.
Se considera que, en condiciones de campo, la denitrificación estaría limitada por la cantidad de carbono susceptible de ser mineralizada (Khalil et al., 2001; Sainz Rozas et al., 2001). La biomasa de bacterias heterotróficas, entre ellas las denitrificadoras, está probablemente controlada en forma primaria por la disponibilidad de carbono bajo condiciones aeróbicas, aumentando las pérdidas por denitrificación (Palma et al., 1997). El aporte diferencial de materia seca puede observarse en la tabla 2, los mayores rendimientos de los cultivos inoculados aportan mayores residuos, de baja relación C/N, debido a la alta estabilidad presentada por el índice de cosecha para las condiciones en que fue desarrollado el experimento. Por otro lado, en situaciones sin fertilización nitrogenada, la presencia de plantas probablemente disminuyó seriamente la cantidad de nitrógeno mineral edáfico, limitando el proceso de denitrificación, el principal responsable de las emisiones de óxido nitroso.
La humedad es considerada uno de los principales reguladores de las emisiones gaseosas de nitrógeno a campo (McTaggart et. al., 1997; Clayton et. al., 1997; Dobbie et. al., 1999). Sin embargo en el presente trabajo, no se encontró una relación significativa entre las emisiones y la humedad (P=0.35). La humedad presenta un mayor control en las emisiones de N2O entre el estadío fenológico R5,5 y la Madurez Comercial del cultivo, coincidente con un balance positivo del N disponible en el suelo, por una disminución de la demanda por el cultivo y un incremento en los aportes debido a la descomposición del sistema radicular y nodular (Yang & Cai, 2005). Esta interacción también puede explicar las menores emisiones de óxido nitroso ocurridas al comienzo de la Fructificación-Formación de vainas del cultivo (a los 70 días de establecimiento del cultivo desde la siembra), donde la humedad edáfica presenta valores elevados (30% de humedad m/m), pero la absorción del cultivo disminuye los nitratos del suelo.
La escasa presencia de correlación entre las variables analizadas y las emisiones de óxido nitroso, se debe probablemente a la combinación compleja de temperatura, estructura del suelo, concentración de nitratos, aireación y contenido de humedad, cada factor variando espacial y temporalmente y teniendo efectos independientes en las emisiones de óxido nitroso (Liang & Mackenzie, 1997).
CONCLUSIÓN
Las emisiones de óxido nitroso presentaron una tendencia creciente durante el ciclo del cultivo, presentando una mayor acumulación durante las etapas fenológicas de Llenado de granos-Madurez fisiológica, representando aproximadamente un 68 % en promedio de las emisiones totales de óxido nitroso. Estos altos niveles de emisiones al finalizar el ciclo de cultivo parecen deberse a mayores niveles de carbono producto de la senescencia nodular y radicular. La inoculación con bacterias de la especie Bradyrhizobium japonicum no tuvo efectos de importancia sobre las emisiones de óxido nitroso, mientras que la fertilización nitrogenada tuvo un efecto decisivo en estas pérdidas de nitrógeno del suelo, en especial en aquellas situaciones donde se cultivó soja inoculada con bacterias simbiontes. Las emisiones se correlacionaron solamente con los niveles de nitratos probablemente debido a que dichas emisiones se encuentran reguladas por una combinación compleja de factores, con una fuerte variación espacial y temporal.
BIBLIOGRAFÍA
1. Benckiser, G. 1994. Relationships between field-measured denitrification losses, CO2 formation and difussional constraints. Soil Biology and Biochemistry 26: 891-899. [ Links ]
2. Bøckman, OC & HW Olfs. 1998. Fertilizers, agronomy and N20. Nutrient cycling in Agroecosystems 52: 165-170. [ Links ]
3. Bremner, JM & CS Mulvaney. 1982. Nitrogen total. En: AL Page et al. (eds.). Methods of Soil Analysis, Part 2. Agronomy 9, 2nd edition, Madison, Wisconsin, USA. Pp. 595-624. [ Links ]
4. Bray, RH & LT Kurtz. 1945. Determination of total, organic and available forms of phosphorous in soil. Soil Science, 134: 376-380. [ Links ]
5. Breitenbeck, GA & JM Bremner. 1989. Ability of free living Bradyrhizobium japonicum to denitrify nitrate in soils. Biol. Fertil. Soils 7:219-224. [ Links ]
6. Carole, RS & FP Scarigelli. 1971. Colorimetric determination of nitrate after hydrazine reduction to nitrite. Microchemical Journal 16: 657-672. [ Links ]
7. Clayton, H; IP McTaggart; J Parker; L Swan & KA Smith. 1997. Nitrous oxide emissions from fertilised grassland: A 2-year study of the effects of N fertiliser form and environmental conditions. Biology and Fertility of Soils 25: 252-260. [ Links ]
8. Dobbie, KE; IP McTaggart & KA Smith. 1999. Nitrous oxide emissions from intensive agricultural systems: Variations between crops and seasons, key driving variables, and mean emission factors. Journal of Geophysical Research 104(D21): 26.891-26.899. [ Links ]
9. Duxbury, JM; DR Bouldin; RE Terry & RL III Tate. 1982. Emissions of nitrous oxide from soils. Nature 298: 462-464. [ Links ]
10. EIA – Energy Information Administration. 1998. Emissions of greenhouse gases in the United States 1997. DOE/EIA-0573(97), Washington DC. [ Links ]
11. Ghosh, S; D Majumdar & MC Jain. 2002. Nitrous oxide emissions from kharif and rabi legumes grow on an alluvial soil. Biol. Fertil. Soils 35:473-478. [ Links ]
12. INDEC, 2004. www.indec.gov.ar [ Links ]
14. Kaiser, EA; K Kohrs; M Kucke; E Schnug; O Heinemeyer & JC Munch. 1998. Nitrous oxide release from arable soil: importance of N-fertilization, crops and temporal variation. Soil Biology and Biochemistry 30 (12): 1553-1563. [ Links ]
15. Khalil, MI; P Boeckx; AB Rosenani& O Van Cleemput. 2001. Nitrogen transformations and emission of greenhouse gases fron three acid soils of humid tropics amended with N sources and moisture regime. II. Nitrous oxide and methane fluxes. Communications in Soil Science and Plant Analysis 32 (17-18): 2909-2924. [ Links ]
16. Khera, TS; MS Aulakh & JW Doran. 1999. Significance of soil depth on nitrogen transformations in flooded and nonflooded systems under laboratory conditions. Nutrient Cycling in Agroecosystems 54: 209-213. [ Links ]
17. Liang, BC & AF Mackenzie. 1997. Seasonal denitrificaction rates under corn (Zea mays L.) in two Quebec soils. Canadian Journal of Soil Science 77: 21-25. [ Links ]
18. MacKenzie, AF; MX Fan & F Cadrin. 1998. Nitrous oxide emission in three years as affected by tillage, corn-soybean-alfalafa rotations, and nitrogen fertilization. J. Environ. Qual. 27: 698-703. [ Links ]
19. Marinho, EV; RD DeLaune & CW Lindau. 2004. Nitrous Oxide flux from soybeans grown on mississippi Alluvial Soil. Communications in Soil Science and Plant Analysis 35: 1-8. [ Links ]
20. Mazzarino, MJ; L Szott & M Jimenez. 1993. Dynamics of soil total C and N, microbial biomass, and water-soluble C in tropical agroecosystems. Soil Biology and Biochemistry 25(2): 205-214. [ Links ]
21. McTaggart, IP; H Clayton; J Parker; L Swan & KA Smith. 1997. Nitrous oxide emissions from grassland and spring barley, following N fertiliser appication with and without nitrification inhibitors. Biology and Fertility of Soils 25: 261-268. [ Links ]
22. Mosier, AR; JM Duxbury; JR Freney; O Heinemeyer & K Minami. 1996. Nitrous oxide emissions from agricultural fields: Assesment, measurement and mitigation. Plant and Soil 181: 95-108. [ Links ]
23. Mosier, AR. 1998. Soil processes and global change. Biology and Fertility of Soils 27: 221-229. [ Links ]
24. Nelson, DW; & LE Sommers. 1982. Total carbon, organic carbon and organic matter. In: Page, AL. Methods of Soil Analysis. Part 2. American Society of Agronomy, USA, Agronomy 9, pp. 539-579. [ Links ]
25. Palma, RM; M Rímolo; MI Saubidet & ME Conti. 1997. Influence of tillage system on denitrification in maize-cropped soils. Biology and Fertility of Soils 25: 142-146. [ Links ]
26. Rochette, P; D Angers; G Belanger; M Chantigny; D Prevost & G Levesque. 2004. Emissions of nitrous oxide from alfalfa and soybean crops in eastern Canada. Soil Science Society of America Journal 68: 493-506. [ Links ]
27. Sainz Rozas, HR; HE Echeverría & LI Picone. 2001. Denitrfication in Maize under no-tillage: Effect of nitrogen rate and application time. Soil Science Society of America Journal 65: 1314-1323. [ Links ]
28. SAS Institute Inc.1999 SAS/STAT Guide for personal computers, Version 8. edition Cary NC: SAS Institute Inc. [ Links ]
29. Sexstone, AJ; TB Parkin & JM Tiedje. 1985. Temporal response of denitrification rates to rainfall and irrigation. Soil Science Society of America Journal 49: 99-103. [ Links ]
30. Thomas, GW. 1996. Soil pH and Soil Acidity. En: Sparks DL (Ed.) Methods of Soil Analysis. Part 3. Pp:475-490. Soil Science Society of America, Madison, WI. [ Links ]
31. Watson, RT. 1992. Climate Change 1992, The supplementary reports to the IPCC scientific assesment. In: Greenhouse Gases: Sources and Sinks. Eds. J.T. Houghton, B.A. Callander and S.K. Varney. Pp 25-46. Cambridge Univ. Press, New York, NY, USA. 308p. [ Links ]
32. Yang, L & Z Cai. 2005. The effect of growing soybean (Glycine max L.) on N2O emission from soil. Soil Biology & Biochemestry 37: 1205-1209. [ Links ]














