Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencia del suelo
versión On-line ISSN 1850-2067
Cienc. suelo vol.26 no.2 Ciudad Autónoma de Buenos Aires ago./dic. 2008
TRABAJOS
Influencia de especies forestales sobre la actividad de las enzimas fosfatasa ácida y proteasas en un suelo de bosque
Rl Defrieri*; D Effron*; MP Jimenez* & J Prause**
*Fac. de Agronomía. UBA. Av. San Martin 4453. CP 1417. Capital Federal. e-mail: defrieri@agro.uba.ar.
**Fac. de Ciencias Agrarias. UNNE. Corrientes.
Recibido: 12/02/08
Aceptado: 03/10/08
RESUMEN
Los distintos tipos de cubiertas vegetales y especialmente las especies arbóreas dominantes en los sistemas forestales, afectan las propiedades químicas y bioquímicas de los suelos. Dado que la concentración de algunos nutrientes en la hojarasca, entre ellos N y P, es considerada crítica para la descomposición del material vegetal, el objetivo de este trabajo ha sido estudiar a dos profundidades, la influencia del aporte de biomasa vegetal proveniente de especies forestales dominantes, sobre la actividad de las enzimas fosfatasa ácida y proteasas en un suelo de un monte del Parque Chaqueño Argentino. Se extrajeron muestras de suelo, ubicadas debajo de árboles de cuatro especies del monte, a dos profundidades (0-10 y 10-20 cm), en verano y en invierno sobre las que se determinaron las actividades enzimáticas mencionadas y algunas propiedades edáficas. Para todas las especies y en las dos épocas de muestreo se comprobó que los valores de las actividades de las dos enzimas y los parámetros edáficos analizados resultaron significativamente menores en las muestras a la profundidad de 10-20 cm. La influencia de las especies forestales sobre la actividad de las enzimas estudiadas se puso de manifiesto en el muestreo superficial en donde es mayor la influencia de la incorporación de los residuos orgánicos y en verano. En estas condiciones los valores de las actividades enzimáticas medidas debajo de cada especie oscilaron entre 1.600 y 900 μg p-nitrofenol g-1 h-1 para fosfatasa ácida y entre 850 y 450 mg tirosina g-1h-1 para proteasa. Para dos de las especies estudiadas se pudo vincular la magnitud de su aporte vegetal, su tasa de descomposición y los valores de N y P en hojas senescentes con la magnitud de la liberación de ambas enzimas al suelo según la especie. No se encontró asociación de la influencia de las especies con algunos parámetros edáficos analizados. Por lo tanto la actividad de las enzimas medidas en este trabajo reflejaron mejor los cambios debidos a la influencia de las diferentes especies y de la época del año que otros parámetros químicos del suelo.
Palabras clave. Suelos forestales; Especies forestales; Fosfatasa ácida; Proteasas.
Influence of tree species on the activity of acid phosphatase and protease in a forest soil
ABSTRACT
Plant cover and especially the dominant tree species affect biological and chemical properties of the soil. Litter decomposition rate is affected by its N and P concentration. The aim of this work was to determine the different effects of forest tree species on some biochemical properties of the soil. The study site was located at the Reserva Natural Estricta Colonia Benítez, Chaco, Argentina. Soil samples were taken under trees of the four dominant species in the area and at two depths (0-10 cm and 10-20cm) and moments: in summer and in winter. Activities of acid phosphatase and protease enzymes and some edaphic parameters were determined. The results obtained for all studied variables were significantly lower at the 10-20 cm depth, for all forest species and in both seasons. Values of enzyme activities showed significant differences between species only in surface samples where the incorporation of organic matter is greater and in summer. In these conditions, the values of enzymatic activities obtained in soils under each species ranged between 1,600 and 900 μg p-nitrophenol g-1 h-1 for acid phosphatase and between 850 y 450 g tyrosine g-1h-1 for protease. For two of the studied species, a relationship was found between the amount of litter produced, the different decomposition rates and the N and P concentrations in senescent leaves with the enzyme activities in soils. Inorganic N and available P concentrations in soils did not show significant differences between species. In this study, soil enzyme activities were more related to the overlying species than some measured soil parameters.
Key-words. Forest soil; Forest tree species; Acid phosphatase; Protease.
INTRODUCCIÓN
En los ecosistemas forestales una de las características principales es el desarrollo de una cubierta vegetal que resulta de la caída de hojas, ramas, cortezas y frutos. Esta acumulación de restos orgánicos retiene una gran proporción de los nutrientes extraídos del suelo por los árboles y a su vez estos restos se descomponen liberando nutrientes que son reutilizados por la vegetación y los microorganismos (Smolander & Kitunen, 2002; Ayres et al., 2006). La tasa a la cual se descomponen todos los restos vegetales que se incorporan al suelo depende de factores ambientales, como la temperatura y las precipitaciones y además también depende de las diferentes especies forestales (Gallardo et al., 1991; Prause, 1997).
Los distintos tipos de cubiertas vegetales y especialmente las especies arbóreas dominantes en los sistemas forestales, afectan tanto las propiedades químicas como las biológicas y bioquímicas de los suelos (Priha et al., 2001). Es importante tener en cuenta que el funcionamiento de un suelo no puede ser entendido sin considerar los procesos llevados a cabo por las enzimas (Dilly & Nannipieri, 1998; Andersson et al., 2004). La actividad de las enzimas extracelulares es una medida del potencial que tiene el suelo de llevar adelante los procesos bioquímicos responsables de la liberación de nutrientes para las plantas y microorganismos, a través de la transformación de la materia orgánica (Burns, 1978; Allison & Vitousek, 2005). Las enzimas hidrolíticas tienen un papel fundamental en la degradación de los residuos vegetales participando en la producción de formas asimilables de los nutrientes. Las fosfatasas y las proteasas juegan un importante rol en los ciclos del P y N, respectivamente, (Kang & Freeman, 1999). Sus actividades pueden variar con el tipo de cubierta vegetal y pueden presentar variaciones estacionales (Boerner et al., 2005).
En el sitio de estudio de este trabajo se han determinado en investigaciones previas diferencias en la composición química de hojas, ramas y frutos, en las cantidades medias anuales de aportes de biomasa vegetal y en las velocidades de descomposición de las cuatro especies forestales dominantes (Prause, 1997; Palma et al., 1998, 2000). Además, dado que la concentración de algunos nutrientes en la hojarasca, entre ellos N y P, es considerada crítica para la descomposición del material vegetal (Taylor et al., 1989), el objetivo de este trabajo ha sido estudiar a dos profundidades, la influencia del aporte de biomasa vegetal proveniente de especies forestales dominantes y de importancia económica por la calidad de su madera, sobre la actividad de las enzimas fosfatasa ácida y proteasas en un suelo de un monte del Parque Chaqueño Argentino.
MATERIALES Y MÉTODOS
El sitio de investigación se encuentra en la Reserva Natural Estricta de Colonia Benítez, provincia del Chaco, Argentina. El suelo está clasificado como Argiudol óxico y las principales propiedades del suelo superficial son: C fácilmente oxidable: 28 mg g-1; N total: 3,0 mg g-1; P extractable: 38 mg kg-1; pH: 6,3 (relación suelo:agua 1:2,5); Capacidad de Intercambio Catiónico (CIC): 29 cmolc kg-1 ; textura franco limosa. El clima se caracteriza por tener precipitaciones promedio de 1.300 mm anuales siendo de 39 mm el valor promedio en el mes de julio (invierno) y de 122 mm en el mes de diciembre (verano). La temperatura media anual es de 21,5 ºC, siendo la temperatura media del mes de julio de 15,8 ºC y la de diciembre de 27 ºC.
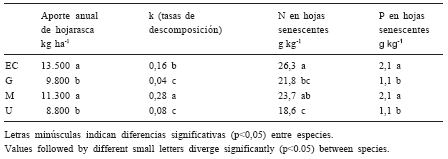
Para el estudio de este bosque polifítico se seleccionaron árboles de las especies dominantes de diferentes familias botánicas, representativas del sitio y de importancia económica por la calidad de su madera: Espina Corona (Gleditsia amorphoides (Griseb.) Taub. (EC), Guayaibí (Patagonula americana L.) (G), Mora (Chlorophora tinctoria (L.) Gaud) (M) y Urunday (Astronium balansae Engl.) (U). En la Tabla 1 se presentan el aporte anual de hojarasca, las tasas de descomposición de la misma y el contenido de N y P en hojas senescentes para cada una de las cuatro especies.
Tabla 1. Aporte anual de hojarasca, tasas de descomposición, N y P en hojas senescentes de las especies: espina corona (EC), guayaibí (G), mora (M) y urunday (U) (Prause, 1997; Palma et al., 2000).
Table 1. Annual litter accumulation, decomposition rate, N and P concentrations in senescent leaves of the following species: espina corona (EC), guayaibí (G), mora (M) and urunday (U) (Prause, 1997; Palma et al., 2000).
Se eligieron al azar 20 árboles de cada una de estas especies con portes similares (diámetro a la altura de pecho) y un buen estado sanitario. Las muestras de suelo libres de residuos vegetales ubicadas debajo de cada especie forestal, se extrajeron a una profundidad de 0-10 y de 10-20 cm (horizonte A), aproximadamente a 50 cm del tronco para evitar la heterogeneidad espacial. Dado que en los últimos 50 años el bosque no sufrió perturbaciones antrópicas ni tampoco hubo incendios naturales, podemos señalar que el patrón de heterogeneidad espacial en el suelo está causado fundamentalmente por las distintas especies forestales.
Se realizaron 2 muestreos, uno en invierno (julio) y otro en verano (diciembre). Las muestras húmedas se guardaron en bolsas plásticas que se mantuvieron refrigeradas hasta su análisis en el laboratorio. Las muestras fueron tamizadas por malla de 2 mm. Las determinaciones analíticas se realizaron por triplicado sobre cada una de las 20 muestras de suelo ubicado debajo de cada especie arbórea y a cada profundidad. Los resultados se expresaron en base a suelo secado a 105 ºC hasta peso constante.
Determinaciones analíticas realizadas en las muestras de suelo
- Actividad de la fosfatasa ácida: según la técnica descripta por Dick et al., 1996 (sin el agregado de tolueno).
- Actividad de proteasas: según la técnica modificada por Dilly & Munch, 1996.
- Carbono fácilmente oxidable: según la técnica de Walkley & Black descripta por Nelson & Sommers, 1982.
- P extraíble: según la técnica de Bray-Kurtz Nº 1, descripta por Olsen y Sommers, 1982.
- N inorgánico(NO3 -+ NH4 + ): según la técnica utilizada por Du Preez et al., 1987.
Análisis estadístico
Los datos fueron analizados mediante un análisis de varianza de una vía, tanto para el tratamiento correspondiente a las especies arbóreas como para el tratamiento profundidad, P disponible y N inorgánico. Previamente se comprobó la normalidad de los datos y la homogeneidad de varianza. Las diferencias entre medias de tratamiento fueron determinadas mediante el test de Tukey (p<0,05).
RESULTADOS Y DISCUSIÓN
Los valores de carbono fácilmente oxidable, P disponible y N inorgánico en el suelo no presentaron diferencias significativas entre especies a ninguna de las dos profundidades y en ninguna estación, siendo significativamente menores a la profundidad de 10-20 cm (Tabla 2a, 2b, 2c). Para todas las especies y en las dos épocas de muestreo se comprobó que los valores de las actividades de las enzimas fosfatasa ácida y proteasas son significativamente mayores (p<0,05) en las muestras tomadas a la profundidad de 0-10 cm comparadas con las tomadas a la profundidad de 10-20 cm (Figs. 1 y 2). La disminución de las actividades enzimáticas observadas con la profundidad podrían deberse a la disminución del C fácilmente oxidable, del P disponible y del N inorgánico con la profundidad (Tabla 2a, 2b, 2c). Un comportamiento similar es informado por Wittmann et al. (2004) quienes encontraron, al estudiar la estratificación de ciertas enzimas hidrolíticas en distintas estaciones del año, que los valores de actividad eran mayores en el horizonte superficial debido a la mayor disponibilidad de sustratos provenientes de la descomposición de la hojarasca. Otros investigadores registraron resultados similares para la actividad de fosfatasa ácida (Dick, 1984; Tabatabai, 1994), demostrando que la actividad de esta enzima decrece a medida que se avanza dentro del perfil del suelo. Esto se lo ha atribuido a la disminución de la microbiota y a factores nutricionales como son el descenso en algunos macro-microelementos, el contenido de materia orgánica y la actividad rizosférica (Sánchez de P., 2003). Jiménez et al. (2005) trabajando en el mismo sitio y con las mismas especies que en el presente trabajo, encontraron un comportamiento semejante al registrar una disminución con la profundidad en los valores del carbono de respiración microbiana, parámetro que es una medida de la actividad microbiana. Estos menores valores de actividad microbiana ocasionarían una menor producción de enzimas a medida que aumenta la profundidad en el perfil.
Tabla 2a. Carbono fácilmente oxidable (mg g-1).
Table 2a. Content of easily oxidizable carbon (mg g-1).
Tabla 2b. Fósforo disponible (mg kg-1).
Table 2b. Available phosphorus concentration (mg kg-1).

Tabla 2c. N inorgánico (mg kg-1).
Table 2c. Content of inorganic N (mg kg-1).


Figura 1. Actividades de la enzima fosfatasa en el suelo ubicado debajo de las especies: espina corona (EC), guayaibí (G), mora (M) y urunday (U) a dos profundidades, en invierno y verano. Letras minúsculas distintas indican diferencias significativas (p<0,05) entre especies en cada profundidad.
Letras mayúsculas distintas indican diferencias significativas (p<0,05) entre profundidades para cada especie.
Figure 1. Phosphatase activity in soil under trees of the following species: espina corona (EC), guayaibí (G), mora (M) y urunday (U) at two depths, in summer and in winter.
Values followed by different small letters indicate significant differences (p<0.05) between species for each depth. Values followed by different capital letters indicate significant differences (p<0.05) between depths for each species.

Figura 2. Actividades de la enzima proteasa en el suelo ubicado debajo de las especies: espina corona (EC), guayaibí (G), mora (M) y urunday (U) a dos profundidades, en invierno y verano.
Letras minúsculas distintas indican diferencias significativas (p<0,05) entre especies en cada profundidad. Letras mayúsculas distintas indican diferencias significativas (p<0,05) entre profundidades para cada especie.
Figure 2. Protease activity in soil under trees of the following species: espina corona (EC), guayaibí (G), mora (M) y urunday (U) at two depths, in summer and in winter.
Values followed by different small letters indicate significant differences (p<0.05) between species for each depth. Values followed by different capital letters indicate significant differences (p<0.05) between depths for each species.
Se encontró que ambas actividades enzimáticas fueron mayores en el muestreo de verano que en el de invierno en las dos profundidades analizadas, reflejando la variación de la vegetación y de los microorganismos, característicos de zonas con diferencias entre estaciones climáticas (Effron, 2001).
La influencia de las especies vegetales sobre la actividad de fosfatasa ácida y de proteasas no se manifestó a ninguna de las dos profundidades en el muestreo de invierno (Figs. 1 y 2). Sin embargo, en el muestreo de verano y en la superficie (0-10 cm) se registran diferencias significativas (p<0,05) entre especies, siendo los mayores valores encontrados los que corresponden al suelo tomado debajo de las especies EC y G, las cuales no difieren significativamente entre sí (p<0,05) pero sí lo hacen de las de M y U, que tampoco difieren entre ellas (Figs. 1 y 2). El hecho que sea en verano cuando se haya manifestado la influencia de las especies forestales estaría vinculado con que en esta estación las temperaturas y las lluvias son mayores que en invierno, condiciones que favorecerían una alta descomposición del material vegetal caído. Por otro lado, en este sitio, generalmente la mayor caída de hojas se produce en los meses de octubre y teniendo en cuenta que Palma et al. (1998) en un trabajo previo en la misma Reserva demostraron que en las especies forestales consideradas la descomposición de las hojas senescentes presenta dos etapas, la primera de ellas con un alto porcentaje de descomposición en los tres primeros meses y una segunda etapa mucho más lenta. Como consecuencia, la mayor descomposición se produciría en verano lo que explicaría la mayor actividad enzimática en este momento del año. Estos autores también encontraron que, en este monte del Parque Chaqueño, el aporte de material vegetal al suelo y su tasa de descomposición difieren según las especies. Así, EC es la especie que mayor aporte vegetal realiza (13.541 kg ha-1 año-1) y su tasa de descomposición es relativamente alta, mientras que el menor aporte corresponde al U (8.782 kg ha-1 año-1) con una baja tasa de descomposición (Tabla 1). Una alta cantidad de aportes vegetales al suelo y una alta tasa de descomposición originaría un aumento de la actividad microbiana que produciría un incremento en la producción de enzimas (Saetre & Baath, 2000). Además los valores de N y P en hojas senescentes reportados por Palma et al. (2000) mostraron los mayores valores para EC y los menores para U (Tabla 1), siendo la concentración de estos nutrientes significativamente menor en ramas y frutos para todas las especies (datos no mostrados). Sin embargo, los valores encontrados de tasa de descomposición, aporte de material vegetal y contenido de N y P en hojas senescentes no permitieron explicar el comportamiento en las actividades enzimáticas en los suelos debajo de las otras dos especies. Esta falta de asociación podría ser debida a la distinta cantidad en que los nutrientes retornan a los árboles por reabsorción, según los requerimientos de las distintas especies, tema que podría estudiarse en futuros trabajos, ya que tampoco dependió de los valores de dichos nutrientes en el suelo los cuales no presentaron diferencias significativas entre especies (Tabla 2).
El hecho que no se hayan encontrado diferencias significativas en los valores de las variables químicas analizadas (C fácilmente oxidable, P disponible y N inorgánico) entre especies para cada profundidad, estaría confirmando que las variables bioquímicas tales como son las actividades de enzimas serían variables más sensibles en detectar diferencias en el suelo (García et al., 1997), provocadas en el presente estudio por las distintas especies forestales.
BIBLIOGRAFÍA
1. Allison, SD & PM Vitousek. 2005. Responses of extracelular enzymes to simple and complex nutrient inputs. Soil Biol. Biochem. 37: 937-944. [ Links ]
2. Andersson, M; A Kjøller & S Struwe. 2004. Enzymes in the Environment: Activity, Ecology and Applications Microbial enzyme activities in leaf litter, humus and mineral soil layers of European forests. Soil Biol. Biochem. 36: 1527-1537. [ Links ]
3. Ayres, E; KM Dromph & RD Bardgett. 2006. Do plant species encourage soil biota that specialise in the rapid decomposition of their litter? Soil Biol. Biochem. 38: 183-186. [ Links ]
4. Boerner, REJ; JA Brinkman & A. Smith. 2005. Seasonal variations in enzyme activity and organic carbon in soil of a burned and unburned hardwood forest. Soil Biol. Biochem. 37: 1419-1426. [ Links ]
5. Burns, RG. 1978. Enzyme activity in soil: some theoretical and practical considerations. 295-340. In: RG Burns (ed). Soil enzymes. Academic Press, London. [ Links ]
6. Dick, WA. 1984. Influence on long term tillage and crop rotation combinations on soil enzymes activities. Soil Sci. Soc. Am. J. 48: 569-574. [ Links ]
7. Dick, RP; DP Brakwell & RF Turco. 1996. Soil enzyme activities and biodiversity measurements as integrative microbiological indicators. Pp 247-271. In: J Doran & A Jones (eds). Methods for Assessing Soil Quality. SSSA Spec. Publ. N° 49. [ Links ]
8. Dilly, O & P Nannipieri. 1998. Intracellular and extracellular enzyme activity in soil with reference to elemental cycling. Z. Pflanzenernähr. Bodenk. 161: 243-248. [ Links ]
9. Dilly, O & JC Munch. 1996. Microbial biomass content, basal respiration and enzyme activities during the course of decomposition of leaf litter in a Black Alder (Alnus glutinosa (L.) Gaertn). Forest. Soil Biol. Biochem. 28: 1073-1081. [ Links ]
10. Du Preez, CC; T Du Burger & DJ Laubscher. 1987. Evaluation of steam distillation procedures for the routine determination of inorganic soil nitrogen. Commun in Soil Sci. Plant Anal. 18(5): 483-493. [ Links ]
11. Effron, D. 2001. Actividad de enzimas relacionadas a los ciclos del carbono, nitrógeno, fósforo y azufre en un suelo nativo de bosque. Influencia de algunos metales pesados sobre dicha actividad. Tesis Magister Scientiae Ciencias del Suelo. Facultad de Agronomia .UBA. Biblioteca y Escuela de Graduados. [ Links ]
12. Gallardo, JF; D Santa Regina & I Hernández. 1991. Ciclos geoquímicos en ecosistemas forestales : producción versus descomposición. Pp 269-271. En: Biological Diversity. FD Pineda et al. (eds). Fundación R Areces. [ Links ]
13. García, C; T Hernández; A Roldán & J Albarejo. 1997. Biological and biochemical quality of a semiarid soil after induced devegetation. J. Environmental Quality. 26(4): 1116-1122. [ Links ]
14. Jimenez, MP; D Effron; RL Defrieri & J. Prause. 2005. Carbono de respiración y actividad de dehidrogenasa en un suelo forestal del parque chaqueño argentino. Pp 150-153. En: Osvaldo A. Barbosa (ed) . Avances en Ingeniería Agrícola. CADIR 2005. Argentina. [ Links ]
15. Kang, H & C Freeman. 1999. Phosphatase and arilsulphatase activities in wetland soils: annual variation and controlling factors. Soil Biol. Biochem. 31: 449-455. [ Links ]
16. Nelson, DW & LE Sommers. 1982. Total carbon, organic carbon and organic matter. Pp 539-579 In: AL Page; RH Miller; DR Keeney (eds). Methods of Soil Analysis, Part. 2. 2da. edn. Agronomy 9. American Society of Agronomy, Madison, Wisconsin, USA.1159. [ Links ]
17. Olsen, SR & LE Sommers. 1982. Phosphorus. Pp 403-430. In: AL Page; RH Miller & DR Keeny (eds). Methods of soil analysis. Part 2. Second edition. Madison, Wiscosin, USA. [ Links ]
18. Palma, MR; J. Prause; AV Fontanive & MP Jiménez. 1998. Litter fall and litter decomposition in a forest of the Parque Chaqueño Argentino. Forest ecology and management 106: 205-210. [ Links ]
19. Palma, MR; RL Defrieri; MF Tortarolo; J Prause & JF Gallardo. 2000. Seasonal changes of bioelements in the litter and their potencial return to green leaves in tour species of the Argentine Subtropical Forest. Annals of Botany 85: 181-186. [ Links ]
20. Prause, J.1997. Aporte de las principales especies forestales a la dinámica de la materia orgánica y los nutrientes en un monte nativo del Parque Chaqueño Húmedo. Tesis Magister Scientiae Ciencias del Suelo. Facultad de Agronomia. UBA. [ Links ]
21. Priha, O; SJ Grayston; R Hiukka; T Pennanen & A Smolander. 2001. Microbial community structure and characteristics of the organic matter in soils under Pinus sylvestris, Picea abies and Betula pendula at two forest sites. Biol. Fertil. Soils 33: 17-24. [ Links ]
22. Saetre, P & E Baath. 2000. Spatial variation and patterns of soil microbial community structure in a mixed spruce-birch stand. Soil Biol. Biochem. 32: 909-917. [ Links ]
23. Sánchez de P., M. 2003. Actividad biológica en la rizósfera del maracuyá -Pasiflora edulis var flavicarpa- en diferentes sistemas de manejo, estados de desarrollo y condiciones fitosanitarias. Tesis doctoral. Universidad Politécnica de Madrid. 261 pp. [ Links ]
24. Smolander, A & V Kitunen. 2002. Soil microbial activities and characteristics of dissolved organic C and N in relation to tree species. Soil Biol. Biochem. 34: 651-660. [ Links ]
25. Tabatabai, MA. 1994. Soil enzymes. In: RW Weaver et al. (eds). Methods of soil analysis: Microbiological and biochemical properties. Part 2. SSSA. Book Ser. 5. SSSA, Madison, WI. 775-883 pp. [ Links ]
26. Taylor, BR; D Parkinson & WFJ Parsons. 1989. Nitrogen and lignin content as predictors of litter decay rates: A microsms test. Ecology. 70: 97-104. [ Links ]
27. Wittmann C; MA Kähkönen; H Ilvesniemi & J Kurola. 2004. Areal activities and stratification of hydrolytic enzymes involved in the biochemical cycles of carbon, nitrogen, sulphur and phosphorus in podsolized boreal forest soils. Soil Biol. Biochem. 36(3): 425-433. [ Links ]














