Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencia del suelo
versión On-line ISSN 1850-2067
Cienc. suelo vol.27 no.1 Ciudad Autónoma de Buenos Aires ene./jun. 2009
TRABAJOS
Parámetros químicos y biológicos como indicadores de calidad del suelo en diferentes manejos
Laura Ferreras 1*; Silvia Toresani 2; Beatriz Bonel 3; Estela Fernández 1; Silvina Bacigaluppo 4; Valeria Faggioli 5 & Celina Beltrán 6
1 Edafología;
2 Microbiología Agrícola;
3 Manejo de Tierras;
4 Estadística - Facultad Ciencias Agrarias - UNR - Campo Experimental. J.F. Villarino, 2125 Zavalla, Santa Fe;
5 Estación Experimental Agropecuaria INTA Oliveros;
6 Estación Experimental Agropecuaria INTA Marcos Juárez. Correo electrónico: ferrerasla@gmail.com; lferrera@unr.edu.ar
Recibido: 30-09-08
Aceptado: 20-05-09
RESUMEN
El objetivo del trabajo fue evaluar la sensibilidad de una serie de parámetros químicos y bioquímicos en suelos representativos de la Región Pampeana bajo diferentes manejos con la finalidad de: i) establecer los parámetros que reflejen de manera más sensible y tempranamente el grado de degradación o recuperación; ii) comparar la información generada de las parcelas bajo cultivo con el mismo tipo de suelo no perturbado, considerado como referencia (T). En ensayos con diferentes manejos localizados en las EEA INTA Oliveros, Marcos Juárez y Rafaela se evaluó: Carbono orgánico total (COT), carbono asociado a la fracción fina (COff), carbono asociado a la fracción gruesa (COfg), carbono de la biomasa microbiana (CBM), actividad respiratoria microbiana (ARM) y actividad de las enzimas fosfatasa ácida (Pasa), deshidrogenasa (Dasa) y ureasa (Uasa). Se calculó el cociente metabólico microbiano (qCO2), a través de la relación entre ARM y el CBM, como así también las relaciones entre actividades de las enzimas y CBM en función del COT. Para cada sitio, el suelo bajo cultivo presentó en la mayoría de las variables analizadas valores inferiores con respecto a T (p<0,05). Hubo una reducción de COT y COfg como consecuencia directa del cultivo de los suelos. En el sitio Oliveros, el monocultivo de soja presentó menor actividad Pasa y qCO2 respecto a la secuencia Maíz-Soja-Trigo/Soja, aunque el CBM fue mayor (p<0,05). En Marcos Juárez, el tratamiento labranza combinada presentó valores más bajos de CBM, Pasa, Dasa y Uasa, respecto a la siembra directa con cultivo de cobertura (p<0,05). En Rafaela no hubo diferencias en las actividades enzimáticas, aunque el CBM mostró diferencias entre rotaciones. El qCO2 obtenido en las parcelas bajo cultivo en el sitio Marcos Juárez fue mayor respecto a T, indicando un mayor gasto energético para el mantenimiento metabólico. Las relaciones Pasa/COT en Marcos Juárez y Pasa/COT y Uasa/COT en Rafaela, fueron menores en T con respecto a las situaciones bajo cultivo, probablemente debido a que el COT en los suelos cultivados disminuye a una tasa más elevada que la reducción de la actividad enzimática o porque las enzimas extracelulares pueden formar complejos humo-enzimas. Las actividades enzimáticas presentaron rangos variables de correlación positiva con el COT y la fracción COfg. La estimación de los parámetros bioquímicos a través del CBM, el qCO2 y la actividad de las enzimas entre las diferentes situaciones puede indicar en el corto plazo cambios en la calidad del suelo. Los parámetros evaluados demostraron en algunas situaciones ser sensibles a las perturbaciones antropogénicas, correlacionándose adecuadamente con las funciones del suelo.
Palabras clave. Propiedades Bioquímicas; Biomasa microbiana; Enzimas del suelo; Carbono orgánico; Cociente metabólico; Calidad del suelo.
Chemical and biological parameters as indicators of soil quality under different managements
ABSTRACT
The aim of the work was to assess the sensitivity of chemical and biochemical parameters in representative soils of the Pampa Region under different managements with the purpose of i) establishing the soil parameters that may have a role as early and sensitive indicators of soil ecological stress and restoration; and ii) comparing the results from cropped plots with the same undisturbed soil type, considered as reference (T). The experiment was carried out on experimental plots under different soil managements at the INTA Experimental Stations at Oliveros, Marcos Juárez and Rafaela. Total organic carbon (COT), organic carbon associated with the fine fraction (COff) and organic carbon associated with the coarse fraction (COfg), microbial biomass carbon (CBM), soil microbial respiration (ARM) and enzymatic activities of acid phosphatase (Pasa), dehydrogenase (Dasa) and urease (Uasa) were determined in composite soil samples. The metabolic quotient (qCO2), the relationship between ARM and CBM, the enzymatic activities/COT ratio, and the CBM/ COT ratio were also calculated. For each experimental site, cropped plots presented lower values than undisturbed soil in most of the parameters analyzed (p <0.05). The soil cultivation caused large reductions in COT and COfg. The soybean monoculture, at the experimental site Oliveros, had lower Pasa and qCO2 with respect to corn- soybean-wheat/soybean crop rotation, although the MBC was higher (p <0.05). In Marcos Juarez site, the combined tillage treatment had lower CBM, Pasa, Dasa and Uasa, with respect no-tillage with cover crop (p <0.05). At the Rafaela experimental site, no differences were found in enzymatic activities, although the CBM showed differences between crop rotations. Significant differences were found in qCO2 at the cropped plots with respect to undisturbed soil at the Marcos Juárez experimental site. The higher values of qCO2 in cropped plots are indicative of higher maintenance energy of microorganisms. The Pasa/COT ratio in Marcos Juarez and the relationship between Pasa/COT and Uasa/COT in Rafaela, were lower in T than in cropped plots. One plausible explanation is that in cropped soils, organic carbon decreases at a faster rate than the reduction in enzyme activity, and thus the enzyme activity/COT is higher in cropped than in undisturbed soils. Alternatively, extracellular enzymes could bind to humified organic matter to form humoenzymatic complexes. Soil enzymes were positively correlated with COT and COfg. The assessment of biochemical parameters by means of MBC, qCO2 and enzyme activity of soils under different managements enables short-term changes in soil quality to be monitored. The evaluated soil parameters are shown in some situations be sensitive to anthropogenic disturbance and are well correlated with soil functions.
Key words. Biochemical soil properties; Microbial biomass; Soil enzymes; Soil organic carbon; Metabolic quotient; Soil quality.
INTRODUCCIÓN
La creciente demanda en la producción de alimentos ha impulsado el uso intensivo, y en algunas situaciones hasta desmedido de los recursos naturales. Además de la intensificación agrícola, el empleo de prácticas de manejo inadecuadas ha provocado la degradación de los suelos y como consecuencia, el deterioro de la calidad edáfica en vastas zonas del planeta (Lal et al., 1998). En nuestro país, a partir de la década del '80, también se ha manifestado este proceso de degradación de los suelos, fundamentalmente como consecuencia de la implementación de la agricultura continua, del uso de sistemas de labranza agresivos y de la amplia difusión del doble cultivo trigo/ soja. Estas prácticas de manejo provocaron el deterioro de las propiedades físicas, químicas y biológicas de los suelos y el incremento de la superficie afectada por procesos erosivos y de degradación en grandes extensiones de la Región Pampeana (Buschiazzo et al., 1998; Urricariet & Lavado, 1999; Micucci & Taboada, 2006).
La respuesta a esta problemática es implementar una agricultura sustentable, la cual estimule un aumento sostenido y ecológicamente viable de la producción agrícola, tratando a la vez de detener el agotamiento y la destrucción de los recursos naturales (López Bellido, 1998). Desarrollar sistemas de manejo sustentables no siempre es sencillo debido a que es necesario compatibilizar varios aspectos. En primer lugar, estos sistemas deben satisfacer los requerimientos de la población humana, a su vez hacer un uso eficiente de los recursos y por último deben mantener un equilibrio con el medio que sea favorable tanto para los seres humanos como para la mayoría de las otras especies (Doran & Zeiss, 2000).
Estimar la calidad de los suelos, es importante puesto que contribuye a establecer la sustentabilidad de los diferentes sistemas de manejos. Los suelos con máxima calidad son capaces de mantener alta productividad y causar el mínimo disturbio ambiental. Según este concepto, se considera a la función productiva del suelo como un aspecto fundamental al momento de determinar la calidad (Doran & Parkin, 1994; Gil-Sotres et al., 2005). Si aceptamos que la calidad del suelo se refiere a un adecuado funcionamiento, la degradación o la restauración de los suelos podrían ser evaluadas a través del análisis de las propiedades que determinan las principales funciones del suelo, en particular las propiedades que respondan a los cambios en el manejo (Lal, 1999; Doran & Zeiss, 2000).
La composición y la cantidad de materia orgánica edáfica juegan un rol fundamental en el funcionamiento y sustentabilidad de los sistemas agropecuarios, debido a que impactan significativamente sobre las propiedades físicas, químicas y biológicas del suelo (Rotenberg et al., 2007). Este parámetro usualmente es utilizado como indicador de calidad de suelo, pero para detectar cambios como resultado de los disturbios generalmente se requieren muchos años (5-10 años). No obstante, la mineralización de la materia orgánica de suelo es controlada principalmente por el tamaño y la actividad de la biomasa microbiana que puede responder a los disturbios en una escala de tiempo menor. Los parámetros biológicos y bioquímicos tienden a reaccionar de manera más rápida y sensible a los cambios producidos por el manejo, por lo tanto podrían constituir una señal temprana y sensible y ser de utilidad para estimar la calidad edáfica, incluso antes que las propiedades físicas y químicas (Nannipieri, 1994).
Los microorganismos son la fuente principal de enzimas, y a pesar de sus relativamente bajas cantidades, juegan un rol fundamental en el mantenimiento y dinámica de los nutrientes a través del ciclado de la materia orgánica (Bolinder et al., 1999). Algunas enzimas, como las deshidrogenasas se localizan principalmente en las membranas plasmáticas de las bacterias o en las membranas mitocondriales de hongos y reflejan la actividad oxidativa total de la biomasa microbiana, con lo cual podrían estar representando el tamaño y la actividad de la comunidad microbiana viable (Nannipieri, 1994). Otras enzimas, como las fosfatasas a cargo de la hidrólisis de diversos ésteres fosfato orgánicos e inorgánicos y la ureasa, una hidrolasa relacionada con la transformación del nitrógeno orgánico a amoníaco, están involucradas en los ciclos del fósforo y nitrógeno, respectivamente. Estas enzimas son sintetizadas y secretadas extracelularmente por bacterias u hongos, formando parte de la matriz del suelo (Aon & Colaneri, 2001; Tripathi et al., 2007). Por lo tanto, las actividades de estas enzimas exocelulares, pueden estar reguladas de manera indirecta a través de un aumento de la producción y secreción de microorganismos (Aon et al., 2001), o directamente a través de condiciones físicoquímicas ya que pueden ser estabilizadas por medio de la unión de las enzimas a los coloides del suelo (Sinsabaugh, 1994).
En la actualidad, se ha intensificado el estudio de los indicadores bioquímicos y biológicos puesto que describen los principales procesos metabólicos que ocurren en el suelo, por lo tanto son de gran utilidad para evaluar la calidad edáfica. Por esta razón, estas variables del suelo pueden tener un rol fundamental como indicadores tempranos y sensibles de degradación o restauración de suelo como consecuencia de diferentes prácticas de manejo (Roldán et al., 2003; Marinari et al., 2006). El objetivo del presente trabajo fue evaluar la sensibilidad de una serie de parámetros químicos y bioquímicos en suelos representativos de la Región Pampeana bajo diferentes manejos con la finalidad de: i) establecer los parámetros que reflejen de manera más sensible y tempranamente el grado de degradación o recuperación; ii) comparar la información generada de las parcelas bajo cultivo con el mismo tipo de suelo no perturbado, considerado como un estado de máxima conservación.
MATERIALES Y MÉTODOS
Localización y manejo de los sitios experimentales
La experiencia se llevó a cabo en ensayos ubicados en las áreas de influencia de las Estaciones Experimentales INTA Oliveros, Marcos Juárez y Rafaela. En todos los casos se relevó para cada tipo de suelo una situación bajo pastura o parque considerada como referencia.
Estación Experimental INTA Oliveros (32º32 S; 60º05'O). Ensayo iniciado en el año 2006 sobre un Argiudol Típico serie Maciel (Soil Survey Staff, 2006), horizonte Ap arcilla 215 g kg-1, limo 745 g kg-1, cuya historia agrícola previa consiste en 30 años de agricultura en forma continua y bajo siembra directa en los últimos 7 años. Diseño en parcelas divididas con tres repeticiones. En la parcela principal se dispuso de un sector compactado y uno descompactado mediante la utilización de un Cultivie a 0,25 m de profundidad. En la subparcela (13 x 50 m) se realizaron dos secuencias diferentes: monocultivo de soja (S-S) y la rotación Maíz-Soja-Trigo/Soja (M-S-T/S).
Estación Experimental INTA Marcos Juárez (32º41'S; 62º09'O). Ensayo iniciado en la campaña 1993/94 con la rotación Maíz-Trigo/Soja-Soja, sobre un Argiudol Típico serie Marcos Juárez (Soil Survey Staff, 2006), con la siguiente composición mineral en el horizonte Ap: arcilla 215 g kg-1, limo 689 g kg-1. Diseño con bloques completos con un arreglo factorial de parcelas subdivididas con tres repeticiones. En la parcela principal se dispuso la fertilización: testigo sin aplicación de fertilizante y fertilizado según uso actual medio de los productores (tamaño parcela 36 x 50 m). En la subparcela se realizaron los diferentes sistemas de manejo: labranza combinada que consistió en realizar labranza mínima en trigo, labranza vertical en maíz y soja de primera, y siembra directa en soja de segunda (LC); siembra directa en todos los cultivos (SD); siembra directa con dosis doble de fertilización respecto al uso actual medio de los productores (SD DF) y siembra directa con cultivo de cobertura antes de los cultivos de verano (SD CC). El tamaño de las sub-subparcelas fue de 9 x 50 m.
Estación Experimental INTA Rafaela (31º11'S; 61º33'O). Ensayo iniciado en la campaña 1999/00 con cuatro rotaciones agrícolo-ganaderas sobre un Argiudol Ácuico serie Lhemann (Soil Survey Staff, 2006), composición mineral del horizonte Ap: arcilla 270 g kg-1, limo 700 g kg-1, con siembra directa como único sistema de labranza.
Diseño experimental en bloques con tres repeticiones (parcela 44 x 20 m). Se detallan las rotaciones agrícolas (se encuentra subrayado el cultivo presente durante el muestreo), siguiendo en cada caso un período de 4 años con pasturas perennes (pp4):
Trigo/Soja - Trigo/Soja - Trigo/Soja - Soja: (T/S)3 - S - pp4
Trigo/Soja - Soja - Trigo/Soja - Soja: (T/S - S)2 - pp4
Trigo/Soja - Soja - Maíz - Soja: T/S - S - M - S - pp4
Trigo/Soja - Soja - Soja - Soja: T/S - S - S - S - pp4
Muestreos y análisis de suelo
Se extrajeron para cada tratamiento de los lotes bajo cultivo, como así también en las situaciones de referencia tres muestras de suelo, compuestas de 15 sub-muestras a los 0-7,5 cm de profundidad en el mes de noviembre de 2006. La Tabla 1 presenta los milímetros de agua caída en los tres sitios estudiados durante el segundo semestre del año 2006, período que abarca el momento en que se realizó el muestreo de suelo.
Tabla 1. Precipitaciones mensuales durante los meses de Julio a Diciembre en cada sitio experimental. (Fuente: Estación Experimental Agropecuaria INTA Oliveros, Marcos Juárez y Rafaela).
Table 1. Monthly rainfall during July to December at each experimental site. (Source: INTA Experimental Stations at Oliveros, Marcos Juárez and Rafaela).

Se detalla, para cada sitio experimental, el rendimiento de los cultivos que se realizaron durante el ciclo anterior (2005/06), previos al momento en que se llevó a cabo el muestro de suelo (Fuente: Estaciones Experimentales Agropecuarias INTA Oliveros, Marcos Juárez y Rafaela):
EEA INTA Oliveros: Trigo 3.260 kg y Soja 2.332 kg.
EEA INTA Marcos Juárez: Maíz 8.500-10.150 kg (promedio de 6 años).
EEA INTA Rafaela: (T/S)3 - S - pp4: Trigo 2.233 kg/Soja 2.774 kg; (T/S - S)2 - pp4: Trigo 2.631 kg/Soja 3.203 kg; T/ S - S - M - S - pp4: Maíz 3.307 kg; T/S - S - S - S - pp4: Soja 3.730 kg.
En la EEA INTA Oliveros las muestras se extrajeron sobre los cultivos de soja y maíz (secuencias S-S y M-S-T/S, respectivamente). En la EEA INTA Marcos Juárez las muestras de suelo fueron extraídas sobre el cultivo de soja. En el caso de la EEA INTA Rafaela, todas las parcelas muestreadas se hallaban bajo cultivo de soja (último cultivo del ciclo agrícola de cada rotación).
Las muestras fueron tamizadas por 2 mm y conservadas a 4 °C hasta su análisis, dentro de los 15 días de recolección, evaluando los siguientes parámetros químicos y bioquímicos:
Carbono orgánico total (COT): se determinó por el método de Walkley-Black que consiste en la oxidación del carbono orgánico con dicromato de potasio en ácido sulfúrico concentrado durante 30 minutos, titulando luego el exceso del agente oxidante con sulfato amónico ferroso (Nelson & Sommers, 1982). Se realizó la separación de las fracciones de carbono orgánico asociado a la fracción fina (COff) y el carbono orgánico asociado a la fracción gruesa (COfg), colocando 50 g de suelo en recipientes de vidrio con 100 ml de agua destilada (relación 1:2) y 10 bolitas de vidrio. Se agitó vigorosamente durante 60 minutos para desintegrar los agregados y se pasó a través de un tamiz de 12 cm de diámetro y 53 μm de abertura de malla, lavando con agua destilada. Se recogieron en forma separada las dos fracciones (0-53 y 53- 2.000 μm) y se secaron a temperatura menor de 100 °C (Galantini et al., 1994). El carbono orgánico asociado a la fracción fina (COff) y el carbono orgánico asociado a la fracción gruesa (COfg) se determinó por el método de Walkley-Black.
Carbono de la biomasa microbiana (CBM): se determinó a través del método de fumigación-incubación (Jenkinson& Powlson, 1976). El suelo se expuso a cloroformo durante 24 horas, luego se removió el fumigante y se realizó una incubación de 10 días, al cabo de la cual se determinó la producción de CO2. Controles no fumigados se incubaron bajo las mismas condiciones, y sobre ellos se determinó además la actividad respiratoria microbiana (ARM) al cabo de 10 días, midiendo la variación de CO2 en sistemas cerrados. Las muestras se incubaron en recipientes herméticos, el CO2 se recogió en trampas de álcali en exceso, y el exceso se tituló a la fenolftaleína con ácido clorhídrico 0,5 N en presencia de cloruro de bario (Frioni, 1999). Se calculó la tasa respiratoria diaria y el cociente metabólico microbiano (qCO2) como la relación entre el CO2 producido por respiración microbiana y el CBM. Los resultados de CBM y ARM se expresaron como μg de C-CO2 g-1 de suelo en base seca.
Actividades enzimáticas: la actividad de la fosfatasa ácida (Pasa), deshidrogenasa (Dasa) y ureasa (Uasa) fueron determinadas según Tabatabai (1982). La fosfatasa hidroliza fosfomonoésteres, liberando fosfatos. La estimación de la fosfatasa ácida se basa en la determinación del p-nitrofenol liberado por la actividad de la enzima cuando el suelo es incubado con una solución de p-nitrofenil fosfato disódico (pH 6,5). La actividad deshidrogenasa se determinó utilizando un aceptor artificial de electrones, el trifenil tetrazolium que al reducirse por los protones y electrones transferidos por las deshidrogenasas pasa a trifenil formazán. La ureasa cataliza la hidrólisis de la urea, produciendo CO2 y NH3. La actividad ureasa se estimó mediante la determinación del NH4 + liberado a partir del suelo incubado con una solución de urea. La concentración de los productos de la acción de las tres enzimas se determinó por fotocolorimetría. Los resultados de actividad enzimática se expresaron como μg de producto h-1 g-1 de suelo en base seca.
Análisis estadístico
Para cada sitio se realizó un análisis multivariado, para luego proceder al ANOVA utilizando el test de Tukey para las comparaciones de medias (SAS System, 2001). Las diferencias estadísticamente significativas para todas las variables entre los tratamientos fueron establecidas a un nivel de p < 0,05. Se realizaron correlaciones entre las variables determinadas en los tres sitios a la vez, a través del coeficiente de correlación de Pearson.
RESULTADOS
En los tres sitios estudiados el cultivo provocó una reducción significativa del contenido de carbono orgánico total del suelo, mientras que dentro de cada sitio no se hallaron diferencias significativas entre las situaciones de manejo comparadas (Tabla 2).
Tabla 2. Carbono orgánico total (COT), carbono orgánico asociado a la fracción fina (COff) y asociado a la fracción gruesa (COfg) en las parcelas bajo cultivo y en el suelo de referencia para cada sitio experimental.
Table 2. Total organic carbon (COT), organic carbon associated with the fine fraction (COff) and organic carbon associated with the coarse fraction (COfg) in the cropped plots and the undisturbed soil at each experimental site.

En relación al carbono más lábil, la baja proporción de carbono orgánico recuperado en la fracción menor de 53 μm, respecto a lo informado por otros autores (Eiza et al., 2005), hace suponer que el procedimiento de dispersión de la muestra inicial (0-2.000 μm) de suelo no fue suficientemente enérgico para separar las fracciones orgánicas ligadas estrictamente a los minerales del suelo de aquellas que están libres. Esto condujo a una sobreestimación del carbono más lábil y, por esta razón, los datos se referirán a CO en agregados mayores de 53 μm (COfg) y CO en partículas menores de 53 μm (COff). Teniendo en cuenta estas consideraciones se detecta una disminución del COfg en las situaciones bajo cultivo respecto a las de referencia con una tendencia similar respecto a COT en la comparación entre manejos. No se hallaron diferencias significativas en COff en los suelos de referencia respecto a las parcelas cultivadas, ni entre tratamientos de manejo dentro de cada sitio, excepto en el sitio experimental Marcos Juárez donde se hallaron diferencias significativas entre el tratamiento con fertilización doble y el tratamiento con cultivo de cobertura.
La Tabla 3 detalla los datos obtenidos en los parámetros bioquímicos para los tres sitios estudiados. En el sitio Oliveros, el suelo de referencia se diferenció estadísticamente de las parcelas cultivadas en las variables CBM, ARM, qCO2, Pasa y Uasa (p<0,05). Comparando las parcelas bajo cultivo, no hubo diferencias significativas para el efecto del factor compactado y descompactado en las variables CBM, ARM, qCO2 y Pasa, sin embargo se hallaron diferencias entre secuencias de cultivos (p<0,05). Para las actividades de las enzimas Dasa y Uasa no hubo diferencias estadísticamente significativas entre sector compactado y descompactado ni entre rotaciones.
Tabla 3. Parámetros bioquímicos en las parcelas bajo cultivo y en el suelo de referencia para cada sitio experimental. (CBM) carbono biomasa microbiana, (ARM) actividad respiratoria microbiana, (qCO2) cociente metabólico.
Table 3. Biochemical parameters in the cropped plots and in the undisturbed soil at each experimental site. (CMB) microbial biomass, (ARM) soil microbial respiration, (qCO2) metabolic quotient.

En Marcos Juárez, el suelo de referencia se diferenció estadísticamente de las parcelas cultivadas en las variables CBM, qCO2 y las actividades de las tres enzimas estudiadas (p<0,05). En las parcelas bajo cultivo no se detectaron diferencias estadísticamente significativas en ninguna de las variables analizadas entre las parcelas con y sin aplicación de fertilizante, mientras que para el factor sistema de labranzas se hallaron diferencias en CBM y las actividades de las tres enzimas (Pasa, Dasa y Uasa), siendo el tratamiento SD CC el que presentó los valores más elevados.
Las variables evaluadas en la EEA Rafaela que fueron estadísticamente diferentes en el suelo de referencia respecto al suelo cultivado fueron ARM, Pasa y Dasa (p<0,05). En las parcelas bajo cultivo únicamente se detectaron diferencias estadísticamente significativas en CBM y ARM. Las rotaciones (T/S)3 - S - pp4 y (T/S - S)2 - pp4 presentaron los valores más elevados de CBM, aunque esta última no se diferenció de las rotaciones T/S - S - M - S - pp4 y T/S - S - S - S - pp4.
El qCO2 en Marcos Juárez fue significativamente menor en el suelo de referencia respecto a las parcelas bajo cultivo (p<0,05). En el sitio Rafaela no se hallaron diferencias estadísticamente significativas (Tabla 3).
La Tabla 4 muestra la relación entre la actividad de las enzimas y el CBM por unidad de carbono del suelo para cada uno de los sitios en estudio. En los tres sitios estudiados hubo diferencias estadísticamente significativas entre el suelo de referencia y las parcelas bajo cultivo. En el sitio Oliveros se detectaron diferencias significativas (p<0,05) en las relaciones Pasa/COT y CBM/COT entre parcelas bajo cultivo; mientras que en Marcos Juárez todas las relaciones planteadas fueron significativamente diferentes entre tratamientos. Los resultados obtenidos en Rafaela, expresaron diferencias entre rotaciones de cultivos en las relaciones Pasa/COT y CBM/COT.
Tabla 4. Relaciones entre actividades enzimáticas y carbono biomasa microbiana en función del carbono orgánico total en las parcelas bajo cultivo y en el suelo de referencia para cada sitio experimental. (Pasa) fosfatasa ácida, (Dasa) deshidrogenasa, (Uasa) ureasa, (CBM) carbono biomasa microbiana, (COT) carbono orgánico total.
Table 4. Soil enzyme activities / total organic carbon ratio and CBM/COT in the cropped plots and in the undisturbed soil at each experimental site. (Pasa) acid phosphatase, (Dasa) dehydrogenase, (Uasa) urease, (CBM) microbial biomass and (COT) total organic carbon.

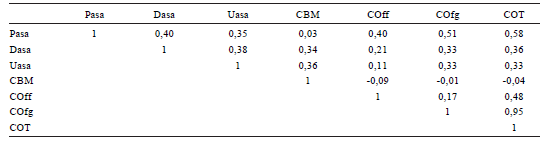
En cuanto a las correlaciones realizadas entre los parámetros químicos y bioquímicos de los tres sitios estudiados, las actividades enzimáticas presentaron rangos variables de correlación con el COT y la fracción COfg (Tabla 5). La actividad deshidrogenasa y ureasa manifestaron coeficientes > 0,34 cuando se correlacionaron con el CBM, mientras que la actividad Pasa correlacionó positivamente con la fracción COff.
Tabla 5. Coeficientes de correlación entre actividades enzimáticas, biomasa microbiana y fracciones de carbono orgánico del suelo para los tres sitios estudiados. (Pasa) fosfatasa ácida, (Dasa) deshidrogenasa, (Uasa) ureasa, (CBM) carbono biomasa microbiana, (COff) carbono orgánico asociado a la fracción fina, (COfg) carbono orgánico asociado a la fracción gruesa, (COT) carbono orgánico total.
Table 5. Correlation coefficients between enzyme activities, microbial biomass and organic carbon in the cropped plots of the three experimental sites. (Pasa) acid phosphatase, (Dasa) dehydrogenase, (Uasa) urease, (CBM) microbial biomass, (COT) total organic carbon, (COff) organic carbon associated with the fine fraction and (COfg) organic carbon associated with the coarse fraction.
DISCUSIÓN
La reducción del COT en parcelas cultivadas respecto a las situaciones más conservadas se atribuye al disturbio provocado por las labranzas y prácticas de manejo en general, que promueven la mineralización de la materia orgánica y un menor aporte de residuos orgánicos al suelo (Gomez et al., 2001; Ogle et al., 2005; Ferreras et al., 2007). Según Urioste et al. (2006), en suelos de textura gruesa, los agregados mayores de 100 μm son los más sensibles al manejo y pueden evidenciar pérdidas de hasta 73% de CO. En este trabajo la mayor disminución de CO se detectó en los agregados mayores de 53 μm con valores de pérdidas comprendidos entre 35 y 52%. Se supone que el carbono orgánico presente en los agregados mayores de 53 μm comprende materiales fácilmente degradables y residuos parcialmente descompuestos, que son los que disminuyen más rápidamente como resultado de la intensificación de la agricultura (Cambardella & Elliott, 1994). Esta fracción está más expuesta a la mineralización puesto que constituye el sustrato inicial para la descomposición microbiana. El COff representa el CO unido a los coloides minerales y queda protegido del ataque microbiano, por consiguiente se mantiene más estable (Gomez et al., 2001). En el sitio Marcos Juárez, el menor contenido de COff en parcelas con fertilización doble respecto a las que tienen cultivo de cobertura puede atribuirse al hecho de que la fertilización tiene un efecto variable sobre el balance de carbono ya que en algunos casos se ha constatado un efecto diferencial de la fertilización sobre las fracciones orgánicas (Galantini & Suñer, 2008).
Las perdidas de COT en los tratamientos bajo cultivo en Oliveros alcanzaron en promedio un 25,7%; en Marcos Juárez oscilaron entre 27,7 en SD CC y 34% en las parcelas bajo LC, con respecto al suelo de referencia. Para el sitio Rafaela, la disminución de carbono fue menor, fluctuando entre 20,6 y 23,3%, el hecho de incluir ciclos con pasturas alternadas con ciclos agrícolas pudo haber incidido en esta menor reducción de carbono en comparación con Oliveros y Marcos Juárez.
La transformación de la materia orgánica del suelo está asociada a la actividad de los microorganismos y las enzimas del suelo. La microbiota constituye un componente activo del pool orgánico del suelo controlando la descomposición de la materia orgánica y por lo tanto la liberación de nutrientes y su disponibilidad para otros organismos. La biomasa microbiana también actúa como un reducido pero lábil reservorio de nutrientes que contribuye a mantener la sustentabilidad agrícola a largo plazo (Tripathi et al., 2007). Diversos autores han sugerido que modificaciones en la biomasa microbiana podrían convertirse en un indicador útil y más sensible para evaluar los cambios en el status de la materia orgánica del suelo en lugar de cuantificar el COT (Bergstrom et al., 1998). Por lo tanto, esta fracción respondería de manera más sensible que otras propiedades a condiciones que alteran la calidad del suelo. Si bien el COT y COfg evaluados en cada sitio fueron significativamente diferentes en el suelo de referencia con respecto al mismo suelo cultivado, no se detectaron diferencias entre las parcelas bajo cultivo (Tabla 2), mientras que el CBM fue sensible a los diferentes tratamientos en los tres sitios estudiados (Tabla 3). En Oliveros, en ambas secuencias de cultivo se observó una marcada reducción del CBM respecto al suelo de referencia, y a su vez la secuencia M-S-T/S presentó valores inferiores a S-S. La actividad respiratoria microbiana en el suelo de referencia fue significativamente mayor respecto a las parcelas bajo cultivo, probablemente debido a la mayor disponibilidad de sustratos fácilmente degradables.
En el sitio Marcos Juárez, el CBM fue mayor en el suelo de referencia respecto a las parcelas bajo cultivo, presentando los valores menores las parcelas bajo LC, en contraste con SD CC, mientras que la actividad respiratoria microbiana no presentó diferencias entre tratamientos. En el sitio Rafaela, las rotaciones (T/S)3 - S - pp4 y (T/S - S)2 - pp4 no mostraron diferencias en CBM con respecto al suelo considerado como referencia. Probablemente las menores pérdidas de COT halladas en este sitio como consecuencia del sistema agrícolo-ganadero planteado pudieron incidir en no detectar diferencias para esta variable. En coincidencia con lo hallado por Melero et al. (2006), en la medida en que la disponibilidad de carbono en el suelo fue más elevada, la biomasa microbiana fue mayor.
Algunos autores han propuesto a la relación entre el CO2 producido por respiración microbiana y el CBM, denominado cociente metabólico, como una medida indicadora de modificaciones en procesos edáficos puesto que refleja la energía de mantenimiento de los microorganismos. El qCO2 puede contribuir al entendimiento de los cambios químicos y biológicos que ocurren bajo diferentes prácticas agrícolas, debido a que provee una medida específica de la actividad metabólica que varía en función de la composición y estado fisiológico de la comunidad microbiana, de la disponibilidad de sustratos y de diferentes factores abióticos (Anderson & Domsch, 1990; Ebhin Masto et al., 2006). Una actividad respiratoria más elevada en relación al tamaño de la biomasa microbiana puede estar manifestando una menor eficiencia metabólica de los microorganismos, reflejada por una mayor energía de mantenimiento como respuesta a la baja disponibilidad de nutrientes o sustratos como el carbono orgánico (Agnelli et al., 2001). El qCO2 hallado en las parcelas bajo cultivo en Marcos Juárez fue mayor respecto al suelo de referencia, poniendo en evidencia un mayor gasto energético para el mantenimiento metabólico. En estos sitios, se determinó una población microbiana de menor tamaño que respiraba a una tasa mayor. Según Anderson & Domsch (1993), coeficientes metabólicos comparativamente bajos constituyen una característica típica de comunidades microbianas diversas y muy relacionadas entre sí. En Rafaela, el qCO2 fue muy similar al obtenido en los tratamientos de las distintas rotaciones.
La actividad microbiana edáfica influye directamente sobre la estabilidad y fertilidad de los ecosistemas y está ampliamente aceptado que un buen nivel de actividad microbiana es esencial para el mantenimiento de la calidad del suelo (Bastida et al., 2006). La producción de enzimas del suelo como resultado del metabolismo microbiano es un indicador sensible de la actividad microbiana edáfica. Algunos autores, consideran a las propiedades relacionadas con los ciclos de los elementos y las transformaciones de la materia orgánica en el suelo como variables adecuadas para la estimación de la calidad de los suelos, ya sea variables relacionadas directamente con la actividad microbiana, como así también las variables que incluyen las actividades de las enzimas hidrolíticas exocelulares (Trasar Cepeda et al., 2008).
Si bien en el sitio Oliveros, hubo una menor actividad microbiana en las parcelas M-S-T/S respecto a S-S, manifestada a través del CBM, se observó que la actividad de las enzimas Pasa y Uasa fue mayor. Posiblemente, la condición de ser exocelulares y la posibilidad de ser retenidas por la fracción coloidal determinaron las diferencias en sus actividades. La actividad deshidrogenasa hallada en las parcelas bajo cultivo no manifestó diferencias significativas entre secuencias. Contrariamente al comportamiento que tuvo la biomasa microbiana en el suelo de referencia, la actividad de la enzima fue menor con respecto a las parcelas cultivadas. La falta de correlación entre la actividad deshidrogenasa y el CBM para la situación de máxima conservación en el sitio Oliveros, podría explicarse a partir del conocimiento que la biomasa microbiana activa es una pequeña proporción del total, durante períodos de conversión o cambios en la población microbiana. En trabajos realizados por McGill et al. (1986), estos autores encontraron que en condiciones normales sólo un 15% de los microorganismos están activos, mientras que la mayoría de ellos están inactivos o no viable.
En Marcos Juárez, las actividades enzimáticas halladas en el suelo de referencia fueron significativamente mayores con respecto al suelo bajo cultivo. Entre tratamientos de labranza, las parcelas SD CC presentaron los valores más elevados de las tres enzimas con diferencias estadísticamente significativas (p<0,05) respecto al resto de los tratamientos. En contraste, LC manifestó los valores más bajos en concordancia con una menor actividad microbiana. Madejón et al. (2007) hallaron una mayor proporción de CBM y actividades enzimáticas en suelos con manejos conservacionistas en comparación con suelos laboreados convencionalmente, atribuyendo las diferencias a un incremento del contenido de materia orgánica, que contribuye a mejorar la calidad bioquímica del estrato superficial. Similares resultados fueron hallados por Aon et al. (2001) y Green et al. (2007), quienes encontraron una mayor actividad enzimática en parcelas bajo siembra directa. En las parcelas SD CC, el incremento en el COT y el cultivo de cobertura tuvieron una incidencia positiva generando un estímulo sobre la comunidad microbiana, debido a una mayor proporción de carbono fácilmente disponible como fuente de energía.
En el sitio Rafaela, el suelo de referencia presentó mayor actividad Pasa y Dasa respecto al suelo bajo cultivo. No obstante, si bien hubo diferencias entre rotaciones en el CBM y ARM, no se detectaron diferencias en las actividades enzimáticas. En este ensayo, las mediciones se realizaron sobre el cultivo de soja, último en la secuencia de cada una de las cuatro rotaciones y el que se repite con mayor frecuencia. Por otra parte, la alternancia con períodos de pastura podrían ser causas en determinar que la actividad enzimática no logre detectar diferencias entre los cultivos de la fase agrícola. Estos factores, sumado a que el sistema de manejo es siembra directa desde el inicio del ensayo (1999/2000) pudieron incidir en no detectar grandes modificaciones en las actividades enzimáticas entre tratamientos. Trabajos realizados por Acosta-Martínez et al. (2007), quienes compararon suelos de textura franca, hallaron que la población microbiana y la actividad enzimática fueron más elevadas en suelos nativos o bajo pastura, en comparación con sistemas agrícolas con diferentes rotaciones de cultivos. El impacto positivo que provocó la cobertura superficial, los diferentes sistemas radiculares y la secreción de sustancias estimulantes para la microbiota, como así también la ausencia de laboreo determinaron una mayor disponibilidad de sustratos carbonados.
Cuando las actividades de las enzimas se expresan por unidad de carbono del suelo se puede apreciar un comportamiento diferente (Tabla 4). En Oliveros, la relación actividad de enzimas y COT conserva la misma tendencia que cuando se analizan estas propiedades en forma individual, es decir el suelo de referencia presentó los mayores valores de COT, de CBM, como así también de actividad enzimática (Uasa y Pasa) y los cocientes también fueron superiores. En Marcos Juárez, el suelo de referencia presentó una menor relación Pasa/COT, lo mismo ocurrió en Rafaela donde las actividades de las enzimas Pasa y Uasa por unidad de COT fueron inferiores en el suelo de referencia con respecto a las situaciones bajo cultivo. Esto podría estar indicando por un lado que la reducción de la materia orgánica en los suelos cultivados disminuye a una tasa más elevada que la reducción de la actividad enzimática, por lo tanto se produce un incremento relativo de actividad de enzimas en función del COT. En la medida que la disponibilidad de carbono sea menor, la comunidad microbiana respirará a una tasa mayor, manifestando una menor eficiencia metabólica como respuesta a la baja disponibilidad de nutrientes o sustratos como el carbono orgánico (Agnelli et al., 2001).
Por otro lado, si bien existe una reducción de carbono que se produce como consecuencia de la actividad agrícola, la fracción que disminuye más fácilmente es la lábil, manteniendo casi constante el carbono humificado (Cambardella & Elliott, 1994). Las enzimas extracelulares pueden unirse a los coloides húmicos para formar complejos humo-enzimas que les confieren protección y contribuyen a su estabilización. La posibilidad de mantener un elevado potencial hidrolítico en el suelo como consecuencia de la estabilización de las enzimas, evita la necesidad de su síntesis continua (Nannipieri, 1994).
La relación CBM/COT puede contribuir a explicar modificaciones en parámetros químicos y biológicos debido a que es un indicador de la disponibilidad de materia orgánica del suelo para los microorganismos. Generalmente, la biomasa microbiana edáfica se incrementa con el aumento de la materia orgánica del suelo, aunque esta relación podría verse afectada por diferentes condiciones macroclimáticas, cambios en la humedad y temperatura del suelo, como así también puede modificarse en función de las rotaciones de cultivos (Anderson& Domsch, 1989). Mediciones de un índice simple, como el carbono de la biomasa microbiana en relación al contenido de carbono orgánico total del suelo (CBM/COT) podría utilizarse como un indicador de la disponibilidad de carbono para los microorganismos, o también podrían expresar la eficiencia de conversión en carbono de la biomasa microbiana, como así también indicar las pérdidas o estabilización del carbono en los suelos (Melero et al., 2006).
Para el caso de Oliveros, en el sitio de referencia a pesar de tener mayores valores de COT, la elevada relación entre CBM/COT estuvo determinada por una elevada proporción de biomasa microbiana en función del carbono disponible. El estímulo que producen los residuos orgánicos de fácil degradación puede incrementar la actividad de la biomasa microbiana. En los sitios Marcos Juárez y Rafaela, los valores de la relación CBM/COT en el sitio de referencia surgen de la significativa mayor proporción de COT respecto al suelo bajo cultivo.
La correlación positiva entre actividad enzimática y COT o COfg puede deberse a que la disponibilidad de carbono orgánico promueve la actividad enzimática, los sustratos carbonados contribuyen a activar a la flora microbiana para producir enzimas relacionadas con los ciclos de los nutrientes más importantes (Dinesh et al., 2004; Melero et al., 2006).
Según Nannipieri (1994), la actividad Dasa podría estar representando el tamaño y la actividad de la comunidad microbiana viable por lo tanto se explica la correlación positiva que hubo entre Dasa y CBM.
La estimación de los parámetros bioquímicos a través del CBM, el qCO2 y la actividad de las enzimas entre las diferentes situaciones de manejo puede indicar en el corto plazo cambios en cuanto a degradación o restauración en la calidad del suelo, y es factible utilizarlos para evaluar respuestas rápidas a cambios en el manejo. La biomasa microbiana responde con mayor sensibilidad a cambios o condiciones que alteran la calidad del suelo, en comparación con variables como el carbono orgánico edáfico. Las enzimas del suelo pueden utilizarse como indicadores biológicos adecuados puesto que son mediciones de la actividad microbiana edáfica, por lo que están estrictamente relacionadas con los ciclos de los nutrientes y además pueden responder rápidamente a los cambios causados tanto por factores naturales y antropogénicos.
CONCLUSIONES
El cultivo del suelo provocó una pérdida de materia orgánica, fundamentalmente del carbono asociado a los agregados > 53 mm, vinculado a materiales fácilmente degradables y los residuos parcialmente descompuestos, como así también hubo una menor actividad microbiana expresada a través del CBM y de las enzimas evaluadas.
Los parámetros evaluados demostraron en algunas situaciones ser sensibles a las perturbaciones antropogénicas. En el caso del sitio Oliveros, la actividad microbiana y la enzima Pasa, permitieron distinguir entre monocultivo de soja y la rotación de cultivos.
Para el sitio Marcos Juárez fueron sensibles para diferenciar los diferentes tratamientos de labranza, el sistema bajo siembra directa con cultivo de cobertura se comportó como el más adecuado para la conservación biológica del suelo.
Los resultados obtenidos en Rafaela, si bien manifestaron una mayor actividad microbiana en algunas rotaciones, no se detectaron diferencias en el comportamiento enzimático. En este caso las actividades enzimáticas no permitieron detectar diferencias dentro del ciclo agrícola. De este modo, la información referida a las comunidades microbianas, su funcionamiento y su participación en los procesos que determinan el funcionamiento del suelo, puede proporcionar información para caracterizar la sustentabilidad de los agroecosistemas.
AGRADECIMIENTOS
Los autores agradecen a los Ing. Agr. M Bodrero; C Galarza y J Villar, responsables de los ensayos en las EEAs INTA Oliveros, Marcos Juárez y Rafaela, respectivamente, por su colaboración y por permitir llevar a cabo la experiencia.
BIBLIOGRAFÍA
1. Acosta-Martínez, V; MM Mikha & MF Vigil. 2007. Microbial communities and enzyme activities in soils under alternative crop rotations compared to wheat-fallow for the Central Great Plains. App. Soil Ecol. 37: 41-52. [ Links ]
2. Agnelli, A; FC Ugolini; G Corti & G Pietramellara. 2001. Microbial biomass C and basal respiration of fine earth and highly altered rock fragments of two forest soils. Soil Biol. Biochem. 33: 613-620. [ Links ]
3. Anderson, TH & KH Domsch. 1989. Ratios of microbial biomass carbon total organic carbon in arable soils. Soil Biol. Biochem. 21: 471-479. [ Links ]
4. Anderson, TH & KH Domsch. 1990. Application of eco-physiological quotients (qCO2 and qD) on microbial biomass from soils of different cropping histories. Soil Biol. Biochem. 22: 251- 255. [ Links ]
5. Anderson, TH & KH Domsch. 1993. The metabolic quotient for CO2 (qCO2) as a specific activity parameter to assess the effects of environmental conditions, such as pH, on the microbial biomass of forest soils. Soil Biol. Biochem. 25: 393- 395. [ Links ]
6. Aon, MA; MN Cabello; DE Sarena; AC Colaneri; MG Franco; JL Burgos & S Cortassa. 2001. I. Spatio-temporal patterns of soil microbial and enzymatic activities in an agricultural soil. Appl. Soil Ecol. 18: 239-254. [ Links ]
7. Aon, MA & AC Colaneri. 2001. II. Temporal and spatial evolution of enzymatic activities and physico-chemical properties in an agricultural soil. App. Soil Ecol. 18: 255-270. [ Links ]
8. Bastida, F; JL Moreno; T Hernández & C García. 2006. Microbiological degradation index of soils in a semiarid climate. Soil Biol. Biochem. 38: 3463-3473. [ Links ]
9. Bergstrom, DW; CM Monreal & DJ King. 1998. Sensitivity of soil enzyme activities to conservation practices. Soil Sci. Soc. Am. J. 62: 1286-1295. [ Links ]
10. Bolinder, MA; DA Angers; EG Gregorich & MR Carter. 1999. The response of soil quality indicators to conservation management. Can. J. Soil Sci. 79: 37-45. [ Links ]
11. Buschiazzo, D; JL Panigatti & P Unger. 1998. Tillage effects on soil properties and crop production in the subhumid and semiarid Argentinean Pampas. Soil Till. Res. 49: 105-116. [ Links ]
12. Cambardella, CA & ET Elliott. 1994. Carbon and nitrogen dynamics of soil organic matter fractions from cultivated grassland soils. Soil Sci. Soc. Am. J. 58: 123-130. [ Links ]
13. Dinesh, R; MA Suryanarayana; S Ghosha & TE Sheeja. 2004. Long-term influence of leguminous cover crops on the biochemical properties of a sandy clay loam Fluventic Sulfaquent in a humid tropical region of India. Soil Till. Res. 77: 69-77. [ Links ]
14. Doran, JW & TB Parkin. 1994. Defining an assesing soil quality. In: Defining Soil Quality for a Sustainable Environment. Doran, JW; DC Coleman; DF Bezdieck & BA Stewart (eds.). 35 SSSA Special Publication, Madison, WI. pp. 3-21. [ Links ]
15. Doran, JW & M Zeiss. 2000. Soil quality response to long-term nutrient and crop management on a semi-arid Inceptisol. Appl. Soil Ecol. 15: 3-11. [ Links ]
16. Ebhin Masto, R; PK Chhonkar; D Singh & AK Patra. 2006. Changes in soil biological and biochemical characteristics in a long-term field trial on a sub-tropical inceptisol. Soil Biol. Biochem. 38: 1577-1582. [ Links ]
17. Eiza, MJ; N Fioriti; GA Studedert & HE Echeverría. 2005. Fracciones de carbono orgánico en la capa arable: efecto de sistemas de cultivo y de la fertilización nitrogenada. Ciencia del Suelo 23: 59-68. [ Links ]
18. Ferreras, LA; G Magra; P Besson; E Kovalevski & F García. 2007. Indicadores de calidad física en suelos de la Región Pampeana Norte de Argentina bajo siembra directa. Ciencia del Suelo 25: 159-172. [ Links ]
19. Frioni, L. 1999. Procesos Microbianos. Editorial Fundación Universidad Nacional de Río IV. pp. 332. [ Links ]
20. Galantini, JA; RA Rosell & JO Iglesias. 1994. Determinación de materia orgánica empleando el método de Walkley y Black en fracciones granulométricas del suelo. Ciencia del Suelo 12: 81-83. [ Links ]
21. Galantini, JA & L Suñer. 2008. Las fracciones orgánicas del suelo: análisis en los suelos de Argentina. Agriscientia 1: 41-55. [ Links ]
22. Gil-Sotres F; C Trasar-Cepeda; M Leirós & S Seoane. 2005. Different approaches to evaluating soil quality using biochemical properties. Soil Biol. Biochem. 37: 877-887. [ Links ]
23. Gomez, E; LA Ferreras; S Toresani; A Ausilio & V Bisaro. 2001. Changes in some soil properties in a vertic soil under shortterm conservation tillage. Soil Till. Res. 61: 179-186. [ Links ]
24. Green, VS; DE Stott; JC Cruz & N Curi. 2007. Tillage impacts on soil biological activity and aggregation in a Brazilian Cerrado Oxisol. Soil Till. Res. 92: 114-121. [ Links ]
25. Jenkinson, D & D Powlson. 1976. The effects of biocidal treatments on metabolism in soil. V. A method for measuring soil biomass. Soil Biol. Biochem. 8: 209-213. [ Links ]
26. Lal, R; WH Blum; C Valentine & BA Stewart. 1998. Methods for assessment of soil degradation. In: Advances in Soil Science, Lewis Publishers, Boca Raton, p. 558. [ Links ]
27. Lal, R. 1999. Soil Quality and Soil Erosion. Soil and Water Conservation Society, CRC Press, Boca Raton, p. 329. [ Links ]
28. López Bellido, L. 1998. Agricultura y medio ambiente. En: Agricultura Sostenible. Jiménez Díaz et al. (eds.). Mundi prensa. España. pp.5-36. [ Links ]
29. Madejón, E; F Moreno; JM Murillo & F Pelegrín. 2007. Soil biochemical response to long-term conservation tillage under semi-arid Mediterranean conditions. Soil Till. Res. 94: 346- 352. [ Links ]
30. Marinari, S; R Mancinelli; E Campiglia & S Grego. 2006. Chemical and biological indicators of soil quality in organic and conventional farming systems in Central Italy. Ecol. Indicators 6: 701-711. [ Links ]
31. McGill, WB; KR Cannon; JA Robertson & FD Cook. 1986. Dynamics of soil microbial biomass and water-soluble organic C in Breton L after 50 years of cropping to two rotations. J. Soil Sci. 66: 1-19. [ Links ]
32. Melero, S; JC Ruiz Porras; JF Herencia & E Madejon. 2006. Chemical and biochemical properties in a silty loam soil under conventional and organic management. Soil Till. Res. 90: 162- 170. [ Links ]
33. Micucci, F & M Taboada. 2006. Soil physical properties and soybean (Glycine max, Merrill) root abundance in conventionally- and zero-tilled soils in the humid Pampas of Argentina. Soil Till. Res. 86: 152-162. [ Links ]
34. Nannipieri, P. 1994. The potential use of soil enzymes as indicators of productivity, sustainability and pollution. In: Pankhurst, CE; BM Doube; VVSR Gupta & PR Grace (eds.). Soil Biota: Management in Sustainable Farming Systems. CSIRO, Australia, pp. 238-244. [ Links ]
35. Nelson, D & L Sommers. 1982. Total carbon, organic carbon and organic matter. Methods of soil analysis, Part 2, Chemical and Microbiological Properties. Page et al. (eds.). Am. Soc. Agron. Madison, WI, USA, 539-577. [ Links ]
36. Ogle, SM; FJ Breidt & K Paustian. 2005. Agricultural management impacts on soil organic carbon storage under moist and dry climatic conditions of temperate and tropical regions. Biogeochemistry 72: 87-121. [ Links ]
37. Roldán, A; F Caravaca; MT Hernández; C García; C Sánchez- Brito; M Velásquez & M Tiscareño. 2003. No-tillage, crop residue additions, and legume cover cropping effects on soil quality characteristics under maize in Patzcuaro watershed (Mexico). Soil Till. Res. 72: 65-73. [ Links ]
38. Rotenberg, D; A Jiménez Wells; EJ Chapman; AE Whitfield; RM Goodman & LR Cooperband. 2007. Soil properties associated with organic matter-mediated suppression of bean root rot in field soil amended with fresh and composted paper mill residuals. Soil Biol. Biochem. 39: 2936-2948. [ Links ]
39. SAS System. 2001. Version 8.1 of SAS Institute, Inc., Cary, NC, USA. [ Links ]
40. Sinsabaugh, RL.1994. Enzymatic analysis of microbial pattern and process. Biol. Fertil. Soils 17: 69-74. [ Links ]
41. Soil Survey Staff. 2006. Keys to Soil taxonomy. 10th Edition. USDA. NRCS, Washington DC. 341pp. [ Links ]
42. Tabatabai, M. 1982. Soil Enzimes. Methods of soil analysis, Part 2, Chemical and Microbiological Properties. Page et al. (eds.). Am. Soc. Agron. Madison, WI, USA. pp. 903-943. [ Links ]
43. Trasar-Cepeda, C; MC Leiro´s; S Seoane & F Gil-Sotres. 2008. Biochemical properties of soils under crop rotation. Appl. Soil Ecol. 39: 133-143. [ Links ]
44. Tripathi, S; A Chakraborty; A Chakrabarti & BK Bandyopadhyay. 2007. Enzyme activities and microbial biomass in coastal soils of India. Soil Biol. Biochem. 39: 2840-2848. [ Links ]
45. Urioste, AM.; GG Hevia; EN Hepper; LE Antón; AA Bono & DE Buschiazzo. 2006. Cultivation effects on the distribution of organic carbon, total nitrogen and phosphorus in soils of the semiarid region of Argentinian Pampas. Geoderma 136: 621- 630. [ Links ]
46. Urricariet, S & R Lavado. 1999. Indicadores de deterioro en suelos de la Pampa Ondulada. Ciencia del Suelo 17: 37-44 [ Links ]














