Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencia del suelo
versión On-line ISSN 1850-2067
Cienc. suelo vol.28 no.1 Ciudad Autónoma de Buenos Aires ene./jul. 2010
TRABAJOS
Eficiencia del embudo Berlese-Tullgren para extracción de artrópodos edáficos en suelos argiudoles típicos de la provincia de Buenos Aires
Rosana V. Sandler; Liliana B. Falco; Cesar Di Ciocco; Romina De Luca & Carlos E. Coviella
Departamento de Ciencias Básicas e Instituto de Ecología y Desarrollo Sustentable. Universidad Nacional de Luján (INEDES). Av. Constitución y Ruta 5 - CC 221 (6700) Luján
*Correo electrónico: rosandler@yahoo.com.ar
Recibido: 09-02-10
Aceptado: 26-05-10
RESUMEN
Con la finalidad de evaluar la eficiencia del embudo de Berlese-Tullgren como método de extracción de artrópodos edáficos en suelos Argiudoles típicos de la provincia de Buenos Aires, se recolectaron 54 muestras de suelo de campos agrícolas, ganaderos y pastizales naturalizados ubicados en las localidades de Chivilcoy y Navarro en dos épocas del año: mayo y agosto del 2009. En cada fecha, se tomaron 27 muestras al azar de suelo en cuadrados de 25 x 25 cm y 5 cm de profundidad. Las muestras se recolectaron en recipientes de 150 cm³. A todas ellas se les aplicó en primer lugar el método de Berlese-Tullgren y luego el de flotación con sulfato de magnesio, con el objetivo de detectar y cuantificar la información que se pierde si sólo se aplica el método de Berlese. Los grupos taxonómicos encontrados fueron Ácaros (Oribátidos, Prostigmatas, Mesostigmatas), Colémbolos, Dípteros e Himenópteros. A los datos obtenidos (Ind/muestra) se les realizó un test no paramétrico (prueba de Wilcoxon) y un análisis de regresión logística. Se registraron diferencias significativas en las abundancias de individuos entre ambos métodos para todos los grupos de organismos. Si bien ambos métodos extraen los mismos grupos taxonómicos, el método de flotación es significativamente más eficiente en la extracción de ácaros y colémbolos, mientras que el embudo de Berlese extrae los Dípteros e Himenópteros.
Palabras clave. Muestreo de suelos; Artrópodos edáficos; Método de flotación.
Berlese-Tullgren funnel efficiency for soil arthropod extraction from typic argiudoll soils in Buenos Aires province (Argentina)
ABSTRACT
The efficiency of the Berlese-Tullgren funnel as a method for soil arthropod extraction from typical argiudol soils in Buenos Aires Province (Argentina) was evaluated. Fifty-four samples were taken from agricultural, cattle grazing, and naturalized prairie soils in Navarro and Chivilcoy sites on two different occasions: may and august, 2009. On each date, 27 soil samples were taken from randomly selected 25 x 25 square samples 5 cm in depth. The samples were collected in 150 cm³ containers. The Berlese-Tullgren funnel method was then applied to each sample, followed by the flotation method with Magnesium Sulphate, to detect and quantify the information that is lost when only the Berlese method is used. The taxonomic groups found were Acari (Oribatida, Prostigmata, and Mesostigmata), Collembola, Diptera, and Hymenoptera. The non-parametric Wilcoxon test and a logistic regression were performed on the data. Significant differences were detected between methods for all the biological groups. Even though both methods extract the same taxa, the flotation method is more efficient in extracting Acari and Collembola, while the Berlese method is more efficient in retrieving Diptera and Hymenoptera.
Key words. Soil sampling; Soil arthropod; Flotation method.
INTRODUCCIÓN
Los servicios ecosistémicos que brinda el suelo son el resultado de diversos procesos en los cuales los invertebrados juegan un rol preponderante. La fauna del suelo influye en el tipo de humus que se forma, en las propiedades físicas y químicas que adquiere el suelo, en la tasa de descomposición de la materia orgánica y en el ciclado de nutrientes (Vedder et al., 1996; Michelena et al., 1998; Kandeler et al., 1999; Momo & Falco, 2003).
En el suelo existen diversas comunidades cuya organización se basa en las relaciones funcionales entre los distintos organismos que allí habitan. Así, cada componente biológico juega un rol funcional determinado en su nicho específico y difícilmente puede ser reemplazado por otros presentes en este complejo sistema (Decaens et al., 2006). En particular, la importancia de la mesofauna edáfica en un ecosistema radica en su diversidad estructural y funcional al contribuir, en interacción con la microflora, a la descomposición de la materia orgánica y al ciclo de nutrientes. Sus representantes han mostrado ser, además, indicadores excelentes de la calidad del suelo (Paoletti et al., 1991).
En este sentido, existe en el mundo una tendencia creciente a utilizar la estructura de la comunidad presente en un sitio como indicadora de su calidad, especialmente al momento de la toma de decisiones respecto del manejo de recursos. Así por ejemplo, la Directiva Marco para el Manejo de los recursos hídricos de la Comunidad Europea, utiliza el concepto de «estado ecológico» al momento de definir la calidad del recurso hidrológico (Olivera & Cortés, 2006).
Por esto, y para una adecuada estimación de la composición específica y de la estructura de la comunidad del suelo, es indispensable contar con sistemas de muestreo apropiados y con un método eficiente para la extracción de la fauna edáfica.
Desde inicios del siglo XX, se han desarrollado y utilizado diferentes métodos de extracción de fauna edáfica, los cuales se pueden dividir en dos grupos (Southwood et al., 2000): los llamados métodos activos o dinámicos, entre los cuales podemos señalar el desarrollado por Berlese (1905), modificado por Krausse (1915) y Tullgren (1918); y el de alto-gradiente desarrollado por Macfayden (1961). El otro grupo incluye los llamados métodos pasivos o mecánicos, como el método de flotación desarrollado por Ladell (1936), modificado por Salt & Hollick (1944) y Aucamp & Ryke (1964), en los cuales las muestras de suelo se mezclan con un líquido con una densidad mayor que la de los artrópodos y menor que la del sustrato; también se incluyen los desarrollados por Geurs (1991), Andre & Ryke (1993) y Ducarme (1999), que están basados en la afinidad que presenta la cutícula de los artrópodos hacia los derivados del petróleo, como heptano o 1,2 dibromoetano.
Los métodos dinámicos requieren de la migración activa de los individuos. Los artrópodos se mueven a través del suelo en respuesta a cambios en un gradiente de humedad y de temperatura (Merchant & Crossley, 1970), por tal motivo estos métodos extraen solo organismos activos y de buena movilidad. Por otro lado, los métodos pasivos extraen tanto organismos activos como pasivos, así como también estados de quiescencia (Walter et al., 1987).
En general, los métodos dinámicos son más rápidos y sencillos de utilizar, mientras que los sistemas pasivos recuperan una mayor cantidad de información pero son extremadamente intensivos en mano de obra (Ducarme, 1999), por lo cual su utilización es menos frecuente.
Asímismo, la eficiencia de cada método depende de la textura del suelo, humedad y de las características (tamaño, movilidad) de los organismos que se pretende extraer (Macfayden, 1953).
El objetivo de este trabajo fue el de cuantificar la información que se pierde al utilizar solamente un método, en este caso el sistema de Berlese-Tullgren, para la extracción de artrópodos en suelos del tipo Argiudoles con diferentes manejos y de esta forma estimar que método resulta más apropiado en este tipo de suelo.
MATERIALES Y METODOS
Sitio de muestreo
El estudio se llevó a cabo en campos agrícolas, ganaderos y pastizales naturalizados de las localidades de Chivilcoy y Navarro, provincia de Bueno Aires, cuyos suelos son Argiudoles típicos según la nomenclatura de suelos del USDA (USDA-NRCS, 2010). Se tomaron un total de 54 muestras en dos fechas, 27 muestras en mayo y 27 en agosto de 2009. Nueve muestras por cada uso de suelo en cada fecha de muestreo. La toma de las mismas se realizó determinando cuadrados al azar de 25 x 25 cm tomando la muestra de los primeros 5 cm de profundidad del suelo de cada cuadrado. El tamaño de la muestra fue de 150 cm³. Una vez extraídas, las muestras se colocaron en heladera a una temperatura de aproximadamente 6 °C hasta su arribo al laboratorio para su procesamiento el mismo día (Lakly & Crossley, 2000).
Cada muestra se sometió a dos técnicas de extracción en forma sucesiva: Embudo de Berlese-Tullgren, y método de flotación con sulfato de magnesio. Una vez que las muestras llegaron al laboratorio, se las colocó en los embudos, por 10 días, luego se las retiró y se las sometió al método de flotación para extraer los artrópodos remanentes.
Embudo de Berlese-Tullgren
Este método fue descripto en primer lugar por Berlese (1905) y luego fue modificado por Tullgren (1918) el cual le agregó el uso de una fuente de luz.
El mismo constó de un embudo sobre el cual se colocó un tamiz con un diámetro de malla de 3 mm. Sobre el tamiz se colocó un volumen de 150 cm³ de suelo, de forma invertida y ligeramente desagregada manualmente y sobre el conjunto se aplicó una fuente de luz de 40 W de intensidad a 40 cm de distancia durante 10 días. Para evitar un secado demasiado rápido la muestra fue humedecida regularmente durante las primeras 72 hs. A medida que la muestra se va secando, los ejemplares se concentran en la parte inferior de la misma y acaban cayendo a un recipiente o colector, completamente oscuro, situado en el extremo del embudo y que contiene alcohol al 70% como fijador y conservante. Posteriormente se procedió al reconocimiento de los organismos bajo lupa y a su clasificación.
La mayoría de los organismos del suelo son lucífugos (huyen de la luz) al tiempo que higrófilos (con afinidad por la humedad) por lo que resulta fácil extraerlos aplicándoles un gradiente creciente de luz y calor, el cual es el fundamento de este tipo de técnica.
Técnica de flotación
Este método ha sido desarrollado por Ladell (1936), Salt & Hollick (1944) y por Strickland (1945).
Luego de aplicado el método de Berlese-Tullgren las muestras fueron sometidas a un tamizado húmedo a través de tamices de distinto tamaño de malla, 4, 2 y 1 mm, los cuales se colocaron uno encima del otro dentro de un recipiente plástico. El objetivo de hacer pasar la muestra por estos tamices es ir recolectando los organismos de mayor tamaño, así como también ir disgregando el suelo en porciones de menor tamaño para que la solución agregada actúe de manera más eficiente. Al filtrado que quedó en este recipiente (agua con sedimentos) se le agregó una solución de sulfato de magnesio al 1,2%, se mezcló bien para que esta pueda actuar de forma correcta en todo el volumen de la muestra y se lo dejó actuar durante 20 a 30 minutos. Debido a una diferencia de densidad, esta técnica permite que floten los organismos y así puedan ser extraídos con pipetas Pasteur o pincel. Una vez que la muestra decantó se colectó el sobrenadante y posteriormente se colocó en alcohol 70% para su conservación y posterior reconocimiento bajo lupa y clasificación.
Los organismos encontrados en las muestras fueron clasificados en grandes grupos taxonómicos
Análisis estadístico
Para evaluar posibles diferencias en la eficiencia entre ambos métodos los datos obtenidos fueron analizados mediante el test no paramétrico de la prueba de los rangos con signo de Wilcoxon, al no cumplirse los supuestos de homogeneidad de varianza y distribución normal de los datos (Test de Levene).
Posteriormente, para analizar el vínculo entre ambos métodos se realizó una regresión logística que permite encontrar la relación entre una probabilidad (una variable y comprendida entre 0 y 1) y una variable independiente x. Para nuestro caso la variable y fue la probabilidad de extracción del método de Berlese, en tanto que la variable independiente fue el total de individuos encontrados en cada muestra, obtenido sumando los resultados del método de Berlese-Tullgren y el de flotación. La regresión se aplicó para cada uno de los grupos taxonómicos identificados.
RESULTADOS
Ambos métodos colectaron los mismos grupos taxonómicos (Ácaros: Oribátidos, Mesostigmatas y Prostigmatas, Colémbolos, y los agrupados en la macrofauna: adultos de Dípteros, e Himenópteros), la diferencia encontrada, a este nivel de observación, fue en las abundancias. La Tabla 1 muestra los individuos encontrados aplicando primero el embudo y luego flotación.
Con respecto a la interacción método x grupo faunístico, el test de Wilcoxon mostró diferencias significativas (n=54, p<0,0001) encontrándose que en este tipo de suelos el método de flotación fue más eficiente para los ácaros y colémbolos, mientras que el método de Berlese-Tullgren extrae los organismos de mayor tamaño tales como dípteros e himenópteros (Fig. 4).
Mientras que para los colémbolos la eficiencia de la técnica de flotación fue, aproximadamente, 7 veces mayor que el embudo, para los oribátidos esta eficiencia fue 18 veces mayor (Tabla 1). Para los prostigmatas y mesostigmatas la abundancia obtenida también fue mayor mediante el método flotación. El embudo extrajo la mayoría de los Dípteros e Himenópteros ya que los encontrados con flotación estuvieron en muy baja cantidad.
Con el análisis de regresión logística se espera que la probabilidad de encontrar un individuo aumente con la abundancia, con un coeficiente b negativo para la regresión. Pero contrariamente a lo esperado, los resultados obtenidos con este análisis con respecto a los ácaros y colémbolos muestran que, a medida que aumenta la abundancia de individuos en una muestra, la probabilidad de encontrar un individuo con el método de Berlese-Tullgren disminuye (Figs. 1 y 2), con un coeficiente b positivo para la regresión (Tabla 2), mientras que aumenta la probabilidad de encontrarlo con el método de flotación.
Tabla 1. Promedios de abundancia (±SD) encontrados en ambas series de datos según el método de separación empleado (Berlese-Tullgren y Flotación).
Table 1. Abundance average (±SD) found for both data series according to the extraction method used (Berlese-Tullgren or flotation).


Figura 1. Probabilidad de encontrar un ácaro con el método de Berlese-Tullgren a medida que aumenta la abundancia. r²=0,997.
Figure 1. Probability of finding a mite with the increase in abundance, using the Berlese-Tullgren method. r²=0.997.
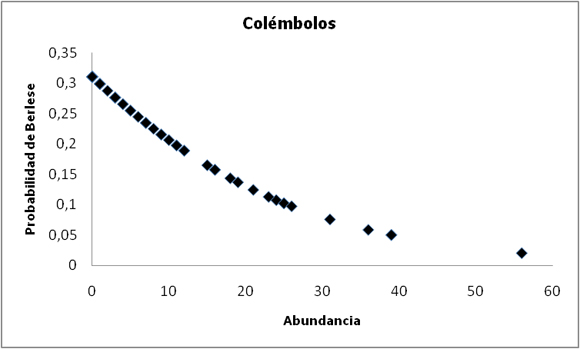
Figura 2. Probabilidad de encontrar un colémbolo con el método de Berlese-Tullgren a medida que aumenta la abundancia. r²=0,997.
Figure 2. Probability of finding a collembolan with the increase in abundance, using the Berlese-Tullgren method. r²=0.997.
Tabla 2. Parámetros de la regresión logística ![]() para los diferentes grupos de organismos. X=abundancia total de organismos.
para los diferentes grupos de organismos. X=abundancia total de organismos.
Table 2. Parameters of the logistic regression![]() for the different biological groups. X= total abundance.
for the different biological groups. X= total abundance.

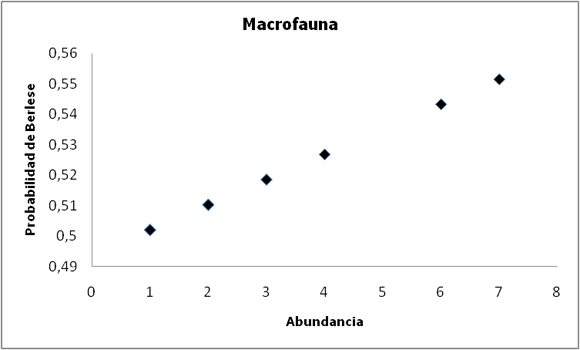
Figura 3. Probabilidad de encontrar un Díptero o Himenóptero con el método de Berlese-Tullgren a medida que aumenta la abundancia. r²=0,895.
Figure 3. Probability of finding a Dipteran or Hymenopteran with the increase in abundance, using the Berlese-Tullgren method. r²=0.895.

Figura 4. Porcentajes extraídos por cada método para cada grupo faunístico analizado.
Figure 4. Percentage extracted by each method for each analyzed group.
Para los organismos de mayor tamaño, como lo son los dípteros e himenópteros, la regresión logística dio como resultado que la probabilidad de encontrar un individuo con Berlese-Tullgren, aumenta con la abundancia (b negativo) (Fig. 3).
DISCUSIÓN
La menor eficiencia en estos suelos del método de Berlese con respecto a los ácaros y colémbolos se debe a que estos organismos poseen un tamaño menor, no siendo este el suficiente para permitir romper la estructura del suelo producto de los movimientos a través de los poros (Stork & Eggleton, 1992). Mientras que, si bien los grupos de organismos de mayor tamaño no presentaron una alta abundancia, esta fue mayor en el embudo de Berlese debido a su mayor tamaño y movilidad lo que les permite desplazarse por los poros presentes en el suelo.
Los resultados aquí presentados no concuerdan con los obtenidos por El-Kifl (1957) quién encontró que el embudo Berlese-Tullgren es más eficiente para la extracción de colémbolos y ácaros que el de flotación. Wood (1965) encontró que el método Berlese-Tullgren fue superior al de flotación para la extracción de grupos de ácaros y colémbolos, especialmente formas débilmente esclerotizadas, de suelos poco productivos con un desarrollo vertical muy escaso.
Macfadyen (1967) también encuentra diferencias entre los métodos en suelos minerales y turberas siendo más eficiente la flotación para colémbolos y el embudo para ácaros. Estos resultados son inversos a los encontrados por Yoshida (2008) en la hojarasca del dosel de una plantación de cedros en Japón, en donde el embudo resultó mucho más eficiente para los colémbolos, debido a su amplia capacidad de dispersión, mientras que los métodos de flotación resultaron ser más eficientes para ácaros, coleópteros y larvas de dípteros debido a su menor movilidad.
Para ecosistemas forestales y otros sistemas con suelos con alto contenido de materia orgánica, el método de extracción de Berlese-Tullgren es el elegido basado en su simplicidad y rápido procesamiento pese a no ser un método altamente eficiente (Crossley & Blair, 1991).
La eficiencia de los embudos es más variable que el método de flotación debido a su baja eficacia en la extracción de estados inactivos, o diferencial eficiencia para algunos grupos de microartropodos (Lakly & Crossley, 2000).
Al coincidir nuestros resultados con los de algunos autores y no coincidir con los de otros, una de las conclusiones a la cual se llega es que la eficiencia de los diferentes métodos de extracción de fauna del suelo depende de las características del suelo en el cual se están realizando los estudios, concordando con diferentes autores (Forsslund, 1948; Berthet, 1954; Macfadyen, 1955; Nef, 1960; Haarlov, 1962; Wood, 1965; Tanaka, 1970; Lussenhop, 1971; Huhta, 1972), los cuales detallan que los diferentes métodos de extracción operan con diferente eficiencia dependiendo de la naturaleza del suelo, así como del tamaño y la movilidad de los organismos a los cuales se quiera evaluar.
Los resultados obtenidos con la regresión logística podrían indicar que en este tipo de suelos, el método del embudo de Berlese-Tullgren extrae principalmente los organismos que se encuentran en los primeros cm de suelo. En este caso, los organismos que aumentan en abundancia serían los que se encuentran a mayor profundidad, los cuales son entonces extraídos más eficientemente con el método de flotación, lo que explicaría la relación inversa entre probabilidad de extracción de Berlese-Tullgren vs. abundancia. Es necesaria una mayor resolución taxonómica a fin de evaluar si esas diferencias se corresponden con algunos grupos taxonómicos o funcionales en particular. Muestreos actualmente en curso en los mismos sitios proveerán de los datos necesarios.
Este trabajo se realizó dentro del contexto de un proyecto en el que se realizan estudios de las comunidades de la mesofauna edáfica en suelos con diferentes usos, como son los de agricultura y la ganadería con destino a la generación de índices biológicos de calidad de suelo. Por tal motivo y para los objetivos específicos del proyecto citado el método de flotación brinda una mayor y mejor información que el método de Berlese-Tullgren. Es de destacar, sin embargo, que para estudios taxonómicos y sistemáticos, el método de Berlese-Tullgren puede resultar de mayor utilidad debido a que consume menos tiempo y esfuerzo y el material obtenido resulta menos dañado.
AGRADECIMIENTOS
Los autores desean agradecer la colaboración brindada por el Dr. Fernando Momo y la Dra. Susana Filipini con los análisis estadísticos. Asimismo desean reconocer la colaboración de los Sres. Edgardo Ferrari y Pablo Peretto por facilitar los campos en los que se realizaron los muestreos. Desean asimismo agradecer el trabajo de dos revisores anónimos, cuyos comentarios ayudaron a mejorar la versión final de este manuscrito. Este trabajo fue financiado mediante el PICT-02293-2006 de la Agencia Nacional de Promoción Científica y Tecnológica y por la Universidad Nacional de Luján.
BIBLIOGRAFÍA
1. Andre, HM & MI Noti. 1993. Extracting sand microarthropods a carbon-tetrachloride flotation method. Eur. J. Soil Biol. 29: 91-96. [ Links ]
2. Aucamp, JL & PA Ryke. 1964. Preliminary report on a grease film extraction method for soil microarthropods. Pedobiologia 4: 77-79. [ Links ]
3. Berlese, A. 1905. Apparachio per raccogliere presto ed in gran numero piccoli Artropodi. Redia 2: 85-9. [ Links ]
4. Berthet, P. 1954. L'chantillonnage de la litiere des forets pour l'6tude quantitative des populations d'Acariens et de Collemboles. Ann. Soc. Roy. Zool. Belg. 85: 5-22. [ Links ]
5. Crossley, DA, Jr & JM Blair. 1991. A high efficiency, 'low technology' Tullgren-type extractor for soil microarthropods. Agric. Ecosyst. Environ. 34: 182-187. [ Links ]
6. Decaëns, T; JJ Jiménez; C Gioia; J Measey & P Lavelle. 2006. The values of soil animals for conservation biology. Eur. J. Soil Biol. 42(Supplement 1): S23-S38. [ Links ]
7. Ducarme, X; HM Andre & P Lebrun. 1999. Extracting endogenous microarthropods: a new flotation method using 1,2-dibro-moethane. Eur. J. Soil Biol. 34: 143-150. [ Links ]
8. El-Kifl, AH. 1957. Comparison between a wet and a dry method for extraction of soil arthropod fauna. Bull. Soc. ent. Egypt. 41: 525-6. [ Links ]
9. Forsslund, KH. 1948. Nagot om insamlingsmetodiken vid markfaunaunders6kningar. Medd. Skogforskn. Inst. Stockh. 37(7): 1-22. [ Links ]
10. Geurs, M; J Bongers & L Brussaard. 1991. Improvements to the heptane flotation method for collecting microarthropods from silt loam soil. Agric. Ecosyst. Environ. 34: 213-221. [ Links ]
11. Haarlov, N. 1962. A quantitative comparison of hand sorting and extraction with a Tullgren funnel. Pp. 156-157. In: Murphy (ed.). Soil Zoology. PW Butter- worth. London. [ Links ]
12. Huhta, V. 1972. Efficiency of different dry funnel techniques in extracting Arthropoda from raw humus forest soil. Ann. Zool. Fennici. 9: 42-48. [ Links ]
13. Kandeler, E; C Kampichler; RG Joergensen; K Molter. 1999. Effects of mesofauna in a spruce forest on soil microbial communities and N cycling in field mesocosms. Soil Biol. Biochem. 31: 1783-1792. [ Links ]
14. Krausse, A. 1915. Hexapodologische Notizen. Arch. Naturgesch. 81(A): 160-167. [ Links ]
15. Ladell, WRS. 1936. A new apparatus for separating insects and other arthropods from the soil. Ann. Appl. Biol. 23: 862-79. [ Links ]
16. Lakly Michelle, B & DA Crossley, Jr. 2000. Tullgren extraction of soil mites (Acarina): Effect of refrigeration time on extraction efficiency. Exp. Appl. Acarol. 24: 135-140 [ Links ]
17. Lussenhop, J. 1971. A simplified canister-type soil arthropod extractor. Pedobiologia 11: 40-45. [ Links ]
18. Macfadyen A. 1953. Notes on Methods for the Extraction of Small Soil Arthropods. Pp. 65-77. Journal of Animal Ecology. Vol. 22. No. 1. Published by: British Ecological Society. [ Links ]
19. Macfadyen A. 1955. A comparison of methods for extracting soil arthropods. Pp. 315-332. In: Mc E. Kevan (ed.). Soil Zoology. D.K. Butterworth, London. [ Links ]
20. Macfadyen A. 1961. Improved funnel-type extractors for soil Arthropods. J. Anim. Ecol. 30: 17 l-182. [ Links ]
21. Macfadyen, A. 1967. Methods of investigation of productivity of invertebrates in terrestrial ecosystems. Pp. 383-412 In: K. Petrusewicz (ed.). Secondary productivity of terrestrial ecosystems. [ Links ]
22. Merchant, VA & DA Crossley, Jr. 1970. An inexpensive, high-efficiency Tullgren extractor for soil microarthropods. J. Georgia Entomol. Soc. 5: 83-87. [ Links ]
23. Michelena, RO; CB Irurtia; A Pittaluga; F Vavruska & ME B de Sardi. 1988. Degradación de los suelos en el sector norte de la Pampa Ondulada. Ciencia del Suelo 6: 60-66. [ Links ]
24. Momo, F & L Falco. 2003. Mesofauna del suelo. Biología y ecología. Pp 51-58. En: A. Albanesi (ed.). Microbiología Agrícola. Un Aporte de la Investigación Argentina. Editorial de la Universidad Nacional de Santiago del Estero, Santiago del Estero. [ Links ]
25. Nef, L. 1960. Comparaison de l'efficacit de differentes variantes de l'appareil de Berlese-Tullgren. Z. angew. Ent. 46: 178-199. [ Links ]
26. Olivera, SV & RMV Cortés. 2006. Environmental indicators of ecological integrity and their development for running Waters in Northern Portugal. Limnetica 25(1-2): 479-498. [ Links ]
27. Paoletti, MG; MR Favretto; BR Stinner; FF Purrington & JE Bater. 1991. Invertebrates as bioindicators of soil use. Pp. 341-362. In: DA Crossley Jr., et al. (eds.). Modern techniques in soil ecology. Elsevier, Nueva York. [ Links ]
28. Salt, G & FSJ Hollick. 1944. Studies of wireworm populations. I. A census of wireworms in pasture. Ann. Appl. Biol. 31: 52-64. [ Links ]
29. Southwood, TRE & PA Henderson. 2000. Ecological Methods. 3rd Edition. 575 pp. Blackwell Publishing, Oxford, OK. [ Links ]
30. Stork NE & P Eggleton. 1992. Invertebrates as determinants and indicators of soil quality. American Journal of Alternative Agriculture 7: 38-47. [ Links ]
31. Strickland, AH. 1945. A survey of the arthropod soil and litter fauna of some forest reserves and cacao estates in Trinidad, British West Indies. J. Anim. Ecol. 14: 1-11. [ Links ]
32. Tanaka, M. 1970. The bio-economics on the populations of Isotoma (Desiora) trispinata Mac Gillivary (Collembola; Isotomidae) and Onychiurus (Protaphorura) sp. (Collembola; Ony-chiuridae) in a grassland. Publ. Amakusa Marine Biol. Lab., Kyushu Univ. 2: 51-120. [ Links ]
33. Tullgren, A. 1918. Ein sehr einfacher Ausleseapparat fuAr terricole Tierfaunen. Z. angew. Ent. 4: 149-50. [ Links ]
34. United States Department of Agriculture, Natural Resources Conservation Service. 2010. Keys to soil taxonomy, 11th Edition, Washington DC, USA. [ Links ]
35. Vedder, B; C Kampichler; G Bachmann; A Bruckne & E Kandeler. 1996. Impact of Faunal. Complexity on Microbial Biomass and N Turnover in Field Mesocosms from a Spruce Forest Biol. Fertil Soils 22: 22-30. [ Links ]
36. Walter, DE; J Kethley & JC Moore. 1987. A heptane flotation method for recovering microarthropods from semiarid soils, with comparisons to the Merchant-Crossley highgradient extraction method and estimates of microarthropod biomass. Pedobiologia 30: 221-232. [ Links ]
37. Wood, TG. 1965. Comparison of a Funnel and a Flotation Method for Extracting Acari and Collembola from Moorland Soils. Pedobiologia 5: 131-139. [ Links ]
38. Yoshida Tomohiro & Naoki Hijii. 2008. Efficiency of extracting microarthropods from the canopy litter in a Japanese cedar (Cryptomeria japonica D. Don) plantation: a comparison between the washing and Tullgren methods. J. For. Res. 13: 68-72. [ Links ]














