Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencia del suelo
versión On-line ISSN 1850-2067
Cienc. suelo vol.28 no.2 Ciudad Autónoma de Buenos Aires ago./dic. 2010
TRABAJOS
Determinación de la actividad lignocelulolítica en sustrato natural de aislamientos fúngicos obtenidos de sabana de pastoreo y de bosque secundario de sabana inundable tropical
Martha Lucía Ortiz Moreno1* & Daniel Uribe Vélez2
1 Facultad de Ciencias Básicas e Ingeniería, Universidad de los Llanos, km 12 vía Puerto López vereda Barcelona, Villavicencio, Colombia.
2Instituto de Biotecnología, Universidad Nacional de Colombia, Cr 30#45-02, Bogotá, Colombia.
*Correo electrónico: mlortizm@unillanos.edu.co
Recibido: 06-03-10
Aceptado: 08-11-10
RESUMEN
El objetivo de este trabajo fue identificar aislamientos de hongos ligninolíticos y celulolíticos que pudieran degradar desechos de cosecha y mejorar las características del suelo en los Llanos Orientales, se realizó un muestreo siguiendo la metodología de transepto y muestras integradas. Se obtuvo una cepa ligninolítica (005L Verticillium spp.) y 72 cepas celulolíticas. La comparación de los usos del suelo (sabana de pastoreo y bosque secundario) mostró que no existía una relación entre el número de géneros obtenidos y las características del suelo. Posteriormente, se realizó la cuantificación de la actividad celulolítica y ligninolítica de los aislamientos para identificar las cepas que posteriormente serían evaluadas en el sustrato natural pasto seco (Brachiaria spp.). Se encontraron dos cepas con alta actividad exoglucanasa (055C y 061C Penicillium spp.) y una cepa con alta actividad endoglucanasa (019C Trichoderma spp.) respecto al control Trichoderma viride. En el sustrato natural se evaluaron los consorcios de las cepas seleccionadas formados por pares: una ligninolítica y una celulolítica. Las pruebas mostraron que los aislamientos promisorios aumentaron su actividad enzimática en el sustrato pasto superando a los controles positivos (Pleurotus ostreatus para lignina y T. viride para celulosa) y que los consorcios no afectaron la capacidad enzimática de las cepas que los formaban. Por lo tanto, se recomienda utilizar estos consorcios para el desarrollo de biofertilizantes acondicionadores del suelo, empleando especialmente el consorcio formado por las cepas 005L (Verticillium spp.) y 055C (Penicillium spp.), que mostró alta actividad ligninolítica y celulolítica.
Palabras clave. Llanos; Deuteromicetos; Celulosa; Lignina; Consorcio.
Determination of lignocellulolytic activity in a natural substrate of native fungi strains obtained from savanna and of secondary forest from a tropical flooded savanna
ABSTRACT
The aim of this work was to identify lignolytic and cellulolytic fungal strains capable of degrading harvest waste and thereby improving the soil characteristics of the eastern Llanos of Colombia. Sampling was carried out using the transept methodology and integrated samples. A lignolytic strain (005L Verticillium spp.) and 72 cellulolytic strains were obtained. A comparison of soil usages (savanna grazing and secondary forest) showed no correlation between the number of obtained genera and soil characteristics. Selection of the strains to be evaluated in a dry-grass natural substrate (Brachiaria spp.) was carried out by quantification of lignolytic and cellulolytic activity. Two strains with high exoglucanase activity (055C and 061C Penicillium spp.) and a strain with high endoglucanase activity (019C Trichoderma spp.) relative to the Trichoderma viride control were selected and evaluated in the natural substrate in consortia formed by one lignolytic and one cellulolytic. The test showed that the enzymatic activity of the selected strains increased in the substrate grass, surpassing that of the positive controls (Pleurotus ostreatus for lignin and T. viride for cellulose) for both consortia. The use of the consortia is therefore recommended for the development of soil conditioning biofertilizers, especially that formed by the 005L (Verticillium spp.) and 055C (Penicillium spp.) strains with high lignolytic and cellulolytic activity.
Key words. Llanos; Deuteromycetes; Cellulose; Lignin; Consortia.
INTRODUCCIÓN
La productividad en las áreas agrícolas depende de la calidad del suelo en términos de estructura, textura, contenido de nutrientes y actividad biológica (Paul & Clark, 1996; Bronick & Lal, 2005; Vargas-García et al., 2010). La lignina y la celulosa son polímeros vegetales cuya degradación determina la dinámica del ciclo del carbono en el ecosistema. Además, la degradación de estos componentes de la biomasa vegetal asegura el retorno de nutrientes al suelo, que permiten la sostenibilidad de la productividad del ecosistema. Sin embargo, las prácticas agrícolas tradicionales como la quema y el arado, truncan el ciclo de los nutrientes al eliminar la cobertura y romper la estructura del suelo (Bronick & Lal, 2005; Rickelfs & Miller, 2000; Bastidas et al., 2009).
En Colombia, los Llanos Orientales comprenden el 38% del territorio nacional. Poseen suelos ácidos con baja fertilidad, altos contenidos de aluminio, hierro y manganeso, baja disponibilidad de nitrógeno, fósforo, potasio, calcio y magnesio. Estos parámetros se asocian con la alta intemperización del material parental que le da origen al suelo (Martin & Botero, 1991; IGAC, 1996). Además, la escasa estructuración del mismo lo hace altamente susceptible a procesos erosivos rápidos, ligados a la alta pluviosidad y el clima húmedo tropical (Rippstein et al., 2001).
La agricultura y la ganadería comercial de los Llanos Orientales Colombianos generan aproximadamente 3x106 t/año de desechos vegetales, compuestos por: 1x106 Mg/ año de celulosa; 0,9x106 Mg/año de hemicelulosa y pectina; 0,2x106 Mg/año de lignina (Rippstein et al., 2001), siendo la lignina y la celulosa los compuestos más recalcitrantes (Paul & Clark, 1996; Días et al., 2010). Estos polímeros de origen vegetal pueden convertirse en una fuente importante de nutrientes para el cultivo de pastos, ya que la materia orgánica es el mayor reservorio de macro y micronutrientes asimilables para las plantas en los suelos fisicoquímicamente deteriorados (Paul & Clark, 1996; Bronick & Lal, 2005; Vargas-García et al., 2010). Una vía para utilizar esta fuente de nutrientes y mejorar las características de los suelos es incorporar microorganismos lignocelulolíticos a los desechos agrícolas para que realicen su degradación in situ. La estrategia de bioaumentación que implica la incorporación al suelo de microorganismos benéficos estimula la actividad biológica edáfica, manteniendo el reciclaje de nutrientes y su biodisponibilidad en el suelo. Además, permite la formación de agregados e indirectamente reduce los requerimientos de fertilización química de los cultivos (Madigan et al., 2000; Bronick & Lal, 2005; Xu et al., 2009; Vargas-García et al., 2010).
Entre los microorganismos capaces de degradar lignina y celulosa, los hongos son los más importantes en los ecosistemas tropicales por su capacidad de secretar enzimas extracelulares, su adaptación a ambientes ácidos, y al estrés hídrico, su rápido crecimiento y estabilidad genética (Paul & Clark, 1996; Madigan et al., 2000; Vargas-García et al., 2010). Los hongos degradan la celulosa rompiendo los enlaces glicosídicos b 1-4, por medio de endoglucanasas que cortan la regiones internas amorfas de la celulosa y exoglucanasas que cortan los extremos libres (Aro et al., 2005; Sánchez, 2009; Bastias et al., 2009; Días et al., 2010).
La lignina es un polímero de unidades fenilpropano, altamente variable, que le da rigidez y resistencia a los tejidos vegetales. Los hongos ligninolíticos producen tres tipos de enzimas extracelulares para su degradación, las lignin y manganeso peroxidasas que oxidan los anillos aromáticos utilizando el peróxido de hidrógeno como cosubstrato y la laccasa que oxida los residuos metoxilo laterales utilizando oxígeno molecular como co-substrato (Leonowicz et al., 1999; Hobbie et al., 2003; Sánchez, 2009; Dias et al., 2010).
El objetivo de este estudio fue seleccionar cepas de hongos ligninolíticos y celulolíticos nativos obtenidos a partir de muestras de suelo con dos diferentes usos (sabana de pastoreo y bosque secundario) de sabana inundable de los Llanos Orientales Colombianos. Se espera, en el futuro, que estas cepas puedan ser utilizadas como inóculo para la degradación in situ de desechos agrícolas y mejorar las características del suelo.
MÉTODOS
Muestreo del suelo
Las muestras de suelo fueron obtenidas de tres fincas que poseían bosque secundario y sabana de pastoreo con Brachiaria spp. ubicadas en inmediaciones de las coordenadas 4°10'N 73°0'O en la vereda La Balsa (Puerto López), departamento del Meta, Colombia, Sudamérica; con una altura de 100-200 msnm, temperatura media de 27 °C y una pluviosidad media anual de 3.000 mm (IDEAM, 2009). El análisis de los suelos indicó que las localidades poseían suelos francos, con poca estructura y bajo contenido de materia orgánica (inferior al 2%), con altas concentraciones de aluminio y hierro (>1meq/100 g >100 mg/kg, respectivamente).
En cada uso del suelo las muestras fueron obtenidas de la siguiente manera: se seleccionó tres transeptos de 15m pseudo-aleatoriamente, es decir, la ubicación del transepto fue aleatorizada para las zonas donde existía acceso por carretera en cada finca. En cada transepto, se colectaron tres muestras de suelo integradas. Cada muestra integrada estaba conformada por cinco sub-muestras (de 100 g cada una) colectadas cada metro dentro del transepto (ICONTEC, 1994). Dieciocho muestras de suelo fueron colectadas en total en bolsas plásticas y almacenadas a 4 °C hasta su análisis de laboratorio.
Aislamiento de hongos
Los hongos celulolíticos y ligninolíticos fueron aislados por dilución seriada de las muestras del suelo. Se preparó una suspensión al 10%p/v con 1g de suelo. Para el aislamiento de hongos celulolíticos y ligninolíticos se empleo agar carboximetilcelulosa (CMC) (Teather & Wood, 1982) y agar lignina (Thorn et al., 1996 modificado), respectivamente. El conteo de colonias se realizó después de 8 días de incubación a 25 °C en oscuridad. Después se realizó el aislamiento de los diferentes morfotipos en los medios específicos donde fueron obtenidos. Los aislamientos fueron determinados taxonómicamente empleando las claves de Barnett & Hunter (1975) y Gilman (1973) que se basan en caracteres macro y microscópicos. Las cepas se almacenaron a -70 °C usando glicerol al 25% como crioprotector.
Actividad celulolítica
La actividad celulolítica de los aislamientos fúngicos fue evaluada usando 10 ml de un caldo de sales (Teather & Wood, 1982) con papel (al 0,8%p/v) como substrato para exoglucanasas y CMC en la misma proporción para endoglucanasas (Romero et al., 1999; Brasil et al., 2004). Se inóculo un plug de agar (1 cm3) de un cultivo con 8 días de crecimiento para cada aislamiento, usando tres réplicas por cepa. Los cultivos se incubaron a 25 °C por 15 días con 150 rpm de agitación. Después se separó la biomasa centrifugando los cultivos a 10.000 g por 10 minutos. El sobrenadante se recuperó y se colocó 500 µl en un tubo de microcentrífuga previamente preparado con 500 µl de buffer citrato y el substrato enzimático (CMC o papel 0,8%p/v). La reacción se incubó a 50 °C por 72 horas y se utilizó la técnica del ácido dinitrosalicilico (DNS) reportada por Miller (1959) para cuantificar los azúcares reductores producidos. La absorbancia fue medida a 451 nm usando un espectrofotómetro de 96 pozos Merck, Sensident Scan. Se empleó glucosa como blanco y una cepa de Trichoderma viride como control positivo para la actividad celulolítica. Como control negativo se empleó medio de cultivo no inoculado con hongo.
Actividad ligninolítica
La actividad ligninolítica de los aislamientos fúngicos fue evaluada usando caldo lignina (Thorn et al., 1996 modificado). Se utilizaron 10 ml de caldo (con lignina alcalina 0,001%g/ml) inoculado con un plug de 1cm3 de cultivo de la cepa a analizar con 8 días de crecimiento; se hicieron tres réplicas por cepa. Los cultivos se incubaron por 8 días a 25 °C y 150 rpm de agitación. Para revelar la presencia de peroxidasas se agregaron 0,4ml de guayacol al caldo lignina. Finalizada la incubación se midió la absorbancia de muestras de 100 µl de cultivo no centrifugado, con una longitud de onda de 488 nm. La detección de actividad laccasa se realizó adicionando, al momento de la lectura, 100 µl de una solución con ABTS (ácido 2'2-azinobis-3-etilben-zotiazolin-6-sulfónico) 1:100 en buffer sodio citrato pH=4 a 100 µl de sobrenadante obtenido, centrifugando el caldo lignina incubado a 10.000 g por 10 minutos. Se empleó peróxido de hidrógeno como co-substrato de la reacción (0,03%v/v) y se dejó reaccionar por 10 min a 25 °C. Las muestras se leyeron a 405 nm. Como control positivo para la actividad ligninolítica se empleó una cepa de Pleurotus ostreatus (Baldrian, 2006). Como control negativo se empleó medio de cultivo no inoculado con hongo.
Evaluación de la actividad enzimática usando Brachiaria spp. como susbstrato natural
Con base en los resultados de actividad enzimática se seleccionaron tres aislamientos celulolíticos y dos ligninolíticos, los cuáles se evaluaron generando seis combinaciones o consorcios en pares (Tabla 1). Se cuantificó su producción de celulasas y ligninasas usando Brachiaria spp. como substrato modelo de la biomasa vegetal de monocotiledóneas. Las condiciones de crecimiento fueron similares a las anteriormente descritas: tres réplicas que contienen 10 ml de medio adicionado con trozos estériles (1cm) de plantas de Brachiaria spp. secas (0,8%p/v). Cada medio fue inoculado con 1 plug de cada cepa fúngica en la prueba de peroxidasas o 5 plugs por cada cepa para las otras enzimas. Para la evaluación de peroxidasas, se adicionó guayacol al medio de cultivo y las cepas fúngicas fueron incubadas a 25 °C a 150 rpm durante 8 días, la oxidación del sustrato fue medida a 488 nm. Para las laccasas y celulasas se procesaron las muestras de forma similar a la anteriormente descrita, los cultivos se incubaron por 15 días y se les aplicó el sistema de detección por DNS para celulasas y ABTS para laccasas. Como control negativo se empleó medio de cultivo no inoculado con hongo.
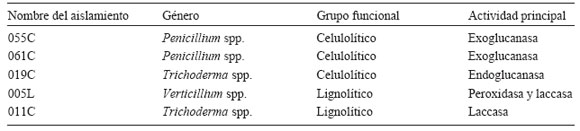
Tabla 1. Aislamientos seleccionados para la prueba enzimática con el substrato Brachiaria spp.
Table 1. Isolates for the enzymatic test with Brachiaria spp. substrate.
La actividad enzimática en todas las pruebas fue expresada en unidades (U) equivalentes a las micromoles de producto de la acción de la enzima por minuto en un litro de medio de reacción.
Análisis estadístico
Se empleó el análisis de varianza y pruebas de comparaciones múltiples para detectar diferencias entre las cepas y consorcios. Los análisis estadísticos se desarrollaron usando el software Minitab 14. Todos los test estadísticos se llevaron a cabo con un 95% de confianza.
RESULTADOS
Conteos de colonias, géneros y morfoespecies por uso del suelo
En el medio de cultivo con lignina crecieron los siguientes géneros en el uso bosque: Penicillium, Verticillium, Fusarium, Zygorhynchus, aunque sólo dos cepas denominadas 005L y 001L pertenecientes al género Verticillium aisladas de bosque y sabana, respectivamente, mostraron actividad ligninolítica por oxidación positiva de guayacol.
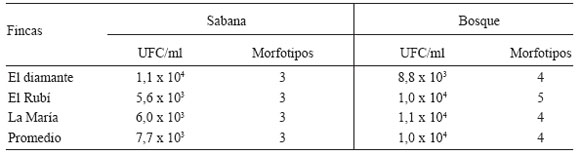
En cuanto a las colonias de hongos degradadores de celulosa se encontró que en el bosque había mayores conteos de unidades formadores de colonias (UFC) por gramo de suelo (valor P=0,006) y morfotipos que en la sabana de pastoreo (valor P=0,002), con diferencias significativas detectadas en el ANOVA con un 95% de confianza (Tabla 2).
Tabla 2. Conteos de colonias y morfotipos de hongos celulolíticos en las localidades estudiadas.
Table 2. Morphotypes and colony counts of cellulolytic fungi in the studied sites.
En bosque las cepas celulolíticas pertenecían a los géneros Actinomucor, Penicillium, Verticillium, Trichoderma, Trichosporonoides, Fusarium, Mucor, Phialophora, Cladosporium y Oidiodendron, siendo estos tres últimos únicos para este uso del suelo. Geotrichum fue encontrado sólo en la sabana, mientras que los demás géneros se repetían en ambos usos del suelo. La Figura 1 muestra el número de morfoespecies que representa a cada género: A) de bosque; B) de sabana.
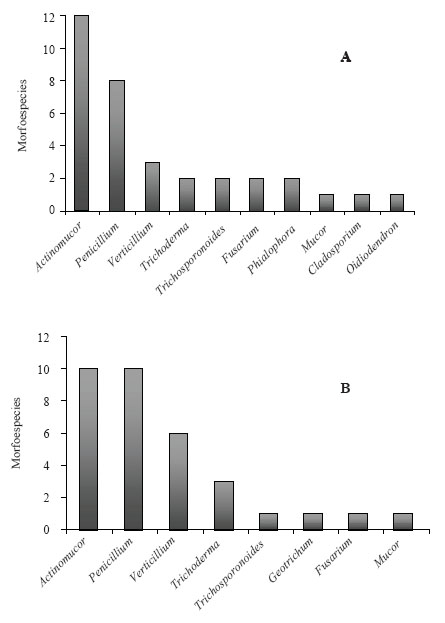
Figura 1. Géneros celulolíticos y el número de morfoespecies registradas para cada uno obtenidos a partir de: A) Bosque; B) Sabana.
Figure 1. Cellulolytic genera and number of morphospecies recorded from: A) Forest, B) Sabana.
Al evaluar los datos obtenidos para géneros celulolíticos por uso del suelo, a través de ANOVA no se encontró diferencias significativas con un valor P=0,789, al 95% de confianza.
A todos los aislamientos obtenidos se les evaluó su actividad enzimática de acuerdo al grupo funcional al que pertenecían.
Actividad enzimática
La actividad peroxidasa para la cepa nativa de Verticillium sp. (005L, aislada de bosque) fue 2 x 10-9U, mientras que la cepa 001L (aislada de sabana) tuvo 1 x 10-9U, Trichoderma viride fue de 3 x 10-9U y Pleurotus ostreatus (control) 1,5 x 10-8U, indicando que la cepa nativa 005L tiene 7,5 veces menos actividad peroxidasa que el control ante el sustrato lignina alcalina (Fig. 2A). Con respecto a la enzima laccasa se encontró que la cepa 005L mostró 2 veces menos actividad que el control en lignina alcalina. No fue detectada actividad enzimática en T. viride y la cepa 001L (Fig. 2B).
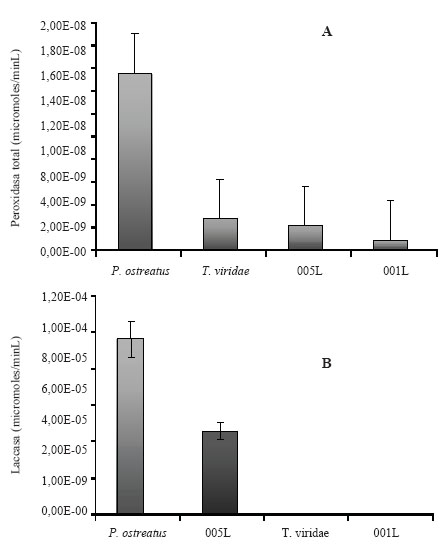
Figura 2. Actividad enzimática para cepas ligninolíticas: A) Actividad peroxidasa; B) Actividad laccasa.
Figure 2. Ligninolytic enzyme activity for strains: A) Peroxidase activity, B) laccase activity.
La actividad exoglucanasa se evaluó en 72 aislamientos, utilizando T. viride como control. De los aislamientos evaluados, 39 superaron al control, siendo las cepas de mayor actividad 055C, 061C, 058C, 059C y 056C. El ANOVA revela diferencias significativas entre la actividad exoglucanasa de las cepas con un valor P=0,000, con el 95% de confianza. El análisis por comparaciones múltiples de Dunnett con el control, indica que las cepas con más actividad exoglucanasa fueron la 055C y la 061C, ambas pertenecientes al género Penicillium y aisladas de sabana (Tabla 3).
Tabla 3. Actividad exoglucanasa de aislamientos fúngicos celulolíticos. Las letras minúsculas indican los grupos de significancia.
Table 3. Exoglucanase activity of cellulolytic fungal isolates. Lowercase letters indicate significance groups.
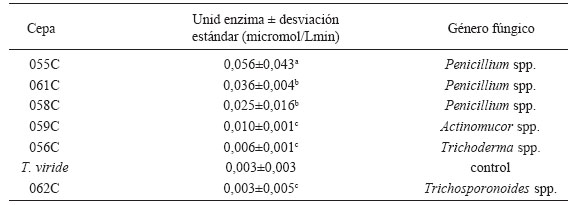
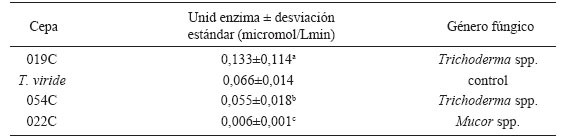
El análisis de la actividad endoglucanasa mostró que de la totalidad de los aislamientos sólo la cepa 019C perteneciente al género Trichoderma superó al control con 0,13U. Esto se pudo detectar con el resultado significativo del ANOVA (valor P=0,000, al 95% de confianza) y el análisis de Dunnett versus T. viride (Tabla 4).
Tabla 4. Actividad endoglucanasa de aislamientos fúngicos celulolíticos. Las letras minúsculas indican los grupos de significancia.
Table 4. Endoglucanase activity of cellulolytic fungal isolates. Lowercase letters indicate significance groups.
Para ampliar el número de cepas con actividad ligninolítica se evaluó la producción de peroxidasas y laccasas por aislamientos celulolíticos pertenecientes a los géneros Trichoderma y Verticillium. Estos géneros se seleccionaron por poseer actividad ligninolítica reportada en la literatura ( Krivobok, 1998; Kiiskinen et al., 2004) y se encontró que la cepa 011C (Trichoderma sp.) produjo 3,8 x 10-9U de peroxidasa y 4,4 x 10-5U de laccasa, esto la ubica con la mayor actividad laccasa dentro del grupo de cepas elegibles.
Las pruebas realizadas permitieron seleccionar las cepas 055C y 061C (actividad exoglucanasa), 019C (actividad endoglucanasa), las cepas 005L y 011C (actividad ligninolítica), para el ensayo con sustrato natural pasto.
Sustrato natural pasto
La evaluación de la actividad ligninolítica en el sustrato pasto muestra que tanto para la producción de peroxidasas como de laccasas, la cepa 005L (Verticillium sp.) y sus consorcios tuvieron tanta actividad enzimática como el control P. ostreatus y superaron a los demás aislamientos y consorcios (ANOVA, valor P=0.000 y Dunnett) (Fig. 3).
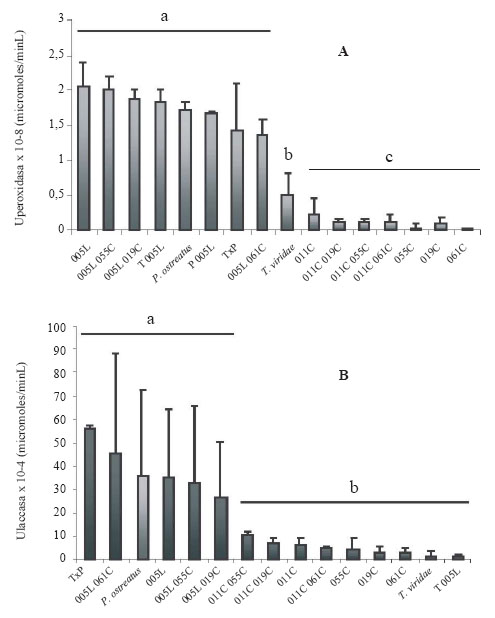
Figura 3. Actividad ligninolítica para los aislamientos fúngicos en consorcios con sustrato pasto: A) Actividad peroxidasa; B) Actividad laccasa. Las letras minúsculas indican los grupos de significancia.
Figure 3. Ligninolytic activity for fungal isolates in consortia with grass substrate: A) Peroxidase activity, B) Laccase activity. Lowercase letters indicate significance groups.
En cuanto a la actividad celulolítica se encontró que los aislamientos 061C, 011C, 055C y 019C, tuvieron actividades exoglucanasas similares al control T. viride, aproximadamente 0,02U (grupo A de significancia de Dunnett, Figura 4A). Las cepas 061C y 055C pertenecen al género Penicillium; 019C y 011C a Trichoderma.
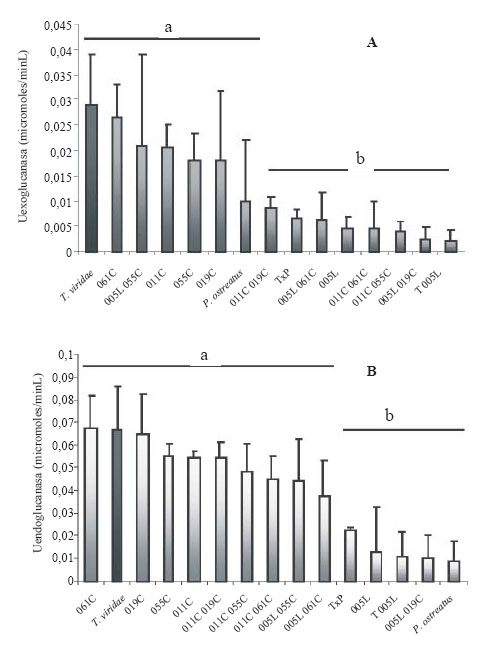
Figura 4. Actividad celulolítica de los aislamientos fúngicos en consorcios con sustrato pasto: A) Producción de exoglucanasas; B) Producción de endoglucanasas. Las letras minúsculas indican los grupos de significancia.
Figure 4. Cellulolytic activity of fungal isolates in consortia with grass substrate: A) exoglucanasa and B) endoglucanase production. Lowercase letters indicate significance groups.
Sólo el consorcio entre las cepas 005L y 055C tuvo tanta actividad exoglucanasa como el control y cada una de las cepas individuales (grupo A de significancia de Dunnett, Fig. 4A), mientras los demás fueron significativamente más bajos. Esto indica que sólo el aislamiento 055C de Penicillium es compatible con las cepas del género Verticillium.
Con respecto a la actividad endoglucanasa, todas las cepas individuales tuvieron tanta actividad como el control, aproximadamente 0,06U (grupo A de significancia de Dunnett, Fig. 4B) y este patrón se mantuvo con respecto a las pruebas anteriores. Es de destacar que la cepa 061C (Penicillium sp.) seleccionada por su actividad exoglucanasa también tuvo una actividad endoglucanasa similar a T. viride (0,07U), al igual que la cepa 019C (Trichoderma sp.) (Fig. 4B). Estos datos indicarían que la cepa 061C es altamente promisoria como degradadora de celulosa, aunque no se recomienda utilizarse en consorcio, ya que al mezclarse con la cepa 005L (Verticillium sp.) disminuyó su actividad celulolítica.
Los diferentes consorcios evaluados, excepto el 005L-019C, tuvieron actividad endoglucanasa similar al control T. viride, lo cual permite inferir que la producción de endoglucanasas no fue afectada por los consorcios, contrario a lo que ocurrió con la actividad exoglucanasa (Fig. 4A). Cabe mencionar que la actividad celulolítica del hongo Pleurotus ostreatus frente al sustrato pasto fue muy baja con respecto a los aislamientos nativos (Fig. 4).
DISCUSIÓN
Aislamientos ligninolíticos y celulolíticos
En el medio de cultivo agar-lignina sólo se obtuvieron dos cepas pertenecientes al género Verticillium (005L y 001L aisladas de bosque y sabana, respectivamente) que mostraron actividad ligninolítica. En la literatura se reporta actividad degradadora de compuestos aromáticos, como la lignina en Verticillium (Krivobok et al., 1998; Ravelet et al., 2000; Saraswathy & Hollberg, 2002; Verdin et al., 2004; Baldrian, 2004; Kiiskinen et al., 2004; Dhouib et al., 2005; Hao et al., 2006).
En el muestreo se obtuvieron aislamientos celulolíticos representantes de diferentes géneros: Actinomucor, Penicillium, Verticillium, Trichoderma, Trichosporonoides, Fusarium, Mucor, Phialophora, Cladosporium y Oidiodendron en bosque, siendo estos tres últimos únicos para este uso del suelo. En la sabana se encontraron los mismos géneros y, adicionalmente, a Geotrichum. Deacon et al. (2006) reportan en sabanas de Inglaterra los siguientes géneros fúngicos comunes al presente trabajo: Penicillium, Trichoderma, Fusarium, Mucor, Cladosporium. Zhao et al. (2005) reporta la presencia de Verticillum en suelos con uso agrícola en China, lo cual indica que estos géneros celulolíticos son frecuentes en sabanas de pastoreo sin importar la latitud en la que se encuentren.
Numerosos estudios han demostrado que el manejo agrícola disminuye la biodiversidad del suelo y altera la estructura de las comunidades edáficas al comparar ecosistemas de bosque nativo y sabanas de pastoreo (Beare et al., 1997; Bastias et al., 2009). Sin embargo, en el presente trabajo el análisis de varianza no mostró diferencias significativas en cuanto a número de géneros fúngicos por uso del suelo, lo cual puede estar relacionado con la oferta de sustratos generada por el bosque secundario evaluado, ya que posiblemente no tiene la suficiente variedad como para soportar una comunidad de hongos celulolíticos cultivables muy diversa (Paul & Clark, 1996; Hao et al., 2006; Bastias et al., 2009; Sánchez, 2009; Dias et al., 2010).
Con respecto al número de UFC/g de hongos celulolíticos, se encontró que en el bosque fue mayor, concordando con estudios anteriores (Beare et al., 1997; Ruegger & Tauk-Tornisielo, 2004; Hao et al., 2006; Bastias et al., 2009). En los suelos agrícolas predominan los hongos degradadores de celulosa, hemicelulosa y pectina. También se ha reportado que los hongos juegan un papel crucial en la degradación de residuos de cosecha de cereales como el centeno y que mejoran la estructura del suelo (Beare et al., 1997; Bronick & Lal; 2005; Consentino et al., 2006; Días et al., 2010).
Los microorganismos del suelo regulan el ciclaje de nutrientes al efectuar procesos de descomposición que influencian la liberación y retención de nutrientes, especialmente carbono, nitrógeno, fósforo, potasio y micronutrientes que se encuentran en la biomasa vegetal (Aro et al., 2005; Bronick & Lal, 2005; Deacon et al., 2006; Sánchez, 2009; Vargas-García et al., 2010). En el trópico los géneros Aspergillus, Fusarium y Penicillium están directamente implicados en los ciclos del carbono, nitrógeno, fósforo y azufre (Beare et al., 1997; Bastias et al., 2009).
En general, los géneros encontrados corresponden a hongos deuteromicetos predominantemente saprótrofos cosmopolitas, de crecimiento rápido y tolerantes al estrés ambiental (Paul & Clark, 1996; Madigan, et al., 2000; Hao et al., 2006).
Actividad enzimática
En la prueba con lignina alcalina la cepa 005L (Verticillium spp.) tuvo menos actividad peroxidasa (2 x 10-9U) y laccasa (4 x 10-5U) que el control P. ostreatus (1,5 x10-8U; 9 x 10-5U, respectivamente), esto se puede deber a que la lignina alcalina no causó la estimulación metabólica necesaria para activar la síntesis de enzimas ligninolíticas en la cepa nativa, este mecanismo de inducción depende de la liberación en el medio de metabolitos de bajo peso molecular que al ingresar en la célula fúngica activan la maquinaria biosintética, siendo el patrón de metabolitos específico para cada tejido vegetal (Leonowicz et al., 1999; Sánchez, 2009). La cepa ligninolítica adicional seleccionada 011C (Trichoderma spp.) produjo 3,8 x 10-9U de peroxidasa y 4,4 x 10-5U de laccasa, es decir, tuvo una actividad enzimática similar a la de la cepa 005L.
Los aislamientos de mayor actividad exoglucanasa en sustrato papel fueron 055C, 061C, 058C todos ellos pertenecientes al género Penicillium spp. con una actividad enzimática de 0,06 a 0,02U. Hobbie et al. (2003) afirman que Aspergillus, Penicillium y Fusarium tienen predilección por los sustratos hemicelulósicos y celulósicos con respecto a los azúcares simples.
Las cepas con mayor actividad endoglucanasa en sustrato carboximetilcelulosa fueron 019C y 054C pertenecientes al género Trichoderma spp. con 0,05 a 0,13U. Beare et al., (1993) reportan que Trichoderma, Aspergillus y Penicillium son géneros de saprótrofos celulolíticos asociados a suelos sin labranza o con labranza reducida, como los suelos analizados.
Sustrato pasto
Las características fisicoquímicas de la biomasa vegetal disponible para los hongos celulolíticos y ligninolíticos afectan su actividad enzimática y distribución en el suelo, al igual que la tasa de descomposición del sustrato (Beare et al., 1997; Aro et al., 2005; Bastias et al., 2009; Sánchez, 2009). Para biomasas con bajos o moderados contenidos de lignina como los pastos y algunos residuos de cosecha, las tasas de descomposición pueden ser pre-dichas en base a los contenidos de nitrógeno inicial o la relación carbono: nitrógeno del residuo (Melillo et al., 1982; Paul & Clark, 1996; Hao et al., 2006; Xu et al., 2009; Dias et al., 2010).
A pesar de la baja cantidad de lignina del pasto, se observó una alta inducción de la actividad ligninolítica en las cepas nativas superando al sustrato lignina alcalina. La cepa 005L (Verticillium sp.) y sus consorcios tuvieron tanta actividad como el control P. ostreatus (peroxidasa 1,5-2 x 10-8U y laccasa 30-55 x 10-4U; Prueba de Dunnett). Esto indica que la cepa nativa 005L tiene un gran potencial como degradador de desechos agroindustriales que contengan lignina y que, además es compatible con otros géneros y cepas, permitiendo que se pueda utilizar para obtener productos basados en consorcios de microorganismos. La cepa 005L también es de interés, ya que este tipo de deuteromicetes realizan la oxidación parcial de la lignina a ácidos húmicos y fúlvicos, favoreciendo la formación de agregados en el suelo, contrario a lo que ocurre con los basidiomicetes, quienes realizan una mineralización total de la materia orgánica a CO2 y pueden ser más interesantes para biorremediación (Regalado, et al., 1997; Aro, 2005; Consentino et al., 2006; Ortiz & Uribe, 2007; Sánchez, 2009; Xu et al., 2009; Dias et al., 2010).
Los aislamientos 061C, 011C, 055C, 019C, tuvieron tanta actividad exoglucanasa como el control T. viride, también se detectó que el sustrato determinó de manera importante el comportamiento de las cepas, tal y como lo reporta la literatura (Beare et al., 1997; Hobbie et al., 2003; Brasil et al., 2004; Aro et al., 2005; Deacon et al., 2006; Hao et al., 2006; Sánchez, 2009), pero los patrones de actividad enzimática de cada aislamiento fueron consistentes con los hallazgos en las pruebas anteriores.
Sólo el consorcio entre las cepas 005L y 055C tuvo tanta actividad exoglucanasa como el control, mientras los demás fueron significativamente inferiores; esto indica que sólo el aislamiento 055C de Penicillium es compatible con el aislamiento del género Verticillium y esto puede estar relacionado con sus características fisiológicas (Baldrian, 2004; Deacon et al., 2006).
Todas las cepas individuales tuvieron tanta actividad endoglucanasa como el control. Es de destacar que la cepa 061C (Penicillium sp.) seleccionada por su actividad exoglucanasa, también tuvo la mayor actividad endoglucanasa de la prueba. Estos datos indicarían que la cepa 061C es altamente promisoria como degradadora de celulosa, aunque no se recomienda su uso en consorcio, ya que al mezclarse con las cepas ligninolíticas 005L (Verticillium spp.) y 011C (Trichoderma spp.) disminuyó su actividad celulolítica (diferencias no significativas); posiblemente, esto se deba a un efecto de restricción fisiológica causado por la interacción de sus metabolitos secundarios (Krivobok, 1998; Kiiskinen et al., 2004; Baldrian et al., 2006).
Los diferentes consorcios para endoglucanasas, excepto el 005L-019C, tuvieron tanta actividad como el control T. viride, lo cual permite inferir que la producción de esta enzima no fue afectada por los consorcios, contrario a lo que ocurrió con la actividad exoglucanasa. El sustrato pasto permitió un mejor funcionamiento de las enzimas endoglucanasas debido a la oferta de un mayor número de regiones de celulosa amorfas para actuar (Paul & Clark, 1996; Aro et al., 2005; Sánchez, 2009).
Cabe mencionar que la actividad celulolítica del hongo Pleurotus ostreatus frente al sustrato pasto fue muy baja, con respecto a los aislamientos nativos, por lo tanto no debería utilizarse para degradar desechos agrícolas ricos en celulosa. Adicionalmente P. ostreatus no se adapta a las condiciones ambientales de las sabanas llaneras, con temperaturas superiores a los 30 °C, humedad relativa inferior al 70% y alta exposición a los rayos ultravioleta (Paul & Clark, 1996; Beare et al., 1997; Rippstein et al., 2001; Ortiz & Uribe, 2007; Días et al., 2010).
En resumen, se puede decir que se identificaron dos cepas promisorias para ser utilizadas como consorcio base para un producto degradador de desechos agrícolas lignocelulósicos: la 005L (Verticillium sp. aislada de bosque) y la 055C (Penicillium sp. aislada de sabana), estas cepas no sólo se podrían utilizar para mejorar la calidad del suelo, sino también en otras aplicaciones industriales, como la obtención de biocombustibles, la biorremediación y el procesamiento de papel, procesos que requieren la eliminación de la lignina o compuestos aromáticos similares (Leonowicz et al., 1999; Bronick & Lal., 2005; Aro et al., 2005; Sánchez, 2009).
La cepa 061C (Penicillium sp., aislada de sabana) puede ser utilizada como cepa individual en un producto degradador de celulosa para desechos agrícolas celulósicos o también para la industria de alimentos y textiles, donde se requiere alterar los contenidos de celulosa a las materias primas para proporcionarles propiedades nuevas (Paul & Clark, 1996; Leonowicz, et al., 1999; Aro et al., 2005; Sánchez, 2009; Días et al., 2010).
AGRADECIMIENTOS
Personal académico y administrativo de la Maestría en Microbiología y el Instituto de Biotecnología, de la Universidad Nacional de Colombia, sede Bogotá, por su colaboración en el desarrollo de esta investigación.
BIBLIOGRAFÍA
1. Aro, N; T Pakula & B Penttilä. 2005. Transcriptional regulation of plant cell wall degradation by filamentous fungi, FEMS Microbiology Reviews 29: 719-739. [ Links ]
2. Baldrian, P. 2004. Increase of laccase activity during interspecific interactions of white-rot fungi, FEMS Microbiology Letters 220: 235-240. [ Links ]
3. Baldrian, P. 2006. Fungal laccases, occurrence and properties. FEMS Microbiology Reviews 30: 215-242. [ Links ]
4. Barnett, H & B Hunter. 1975. Illustrated genera of imperfect fungi, third edition, Burgess Publishing Company, Minneapolis. [ Links ]
5. Bastias, B; I Anderson; I Rangel-Castro; P Parkin; J Prosser & W Cairney. 2009. Influence of repeated prescribed burning on incorporation of 13C from cellulose by forest soil fungi as determined by RNA stable isotope probing, Soil Biology and Biochemistry 41(3): 467-472. [ Links ]
6. Beare, M; B Pohlad; D Wright & D Coleman. 1993. Residue placement and fungicide effects on fungal communities in conventional and no-tillage soils, Soil Science Society of America Journal 57: 392-399. [ Links ]
7. Beare, M; M Reddy; G Tian & S Srivastava. 1997. Agricultural intensification, soil diversity and agroecosystem function in the tropics: the role of decomposer biota, Applied soil ecology 6: 87-108. [ Links ]
8. Brasil, P; J Freer; M Siika-Aho & A Ferraz. 2004. Extraction and determination of enzymes produced by Ceriporiopsis subvermispora during biopulping of Pinus taeda wood chips. Enzyme and Microbial Technology 34: 228-234. [ Links ]
9. Bronick, C & R Lal. 2005. Soil structure and management: a review. Geoderma 124: 3-22. [ Links ]
10. Consentino, D; C Cheng & Y Le Bissonnais. 2006. Agreggate stability and microbial community dynamics under drying-wetting cycles in a silt loam soil. Soil Biology and Biochemistry 38: 2053-2062. [ Links ]
11. Deacon, L; E Pryce-Miller; J Frankland; B Bainbridge; P Moore & Crobinson. 2006. Diversity and function of decomposer fungi from a grassland soil. Soil Biology & Biochemistry 38: 7-20. [ Links ]
12. Dhouib, A; M Hamza; H Zouari; T Mechichi; R H'midi; M Labat; M Martinez & S Sayadi. 2005, Autochthonous fungal strains with high ligninolytic activities from Tunisian biotipes. African Journal of Biotechnology 4(5): 431-436. [ Links ]
13. Dias, A; G Freitas; G Marques; A Sampaio; I Fraga; M Rodrigues; D Evtuguin & R Bezerra. 2010. Enzymatic saccharification of biologically pre-treated wheat straw with white-rot fungi. Bioresource technology 101(15): 6045-6050. [ Links ]
14. Gilman, J. 1973. Manual de los hongos del suelo, segunda edición, Compañía Editorial Continental S.A., México D.F. [ Links ]
15. Hao, J; X Tian; F Song; X He; Z Zhang & P Zhang. 2006. Involvement of lignocellulolytic enzymes in the decomposition of leaf litter in a subtropical forest, Journal of Eukaryotic Microbiology 53: 193-198. [ Links ]
16. Hobbie, E; L Watrud; S Maggard; T Shiroyama & P Rygiewicz. 2003. Carbohydrate use and assimilation by litter and soil fungi assessed by carbon isotopes and BIOLOG® assays. Soil Biology & Biochemistry 35: 303-311. [ Links ]
17. ICONTEC. 1994. NTC-3656 Gestión ambiental. Suelo. Toma de muestras de suelo para determinar contaminación, Comité de Calidad del Suelo. Publicaciones ICONTEC, Bogotá [ Links ].
18. IDEAM. 2009. Atlas meteorológico de Colombia, Instituto de hidrología, meteorología y estudios ambientales. Disponible en línea en: http://www.ideam.gov.co/atlas/mclima.htm [ Links ]
19. IGAC. 1996. Diccionario geográfico de Colombia, Tomo 3, Horizonte Impresores Ltda, Bogotá [ Links ].
20. Kiiskinen, L; M Rättö & K Kruus. 2004. Screening for novel laccase-producing microbes. Journal of Applied Microbiology 97: 640-646. [ Links ]
21. Krivobok, S; E Miriouchkine; F Seiole_Murandi & J Benoit-Guyod. 1998. Biodegradation of anthracene by soil fungi. Chemosphere 31(3): 523-530. [ Links ]
22. Leonowicz, A; A Matuszewska; J Luterek; D Ziegenhagen; M Wojtao-Wasilewska; N Cho; M Hofrichter & J Rogalski. 1999. Biodegradation of lignin by white rot fungi. Fungal Genetics and Biology 27: 175-185. [ Links ]
23. Madigan, M; J Martinko & J Parker. 2000. Biology of microorganisms, nine edition, Prentice Hall International Inc., New York. [ Links ]
24. Marín, P & P Botero. 1991. Informe sobre el área muestra Villavicencio, Puerto López, Puerto Gaitán, Carimagua (Meta), Documento técnico IGAC, Bogotá [ Links ].
25. Melillo, J; J Aber & J Muratore. 1982. Nitrogen and lignin control of hardwood leaf litter decomposition dynamics. Ecology 63: 621-626. [ Links ]
26. Miller, G. 1959. Use of dinitrosalisylic reagent for the determination of reducing sugar. Analytic Chemistry 31: 426-428. [ Links ]
27. Ortiz, M & D Uribe. 2007. Aislamiento de hongos degradadores de lignina a partir de suelos con dos usos agrícolas (sabana de pastoreo y bosque secundario) de sabana inundable, Puerto López (Meta). Suelos ecuatoriales 37(1): 70-74. [ Links ]
28. Paul, E & F Clark. 1996. Soil microbiology and biochemistry, second edition, Academic Press, San Diego. [ Links ]
29. Ravelet, C; S Krivobok; L Sage & R Steiman. 2000. Biodegradation of pyrene by sediment fungi. Chemosphere 40: 557-563. [ Links ]
30. Regalado, V; A Rodríguez; F Perestelo; A Carnicero; G De la Fuente & M Falcon. 1997. Lignin degradation and modification by the soil-inhabiting fungus Fusarium proliferatum. Applied and Environmental Microbiology 63(9): 3716-3718. [ Links ]
31. Rickelfs, R & G Miller. 2000. Ecology, 4ed, WH Freeman and Company, New York. [ Links ]
32. Rippstein, G; G Escobar & F Motta. Agroecología y biodiversidad de las sabanas en los Llanos Orientales de Colombia (en línea), 2001 (ref. febrero del 2005), Capítulo I, Disponible en el World Wide Web: http://www.ciat.cgiar.org/es/descargar/ pdf/Agroecologia_y_biodiversidad.pdf [ Links ]
33. Romero, M; J Aguado; L Gonzalez & M Ladero. 1999. Cellulase production by Neurospora crassa on wheat straw. Enzyme and Microbial Technology 25: 244-250. [ Links ]
34. Ruegger, M & S Tauk-Tornisielo. 2004. Atividade da celulase de fungos isolados do solo da Estação Ecológica de Juréia-Itatins, São Paulo, Brasil. Revista Brasileira de Botanica 27(2): 205-211. [ Links ]
35. Sánchez, C. 2009. Lignocellulosic residues: Biodegradation and bioconversion by fungi. Biotechnology Advances 27(2): 185-194. [ Links ]
36. Saraswathy, A & R Hollberg. 2002. Degradation of pyrene by indigenous fungi from a former gasworks site. FEMS Microbiology Letters 210: 227-232. [ Links ]
37. Teather, R & P Wood. 1982. Use of congo red-polysaccharide interactions in enumeratiion and characterization of cellulolytic bacteria from the bovine rumen. Applied Environmental Microbiology 43(4): 777-780. [ Links ]
38. Thorn, G; A Reddy; D Harris & E Paul. 1996. Isolation of saprophytic basidiomicetes from soil. Applied and Environmental Microbiology 62(11): 4288-4292. [ Links ]
39. Vargas-García, M; F Suárez-Estrella; M López & J Moreno. 2010. Microbial population dynamics and enzyme activities in composting processes with different starting materials. Waste management 30(5): 771-778. [ Links ]
40. Verdin, A; A Lounès-Hadj & R Durand. 2004. Degradation of benzo(a)pyrene by mitosporic fungi and extracellular oxidative enzymes. International Biodegradation & Biodeterioration 53: 65-70. [ Links ]
41. Xu, C; F Ma & X Zhang. 2009. Lignocellulose degradation and enzyme production by Irpex lacteus CD2 during solid-state fermentation of corn stover. Journal of bioscience and bioengineering 108(5): 372-375. [ Links ]
42. Zhao, Y; W Li; Z Zhou; L Wang; Y Pan & L Zhao. 2005. Dynamics of microbial community structure and cellulolytic activity in agricultural soil amended with two biofertilizers. European Journal of Soil Biology 41: 21-29. [ Links ]














