Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencia del suelo
versão On-line ISSN 1850-2067
Cienc. suelo vol.29 no.2 Ciudad Autónoma de Buenos Aires jul./dez. 2011
TRABAJO
Propiedades microbiológicas en un suelo de la patagonia argentina bajo la influencia de diferentes especies forestales
Microbiological properties of a soil of the argentine patagonia under the influence of different tree species
Diana Noemí Effron; Rosa Lina Defrieri; Gabriela Cristina Sarti; Jhovana Escobar Ortega & Ines García de Salamone
Facultad de Agronomía. Universidad de Buenos Aires. Av. San Martín 4453. Buenos Aires. Argentina. Autor para correspondencia: effron@agro.uba.ar
Recibido: 28-12-10
Recibido con revisiones:14-04-11
Aceptado: 03-05-11
Resumen
En los sistemas forestales, la hojarasca es generalmente la principal fuente de nutrientes para la vegetación y microorganismos, pudiendo variar éstos en relación a la biomasa y calidad de los materiales aportados por diferentes especies. Las raíces de los árboles ejercen influencia en el desarrollo y actividad de la microflora. El objetivo de este trabajo fue evaluar la influencia sobre el suelo de dos especies arbóreas implantadas, con distinta composición del residuo vegetal aportado al suelo. El suelo está clasificado como un Andisol y está ubicado en la Estación Forestal Trevelín, Chubut, Argentina, Lat. 43º Sur, Long 71º31´ Oeste. Se extrajeron muestras superficiales de suelo de dos parcelas de bosque con una especie dominante cada una: Pino radiata (Pinus radiata D. Don.) y Roble europeo (Quercus robur). Se determinó carbono orgánico, respiración microbiana, actividad deshidrogenasa, diversidad funcional de comunidades microbianas asociadas y se calculó el índice de diversidad de Shanon Weaver (H). Se cuantificaron bacterias totales, bacterias amilolíticas, actinomicetes y hongos. Los valores de respiración microbiana y carbono orgánico resultaron significativamente superiores en el suelo debajo de Roble. No se encontraron diferencias significativas entre valores de deshidrogenasa. Los recuentos de flora bacteriana total y de bacterias amilolíticas dieron significativamente superiores en el suelo asociado a Roble, mientras que los actinomicetes y hongos no mostraron diferencias significativas entre especies. El análisis de componentes principales mostró variaciones significativas en la fisiología de las comunidades microbianas asociadas a estas dos especies. El índice de diversidad H de la microflora fue significativamente mayor para Pino. Los residuos de Roble por ser una especie latifoliada y por lo tanto poseer menor contenido de sustancias recalcitrantes que una conífera, asociado al mayor desarrollo de bacterias totales y amilolíticas, podría favorecer una mayor descomposición del residuo vegetal aportado al suelo y explicar los mayores valores de carbono orgánico y respiración microbiana obtenidos.
Palabras clave. Suelo forestal; Respiración microbiana; Actividad deshidrogenada; Diversidad funcional microbiana.
Abstract
In forest systems, leaf litter is usually the main source of nutrients for the vegetation and microorganisms. Leaf litter composition may vary according to the biomass and quality of the materials produced by different species. Tree roots affect the development and activity of microflora. The aim of this study was to evaluate the influence of two implanted tree species, with different composition of plant residues, on the soil characteristics. The soil is classified as an Andisol and is located in the Trevelín Forest Station, Chubut, Argentina, Lat. 43° S, Long 71º31' West. The samples were extracted from the surface soil of two forest plots with a dominant species each: Radiata Pine (Pinus radiata D. Don.) and European Oak (Quercus robur). The following analytical determinations were carried out on soil samples: organic carbon, microbial respiration, deshydrogenase activity, microbial count (bacterial communities, amilolytic, actinomyces and fungi) as well as the functional diversity of associated microbial communities. The Shannon-Weaver index (H) was calculated. The soil under Oak trees showed the highest values of microbial respiration, organic carbon and amilolytic and bacterial community counts. No significant differences were found in deshydrogenase activity, actinomyces and fungi counts between species. The principal component analysis showed significant variations in the physiology of microbial communities associated with these two tree species. The microorganism H diversity index was significantly greater for Pine. Plants residues of broadleaf species such as Oak have lower contents of recalcitrant substances than conifer species, and this fact, associated with the higher development of total and amylolytic bacteria, could result in an increase in the decomposition of plant residues in the soil and in higher organic carbon and microbial respiration values.
Key words. Forest soil; Microbial respiration; Deshydrogenase activity; Microbial functional diversity.
INTRODUCCIÓN
Las propiedades microbiológicas que se determinan en los suelos están íntimamente vinculadas con la diversidad de funciones que se realizan en el mismo. Muchas de ellas son considerados como excelentes bioindicadores de la calidad del suelo (Pankhurst et al., 1995; Alvear et al., 2006), debiendo ponerse énfasis en el estudio de éstas (Alvear et al., 2007). Dada la gran cantidad de estos parámetros que están descriptos en la bibliografía, Nannipieri et al. (1995), los agrupan en parámetros generales y específicos. Los generales incluyen las variables directamente relacionadas con la actividad microbiana tales como carbono de respiración, actividad de la enzima intracelular deshidrogenasa, biomasa global medida a través de la hidrólisis del diacetato de fluoresceína, el contenido de ergosterol, etc. Los parámetros específicos incluyen actividades de enzimas involucradas en los ciclos del nutrientes responsables de la liberación de nutrientes para las plantas y microorganismos a través de la transformación y degradación de la materia orgánica (Nannipieri, 1994; Jiménez et al., 2004; Effron et al., 2006; Defrieri et al., 2008).
Los microorganismos del suelo juegan un rol fundamental en la sustentabilidad de los diversos ecosistemas desarrollando funciones esenciales como: ciclado de nutrientes para el crecimiento de las plantas, formación del humus del suelo, mejora de propiedades físicas y mantenimiento de la biodiversidad de los ecosistemas (Campbell et al., 1997). En los últimos años han aumentado las investigaciones interesadas en determinar la composición y función microbiológica (Zogg et al., 1997; Balser & Firestone, 2005). Estudios previos indican que la composición microbiana es influenciada por factores como el pH (Högberg et al., 2007) y la disponibilidad de carbono y nutrientes (Fierer et al., 2007), posteriormente otros estudios reportan que la composición de la comunidad microbiana del suelo puede ser influenciada por las especies vegetales (Waldrop et al., 2000; Balser & Firestone, 2005).
En los últimos años, la diversidad funcional de los microorganismos en suelo y hojarasca ha sido determinada investigando su capacidad para utilizar diferentes sustratos. Por lo tanto, además de la importancia de los parámetros biológicos generales y específicos mencionados, las técnicas utilizadas para describir la diversidad funcional como son la utilización de fuentes carbonadas cobran cada vez más relevancia (Garland & Mills, 1991; Agnelli et al., 2004; Grayston & Prescott, 2005).
El objetivo de este trabajo fue evaluar la influencia en un suelo forestal de dos especies arbóreas implantadas, con distinta composición del material vegetal aportado al suelo sobre parámetros microbiológicos tales como respiración microbiana, actividad de la enzima deshidrogenada y diversidad funcional de las comunidades microbianas asociadas.
MATERIALES Y MÉTODOS
El sitio de investigación se encuentra en la Estación Forestal INTA de Trevelin, Chubut, Argentina, Lat. 43º Sur, Longitud 71º 31´ Oeste, altitud 470 ms.n.m. La superficie de la Estación es de 3.020 ha. El suelo corresponde a un Andisol. El material originario está compuesto por cenizas volcánicas mezclado con material coluvial. El clima se caracteriza por tener precipitaciones promedio de 942 mm anuales, produciéndose el 80,6% de las mismas entre los meses de abril y setiembre. La temperatura máxima media anual es de 15,7 ºC y la mínima media anual de 3,4 ºC. En los meses de diciembre y febrero ocurre anualmente sequía temporaria, que afecta a varias especies forestales en su crecimiento y desarrollo.
Se seleccionaron al azar 10 árboles de cada una de las especies con un buen estado sanitario y con portes similares. Se tomaron muestras superficiales (0-10 cm) de suelo ubicadas en pie de colina de dos parcelas, de aproximadamente de 2 ha cada una, de bosque implantado con una especie dominante cada una: Pino radiata (Pinus radiata D. Don.) y Roble europeo o Eslavonia (Quercus robur) con igual tiempo de implantación (50 años). Las mismas fueron tomadas previo despeje del material vegetal superficial, y a una misma distancia del tronco de los árboles seleccionados. Debajo de cada uno de los 10 árboles, para ambas especies, se tomaron 4 muestras de las cuales se hizo una muestra compuesta por árbol. Dichas muestras se obtuvieron en el mes marzo del año 2010 y sobre ellas se efectuaron las determinaciones analíticas. Las muestras húmedas se guardaron en bolsas plásticas que se mantuvieron refrigeradas hasta su análisis en el laboratorio. Las muestras fueron tamizadas por malla de 4 mm o 2 mm según la determinación a realizar. Los resultados se expresaron en base a suelo secado a 105 ºC hasta peso constante.
Análisis de las muestras de suelo
Las siguientes determinaciones se realizaron sobre las 10 muestras compuestas tomadas debajo de cada especie y los análisis se efectuaron por duplicado.
Carbono de respiración: se determinó midiendo el CO2 liberado durante la incubación del suelo, el que es retenido por una solución de NaOH y valorando el NaOH remanente (Anderson, 1982).
Actividad deshidrogenasa: se incubó el suelo con una solución de una sal de amonio cuaternario (cloruro de 2-p-iodofenil-3-p-nitrofenil-5-fenil tetrazolio o INT) que funciona como un aceptor artificial de electrones a un pH regulado de 7,6. El formazán derivado (INTF), producto de la reducción se determinó colorimétricamente (Gong, 1996).
Carbono orgánico por el método de Walkley y Black (Nelson & Sommers, 1982).
Las siguientes determinaciones se realizaron sobre 4 de las 10 muestras compuestas tomadas debajo de cada especie y los análisis se efectuaron por duplicado.
Recuentos de bacterias totales, amilolíticas, actinomicetes y hongos totales: se efectuaron suspensiones y diluciones adecuadas de suelo para efectuar los recuentos en medios de cultivo sólidos (Frioni, 1990).
Diversidad funcional de comunidades microbianas: se efectuaron suspensiones y diluciones del suelo y para cada muestra se utilizó la dilucion 10-4. Las microplacas se incubaron a 30 ºC por 4 días. Se utilizaron los valores de absorbancia para realizar el análisis de los datos (Garland & Mills, 1991; adaptada por García de Salamone et al. , 2007).
Se calculó el Índice de diversidad de Shanon-Weaver según Gómez et al. (2004).
Análisis estadístico
Los datos para las variables carbono de respiración, actividad deshidrogenasa y carbono orgánico fueron analizados estadísticamente mediante un análisis de varianza de una vía correspondiente a un diseño completamente aleatorizado, entre tratamientos correspondiente a las dos especies arbóreas. Las diferencias entre medias de tratamiento fueron determinadas mediante el test de Tukey (p<0,05). Los recuentos se analizaron utilizando transformaciones logarítmicas y los perfiles de uso de las fuentes carbonadas se obtuvieron mediante análisis multivariado de componentes principales. Se utilizó el programa estadístico INFOSTAT /PROFESIONAL ® Versión 1.1- Universidad de Córdoba.
RESULTADOS Y DISCUSIÓN
Los valores hallados en el presente trabajo mostraron que la respiración microbiana y carbono orgánico resultaron significativamente superiores en el suelo debajo de la especie Roble europeo respecto del suelo debajo de Pino radiata (p<0,05). No se encontraron diferencias significativas entre los valores de actividad de deshidrogenasa medidos en el suelo debajo de ambas especies (p<0,05) (Tabla 1). Sin embargo, en otros trabajos, en el mismo sitio de estudio, pero con diferentes especies (Defrieri et al., 2010) y en suelos de una Reserva Forestal de Chaco con especies nativas (Defrieri et al., 2007) encontraron que la actividad deshidrogenada resultó un indicador sensible en detectar diferencias significativas entre las especies estudiadas.
Tabla 1. Valores medios de los parámetros respiración microbiana, actividad deshidrogenasa y carbono orgánico en el suelo debajo de las especies Roble europeo o eslavonia (Quercus robur) y Pino radiata (Pinus radiata D. Don.).
Table 1. Mean parameter values for microbial respiration, deshydrogenase activity and organic carbon in the soil under European Oak (Quercus robur) and Radiata Pine (Pinus radiata D. Don.) species.
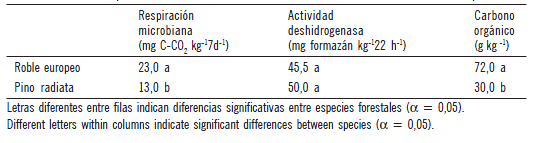
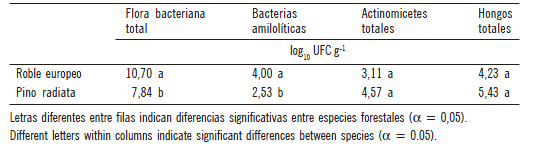
Los recuentos de flora bacteriana total y de bacterias amilolíticas dieron valores significativamente superiores (p<0,05) en el suelo asociado a la especie Roble europeo, mientras que los actinomicetes y hongos no mostraron diferencias significativas entre especies (Tabla 2). Esto podría explicarse teniendo en cuenta la diferente composición del material vegetal aportado por ambas especies. Así, el porcentaje de sustancias recalcitrantes tales como lignina y celulosa foliares determinado por Effron et al. (2009) para la especie Roble europeo (lignina: 6%; celulosa: 11,0%), y Defrieri et al. (2010) para la especie Pino radiata (lignina: 16,5%; celulosa: 14,5%) muestran que para la primer especie dichos contenidos son menores, como es de esperar por ser una especie latifoliada y la otra una conífera. Entonces para el suelo asociado a Roble europeo, se halló un significativo mayor número de microorganismos, especialmente bacterias totales y amilolíticas, las cuales se desarrollan rápidamente cuando encuentran fuentes carbonadas y nitrogenadas fácilmente descomponibles. Si bien en los recuentos fúngicos y de actinomicetes no se hallaron diferencias significativas entre especies (p< 0,05), se puede observar que los mismos fueron mayores debajo de Pino radiata lo que se podría vincular y confirmar en futuros trabajos con el hecho que esta especie posee mayor contenido de lignina, siendo ésta una clase de polímero que es degradado principalmente por diferentes especies de hongos y actinomicetes (Tuomela et al., 2000). Effron et al. (2009) en un trabajo previo en el mismo sitio y trabajando con dos especies forestales, una conífera y otra latifoliada, encontraron valores más elevados de actividades enzimáticas extracelulares tales como fosfatasa ácida, β glucosidasa y proteasa en el suelo debajo de la especie latifoliada, hecho que podría explicarse teniendo en cuenta que estas enzimas participan en la transformación y ciclado de nutrientes, siendo mayor su actividad en aquel suelo donde hay mayor proporción de material vegetal fácilmente descomponible como sería en este caso. Priha et al. (2001) encontraron resultados similares a los hallados en este trabajo donde concluyeron que especies forestales tales como el Abedul (Betula pendula y Betula pubescens) presentaron mayores valores del carbono de respiración y de las actividades enzimáticas a las encontradas en el suelo bajo Abeto (Picea mariana). Ellos sugirieron que la razón puede ser las diferentes cantidades de carbono lábil liberadas por cada una de las especies con la consecuente influencia sobre los microorganismos del suelo.
Tabla 2. Valores medios de recuentos de bacterias totales, amilolíticas, actinomicetes y hongos totales en el suelo debajo de las especies Roble europeo o eslavonia (Quercus robur) y Pino radiata (Pinus radiata D. Don.)
Table 2. Mean values of microbial counts (bacterial communities, amilolytic, actinomyces and fungi) in the soil under European Oak (Quercus robur) and Radiata Pine (Pinus radiata D. Don.) species.
El análisis de varianza de los componentes principales mostró variaciones significativas en la fisiología de las comunidades microbianas asociadas a estas dos especies forestales (Fig. 1). Los datos obtenidos muestran que el presente análisis de componentes principales (CP) explica un 40% y 20% para el CP1 Y CP2, respectivamente. Además mediante el análisis de los componentes principales pudo determinarse las fuentes carbonadas que explican una proporción relevante de la variabilidad total, según los valores de correlación de Pearson. Dado que se observaron diferencias significativas entre tratamientos para CP1, se analizaron los valores de absorbancia de las fuentes carbonadas que mostraron altos coeficientes de correlación para dicho componente (Tabla 3). Se observó que las comunidades microbianas presentes en las muestras de suelos asociadas a las dos especies forestales utilizaron de manera diferencial (p<0,05) algunas fuentes carbonadas (Tabla 3). La microflora asociada a Pino radiata utilizó más ácido láctico, dextrosa y celobiosa que aquella asociada al Roble europeo. Por otra parte, las comunidades microbianas asociadas a esta última especie utilizaron significativamente más fenilalanina. La glutamina fue utilizada similarmente por la microflora asociada a ambas especies vegetales. El análisis del índice de diversidad de Shannon-Weaver (H) mostró diferencias significativas entre las comunidades microbianas asociadas a ambas especies, siendo significativamente mayor para el suelo asociado a Pino radiata (Fig. 2). Resultados similares fueron encontrados por Ushio et al. (2008), quienes encontraron que la composición de la comunidad microbiana mostró diferencias significativas entre especies de coníferas y latifoliadas, atribuyendo estas diferencias al efecto que pueden tener las diferentes especies sobre propiedades del suelo tales como pH, C total y N, los cuales podrían ser importantes factores que tengan influencia en la composición de la comunidad microbiana del suelo. También Defrieri et al. (2007) encontraron diferencias significativas en la utilización de fuentes carbonadas entre especies forestales nativas en un suelo forestal de Chaco, Argentina.
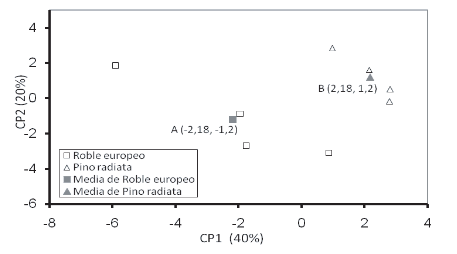
Figura 1. Análisis de componentes principales (CP) de los valores de CP1 y CP2 para la fisiología de las comunidades microbianas asociadas a los suelos bajo la influencia de las especies Roble europeo o eslavonia (Quercus robur) y Pino radiata (Pinus radiata D. Don.).
Figure 1. Principal component (CP) analysis of CP1 and CP2 values for the physiology of microbial communities in soils under influence of European Oak (Quercus robur) and Radiata Pine (Pinus radiata D. Don.) species
Las letras distintas indican diferencias significativas entre las medias del CP1 según la Prueba de Tukey (α = 0,05).
Different letters indicate significant differences between mean values by Tukey's test (α = 0.05)
Tabla 3. Valores de Absorbancia del suelo corregidos por el tiempo cero para cinco fuentes carbonadas (FC) y sus coeficientes de correlación de Pearson con el CP1.
Table 3. Soil absorbance values †corrected by time zero to five carbon sources and Pearson correlation coefficients with PC1.
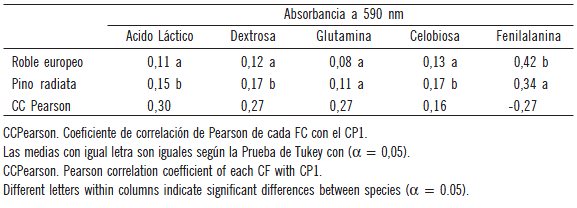
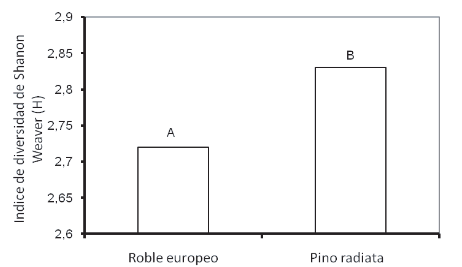
Figura 2. Indice de Shannon-Weaver (H) para las medias de los tratamientos en el suelo bajo la influencia de las especies Roble europeo o eslavonia (Quercus robur) y Pino radiata (Pinus radiata D. Don.). Letras distintas indican diferencias significativas entre especies forestales, mediante tests de Tukey (α = 0,05).
Figure 2. Shannon-Weaver index (H) for mean values of soils under the influence of European Oak (Quercus robur) and Radiata Pine (Pinus radiata D. Don.) species. Different letters indicates significant differences between forestal species (Tukey Test; α = 0.05).
El análisis de estos resultados se podría continuar incorporando otro tipo de variables físicoquímicas y biológicas que permitan interpretar aún mejor las diferencias entre los tratamientos estudiados.
CONCLUSIONES
Los residuos de Roble por ser una especie latifoliada y por lo tanto poseer menor contenido de sustancias recalcitrantes que una conífera, asociado al mayor desarrollo de bacterias totales y amilolíticas, podría favorecer una mayor descomposición del residuo vegetal aportado al suelo y así a mayores valores de carbono orgánico y respiración microbiana hallados
Sin embargo, las propiedades del residuo de Pino radiata favorecen una mayor diversidad funcional de la comunidad microbiana asociada a esta especie forestal. El análisis de componentes principales mostró variaciones significativas en la fisiología de las comunidades microbianas asociadas a estas dos especies forestales.
AGRADECIMIENTO
Este trabajo fue financiado con el proyecto UBACyT G413.
BIBLIOGRAFÍA
1. Agnelli, A; J Ascher; G Corti; MT Ceccherini; P Nannipieri & G Pietramellara. 2004. Distribution of microbial communities in a forest soil profile investigated by microbial biomass, soil respiration and DGGE of total and extracellular DNA Soil Biol. Biochem. 36: 859-868. [ Links ]
2. Alvear, M; M Pino; C Castillo; C Trasar Cepeda & F Gil Sotres. 2006. Efecto de la labranza cero sobre algunas actividades biológicas en un alfisol del sur de Chile. Ciencia del Suelo y Nutrición Vegetal 6: 38-53. [ Links ]
3. Alvear, M; F Reyes; A Morales; C Arriagada & M Reyes. 2007. Actividad biológica y agregados estables al agua en dos tipos de formaciones vegetales de un bosque templado del Centro-Sur de Chile con perturbación antrópica. Ecología Austral 17: 113-122 [ Links ]
4. Anderson, T. 1982. Soil respiration. Pp 841-845. In: Page A et al. (eds.) Methods of Soil Analysis. Agronomy. ASA y SSSA. Madison, Wisconsin, USA. [ Links ]
5. Balser, TC & MK Firestone. 2005. Linking microbial community composition and soil processes in a california annual grassland and mixed conifer forest. Biogeochemistry 73: 395-415. [ Links ]
6. Campbell, C; S Grayston & D Hirst. 1997. Use of rhizosphere carbon sources in sole carbon source tests to discriminate soil microbial communities. J of Microbiological Methods 30: 33-41. [ Links ]
7. Effron, D; MP Jimenez; RL Defrieri & J Prause. 2006. Relación de la actividad de fosfatasa ácida con especies forestales dominantes y con algunas propiedades del suelo de un bosque argentino. Información Tecnológica. CIT. (Revista Internacional arbitrada, indexada en índices internacionales).Chile.17. Nº 1: 3-7. ISSN versión impresa 0716-8756. ISSN versión electrónica 0718-0764. [ Links ]
8. Defrieri, RL, D Effron; J Prause; F Tortarolo; G Sarti & MP Jiménez. 2007. Ecosistema forestal nativo: influencia de las especies forestales sobre algunas propiedades microbiológicas en un monte chaqueño argentino... Biología de Suelos. Compilado por Bedmar E, Olmedo C, Thuar A, Castro E. Primera Edición. Río Cuarto: Universidad de Río Cuarto. ISBN 978-950-665-438-2. Versión digital. [ Links ]
9. Defrieri, RL; G Sarti, MF Tortarolo & D Effron. 2010. Propiedades bioquímicas y microbiológicas en un suelo de la Patagonia argentina con especies forestales implantadas. XXII Congreso Argentino de Ciencia del Suelo. Rosario, Argentina. [ Links ]
10. Effron, D; RL Defrieri; GC Sarti & MF Tortarolo. 2009. Indicadores del suelo en bosques de Chubut, Argentina como aporte al conocimiento de su diversidad biológica. Pp 375-384. En: Estrategias integradas de mitigación y adaptación a cambios globales. PIUBACC. Edición: L. Fernández Reyes, AV Volpedo & A Pérez Carrera. Buenos Aires, Argentina. Versión digital. [ Links ]
11. Fierer, N; MA Bradford & RB Jackson. 2007. Toward an ecological classification of soil bacteria. Ecology 88: 1354-1364. [ Links ]
12. Frioni, L. 1990. Ecología Microbiana del Suelo. Dpto de Publicaciones y Ediciones de la Universidad de la República. Montevideo. Uruguay. [ Links ]
13. García de Salamone, IE; LP di Salvo; JS Escobar Ortega & AE Tovagliari. 2007. Respuesta al cultivo de arroz a la inoculación con Azospirillum y fisiología de las comunidades bacterianas rizosféricas. VI Reunión Nacional Científico tecnica de Biología de suelos y VI Encuentro sobre Fijación Biológica de N. Córdoba. Argentina. [ Links ]
14. Garland, J & A Mills 1991. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community level soil carbon source utilization. Appl. Environ. Microbiol. 57: 2351-2359. [ Links ]
15. Gómez, E; J Garland & M Conti. 2004. Reproducibility in the response of soil bacterial community-level physiological profiles from a land use intensification gradient. Applied soil Ecology. 26: 21-30. [ Links ]
16. Gong, P. 1996. Deshidrogenase activity in soil: a comparison between the TTC and INT assay under their optimum conditions. Soil Biol. Biochem. 29: 211-214. [ Links ]
17. Grayston, SJ & CE Prescott. 2005. Microbial communities in forest floors under four tree species in coastal British Columbia. Soil Biol and Biochem. 37: 1157- 1167. [ Links ]
18. Hogberg, MN; P Hogberg & DD Myrold. 2007. Is microbial community composition in boreal forest soils determined by pH, C to N ratio, the trees or all three? Oecología 150: 590-601. [ Links ]
19. Jiménez, MP; DN Effron; RL Defrieri; MF Tortarolo & AM de la Horra. 2004. Vinculación de las actividades de las enzimas ß-glucosidasa y proteasa con distintas formas de C y N en un suelo nativo de bosque. Pp 105-110. Biología del Suelo. Ed. Fac. de Agronomía. UBA. [ Links ]
20. Nannipieri, P ; L Lansi & J Badalucco. 1995. La capacitá metabolica a la qualita del suolo. Agronomía 29: 312-316. [ Links ]
21. Nannipieri, P. 1994. The potencial use of enzymes as indicators of productivity, sustainability and pollution. Pp238-244. In: CE Pankhurst; BM Doube; BB Gupta & PR Grace (eds.) Soil biota: management in Sustainable farming System CSIRO Press. East Melbourne. [ Links ]
22. Nelson, D & LE Sommers. 1982. Total carbon, organic carbon, and organic matter. Pp 539-579. In: Methods of soil analysis. Part 2. Second edition, A Page; R Millar y D Keeny editors. Madison, Wiscosi. USA. [ Links ]
23. Pankhurst, CE; BG Hawke; HJ McDonald; CA Kirkby & JC Buckerfield. 1995. Evaluation of soil biological properties as potential bioindicators of soil health. Australian journal of experimental Agriculture 35: 1015-1028. [ Links ]
24. Tuomela, M; M Vikman; A Hatakka & M Itavaara. 2000. Biodegradation of lignin in a compost environment: a review. Biore-sourse Technology 72: 169-183. [ Links ]
25. Ushio, M; R Wagai; T Balser & K Kitayama. 2008. Variations in the soil microbial community composition of a tropical montane forest ecosystem : does tree species matter? Soil Biology & Biochemistry 40: 2699-2702 [ Links ]
26. Waldrop, MP; TC Balser & MK Firestone. 2000. Linking microbial community composition to function in a tropical soil. Soil Biol and Biochem. 32: 1837-1846. [ Links ]
27. Zogg, CP; DR Zak; DB Mac Donald; KS Pregitzer & DC White. 1997. Compositional and functional shifts in microbial communities due to soil warming. Soil Sci Society of America journal 61: 474-481. [ Links ]














