Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencia del suelo
versión On-line ISSN 1850-2067
Cienc. suelo vol.30 no.2 Ciudad Autónoma de Buenos Aires ago./dic. 2012
TRABAJOS
Características químicas determinan la capacidad micotrófica arbuscular de suelos agrícolas y prístinos de Buenos Aires (Argentina)
Fernanda Covacevich*1; Mercedes Eyherabide2; Hernán Sainz Rozas1-2-3& Hernán Eduardo Echeverría2-3
1 CONICET-INTA;
2 INTA;
3 FCA-UNMdP.
* Autor de contacto: mail covacevich.fernanda@balcarce.inta.gov.ar; Unidad Integrada EEA INTA-FCA,UNMP C.C. 276, Balcarce, Buenos Aires 7620. Argentina. Tel: 00-54-2266 439140
Recibido: 29-02-12
Recibido con revisiones: 19-05-12
Aceptado: 23-05-12
RESUMEN
Los suelos de la provincia de Buenos Aires (Argentina) presentan muy buenas características físicas y químicas para la producción agrícola, así como elevada diversidad microbiana. Sin embargo, la continua explotación agrícola del suelo, con permanente extracción de nutrientes, aceleró su degradación, afectó su fertilidad natural y las poblaciones microbianas po-tencialmente benéficas como los hongos formadores de micorrizas arbusculares (HMA), aspecto que ha sido poco explorado. El objetivo de este trabajo es identificar cambios en el contenido de nutrientes en suelos sometidos a manejos agrícolas contrastantes que podrían incidir en la capacidad micotrófica de los HMA. Se tomaron muestras de suelo de 29 sitios de la provincia de Buenos Aires bajo manejo agrícola, o sin uso (prístino). Se determinaron las características químicas (CIC, Fe, Mn, Cu, Zn, B, P-Bray, CO y pH), así como el grado de micorrización nativa, luego de 12 semanas desde la instalación de cultivos trampa. Los valores de las características químicas fueron, en general, mayores para los sitios prístinos que para los que estuvieron bajo agricultura. Sin embargo, la intensidad de micorrización no fue significativamente diferente en relación al manejo del suelo. El análisis de componentes principales permitió agrupar por una parte los sitios que se encontraban bajo agricultura y por otra parte los sitios prístinos. El contenido de P disponible en el suelo, juntamente con el contenido de Fe parecerían ser los principales depresores de la capacidad micotrófica de los suelos analizados, particularmente en condiciones de moderado a bajo contenido de Carbono Orgánico.
Palabras clave. Micorrización arbuscular; Capacidad infectiva; Nutrientes edáficos; Manejo de suelo.
Chemical characteristics as determinants of arbuscular mycotrophic ability of agricultural and pristine soils from Buenos Aires (Argentina)
ABSTRACT
The soils of Buenos Aires Province (Argentina) have very good physical and chemical properties for agricultural production, and also a high microbial diversity. However, the continuous cropping of agricultural soils with a high nutrient removal rate has accelerated its degradation. Consequently, the soils' natural fertility and the beneficial microbial populations such as arbuscular mycorrhizal fungi (AMF) could be affected. The objective of this study was to identify changes in the nutrient content in soils under contrasting managements (agricultural vs. pristine) that could influence the mycotrophic ability of AMF. Soil samples were collected from 29 agricultural sites in Buenos Aires Province under cropped and non-cropped (pristine) systems. Chemical characteristics were determined (CIC, Fe, Mn, Cu, Zn, B, P-Bray, CO and pH) in composed samples collected from each field. Mycotrophic ability was estimated by assessing the degree of root colonization by native mycorrhiza in trap crops after 12 weeks of sowing. The values of chemical properties were generally higher for pristine sites than for agricultural plots. However, the mycotrophic ability did not differ between cropped and pristine soils. The principal component analysis allowed grouping field sites under agriculture or pristine conditions. Soil available P content, together with Fe and to a lesser extent Mn content- seemed to depress the mycotrophic ability of the analyzed soil, particularly under moderate to low organic carbon contents conditions.
Key words. Arbuscular mycorrhiza; Infective capacity; Soil nutrients; Soil management.
INTRODUCCIÓN
La mayoría de los cultivos agrícolas son colonizados por hongos formadores de micorrizas arbusculares (HMA), los cuales están presentes en la mayoría de los ecosistemas (Boerner, 1996). Estos hongos constituyen el principal componente de la biota del suelo en la mayoría de los agro-ecosistemas (Alguacil et al., 2008; Khade& Rodrigues, 2009). Algunos reportes evidencian asociaciones entre la infectividad de los HMA y las prácticas de manejo agrícola tales como: (i) los sistemas de cultivo (Hendrix etal,, 1995; Kabir et al, 1997; Bagayoko et al, 2000); ii) la aplicación de fertilizantes (Kabir et al, 1997; Joner, 2000; Liu et al, 2000; Covacevich et al, 2006, 2007; Siddiqui et al.,2008); (iii) los cultivos (Johnson& Pfleger, 1992), y (iv) la intensidad de uso del suelo (Oehlet al, 2003). Sin embargo, los resultados son contradictorios y no permiten establecer conclusiones globales.
Los suelos de la provincia de Buenos Aires presentan en general, aptitudes adecuadas para ser utilizados en agricultura. Sin embargo, la explotación intensiva en las últimas décadas del suelo bajo agricultura convencional (de altos insumos), con permanente extracción de nutrientes, aceleró su degradación y afectó su fertilidad natural, poniendo en peligro su productividad. Por el contrario, las políticas agrícolas actuales a tanto nivel mundial como en la Argentina están tendiendo hacia sistemas agrícolas sostenibles destinados a la producción de cultivos con un mantenimiento del óptimo equilibrio físico, químico y biológico en el suelo teniendo como objetivo no sólo el incremento de los rendimientos sino cuidando la soste-nibilidad del sistema edáfico (Pengue, 2001; Berardo, 2004). Si bien los suelos agrícolas de la provincia de Buenos Aires tienen una gran diversidad microbiana (Aon et al, 2001; Romaniuk et al, 2011), ha sido ampliamente documentado que las prácticas agrícolas y la aplicación de insumos químicos inciden negativamente sobre el desarrollo de las poblaciones de microorganismos que poten-cialmente podrían ser utilizados para reducir el uso de agroquímicos (Menéndez et al, 2001; Covacevich et al, 2006; 2007). En tal sentido, modificaciones en las características edáficas del suelo podrían afectar la funcionalidad de sus poblaciones microbianas, particularmente las asociadas a la fertilidad del mismo.
Algunos reportes en otros países (de Oliveira& de Oliveira, 2010; Covacevich& Berbara, 2011) han puesto de manifiesto que ciertas características edáficas tales como el P, Fe y pH, entre otras, pueden afectar la capacidad micotrófica de los HMA. Djuuna et al. (2010) reportaron que a partir de algunas propiedades del suelo podrían predecir la infectividad de los HMA nativos de Wickepin (Australia) basados en las características del suelo y la historia de uso del mismo. Sin embargo, en nuestro país, y particularmente en la provincia de Buenos Aires este aspecto no ha sido explorado. Asimismo, diferencias en la capacidad micotrófica asociadas a manejos contrastantes en áreas agroecológicas con sistemas productivos de importancia no ha sido reportada hasta el momento para nuestro país.
En la Argentina, varios reportes han descrito la presencia de HMA nativos. Por ejemplo, en el sudeste Bonaerense se ha descrito colonización micorrícica espontánea en cultivos para grano y forraje (Covacevich et al, 2006; 2007). Las características edáficas afectan el desarrollo así como la efectividad de los hongos micorrícicos (Siddiqui et al, 2008). En nuestro país, Covacevich et al. (2006) reportaron que, para una misma área agroecológica, diferentes manejos de la fertilización afectaron el potencial micorrícico de los suelos. Asimismo, Schalamuk y Cabello (2010 a y b) han mencionado la ocurrencia de cambios en la densidad y diversidad de esporas de HMA asociadas al manejo de los cultivos y el estado fenológico de los mismos.
El objetivo del presente trabajo fue identificar cambios en el contenido de nutrientes de suelos agrícolas y prístinos, y determinar su relación con la capacidad micotrófica de los HMA nativos de sistemas productivos de la provincia de Buenos Aires.
MATERIALES Y MÉTODOS
Se colectaron muestras de suelo durante los años 2010 y 2011 a 0-20 cm de profundidad en 29 sitios agrícolas de la provincia de Buenos Aires (Tabla 1). En cada sitio de muestreo se tomó una muestra compuesta por más de 20 sub-muestras en situación de manejo agrícola (Agr) y otra muestra compuesta de suelo denominado prístino (Pr). El suelo Agr provino de al menos 15 años de agricultura continua; como suelos Pr se consideraron parques, pasturas o clausura y alambrados no disturbados. Las muestras se tomaron del área más representativa de cada lote y fueron georeferenciadas. Ambos suelos estaban en similar posición de relieve y las sub-muestras se tomaron a no más de 50 m de radio del punto de georeferencia.
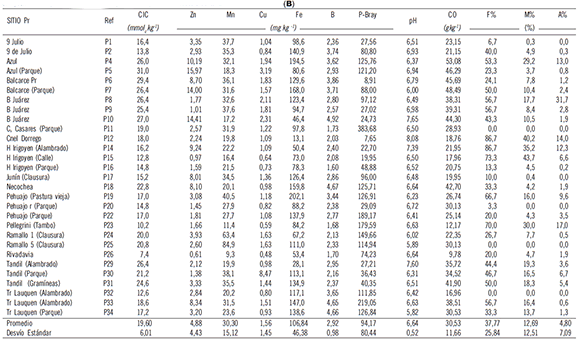
Tabla 1. Sitios de colecta agrícolas (A) y prístinos (B) de las muestras de suelo en la provincia de Buenos Aires (Argentina). Se presenta la descripción de su historia agrícola y manejo (entre paréntesis iniciales de cultivos principales y rotaciones), resultados de los análisis físico-químicos y microbiológicos. Se muestran referencias (Ref) de los sitios que luego se utilizaron en Figura 2.
Agr= agrícola; Pr= prístino; A= años; Ceb= cebada; Cen= centeno; M= maíz; G= girasol; S= soja; Sor= sorgo; T= trigo; CIC= capacidad de intercambio catiónico; CO= carbono orgánico; F% = frecuencia de hongos micorrícicos; M% = intensidad de micorrización; A%= contenido de arbúsculos.
Table 1. Agricultural (A) and pristine (B) collection sites of soil samples in Buenos Aires Province (Argentina). Description of agricultural history and management (in brackets initial letter of main crop and rotations), results of physicochemical and microbiological analysis are shown. References (Ref) of sites which are then used in Figure 2 are shown.
Agr = agricultural; Pr = pristine; A = years; Ceb = barley; Cen= rye; M = maize; G =sunflower; S = soybean; Sor =sorghum; T = wheat; CEC = cation exchange capacity; CO =organic carbon; F% = frequency of mycorrhizal fungi; M% = intensity of mycorrhization; A% = arbuscule content.

Parte del suelo fue utilizado para el análisis químico. Las muestras fueron secadas (30 °C), tamizadas y se determinó el contenido de Fe, Mn, Cu y Zn disponible con el ácido Dietilentriaminopentaacetico-DTPA (Lindsay& Norwell, 1978) con cuantificación por espectrofotometría de absorción atómica y el B disponible (soluble en agua) se determinó según la metodología propuesta por Bingham (1982). Se determinó el contenido de carbono orgánico (CO) (Walkley& Black,1934), pH (relación suelo:agua de 1:2.5), P-Bray (Bray& Kurtz, 1945) y la capacidad de intercambio catiónico para los cationes Ca, Mg, Na y K (Chapman, 1965).
El suelo restante fue utilizado para montar cultivos trampa los que fueron preparados en macetas de 100 mL mezclando suelo de cada sitio con sustrato (perlita/vermiculita 1:1) estéril (suelo/sustrato 1:1). Se utilizaron semillas de ryegrass (Lolium multiflorum Lam.) estériles como plantas hospeda-doras de los cultivos trampa. Las plantas fueron mantenidas en cámara de crecimiento (12 h luz/12 h oscuridad; 23 °C), regadas diariamente con agua destilada y con solución Hoagland (P al 50%) cada dos semanas. Transcurridas 12 semanas las plantas fueron desmontadas, las raíces lavadas con agua y procesadas para la tinción con Azul tripán (AT) usando una modificación de la metodología propuesta por Phillips& Hayman (1970), en la que se ha omitido la utilización de fenol en los reactivos. Para ello, las raíces fueron clarificadas con KOH 10% (20 min, 90 °C), lavadas con agua, acidificadas (HCl 0,1 N), lavadas con agua y teñidas con AT (0,05%) en lactoglicerol (ácido láctico, glicerol, agua destilada 1:1:1, 5 min, 100 °C). Los segmentos de raíces teñidos fueron montados en portaobjetos y se detectó la presencia de HMA totales registrando los segmentos de raíz colonizados con estructuras de HMA (hifas, arbúsculos, vesículas, esporas). Se realizó la cuantificación microscópica (Trouvelot et al.,1986) del grado o intensidad de infección micorrícica presente en las raíces el que fue expresado como frecuencia de HMA (F%), intensidad de infección (M), y contenido de arbúsculos (A %)
Se utilizó el análisis de correlación de Pearson (SAS, 1990). Se realizó el Análisis de Componentes Principales (PCA) utilizando el programa CANOCO (Ter Braak, 1988) incluyendo los datos químicos del suelo, con los parámetros de presencia de HMA y de colonización micorrícica en las plantas trampas.
RESULTADOS Y DISCUSIÓN
El rango de valores para todas las características analizadas en los suelos ha sido amplio (Tablas 1 A y B) y para algunas características (por ejemplo P-Bray) ha aumentado/disminuido hasta 50 veces entre sitios. En general, los valores de las características químicas fueron mayores para los sitios Pr que para los Agr (Tabla 1). En algunos casos, (contenidos de Zn y P-Bray), la variabilidad entre sitios fue muy elevada, independientemente del manejo y prácticamente superó a su valor promedio entre sitios. Esto es un indicativo de la elevada variabilidad para los nutrientes poco móviles tales como P y Zn, independientemente del manejo agrícola. El pH fue el parámetro que evidenció menor variabilidad entre manejos de suelos como consecuencia del elevado poder buffer de los mismos. Contrariamente a lo esperado, las diferencias entre manejos para la colonización micorrícica de las plantas trampa fueron muy bajas, determinándose en algunos casos mayor micorriza-ción (indicativo de una mayor capacidad micotrófica) en las plantas que crecieron en suelo Agr que en suelo Pr. Como para el caso de los nutrientes, la capacidad micotrófica de las plantas trampa que crecieron tanto en los suelos Agr como Pr presentó elevada variabilidad entre sitios independientemente del manejo.
La mayoría de las plantas trampa (a excepción de las que crecieron en los suelos colectados en Carlos Casares y Pehuajó Agr y Pr, Trenque Lauquen en 3 sitios Agr y 1 Pr, Junín y Ramallo Pr) formaron micorrizas. En las raíces de las plantas que crecieron en suelos provenientes tanto de sitios Agr como Pr y que formaron micorrizas, se encontraron todas las estructuras características de los HMA (Fig. 1). Los valores obtenidos para la frecuencia de micorrización superaron en algunos casos hasta 10 veces la intensidad de colonización, la que se mantuvo dentro de un rango que varió entre el 0-40 % (Tabla 1). Esto es debido a que en algunos casos se encontraron hifas con las características típicas de los HMA (Fig. 1, Junín Agr), pero estas no penetraron en las raíces, es decir, no formaron micorrizas. Como era de esperar, en todas las muestras el contenido de arbúsculos, sitio de intercambio de nutrientes entre los simbiontes planta-hongo (Morton& Benny, 1990) fue menor y se mantuvo dentro del rango 0-30%. En tal sentido es de destacar que de las variables analizadas, la M% y A% son las que darían cuenta de la capacidad micotrófica de los HMA dado que cuantifican grados de colonización micorrícica en las raíces, mientras que la F% indicaría la capacidad de los HMA para germinar y desarrollarse en el suelo aun sin penetrar en las raíces.

Figura 1. Imágenes fotográficas tomadas del microscopio óptico de las raíces de las plantas trampa (rye grass) que fueron crecidas en los diferentes suelos durante 12 semanas en suelos Agrícolas (Agr) y Prístinos (Pr).
Figure 1. Photographic images of roots of trap plants (rye grass) taken with an optical microscope. to Plants were grown on Agricultural (Agr) and Pristine (Pr) soils for 12 weeks.
Las diferencias de colonización (tanto entre sitios para el mismo manejo, como entre manejos para el mismo sitio) no deberían ser atribuidas a la planta hospedadora, dado que fue la misma para todos los cultivos trampa. Asimismo, es muy probable que las diferencias de colonización se deban a las características del sustrato y no a tiempo insuficiente transcurrido desde la germinación de las plantas hospedadoras para formar las micorrizas. La formación de esporas es una de las fases del ciclo de los hongos mi-corrícicos que darían cuenta de la llegada de los mismos a la madurez. En general, la esporulación puede ocurrir a partir de las 3-4 semanas de iniciada la micorrización bajo la mayoría de las condiciones, excepto bajo elevados contenidos de P que puede inhibir la formación de micorrizas (Covacevich et al, 2007; INVAM 2011). Declerck et al. (2001) determinaron que la esporulación se incrementa a partir de la cuarta o quinta semana y llega al máximo en la décima. En estas condiciones las determinaciones se realizaron a la décima segunda semana de crecimiento. Dicho tiempo se estableció por monitoreos previos de la evolución de la micorrización cada dos semanas en el cultivo trampa utilizado en este estudio (datos no mostrados), en los que se ha establecido que las raíces de plantas alcanzaron un porcentaje de micorrización estable a la décima semana de crecimiento. Por dicha razón, se considera que el tiempo que permanecieron las raíces de las plantas trampa en contacto con los propágulos nativos fue suficiente para permitir el establecimiento y estabilidad de la colonización micorrícica. Además, aunque no se realizó extracción y recuento de esporas, se encontraron esporas a los lados de las raíces en la mayoría de las muestras observadas (Fig. 1), lo que se espera en etapas tardías de la simbiosis.
El análisis de correlación lineal de Pearson (Tabla 2) evidenció que todos los nutrientes analizados, así como la CIC, se asociaron negativa, y en algunos casos significativamente con algunos de los parámetros cuantifica-dos de la infección micorrícica de las plantas trampa. Los micronutrientes en general no presentaron asociación significativa con la capacidad micotrófica. Únicamente el Fe y el Mn presentaron asociaciones negativas con aceptable (P< 0,05) y baja significancia, respectivamente. El pH se asoció con una baja significancia para la frecuencia e intensidad de micorrización y no presentó asociación con el contenido de arbúsculos. En estudios previos se ha reportado que, en algunos casos, la acidez del suelo puede afectar el desarrollo de la micorrización (Porter et al., 1987; Kittiworawat et al., 2010). En tal sentido Covacevich& Berbara (2011) determinaron alto grado de asociación entre la capacidad micotrófica de plantas trampa (Brachiaria sp.) y el pH de suelos de Brasil con diferente estado sucesional de la cobertura vegetal. En este sentido, Siqueira etal.(1990) mencionaron que la micorrización en Brachiaria sp. no varió para suelos de Brasil entre rangos de pH entre 4,56,0. En un estudio previo, sin embargo, Siqueira etal.(1986) mencionaron que el desarrollo de la micorrización asociado al pH del suelo varió con las especies de HMA. La correlación lineal indicaría que el CO no presenta asociación con la capacidad micotrófica en las condiciones evaluadas. Sin embargo, Covacevich& Echeverría (2000) han determinado que para suelos Hapludoles del SE Bonaerense, la micorrización nativa en pasturas (Lolium multiflorum, Dactilisglomeratay Trifolium repens,entre otros) se asoció significativa y positivamente con el contenido de CO del suelo, mientras que no presentó asociación significativa con el pH. Becerra etal.(2007) tambien reportaron que la micorrización espontánea de Alnusacuminata en dos bosques del Noroeste Argentino presentó asociación positiva y significativa con el contenido de MO pero sólo en uno (Sierra de Narváez, Catamarca) de los dos sitios así como en una sola estación (primavera) de las dos mues-treadas. En el presente trabajo, el análisis de correlación lineal realizado indicaría que la relación entre el P disponible y los parámetros de micorrización analizados presentó baja o nula significancia y con coeficientes también bajos. Sin embargo, ha sido ampliamente reportado que el P disponible en el suelo se asocia negativamente con la formación de micorrizas (Covacevich et al., 2006, 2007; Siddiqui et al., 2008). Djuuna et al. (2010) tampoco encontraron relación entre la micorrización y el P disponible en el suelo analizando 291 puntos de muestreo provenientes de 15 sitios agrícolas de Australia utilizando modelos generales lineales y modelos aditivos para predecir la micorrización por características del suelo. Asimismo, los autores evidenciaron relaciones negativas entre la micorrización y el CO. Los resultados obtenidos en nuestro estudio (particularmente en lo referido al P disponible y al CO) evidenciarían que la correlación lineal no es un análisis del todo sensible para los datos evaluados.
Tabla 2. Coeficiente de correlación de Pearson (r) entre las características químicas de los suelos y los parámetros de colonización micorrícica de las plantas trampa. CIC= capacidad de intercambio catiónico; CO= carbono orgánico; F%= frecuencia de hongos micorrícicos; M% = intensidad de micorrización; A%= contenido de arbúsculos; P= probabilidad.
Table 2. Pearson's correlation coefficient (r) among soil chemical characteristics and mycorrhizal colonization of trap plants. CIC = cation exchange capacity; CO = organic carbon; F% = frequency of mycorrhizal fungi; M% = intensity of mycorrhization; A% = arbuscule content; P= probability.

El análisis de componentes principales (PCA) basado en las características químicas de los suelos analizados y la micorrización de las plantas trampa que crecieron en dichos sustratos, permitió separar los sitios de estudio según su manejo. En general, se agruparon por una parte los sitios Agr y por otra parte los sitios Pr (Fig. 2). El análisis explicó el 55,9 % de la variabilidad total en las dos primeras componentes siendo el 32,7 % de la variancia explicada por el componente principal 1 (PC1, eje horizontal). Asimismo, el CP1 muestra una asociación positiva (a la derecha) entre todas las características químicas relacionadas con la fertilidad del suelo, explicadas principalmente por los suelos de los sitios Pr. En oposición (a la izquierda), se proyectan negativamente los parámetros de micorrización (F%, M% y A%). De esta manera el PC1 sintetizó el manejo del suelo separando casi en su totalidad los sitios bajo agricultura de los prístinos. El PC2 (vertical) explicó aproximadamente el 23% de la variabilidad, y mostró proximidad entre los parámetros de micorrización (F%, M% y A%) con el pH del suelo. Asimismo, se evidencia una clara asociación negativa (flechas opuestas) entre los parámetros de micorrización con el P-Bray y el contenido de Fe, y en menor medida con el Mn, B y Zn.

Figura 2. Análisis de componentes principales (PCA) para las características químicas determinadas en suelos colectados bajo manejo agrícola (A) y sin manejo (P= prístino) con la capacidad micotrófica (F%= frecuencia de hongos micorrícicos; M% = intensidad de micorrización; A%= contenido de arbúsculos) determinada por la colonización micorrícica de las plantas crecidas en dichos suelos (Referencias de Sitios disponibles en Tabla 1).
Figure 2. Principal component analysis (PCA) for chemical properties assessed for soils collected under cultivated (A) and uncultivated (P = pristine) soils with the mycotrophic ability (F% = frequency of mycorrhizal fungi; M% = intensity of mycorrhization; A% = arbuscules content) determined by root mycorrhizal colonization of trap plants grown in these soils (references of sites available in Table 1).
Para el caso de los suelos agrícolas, se puede mencionar que en general los bajos grados de micorrización determinados (M% y A% < 5%) en los suelos provenientes de 9 de Julio, Azul, Benito Juárez, Carlos Casares, Hipólito Irigoyen, Pehuajó y Tandil bajo agricultura (Tabla 1 A) ocurrieron con elevados contenidos de P disponible (entre 24 y 39 ppm) y de Fe (entre 80 y 150 ppm). Para el caso de Trenque Lauquen (muestra colectada en tapera) la capacidad micotrófica fue nula y tampoco se evidenciaron hifas de HMA aun sin penetrar en las raíces. El suelo proveniente de dicho sitio presentó el más alto contenido de P disponible (> 480 ppm) junto con elevados contenidos de Fe (< 150 ppm). Si bien la asociación negativa entre el P del suelo y el desarrollo de las micorrizas es un aspecto que ha sido ampliamente documentado, pocos son los reportes tendientes a determinar el efecto de otros nutrientes del suelo sobre los HMA. En tal sentido de Oliveira& de Oliveira (2011) también determinaron para un Oxisol agrícola de Brasil correlaciones negativas entre la micorrización nativa de Paulinia cupana con el contenido de Fe disponible en el suelo.
Para el caso de los suelos prístinos, la baja capacidad micotrófica (M% y A% <5) determinadas en 9 de Julio, Hipólito Irigoyen, Junín, Necochea, Pehuajó y Rivadavia también podría deberse a contenidos medios a elevados de P disponible (27 ppm en 9 de julio, mientras que para los otros sitios entre 40 y 180 ppm), elevados contenidos de Fe (entre 74 y 140 ppm) (Tabla 1 B). Los sitios que no presentaron HMA con capacidad micotrófica ni tampoco estructuras propias observables en la muestra aún sin formar micorrizas (Carlos Casares, Ramallo y un sitio de Trenque Lauquen) fueron los que presentaron los mayores contenidos de P disponible (entre 110 y 380 ppm) juntamente con elevados contenidos de Fe (aproximadamente 100 ppm). Si bien en Tandil Pr (P30 y P31) se determinó una mediana micorrización asociada con valores medios de P y elevados de Fe, el elevado contenido de MO (entre 6 y 7%) podría haber actuado como amortiguadora de los efectos depresivos de la micorrización de los mencionados nutrientes.
Los resultados obtenidos parecieran indicar que la capacidad de formar micorrizas para los HMA nativos de los suelos de sistemas productivos de la provincia de Buenos Aires estaría asociada principalmente a la disponibilidad de P y Fe y no al manejo agrícola de los suelos.
CONCLUSIÓN
En suelos con manejos agrícolas y prístinos de la provincia de Buenos Aires, elevados contenidos de P disponible en el suelo, juntamente con elevados contenidos de Fe se manifestaron como depresores de la capacidad micotrófica de plantas-trampa crecidas en condiciones controladas durante 12 semanas.
Este trabajo constituye el primer reporte de la influencia de las características químicas del suelo sobre la capacidad micotrófica de HMA en sistemas productivos de la provincia de Buenos Aires bajo manejo agrícola y su comparación con suelos prístinos.
AGRADECIMIENTOS
Los resultados de análisis químicos de suelo de este trabajo corresponden a parte de la Tesis en ejecución de M.Sc. de la Bioq. M. Eyherabide. Proyectos: INTA AERN-295582, AERN-295561; AGR 319/10 UNMdP; CONICET PIP 11420100100252, Convenio de vinculación tecnológica entre INTA y FERTILIZAR ASOCIACIÓN CIVIL (20628). Se agradece al laboratorio Suelofertil del ACA Pergamino y al laboratorio de suelos EEA INTA Balcarce por la realización de los análisis de suelo. Al Dr. Mondino por su asistencia en el análisis de componentes principales.
BIBLIOGRAFÍA
1. Alguacil, MM; E Lumini; A Roldán; JR Salinas-García; P Bonfante& V Bianciotto. 2008. The Impact of Tillage Practices on Arbuscular Mycorrhizal Fungal Diversity in Subtropical Crops. Ecol. Appl. 18: 527-536. [ Links ]
2. Aon, MA; MN Cabello; DE Sarena; AC Colaneri; MG Franco; JL Burgos& S Cortassa. 2001. Spatio-temporal patterns of soilmicrobial and enzymatic activities in an agricultural soil. Appl. Soil Ecol. 18: 239254. [ Links ]
3. Bagayoko, M; A Buerket; G Lung; A Bationo& V Romheld. 2000. Cereal/legume rotation effects on cereal growth in Sudano-Sahelian West Africa: soil mineral nitrogen, mycorrhizae and nematodes. Plant Soil 218: 103-116. [ Links ]
4. Becerra, AG; NM Arrigo; N Bartoloni; LS Domínguez& MN Cofré. 2007. Arbuscular mycorrhizal colonization of Alnus acuminate Kunth in Northwestern Argentina in relation to season and soil parameters. Ciencia del Suelo 25(1): 7-13. [ Links ]
5. Berardo A. 2004. Manejo de la fertilizacion en una agricultura sus-tentable. Informaciones Agronómicas 23. Disponible en http://www.potafos.org/ppiweb/iaarg.nsf/Swebindex/14CD7A51DA971 26903256F02004C0BBF/$file/Berardo+Sustentabilidad.pdf [ Links ]
6. Bingham, FT. 1982. In: Page, AL (ed.) Methods of Soils Analysis, Part, 2, Chemical and Michrobiological Properties, Agronomy Monograph, 2nd ed, ASA-SSSA. 677 S. Segoe Rd, Madison, WI 53711, USA, 9: 431-447. [ Links ]
7. Boerner, REJ; BG Demars& PN Leicht. 1996. Spatial patterns of mycorrhizal infectiveness of soils long a successional chronosequence, Mycorrhiza 6: 79-90. [ Links ]
8. Bray, RH& LT Kurtz. 1945. Determination of total, organic and available forms of phosphorus in soil. Soil Sci. 59: 360-361. [ Links ]
9. Chapman, HD. 1965. Cation-exchange capacity. In: Black, CA; et al. (eds.) Methods of soil analysis, Part 2, p. 891-901. AgronMonogr 9, ASA and SSSA, Madison, WI. [ Links ]
10. Covacevich, F& HE Echeverría. 2000. Caracterización química y biológica de un Hapludol bajo diferentes manejos. Ciencia del Suelo 18: 144-148. [ Links ]
11. Covacevich, F; MA Marino& HE Echeverria. 2006. The phosphorus source determines the arbuscular mycorrhizal potential and the native mycorrhizal colonization of tall fescue and wheatgrass in a moderately acidic Argentinean soil, Eur. J. Soil Biol. 42: 127-138. [ Links ]
12. Covacevich, F; HE Echeverria& LAN Aguirrezabal. 2007. Soil available phosphorus status determines indigenous mycorrhizal colonization into field and glasshouse-grown spring wheat in Argentina. Appl. Soil Ecol. 35: 1-9. [ Links ]
13. Covacevich F& RLL Berbara. 2011. Indigenous arbuscular mycorrhizae in areas with different successional stages at a Tropical Dry Forest Biome in Brazil. African J. of Microbiology Res. 5: 2697-2705. [ Links ]
14. Declerck, S; D D'or; S Cranenbrouck& E Le Boulengé. 2001. Modelling the sporulation dynamics of arbuscular mycorrhizal fungi in monoxenic culture. Mycorrhiza 11: 225-230. [ Links ]
15. de Oliveira, AN& LA de Oliveira. 2010. Influence of Edapho-Climatic Factors on the Sporulation and Colonization of Arbuscular Mycorrhizal Fungi in Two Amazonian Native Fruit Species. Braz. Arch. Biol. Technol. 53: 653-661. [ Links ]
16. Hendrix, JW; BJ Guo& An ZQ. 1995. Divergence of mycorrhizal communities in crop production systems. Plant Soil 170: 131-140. [ Links ]
17. INVAM. 2011. (http://invam.caf.wvu.edu/fungi/taxonomy/concepts/lifecycle.htm.) Acceso mayo 2012. [ Links ]
18. Joner, EJ. 2000. The effect of long-term fertilization with organic or inorganic fertilizers on mycorrhiza-mediated phosphorus uptake in subterranean clover. Biol. Fert. Soils 32: 435-440. [ Links ]
19. Johnson, NC& FL Pfleger. 1992. Vesicular-arbuscular mycorrhizae and cultural stresses. En: Bethlenvalvay, GJ& RG Lindermann (eds). Mycorrhiza in sustainable agriculture. 54: 71-100. ASA Special Publication, Madison, WI. [ Links ]
20. Kabir, Z; IP O'Halloran& C Hamel. 1997. Seasonal changes of arbuscular mycorrhizal fungi as affected by tillage practices and fertilization: hyphal density and mycorrhiza root colonization. Plant Soil 192: 285-293. [ Links ]
21. Khade, SW& BF Rodrigues. 2009. Applications of arbuscular mycorrhizal fungi in agroecosystems. Tropical and Subtropical Agroecosystems 10: 337-354. [ Links ]
22. Kittiworawat, S; S Youpensuk& B Rerkasem. 2010. Diversity of Arbuscular Mycorrhizal Fungi in Mimosa invisa and Effect of the Soil pH on the Symbiosis. Chiang Mai J. Sci. 37: 517-527. [ Links ]
23. Liu, A; C Hamel; RI Hamilton& DL Smith. 2000. Mycorrhizae formation and nutrient uptake of new corn (Zea mays L.) hybrids with extreme canopy and leaf architecture as influenced by soil N and P levels. Plant Soil 221: 157-166. [ Links ]
24. Lindsay, WL& WA Norwell. 1978. Development of a DTPA soil test for zinc, iron, manganese and cooper. J. Soil Sci. Soc. Am. 42: 421-428. [ Links ]
25. Menéndez, AB; JM Cerviño& AM Godeas. 2001. Arbuscular mycorrhizal populations associated with natural and cultivated vegetation on a site of Buenos Aires province, Argentina. Biol. Fertil. Soils33: 373381. [ Links ]
26. Morton, JB& GL Benny. 1990. Revised classification of arbuscular mycorrhizal fungi (Zygomicetes): a new order, Glomales, two new suborders, Glomineae and Gigasporineae, and two new families, Acaulosporaceae and Gigasporaceae, with an emendation of Glomaceae. Mycotaxon 37: 471-491. [ Links ]
27. Oehl, F; E Sieverding; K Ineichen; P Mader; T Boller& A Wiemken. 2003. Impact of land use intensity on the species diversity of arbuscular mycorrhizal fungi in agro ecosystems of Central Europe. Appl. Env. Microbiol. 69: 2816-2824. [ Links ]
28. Pengue, WA. 2001. Agricultura argentina: sustentables, hasta cuándo? Agroecol e Desenv Rur Sustent (Porto Alegre, Br) 2(4): 48-52. [ Links ]
29. Phillips, J& D Hayman. 1970. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Trans. British Mycol. Soc. 55: 158-161. [ Links ]
30. Porter, WM; AD Robson& LK Abbott. 1987. Factors controlling the distribution of VA mycorrhizal fungi in relation to soil pH. J. Appl. Ecol. 24: 663-672. [ Links ]
31. Romaniuk, R; L Giuffré; A Costantini& P Nannipieri. 2011. Assessment of soilmicrobialdiversity measurements as indicators of soil functioning in organic and conventional horticulture systems. Ecol. Indicators 11: 345-1353. [ Links ]
32. SAS Institute Inc, 1990, SAS User's Guide: Statistics, version 6, 3rd edn, Cary, NC, [ Links ]
33. Schalamuk, S& M Cabello. 2010a. Arbuscular mycorrhizal fungal propagules from tillage and no-tillage systems: possible effects on Glomeromycota diversity. Mycologia 102: 261-268. [ Links ]
34. Schalamuk, S& M Cabello. 2010 b. Effect of Tillage Systems on the Arbuscular Mycorrhizal Fungi (AMF) Propagule Bank in Soils. In: Arya, A& AE Perelló (eds.) Management of Fungal Plant Pathogens. Capítulo13. pp. 162-170. [ Links ]
35. Siddiqui, ZA; MS Akhtar& K Futai (eds.). 2008. Mycorrhizae: Sustainable Agriculture and Forestry, Springer, New Delhi. [ Links ]
36. Siqueira, JO; AW Mahmud& DH Hubbell. 1986. Differential behavior of vesicular-arbuscular mycorrhizal fungi in relation to soil acidity. R. Bras. Ci. Solo. 10: 11-16. [ Links ]
37. Siqueira, JO; WF Rocha; E Oliveira& A Colozzi-Filho. 1990. The relationship between vesicular-arbuscular mycorrhiza and lime: Associated effects on the growth and nutrition of Brachiaria grass. Biol. Fertil. Soils 10: 65-71. [ Links ]
38. Ter Braak, CJF. 1987-1992. CANOCO-a FORTRAN program for canonical community ordination, Microcomputer Power, Ithaca, NY. [ Links ]
39. Trouvelot, A; JL Kough& V Gianinazzi-Pearson. 1986. In:Gianinazzi-Pearson, V& S Gianinazzi (eds).Physiological and genetical aspects of mycorrhizae. pp: 626-630 (INRA, Paris). [ Links ]
40. Walkley, A& Y Black. 1934. An examination of the Degtjareff method for determining soil organic matter and proposed modification of the chromic acid titration method. Soil Science 37: 29-37. [ Links ]













