Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencia del suelo
versión On-line ISSN 1850-2067
Cienc. suelo vol.31 no.2 Ciudad Autónoma de Buenos Aires dic. 2013
TRABAJOS
Acción de los cebos granulados sobre los invertebrados edáficos
Carla Salvio1*; Pablo Luis Manetti1; Natalia Liliana Clemente1 & Alicia Noemí López1
1 Unidad Integrada Facultad de Ciencias Agrarias (UNMdP) - EEA INTA Balcarce C.C. 276, (7620), Balcarce, Argentina. Tel. (02266) - 439100 int. 702.
* Autor de contacto: carlasalvio@hotmail.com
Recibido: 27-01-13
Recibido con revisiones: 28-03-13
Aceptado: 10-04-13
RESUMEN
Los cebos granulados en base a Metaldehído y/o Carbaryl son utilizados para el control de babosas (Mollusca: Pulmonata) y bicho bolita (Crustacea: Isopoda). Sin embargo, es escasa la información sobre el efecto que causan sobre la abundancia de los grupos funcionales. En este trabajo se evaluó el efecto de los cebos Dual Acay (Metaldehído 4%+Carbaryl 8%), Molusquicida Acay y Clartex (Metaldehído 4 y 5%), MataBibos Acay y Clartex BB (Carbaryl 8%) sobre los detrítivoros, predadores, herbívoros y omnívoros a los 7, 10, 23 y 37 días después de la aplicación de los cebos (DDA). Los detritívoros no difirieron entre los tratamientos a los 7, 10, 23 y 37 DDA (p> 0,05). Los predadores a los 7 y 23 DDA no mostraron diferencias (p> 0,05) en cambio, sí a los 10 y 37 DDA (p< 0,05), debido a un incremento en el número de arañas con respecto a los carábidos. En relación al carábido Scarites anthracinus, su densidad no difirió entre los tratamientos a los 7 y 10 DDA (p> 0,05), mientras que, sí a los 23 y 37 DDA (p< 0,05). En ambas fechas de observación, la densidad menor se obtuvo con los cebos que contienen Carbaryl con respecto a los demás tratamientos (p< 0,05). Los herbívoros y los omnívoros disminuyeron con la aplicación de los cebos con respecto al testigo a los 7, 10, 23 y 37 DDA (p< 0,05). En consecuencia, la aplicación de los cebos no afectó la densidad de los detritívoros y predadores pero causó disminución en los herbívoros y omnívoros. Los cebos en base a Carbaryl disminuyeron la densidad de S. anthracinus. Por lo tanto, debería realizarse un uso apropiado de los cebos o bien considerar otra alternativa de manejo que asegure la conservación y el equilibrio biológico de estos organismos.
Palabras clave. Metaldehído; Carbaryl; Grupos funcionales; Siembra directa.
Effects of granulated baits on soil invertebrates
ABSTRACT
Granulated baits based on Metaldehyde and/or Carbaryl are used for the control of slugs (Mollusca: Pulmonata) and woodlices (Crustacea: Isopoda). However, the information on the effect that they cause on abundance of functional groups is scarce. In this study, the effect of Dual Acay baits (Metaldehyde 4%+Carbaryl 8%), Molluscicide Acay and Clartex (Metaldehyde 4 and 5%), MataBibos BB Acay and Clartex BB (Carbaryl 8%) was evaluated on the following functional groups: detritivores, predators, herbivores and omnivores 7, 10, 23 and 37 days after bait application (DAA). Detritivores did not differ between treatments at 7, 10, 23 and 37 DAA (p> 0.05). Predators 7 and 23 DAA showed no differences (p> 0.05); however, at 10 and 37 DAA an increase in the number of spiders was observed respect to carabids (p< 0.05) . The population density of carabid Scarites anthracinus did not differ among treatments at 7 and 10 DAA (p> 0.05); whereas, 23 and 37 DDA significant differences were observed (p< 0.05). In both observation dates, the lowest density was obtained with baits containing Carbaryl in their formulation with respect to the other treatments (p< 0.05). Herbivores and omnivore populations decreased with the application of baits with respect to the control at 7, 10, 23 and 37 DAA (p< 0.05). Consequently, the application of baits did not affect the population densities of detritivores and predators but caused a decrease in the populations of herbivores and omnivores. Furthermore, Carbaryl baits decreased the S. anthracinus density. According to these results, baits should either be used appropriately or alternative control practices should be used to ensure the conservation and biological balance of these organisms.
Key words. Metaldehyde; Carbaryl; Functional groups; No tillage.
INTRODUCCIÓN
En nuestro país así como en otras partes del mundo, con el objeto de mantener las condiciones óptimas para el crecimiento de los cultivos se ha intensificado el uso de las labranzas y de los plaguicidas (Ferraro & Pimentel, 2000). Sin embargo, estas prácticas de manejo producen pérdida paulatina de la materia orgánica, erosión y degradación de las propiedades físico-químicas del suelo (Doran & Safley, 1998). Para solucionar algunos de estos problemas, se introdujeron las labranzas conservacionistas como es la siembra directa (SD) (Lal et al., 2007). La SD es la forma más extrema de reducción de las labranzas, que consiste en sembrar sin remover el suelo dejando los restos del cultivo antecesor (Studdert & Echeverría, 2000). La adopción de este sistema de labranza modifica el régimen térmico del suelo, disminuyendo la temperatura media y la amplitud térmica; el balance de agua, reduciendo la evaporación y el escurrimiento; y el balance de materia, minimizando las pérdidas de material mineral y orgánico (Gil & Garay, 2001).
Por las razones expuestas, la SD genera un ambiente menos perturbado que favorece la provisión de alimentos y refugios para el desarrollo de organismos tanto benéficos como perjudiciales (Wilson-Rummenie et al., 1999; Capowiez et al., 2009). Dentro de estos últimos, se encuentran las babosas (Mollusca: Pulmonata) y los bichos bolita (Crustacea: Isopoda) que ocasionan daños en los cultivos de colza, soja y girasol (Larsen et al., 2007; Clemente et al., 2008; Garavano et al., 2013).
El control químico es la tecnología más utilizada a nivel mundial y local (Bailey, 2002; Iglesias et al., 2002; Mastronardi, 2006; Salvio et al., 2008). Su acción se basa en el uso de cebos tóxicos granulados, formulados con un atrayente alimentario y un ingrediente activo (i.a.) específico. Los molusquicidas de mayor uso comercial contienen 4 o 5% de Metaldehído y como crustacicidas se disponen de cebos con 8% de Carbaryl (CASAFE, 2009; SENASA, 2012). Por último, existe otro cebo de acción combinada, formulado con los dos i.a. en el mismo cebo, Metaldehído (4 %) como molusquicida y Carbaryl (8%) como crustacicida, permitiendo el control conjunto de ambas plagas (SENASA, 2012). En nuestro país, se han alcanzado resultados satisfactorios con la aplicación de estos cebos en el control de babosas y bichos bolita (Mastronardi, 2006; Salvio et al., 2008; Bocca, 2011; Villarino et al., 2011; Garavano et al., 2013).
Los organismos del suelo de diferentes taxa se agrupan en los siguientes grupos funcionales: los herbívoros que consumen distintas partes de la planta; los descomponedores (detritívoros) que producen los detritos orgánicos sobre los cuales actúan los microorganismos, responsables de las transformaciones bioquímicas de la materia orgánica; los predadores que consumen a otros animales y por último, los omnívoros que se alimentan de plantas y de animales (Moore et al., 1988).
La aplicación intensiva de los plaguicidas, dependiendo tanto del tipo del i.a. como de la dosis, puede afectar a los organismos no blanco y en el largo plazo, conducir al desarrollo de daños irreversibles tanto de la estructura como de la función del ecosistema suelo (Muthukaruppan et al., 2005; Reinecke & Reinecke, 2007).
Debido a la escasa información existente sobre el efecto de los cebos tóxicos sobre los invertebrados edáficos se plantea como objetivo determinar el efecto de los cebos que contienen Metaldehído y/o Carbaryl sobre los grupos funcionales: detritívoros, predadores, herbívoros y omnívoros. En consecuencia, la hipótesis de trabajo es que la aplicación de los cebos no afecta la densidad activa de los grupos funcionales.
MATERIALES Y MÉTODOS
El ensayo se realizó durante noviembre y diciembre de 2007 en el establecimiento El Cerrito, partido de Balcarce (37°45' S, 58°18' W, 130 m snm) en un cultivo de soja bajo SD con una infestación natural de 70 ind. m-2 de isópodos, con predomino de Armadillidium vulgare ''bicho bolita'', y 8 ind. m-2 de Milax gagates ''babosa carenada''. El clima del área es mesotermal, húmedo-subhúmedo con una temperatura media anual del aire de 13 ºC y una precipitación media anual de 928 mm (promedio 1970-2000), ocurriendo el 80% de las lluvias en el período primavera-verano. El diseño fue en bloques completos aleatorizados con tres repeticiones y la unidad experimental consistió en una parcela de 20 x 20 m. Se utilizaron los siguientes cebos comerciales: Dual Acay (Metal-dehído 4%+Carbaryl 8%), Molusquicida Acay (Metaldehído 4%) y MataBibos Acay (Carbaryl 8%) (Acay Agro S.R.L.) y Molusquicida Clartex (Metaldehído 5%) y Clartex BB (Carbaryl 8%) (Rizobacter Argentina S.A.). Se probaron 12 tratamientos: 2; 4; 6 kg ha-1 de Dual Acay, 2 y 4 kg ha-1 de Molusquicida Acay y Clartex por MataBibos Acay y Clartex BB y el testigo. Los cebos se aplicaron manualmente al voleo luego de la siembra del cultivo.
El muestreo se realizó con trampas de caída (pitfall) , las cuales sirven para evaluar la densidad activa de los organismos que se desplazan sobre la superficie del suelo (Spence & Niemela, 1994). Las trampas consistieron en un vaso de plástico de 1142 cm3, de 11,5 cm de diámetro y 11 cm de altura, enterrado con la boca a nivel de la superficie del suelo, que en su interior contenía 700 cm3 de una solución de formol (5%). Para la instalación de las trampas se utilizaron soportes que consistieron de vasos del mismo volumen que las trampas, las cuales contenían perforaciones en su base para permitir el drenaje del agua de lluvia. A los 3 días después de la siembra se colocaron en el centro de cada parcela dos trampas de caída, siendo la separación entre ellas de 10 m. Se colocó un total de 72 trampas y el contenido de cada trampa fue recolectado a los 3, 7, 10, 16, 23, 30 y 37 días después de la aplicación de los cebos (DDA). El contenido de cada trampa se analizó en el laboratorio, se identificaron los ejemplares y se determinó el número de individuos por trampa. Los diferentes taxa se agruparon en grupos funcionales teniendo en cuenta su hábito alimenticio y a la función que cumplen en el agroecosistema en: detritívoros, predadores, herbívoros y omnívoros (Moore et al., 1988). Cuando fue posible los ejemplares se identificaron hasta nivel de especie. El número de individuos colectados en las trampas de caída fueron agrupados de la siguiente manera: a) 7 DDA (22 y 26/11/07); b) 10 DDA (29/11/07); c) 23 DDA (5 y 12/12/07) y d) 37 DDA (27/12/07).
La suma de los individuos de cada taxón en las 2 trampas de cada parcela se consideró como una unidad y se calculó el promedio por tratamiento de acuerdo a los días de observación. Teniendo en cuenta que los organismos se distribuyen de manera agregada o contagiosa, los datos se analizaron mediante modelos lineales generalizados asumiendo una distribución binomial negativa (McCullagh & Nelder, 1989). Cuando hubo diferencias entre los tratamientos se efectuaron contrastes con respecto al testigo (a = 0,05). Para el análisis estadístico se utilizó el programa SAS v.8 (SAS Institute Inc., 2001).
Dentro de los predadores carábidos se seleccionó a Scarites anthracinus, que es considerado organismo predador de las babosas y los bichos bolita, y puede ser afectado directa o indirectamente con la aplicación de los cebos. Se analizó el número de S. anthracinus a los 7, 10, 23 y 37 DDA mediante análisis de la varianza (ANOVA), previa validación del supuesto de homogeneidad de varianzas mediante la prueba de Levene (a = 0,05). Cuando se detectaron diferencias entre las medias se realizó la prueba de mínimas diferencias significativas (MDS) (a = 0,05). El análisis se realizó con el programa R 2.13.0 (R Development Core Team, 2011).
RESULTADOS Y DISCUSIÓN
Durante el período de muestreo se capturaron un total de 16.444 individuos, los cuales se agruparon de acuerdo a su hábito alimenticio y a la función que cumplen en el agro-ecosistema en: detritívoros, predadores, herbívoros y omnívoros (Tabla 1). La comunidad edáfica estuvo representada por dos phyla: Annelida y Arthropoda (ver Tabla 1).
Tabla 1. Clasificación de los individuos por nivel taxonómico y por grupo funcional. Noviembre - diciembre de 2007.
Table 1. Classification of individuals by their taxonomic level and functional group. November - December 2007.

Los detritívoros hallados fueron los Collembola: Onychiuridae y Entomobryidae (88,4%), Acarina: Oribatida y Prostigmata (9,3%), Diplopoda: Polydesma: Polydesmidae (1,4%) y Annelida, Oligochaeta: Lumbricidae (0,9%). Los Entomobryidae fueron los más abundantes dentro de los Collembola, puesto que en general son organismos epígeos fácilmente capturados en las trampas de caída. De la misma manera, se halló una gran cantidad de microatrópodos en correspondencia con la información reportada por Edwards & Lofty (1977), Beare et al. (1992) y Gupta (1994). Esto se debe a que, los microartrópodos dependen mayormente de la cantidad y distribución de los restos biológicos en la superficie. Estos residuos son frecuentemente colonizados por una cantidad elevada de hongos, que constituye el alimento preferido de los colémbolos y de algunos grupos de ácaros (Stinner & House, 1990). Mediante su modo de alimentación suprimen a los hongos patógenos que son perjudiciales a las plantas. Además, participan en el ciclo de los nutrientes como así también promueven la estabilización del suelo por la formación de microagregados (Larink, 1997). El grupo de los predadores estuvo constituido principalmente por Araneae (76,3%), Coleoptera: Carabidae y Staphylinidae (20%), Acarina: Gamasida (2,2%) y Chilopoda: Scolopendridae y Lithobiidae (1,4%). Por lo tanto, constituyen los mismos taxa que los informados por Brévault et al. (2007), quienes encuentran como organismos predadores a los Araneae (33,8%), Carabidae (24,6%), Staphylinidae (15,7%) y Scolopendridae (10,3%). Asimismo, Álvarez Castillo et al. (2006) reportaron que bajo SD las arañas, los carábidos y los estafilínidos son los principales integrantes del grupo de los predadores. De manera similar a los resultados obtenidos en este estudio, Wilson-Rummenie et al. (1999) encontraron que entre los preda-dores, las arañas son los organismos más abundantes (51%). Por otra parte, el 76,3% de arañas resultó un valor muy próximo al obtenido por Lietti et al. (1993, citado en Lietti et al., 2008) en un cultivo de soja bajo SD, 86%. La abundancia elevada de las arañas encontrada en sistemas bajo SD se debe a la existencia de una composición del suelo compleja y heterogénea debido a la presencia de los residuos de cosecha del cultivo antecesor. Esto produce una diversificación de los micro-hábitats que favorecen el desarrollo de las arañas (Samu et al., 1999). Los herbívoros, que son generalmente plagas agrícolas, estuvieron representados por Isopoda: Porcellidae y Ar-madillidae (93,1%), Collembola: Sminthuridae (3,5%) y Orthoptera: Gryllidae y Acrididae (3,4%). Resultados similares fueron reportados por Álvarez Castillo et al. (2006). Los isópodos se consideraron dentro de este grupo, porque si bien son detritívoros, actualmente debido a su alto potencial biótico se han transformado en plagas en sistemas de cultivo bajo SD. Por último, en el grupo de los omnívoros se encontraron solamente Hymenoptera: Formicidae.
La aplicación de los cebos sobre los detritívoros no mostró diferencias entre los tratamientos a los 7, 10, 23 y 37 DDA (p> 0,05). En general, el número fue menor a los 7 DDA con respecto a los 10 DDA. A los 7 DDA, la densidad activa menor, 6 ind. trampa-1, se obtuvo con 6 kg ha-1 de Dual Acay, mientras que, a los 10 DDA con 2 kg ha-1 de Molusquicida Acay y 4 kg ha-1 de Clartex BB, 19 ind. tram-pa-1. A los 23 DDA y en la mayoría de los tratamientos el número de detritívoros fue menor a 10 ind. trampa-1, a excepción del Molusquicida Clartex 2 kg ha-1 con el cual se obtuvo la densidad mayor, 23 ind. trampa-1. Mientras que, a los 37 DDA el número de individuos capturados y la variabilidad entre los tratamientos fue mayor con respecto a los 23 DDA. El número mayor, 40 ind. trampa-1, se obtuvo con 4 kg ha-1 de MataBibos Acay, mientras que el número menor, 8 ind. trampa-1, con 6 kg ha-1 de Dual Acay.
En sistemas de SD, la actividad de los detritívoros se concentra en la superficie y en consecuencia, son muy sensibles a la acción de los plaguicidas. A pesar de ello y de acuerdo a lo esperado, la aplicación de los cebos no afectó a la densidad activa de los detritívoros. Esto es particularmente importante puesto que, este grupo de organismos actúa como catalizador en los procesos de transformación de la materia orgánica (Lavelle, 1997).
La densidad activa de los predadores a los 7 y 23 DDA no mostró diferencias (p= 0,17 y p= 0,36, respectivamente) en cambio, sí se observó a los 10 y 37 DDA (p< 0,05) (Fig. 1). A los 10 DDA, el número mayor se obtuvo con 2 kg ha-1 del Molusquicida Acay y 4 kg ha-1 de Matabibos Acay y las arañas fueron los predadores más abundantes (Fig. 1). El número de predadores a los 37 DDA no mostró diferencias entre los tratamientos con respecto al testigo, a excepción del Molusquicida Acay 4 kg ha-1, con el cual se obtuvo 55 ind. trampa-1, siendo más abundantes las arañas (Fig. 1).

Figura 1. Número de predadores (promedio + desvío estándar) trampa-1 en los tratamientos a los 10 y 37 días después de la aplicación (DDA). * indican diferencias significativas con respecto al testigo (p< 0,05).
Figure 1. Number of predators (mean + standard deviation) trap-1 in treatments at 10 and 37 days after application (DAA). * Indicate significant differences compared to the control (p <0.05).
La cantidad de predadores no disminuyó con la aplicación de los cebos, si bien, en algunos tratamientos el número de individuos aumentó considerablemente debido a la presencia dominante de las arañas con respecto a los carábidos.
En los agroecosistemas, los hábitats que están constituidos por vegetación espontánea son importantes, puesto que ofrecen refugios a las arañas y a otros predadores generalistas y son los sitios desde los cuales ciertas especies pueden colonizar a los cultivos (Nyffeler et al., 1992). En sistemas bajo SD, la existencia de una cobertura vegetal permanente provee refugios y disponibilidad de presas que hace a estas áreas apropiadas para el desarrollo de las arañas (Liljesthröm et al., 2002). Como esta experiencia se realizó en un cultivo de soja bajo SD ubicado próximo a un monte de Eucalyptus sp. las condiciones propias del sistema pudieron proporcionar un hábitat favorable para la reproducción y el desarrollo de las arañas. Esto explicaría el predominio de estos organismos en el grupo de los predadores. Liljesthröm et al. (2002) realizaron observaciones similares en ensayos efectuados en áreas sojeras de Oliveros (provincia de Santa Fe). Los autores encuentran que la densidad de arañas es cuatro veces mayor en sistemas bajo SD que la correspondiente a un sistema convencional. Ahora bien, considerando entre de los predadores solo la densidad del carábido S. anthracinus los resultados fueron diferentes. Se observó que a los 7 y 10 DDA la densidad del carábido no difirió entre los tratamientos, p= 0,45 y p= 0,11, respectivamente. En cambio, a los 23 y 37 DDA se obtuvieron diferencias entre los tratamientos en la densidad de S. anthracinus (p< 0,05) (Fig. 2). A los 23 DDA, la densidad menor se obtuvo con 2 y 4 kg ha-1 de Clartex BB y MataBibos Acay y con 2 y 6 kg ha-1 de Dual Acay con respecto a los demás tratamientos (p< 0,05) (Fig. 2). En relación a los 37 DDA, la tendencia fue similar encontrándose la densidad menor con 4 kg ha-1 MataBibos Acay y con 2 y 6 kg ha-1 de Dual Acay (p< 0,05) (Fig. 2).

Figura 2. Número de Scarites anthracinus (promedio + desvío estándar) trampa-1 en los tratamientos a los 23 y 37 días después de la aplicación (DDA). Barras con las letras iguales en cada fecha de observación indican diferencias no significativas entre los tratamientos (MDS, p>0,05).
Figure 2. Number of Scarites anthracinus (mean + standard deviation) trap-1 in treatments at 23 and 37 days after application (DAA). Bars with the same letters in each observation date indicate no significant differences among treatments (LSD, p> 0.05).
Estos resultados fueron confirmados por Salvio et al. (2009, 2012) quienes en condiciones de laboratorio observan que los cebos que contienen Carbaryl como i.a. causan efecto letal sobre S. anthracinus. Ellos obtienen que la dosis letal media (DL50) de Carbaryl es de 2,95 kg de formulado ha-1, equivalente a la dosis que habitualmente se aplica en el campo, y la DL50 de Metaldehído+Carbaryl es de 1,54 kg del formulado ha-1, la mitad de la dosis de aplicación recomendada. En consecuencia, Carbaryl formulado como cebo resulta tóxico sobre este carábido. Teniendo en cuenta los cebos formulados con Metaldehí-do, Salvio et al. (2009, 2012) no encuentran efectos letales sobre S. anthracinus e incluso observan que el mismo es consumido por el carábido sin producirle síntomas visibles. De igual manera, Büchs et al. (1989, citado en Bieri, 2003), en condiciones semicontroladas y en el campo, observaron que los pellets en base a Metaldehído no afectan el comportamiento de Pterostichus cupreus, Carabus granulatus, P. melanarius y Harpalus rufipes (Insecta, Coleoptera: Carabidae). De manera similar a los resultados obtenidos en este trabajo, Wiltshire & Glen (1989) observaron que los cebos con Metaldehído no producen efectos significativos sobre el número de carábidos. Este resultado fue confirmado por Bieri et al. (1989) quienes encuentran efectos tóxicos insignificantes sobre las poblaciones de carábidos e incluso con una dosis 10 veces mayor a la recomendada para el campo. Asimismo, la aplicación de cuatro formulaciones de Metaldehído en el campo no tienen efectos sobre P. melanarius, P. cupreus y H. rufipes (Büchs et al. , 1989, citado en Bieri, 2003). Estos hallazgos fueron similares a los de Samsoe-Peterson et al. (1992) quienes encuentran efectos nulos o insignificantes de este i.a. en las especies mencionadas. Por otro lado, Langan et al. (2004) evaluaron el efecto de Metaldehído sobre P. melanarius alimentados con babosas intoxicadas con el plaguicida y observan que no se produce mortalidad de los individuos.
Los herbívoros difirieron entre los tratamientos a los 7, 10, 23 y 37 DDA (p< 0,05) (Fig. 3). Dentro de este grupo, los isópodos fueron los más abundantes, alcanzando el 93,1%. En general, a los 7 DDA se observó que el número disminuyó con las dosis mayores de Dual Acay y con todos los crustacicidas con respecto al testigo (p< 0,05). A los 10 DDA, con 4 kg ha-1 de Dual Acay, 4 kg ha-1 de MataBibos Acay y 2 kg ha-1 de Clartex BB se obtuvo una disminución en el número de los herbívoros (p< 0,05). En tanto que, los demás tratamientos no difirieron con respecto al testigo (p> 0,05) (Fig. 3). A los 23 y 37 DDA, los herbívoros mostraron una disminución con las tres dosis de Dual Acay y con la mayoría de los crustacicidas (p< 0,05) (Fig. 3). Estos resultados indican que, como los organismos que predominaron fueron los isópodos, los cebos formulados en base a Carbaryl, ya sea solo o combinado con Metaldehído, disminuyeron su densidad.
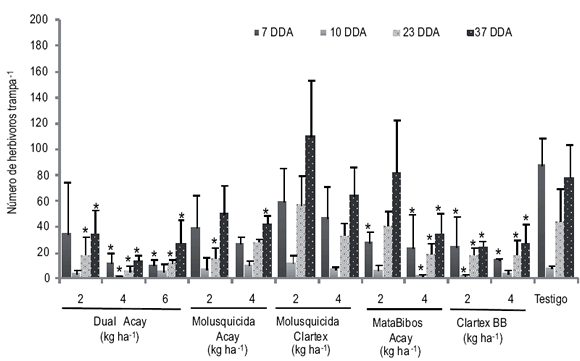
Figura 3. Número de herbívoros (promedio + desvío estándar) trampa-1 en los tratamientos a los 7, 10, 23 y 37 días después de la aplicación (DDA). * indican diferencias significativas con respecto al testigo (p< 0,05).
Figure 3. Number of herbivores (mean + standard deviation) trap-1 in treatments at 7, 10, 23 and 37 days after application (DAA). * Indicate significant differences from the control (p <0.05).
El número de omnívoros capturados presentó diferencias significativas entre los tratamientos a los 7, 10, 23 y 37 DDA (p< 0,05) y se observó en la mayoría de los tratamientos una disminución con respecto al testigo (Fig. 4).

Figura 4. Número de omnívoros (promedio + desvío estándar) trampa-1 en los tratamientos a los 7, 10, 23 y 37 días después de la aplicación (DDA). * indican diferencias significativas con respecto al testigo (p< 0,05).
Figure 4. Number of omnivores (mean + standard deviation) trap-1 in treatments at 7, 10, 23 and 37 days after application (DAA). * Indicate significant differences from the control (p <0.05).
Ahora bien, en todas las observaciones se obtuvieron las densidades menores con 4 y 6 kg ha-1 de Dual Acay y 4 kg ha-1 de Clartex BB, diferenciándose siempre del testigo (Fig. 4). Este resultado se explicaría teniendo en cuenta que estos cebos contienen en su formulación Carbaryl, el cual es utilizado para el control de los formícidos. En efecto, Vásquez et al. (2002) evaluaron la efectividad de un cebo formulado con Carbaryl y obtienen una reducción de un 50% en el número de hormigueros después de los cinco días de su aplicación. Asimismo, Téllez & Serna (2005) encuentran una eficacia de control de 69,6% del cebo que contiene 0,06% de Carbaryl sobre Atta cephalotes (Hymenoptera: Formicidae) con respecto al testigo. No obstante, es difícil estimar el impacto que ocasionan los cebos sobre los formícidos y por lo tanto, se requieren estudios futuros que demuestren la acción directa de estos cebos sobre dichos organismos.
CONCLUSIONES
La aplicación de los cebos en base a Metaldehído y/o Carbaryl no afectó la densidad de los detritívoros y preda-dores pero causó una disminución en la densidad de los herbívoros y omnívoros durante las condiciones experimentales en las cuales se realizó este estudio. A su vez, los cebos en base a Carbaryl disminuyeron la densidad de S. anthracinus. Si bien, la aplicación de los cebos produce reducción de las especies plaga, aquellos cebos que contienen a Carbaryl también causan efectos adversos sobre los organismos benéficos edáficos. Por lo tanto, debería realizarse un uso apropiado de los cebos o bien considerar otra alternativa de manejo que asegure la conservación y el equilibrio biológico de estos organismos.
BIBLIOGRAFÍA
- Álvarez Castillo, HA; AM Vincini; AN López; D Carmona & P Manetti. 2006. Composición específica y funcional de la fauna edáfica en agroecosistemas experimentales con rotaciones mixtas. En: Reseña histórica y técnica de los ensayos de larga duración y del laboratorio de suelos. INTA. Balcarce, Argentina. 16 p. [ Links ]
- Bailey, S. 2002. Molluscicidal baits for control of terrestrial gastropods. In: GM Barker (ed.). Molluscs as crop pests. Pp. 33-54. CABI Publishing, Hamilton, New Zealand. [ Links ]
- Beare, MH; RW Parmelee; PF Hendrix; W Cheng; DC Coleman & DA Crossley. 1992. Microbial and faunal interactions and effects on litter nitrogen and decomposition in agroecosystems. Ecol. Monogr. 62: 569-591.
- Bieri, M. 2003. The environmental profile of metaldehyde. [en línea] <http://ucdavis.edu/files/ filelibrary/2017/11554> [consulta: 1° de agosto de 2006].
- Bieri, M; H Schweizer; K Christensen & O Daniel. 1989. The effect of metaldehyde and methiocarb slug pellets on Lumbricus terrestris L. In: I Henderson (ed.). Slugs and snails in world agriculture. Pp. 237-244. British Crop Protection Council, Thornton Heath. [ Links ]
- Bocca, F. 2011. Competencia de Armadillidium vulgare (Crustacea: Isopoda) y Milax gagates (Mollusca: Pulmonata) por cebos comerciales utilizados para el control de ambas plagas. Tesis de grado. Facultad de Ciencias Agrarias, Universidad Nacional de Mar del Plata. Balcarce, Argentina. 29 p.
- Brévault, T; S Bikay; JM Maldés & K Naudin. 2007. Impact of a no-till with mulch soil management strategy on soil macrofauna com-munities in a cotton cropping system. Soil Till. Res. 97: 140-149.
- Capowiez, Y; S Cadoux; P Bouchant; S Ruy; J Roger-Estrade; G Richard & H Boizard. 2009. The effect of tillage type and cropping system on earthworm communities, macroporosity and water infiltration. Soil Till. Res. 105: 209-216.
- CASAFE. 2009. Guía de productos fitosanitarios para la República Argentina. 14º ed. Cámara de Sanidad Agropecuaria y fertilizantes. 3079 p.
- Clemente, NL; AN López; MG Monterubbianesi; NJ Cazzaniga & PL Manetti. 2008. Biological studies and phenology of slug Deroceras reticulatum (Müller, 1774) (Pulmonata: Stylommatophora). Invertebr. Reprod. Dev. 52: 23-30.
- Doran, JW & M Safley. 1998. Defining and assessing soil health and sustainable productivity. In: CE Pankhurst; BM Doube & VVSR Gupta (eds.). Biological Indicators of Soil Health. Pp. 1-28. CAB Publishing, UK.
- Edwards, CA & JR Lofty. 1977. The influence of invertebrates on root growth of crops with minimal or zero cultivation. Ecol. Bull. 25: 348-356. [ Links ]
- Ferraro, DO & D Pimentel. 2000. Pesticides in agroecosystems and their ecological effects on the structure and function of soil faunal populations. Pesticides, People and Nature 2(2): 1-13. [ Links ]
- Garavano, ME; PL Manetti; NL Clemente; AJ Faberi; C Salvio & AN López. 2013. Cebos molusquicidas y molusquicidas líquidos para el control de Deroceras reticulatum (Pulmonata: Stylomatophora), plaga en el cultivo de colza. RIA. 39(1): 60-66. [ Links ]
- Gil, RC & A Garay. 2001. La siembra directa y el funcionamiento sustentable del suelo. En: JL Panigatti; D Buschiazzo & H Marelli (eds.). Siembra directa 2°. INTA. Pp. 5-16. [ Links ]
- Gupta, VVSR. 1994. The impact of soil and crop management practices on the dynamics of soil microfauna and mesofauna. In: CE Pankhurst; BM Doube; VVSR Gupta & PR Grace (eds.). Soil biota: management in sustainable farming systems. Pp. 107-124. CSIRO, East Melbourne. [ Links ]
- Iglesias, J; J Castillejo & A Ester. 2002. Laboratory evaluation of potencial molluscicides for the control of eggs of the pest slug Deroceras reticulatum (Müller) (Pulmonata: Limacidae). Int. J. Pest Manage. 48(1): 19-23. [ Links ]
- Lal, R; DC Reicosky & JD Hanson. 2007. Evolution of the plow over 10,000 years and the rationale for no-till farming. Soil Till. Res. 93: 1-12. [ Links ]
- Langan, AM; A Taylor & CP Wheater. 2004. Effects of metaldehyde and methiocarb on feeding preferences and survival of a slug predator (Pterostichus melanarius (F.): Carabidae, Pterostichini). J. Appl. Entomol. 128(1): 51-55. [ Links ]
- Larink, O.1997. Springtails and mites: important knots in the food web of soils. In: G Benckiser (ed.). Fauna in soil ecosystems. Recycling processes, nutrient fluxes, and agricultural production. Pp. 225-264. New York. [ Links ]
- Larsen, G; P Manetti; N Clemente; A Faberi; C Salvio & A López. 2007. Relevamiento de la densidad de babosas y bichos bolita en siembra directa. IV Congreso Argentino de Girasol, Buenos Aires, Argentina. 29 a 30 de mayo de 2007. 3 p.
- Lavelle, P. 1997. Faunal activities and soil processes: adaptive strategies that determine ecosystem function. Adv. Ecol. Res. 27: 93-132. [ Links ]
- Lietti, M; JC Gamundi; G Montero; A Molinari & V Bulacio. 2008. Efecto de dos sistemas de labranza sobre la abundancia de artrópodos que habitan en el suelo. Ecol. Austral. 18: 71-87. [ Links ]
- Liljesthröm, G; E Minervino; D Castro & A Gonzalez. 2002. La comunidad de arañas del cultivo de soja en la provincia de Buenos Aires, Argentina. Neotrop. Entomol. 31(2): 197-210. [ Links ]
- Mastronardi, F. 2006. Control químico de isópodos y babosas en un cultivo de girasol bajo siembra directa. Tesis de grado. Facultad de Ciencias Agrarias, Universidad Nacional de Mar del Plata. Balcarce, Argentina. 65 p.
- Mc Cullagh, P & JA Nelder. 1989. Generalized linear models. Chapman and Hall (eds.). Cambridge, Great Britain. 541 p.
- Moore, JC; DE Walter & HW Hunt. 1988. Arthropod regulation of micro-and mesobiota in below-ground detrital food webs. Annu. Rev. Entomol. 33: 419-439. [ Links ]
- Muthukaruppan, G; S Janardhanan & GS Vijayalakshmi. 2005. Sublethal toxicity of the herbicide butachlor on the earthworm Perionyx sansibaricus and its histological changes. J. Soils Sediments 5(2): 82-86. [ Links ]
- Nyeffeler, M; DA Dean & WL Sterling. 1992. Diets, feeding specialization and predatory role of two lynx spiders, Oxyopes salticus and Peucetia viridans (Araneae: Oxyopidae), in a Texas cotton agroecosystem. Env. Entomol. 21: 1457-1465. [ Links ]
- R Development Core Team. 2011. R: a language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. Version 2.13.0.
- Reinecke, S & A Reinecke. 2007. Biomarker response and biomass change of earthworms exposed to chlorpyrifos in microcosms. Ecotoxicol. Environ. Saf. 66: 92-101. [ Links ]
- Salvio, C; AJ Faberi; AN López; PL Manetti & NL Clemente. 2008. The efficacy of three metaldehyde pellets marketed in Argentina, on the control of Deroceras reticulatum (Müller) (Pulmonata: Stylommatophora). Span. J. Agric. Res. 6(1): 70-77. [ Links ]
- Salvio, C; AN López; PL Manetti; NL Clemente & HA Álvarez Castillo. 2009. Toxicidad de los cebos en base a metaldehído y/o carbaryl sobre Scarites anthracinus (Coleoptera: Carabidae). XIII Jornadas Fitosanitarias Argentinas, 30 de septiembre a 2 de octubre de 2009, Termas de Río Hondo, Santiago del Estero, Argentina. p. PV77.
- Salvio, C; AN López; PL Manetti; NL Clemente & ML Menone. 2012. Susceptibilidad de Scarites anthracinus (Coleoptera: Carabidae) expuesto a Metaldehído y/o Carbaryl. IV Congreso Argentino de la Sociedad de Toxicología y Química Ambiental SETAC Argentina. 16 a 19 de octubre de 2012, Buenos Aires, Argentina. p.18.
- Samsoe-Petersen, L; M Bieri & W Buchs. 1992. Interpretation of laboratory measured effects of slug pellets on soil dwelling invertebrates. Aspect Appl. Biol. 31: 87-96. [ Links ]
- Samu, F; KD Sunderland & S Csaba. 1999. Scale-dependent dispersal and distribution patterns of spiders in agricultural systems: a review. J. Arachnol. 27: 325-332. [ Links ]
- SAS Institute. 2001. SAS/STAT software release 8.02. Cary, USA, SAS Institute Inc.
- SENASA. 2012. Organismo responsable de garantizar y certificar la sanidad y calidad de la producción agropecuaria, pesquera y forestal [en linea] <www.senasa.gov.ar/> [consulta: 2 febrero de 2012].
- Spence, JR & JK Niemela. 1994. Sampling carabid assemblages with pitfall traps: the madness and the method. Can. Entomol. 126: 881-894. [ Links ]
- Stinner, BR & GJ House. 1990. Arthropods and other invertebrates in conservation - tillage agriculture. Annu. Rev. Entomol. 35: 299-318. [ Links ]
- Studdert, GA & HE Echeverría. 2000. Maíz, girasol y soja en los sistemas de cultivo del sudeste bonaerense. En: FH Andrade & V Sadras (eds.). Bases para el manejo del maíz, el girasol y la soja. Pp. 407-437. EEA Balcarce INTA-FCA, UNMdP. Balcarce, Argentina.
- Téllez, LG & FJ Serna. 2005. Evaluación de la eficacia del cebo con ingrediente activo carbaryl en el control de hormiga arriera Atta cephalotes (l.) (Hymenoptera: Formicidae) en el municipio de San Francisco-Cundinamarca. V Coloquio de Insectos Sociales IUSSI-Sección Bolivariana, Cali. 7 a 9 de Septiembre de 2005. p.129.
- Vázquez, LL; E Peña & D López. 2002. Evaluación de diferentes atrayentes e insecticidas para cebo formicida. Fitosanidad 6(1): 19-23.
- Villarino, SV; PL Manetti; AN López; NL Clemente & AJ Faberi. 2011. Formulaciones con combinación de ingredientes activos para el control de Armadillidium vulgare (Crustacea: Isopoda), plaga en el cultivo de colza. RIA 30(1): 91-96.
- Wilson-Rummenie, AC; BJ Bradford; LN Robertson; GB Simpson & KL Bell. 1999. Reduced tillage increases population density of soil macrofauna in a semiarid environment in Central Queensland. Environ. Entomol. 28(2):163-172.
- Wiltshire, CW & DM Glen. 1989. Effects of molluscicides on slugs and soil arthropods in winter cereal crops. Monograph-British Crop Protection Council No 41. Pp. 399-406.














