Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencia del suelo
versão On-line ISSN 1850-2067
Cienc. suelo vol.36 no.1 Ciudad Autónoma de Buenos Aires jul. 2018
BIOLOGÍA DEL SUELO
Incorporación de trigo en la rotación agrícola: una herramienta para potenciar el funcionamiento del agroecosistema
Wheat incorporation in agricultural crop rotation: a tool to enhance the functioning of the agroecosystem
Dannae Lilia Serri1*, José Meriles2, Cinthia Conforto1, Carolina Pérez Brandan3, Silvina Pastor1, Betiana Grümberg4, Celina Luna4, Claudio Lorenzon5, Juan Arce5, Hugo Marelli5, Silvina Vargas Gil1
1 Instituto de Patología Vegetal, CIAP, INTA
2 Instituto Multidisciplinario de Biología Vegetal - CONICET
3 EEA INTA Salta
4 Instituto de Fisiología y Recursos Genéticos Vegetales, CIAP, INTA
5 EEA INTA Marcos Juárez
* Autor de contacto: serri.dannae@inta.gob.ar
Recibido: 14/09/2017
Recibido con revisiones: 15/04/2018
Aceptado: 15/04/2018
Resumen
Argentina es uno de los principales productores y exportadores de granos a nivel mundial. En particular, la región Pampeana es el área de mayor actividad agrícola centrando su producción en el cultivo de soja, seguido del maíz y trigo en menor proporción. En los últimos años, el sistema basado en la producción continua de un cultivo ha generado un impacto negativo sobre las propiedades del suelo. Históricamente, prácticas conservacionistas como la rotación de cultivos y labranza cero, se han propuesto como alternativas al monocultivo y remoción de residuos de cosecha. De esta manera, la diversificación del sistema (inclusión de gramíneas y/o cultivos de invierno), es una de las herramientas más importantes y válidas para potenciar el funcionamiento de los agroecosistemas. El propósito de este trabajo fue identificar la secuencia agrícola que contribuya a incrementar la actividad microbiana del suelo, en sintonía con las variables químicas edáficas. El estudio se llevó a cabo en un ensayo de larga duración iniciado en 1975 bajo siembra directa. De los tratamientos que conforman el ensayo sólo se seleccionaron cuatro secuencias de cultivos agrícolas: soja-soja (S-S), soja-trigo/soja (S-T/S), maíz-soja (M-S) y maíz-trigo/soja (M-T/S). Sobre las muestras de suelo se determinaron parámetros biológicos, como respiración microbiana y actividades enzimáticas, y parámetros químicos como contenido de materia orgánica y macronutrientes. El análisis conjunto de los parámetros dio como resultado una diferenciación entre las secuencias que incluyeron al cultivo invernal (S-T/S y M-T/S) de las secuencias basadas únicamente en cultivos de verano (S-S y M-S). De esta manera las funciones microbianas junto a la materia orgánica y los nutrientes del suelo, demostraron la importancia de la inclusión de trigo como cultivo de invierno en la rotación agrícola.
Palabras clave: Parámetros microbianos y químicos; manejo agrícola; sustentabilidad.
Abstract
Argentina is one of the main worldwide grains producers and exporters. In particular, the Pampas region is the area with the highest agricultural activity, focusing its production on soybean cultivation, followed by maize and wheat in a smaller proportion. In recent years, continuous cropping based systems have had a negative impact on soil properties. Historically, conservation practices such as crop rotation and zero tillage have been proposed as an alternative to monoculture and crop residue removal. In this way, the diversification of the system (including grasses and/or winter crops) is one of the most important and valid tools for enhancing the functioning of agroecosystems. The purpose of this work was to identify the agricultural sequences that contribute to increase the microbial activity of the soil, in relation with soil chemical variables. The study was carried out in a long-term trial under zero system. The treatments consisted of four agricultural crop sequences: soybean-soybean (S-S), soybean-wheat / soybean (S-T/S), maize-soybean (M-S) and maize-wheat /soybean (M-T/S). Biological parameters, such as microbial respiration and enzymatic activities, and chemical parameters such as organic matter content and macronutrients were determined from soil samples. Joint parameter analysis resulted in a differentiation between sequences that included the winter crop (S-T/S and M-T/S) from the sequences based only on summer crops (S-S and M-S). In this way, the microbial functions along with organic matter and soil nutrients, demonstrated the importance of the inclusion of wheat as winter crop in the agricultural rotation.
Key words: Microbial and chemical parameters; agricultural management; sustainability.
INTRODUCCIÓN
La soja, el maíz y el trigo se encuentran entre los pocos cultivos en los que se basa una gran parte del suministro mundial de alimentos (Andrade & Satorre, 2015). En Argentina, la superficie sembrada con soja es de aproximadamente 20 M ha, mientras que maíz y trigo rondan los 5,9 y 4,3 M ha, respectivamente (MAGYP, 2017). En la actualidad, la región Pampeana concentra el 87% de los suelos sembrados con soja, el 79,5% con maíz y el 90% con trigo, demostrando ser el área de mayor importancia para la producción agrícola del país. De hecho el cultivo de soja ocupa el 75% de los suelos sembrados de la región respecto del maíz (BCR, 2017).
De esta manera, se ve reflejado que los sistemas de producción actuales dependen en gran medida de la soja como cultivo de verano, alternando con largos períodos de barbecho otoñoinvernal (Salado-Navarro & Sinclair, 2009). La proporción de ésta leguminosa es tan grande en comparación con los cultivos de gramíneas, que la hace tendiente al monocultivo (Caviglia & Andrade, 2010). Esta situación es apoyada parcialmente por la adopción de nuevas tecnologías, tales como labranza cero (siembra directa), nuevas variedades de cultivos (principalmente transgénicos), agroquímicos y fertilizantes (Satorre, 2012; Andrade & Satorre, 2015).
A pesar de los beneficios del manejo bajo siembra directa (Taboada 1998, Blanco-Canqui et al., 2011), la siembra continua de soja, presenta desventajas desde el punto de vista de la sustentabilidad del sistema. Éste cultivo tiene un sistema muy pobre de raíces y su bajo aporte de residuos, es insuficiente para proporcionar una adecuada protección y cobertura al suelo (Novelli et al., 2011; Varela et al., 2011). Además, el efecto perjudicial de la falta de diversidad (monocultivo) sobre la actividad y estructura de la comunidad microbiana del suelo ya fue mencionado por Dick (1992) y Vargas Gil & Vargas Gil (2011).
Para contrarrestar la forma en que se produce el cultivo de soja, la diversificación de los sistemas de cultivo y la elección de una rotación que incluya cultivos que brinden más residuos orgánicos, así como protección a la capa superior del suelo, son prácticas comúnmente utilizadas en concepto de agricultura sostenible (Smith et al., 2008; Palm et al., 2014). En este sentido, diversas rotaciones de cultivos pueden alterar el hábitat del suelo afectando la profundidad del enraizamiento, la cantidad y la calidad de los residuos, la agregación/hábitat microbiano, y pueden estimular la diversidad y actividad microbiana del suelo (Balota et al., 2004). También se sabe que la rotación de cultivos influye de manera beneficiosa en muchos parámetros químicos del suelo, incluyendo el contenido de C orgánico, la oferta y la transformación de N, el pH y la cantidad y disponibilidad de P, K, Ca y Mg (Power, 1990; Vargas Gil et al., 2009).
Por consiguiente, la incorporación de gramíneas en la rotación mejora el balance de carbono (C) tanto por la calidad de sus rastrojos como por su cantidad y por permitir una mayor cobertura del suelo. De hecho, las gramíneas poseen un sistema de raíces en cabellera y fibroso que favorece la formación de agregados y poros biológicos (Ferrari, 2010). Una alternativa es el cultivo de trigo, que permite aumentar la intensidad de la rotación dado que habitualmente se lo hace como cultivo antecesor de soja. Es por esto que, para lograr mayor sustentabilidad en los sistemas productivos, los cultivos de invierno como trigo, deben ser parte de los planteos agrícolas (Studdert & Echeverría, 2000). De esta manera, la región Pampeana podría beneficiarse con la implementación de una adecuada secuencia de cultivos que contribuiría a la diversificación del sistema, incrementando las funciones ecosistémicas que brindan los microorganismos, para una mayor eficiencia en el uso de los recursos (Caviglia & Andrade, 2010).
En este contexto productivo, nos planteamos como objetivo explorar el efecto de cuatro secuencias de cultivos agrícolas empleadas en la región Pampeana Argentina sobre parámetros biológicos, como la respiración microbiana y actividades enzimáticas, y parámetros químicos del suelo, como el contenido de materia orgánica y macronutrientes.
MATERIALES Y MÉTODOS
Sitio experimental
El estudio se llevó a cabo en el ensayo de rotaciones de larga duración iniciado en 1975 en INTA EEA Marcos Juárez, Córdoba (Lat. 32º 40' S), en un lote experimental con suelo Argiudol típico franco limoso, serie Marcos Juárez (INTA , 1978). El ensayo se inició con un sistema de labranza mínima para todos los tratamientos, posteriormente a medida que se hizo posible el uso de siembra directa (SD), se fue incorporando en las distintas secuencias. A partir de 1992 todo el ensayo se condujo con SD. El diseño experimental se estableció en bloques completos al azar con tres repeticiones. Los tratamientos fueron cuatro secuencias de cultivos agrícolas sin fertilización: soja-soja (S-S), soja-trigo/soja (S-T/S), maíz-soja (M-S) y maíz-trigo/soja (M-T/S). El tamaño de cada parcela experimental fue de 14,5x90 m.
Muestreo y determinaciones de suelo
Se realizó un muestreo anual en pre-cosecha del cultivo de verano durante tres campañas consecutivas (2010, 2011 y 2012). El número de unidades observacionales por año, quedó definido de la siguiente manera: 4 tratamientos x 3 repeticiones x 6 muestras compuestas (6 submuestras) = 72 unidades experimentales, recolectadas de los primeros 10 cm de profundidad sobre la línea de siembra empleando un barreno. Cada unidad experimental se pasó por tamiz de 2 mm, una parte se conservó a 4 ºC para las determinaciones biológicas y otra se secó para realizar los análisis químicos.
Sobre las muestras de suelo se determinaron parámetros biológicos como respiración microbiana (RM) según el método de Alef (1995), por incubación de muestras de suelo durante 7 días a 28 ºC en presencia de 10 ml de NaOH como secuestrante de CO2; la diversidad catabólica por consumo de sustratos carbonados mediante perfiles fisiológicos a nivel de comunidad (CLPP) de acuerdo con Zak et al., (1994) y expresada a partir del promedio de desarrollo de color del pocillo (AWCD; Garland & Mills, 1991), las fuentes de carbono utilizadas comprendían seis monosacáridos (D-dextrosa, D-manosa, D-fructosa, D-glucosa, D-galactosa, D-xilosa), un disacárido (D-lactosa), cuatro aminoácidos (DL-triptófano, L-arginina, L-asparagina, L-lisina) y una vitamina (tiamina); y las proteínas de suelo relacionadas con glomalina (PSRG) se determinaron en la forma de glomalina fácilmente extraíble según el método propuesto por Wright & Upadhyaya (1996).
Además se analizaron las actividades enzimáticas de hidrólisis de diacetato de fluoresceína (FDA) determinada de acuerdo a Adam & Duncan (2001) procedimiento que mide la fluoresceína derivada de la incubación de 2 g de suelo con 15 ml de buffer (K2HPO4 60 mM, pH 7,6) y sustrato FDA (1000 μg ml-1) a 30 ºC por 20 minutos y 100 rpm, se extrajo con 15 ml de cloroformo/ metanol (2:1 v/v) y se midió espectrofotométricamente; fosfatasa ácida (FA ) utilizando la técnica de Alef (1995) basada en la determinación de paranitrofenol liberado luego de una incubación de 1 g de suelo con 4 ml de buffer universal (0,1 M, pH 6,5) y 1 ml de p-nitrofenil fosfato (25 mM) por 1 h a 37 ºC, se extrajo con 4ml NaOH 0,5 M y 1 ml 0,5 M CaCl2 y se midió espectrofotométricamente; y deshidrogenasa (DHG) siguiendo el método de García et al. (1997), donde 1 g de suelo al 60% de la capacidad de campo se expuso a INT (cloruro de 2-p yodofenil-3-pnitrofenil- 5-feniltetrazolio), luego de incubación a 28 °C durante 24 h en oscuridad, el INTF (iodonitrotetrazolio formazan) formado se extrajo con 10 ml de metanol y se midió espectrofotométricamente. Además, se estudió la estructura de las comunidades microbianas de suelo mediante sus perfiles de fosfolípidos (PLFA ), según la metodología utilizada por Meriles et al. (2009), basada en Zelles (1999). La metodología de extracción y condiciones de análisis de los PLFA s se realizó acorde con Bossio & Scow (1998). Las muestras de suelo (8 g) se extrajeron con 40 ml de una solución buffer que contiene una proporción de 1:2:0,8 cloroformo, metanol y buffer fosfato (8,7 g K2HPO4-dibásico + 1,3 g K2HPO4-monobásico l-1, pH 7,4). La fracción lipídica polar que contiene los fosfolípidos se aisló y se transesterificó en ésteres metílicos de ácidos grasos usando una reacción de metanolisis ácida suave. Los ésteres metílicos de ácidos grasos se analizaron por cromatografía de gases en un Perkin-Elmer Clarus 500 equipado con una columna Elite-5 y detector de llama (FID).
Los parámetros químicos evaluados fueron, materia orgánica (MO) por el método de Walkley & Black (1934) certificado bajo Norma IRAMSAGyP 29571-3, potencial de hidrógeno (pH) (Norma IRAM 29574) y conductividad eléctrica (Ce) (Norma IRAM 21322) por suspensión de la muestra de suelo en una relación de 1:2,5, nitratos (NO3 -) por el método del fenol disulfónico según Bremner (1965), el contenido de fósforo extractable (P) de acuerdo con Bray & Kurtz (1945) normalizado bajo Norma IRAM-SAGyP 29570-1, potasio (K) por solución extractiva de acetato de amonio seguido por fotometría de llama, y azufre (S) de sulfatos (S-SO4) extraído con la solución de Morgan y determinado por turbidimetría.
Análisis estadísticos
Los datos se analizaron mediante modelos lineales generales y mixtos, empleando el programa estadístico InfoStat (Di Rienzo et al., 2015). Los resultados se expresaron como promedio de los tres muestreos considerando a la campaña como repetición (efecto aleatorio). Cuando se constataron diferencias significativas se realizó el test DGC (Di Rienzo, Guzman y Casanoves) con un α≤0,05. Como herramienta exploratoria se utilizó el análisis de componentes principales (ACP) y el análisis de conglomerados (dendogramas) para evaluar la diferencia entre los tratamientos e identificar las variables microbiológicas y químicas que contribuyan con la separación de los mismos. A demás, para el estudio de la relación entre todas las variables se realizó un análisis de Procrustes generalizado.
Tabla 1. Análisis estadístico de los parámetros generales y funciones de las comunidades microbianas del suelo en respuesta a las secuencias agrícolas incluyendo cultivos de soja, maíz y trigo en un ensayo de larga duración, siendo los resultados un promedio de tres campañas agrícolas (2010, 2011 y 2012).
Table 1. Statistical analysis of the general parameters and functions of soil microbial communities in response to agricultural sequences including soybean, maize and wheat crops in a long-term trial, the results being an average of three agricultural seasons (2010, 2011 and 2012).
Referencias: Respiración microbiana (RM), perfiles fisiológicos a nivel de comunidad (CLPP), proteínas de suelo relacionadas con Glomalina (PSRG), hidrólisis de diacetato de fluoresceína (FDA), actividad fosfatasa ácida (FA) y actividad deshidrogenasa (DHG). Soja (S), maíz (M), trigo (T). Letras distintas por parámetro (columna) indican diferencias significativas para ** (p≤0,01), *** (p≤0,001). Ns (no significativo). *Average Well Color Development (Promedio del desarrollo de color del pocillo).
RESULTADOS
Parámetros biológicos de suelo
La RM, CLPP y las PSRG fueron afectadas por las secuencias de cultivos (Tabla 1). RM se diferenció en M-T/S, siendo ésta diferencia estadísticamente significativa con respecto al resto de los tratamientos (Tabla 1). De este modo, el tratamiento M-T/S evidenció la mayor producción de CO2 que fue 29,7% superior respecto a M-S que fue el tratamiento con menor registro de actividad. Con respecto a la técnica CLPP la diferencia entre el consumo promedio de los sustratos de C fue estadísticamente significativa para S-T/S, seguido de S-S y M-T/S, siendo nuevamente el M-S el tratamiento con menor AWCD (Tabla 1). Asimismo, los resultados de CLPP para el tratamiento S-T/S fueron 12,7%, 17,7% y 39,5% superiores a S-S, M-T/S y M-S, respectivamente. PSRG presentó diferencias estadísticamente significativas con valores más altos en M-T/S, seguido de M-S y S-T/S, siendo S-S la secuencia con menor valor de PSRG y diferente significativamente con respecto al resto de tratamientos (Tabla 1). Respecto de este último tratamiento, M-T/S evidencio 27,7% mayor contenido en PSRG en comparación con el resto de tratamientos.
Con respecto a las funciones de las comunidades microbianas se evaluaron a través de la cuantificación de actividades enzimáticas como FDA, FA y DHG. De igual modo, las actividades enzimáticas FDA y FA registraron diferencias estadísticamente significativas con valores superiores para S-T/S y M-T/S (Tabla 1). S-S fue la secuencia que registró menor actividad para FA , siendo esta 46,5% inferior respecto de S-T/S. Por su parte DHG varió en un rango de 1,2 a 14,2 mg INTF g suelo-1. A diferencia de FDA y FA , la actividad enzimática DHG registró los mayores valores para S-S, seguido de M-S, aunque no presentó diferencias estadísticamente significativas entre las secuencias agrícolas (Tabla 1).
A partir de la cuantificación de la estructura de las comunidades microbianas (PLFA ) se determinaron bacterias, hongos totales, y biomasa total (BT). A pesar de observarse un mayor porcentaje de bacterias y hongos totales para S-S y S-T/S respecto de los demás tratamientos, las diferencias en los porcentajes de hongos y bacterias no fueron estadísticamente significativas (datos no mostrados). Sin embargo, BT registró para S-S y S-T/S, diferencias significativas respecto de las secuencias M-T/S y M-S (Tabla 1). El promedio de BT para las secuencias con mayor presencia del cultivo de soja fue 56 % superior respecto de las secuencias con inclusión de maíz.
A su vez, los parámetros microbianos se analizaron mediante un análisis de componentes principales (ACP) (Figura 1a). El ACP generado logró diferenciar las secuencias agrícolas evaluadas, explicando las primeras dos componentes principales, CP1 y CP2, el 49,3 % y 25,4 % de la variabilidad de los datos, respectivamente. Sin embargo, según CP1 se observó la mayor confluencia de los parámetros microbianos contribuyendo en la diferenciación de las secuencias M-T/S y S-T/S. Para una mejor visualización de los resultados se realizó un análisis de conglomerados (Figura 1b). El dendograma reveló las primeras asociaciones entre las secuencias M-S y S-S, y a posterior las secuencias que contienen al cultivo de trigo (T), siendo S-T/S y M-T/S.

Referencias: Respiración microbiana (RM), perfiles fisiológicos a nivel de comunidad (CLPP), proteínas de suelo relacionadas con Glomalinas (PSRG), hidrólisis de diacetato de fluoresceína (FDA), actividad fosfatasa ácida (FA) y actividad deshidrogenasa (DHG). Soja (S), maíz (M), trigo (T).
Figura 1. Análisis de componentes principales (ACP) (a) y análisis de conglomerados basado en la distancia Euclidea (b) para los parámetros generales y funciones de las comunidades microbianas del suelo en respuesta a las secuencias agrícolas incluyendo cultivos de soja, maíz y trigo en un ensayo de larga duración, siendo los resultados un promedio de tres campañas agrícolas (2010, 2011 y 2012).
Figure 1. Principal component analysis (PCA) (a) and cluster analysis based on Euclidean distance (b) for the general parameters and functions of soil microbial communities in response to agricultural sequences including soybean, maize and wheat in a longterm trial, the results being an average of three agricultural seasons (2010, 2011 and 2012).
Parámetros químicos de suelo
El contenido de MO del suelo presentó diferencias estadísticamente significativas para M-T/S, S-T/S y M-S, siendo estas diferencias superiores respecto de la secuencia S-S (Tabla 2). S-S con el 3,77% de MO fue 14,6% inferior respecto de M-T/S. Independientemente de los tratamientos, los valores hallados para pH rondaron entre 5,5 y 7,10 demostrando ser suelos con tendencia ácida. Las diferencias registradas para el pH del suelo fueron estadísticamente significativas entre las secuencias evaluadas, siendo S-S y M-S las secuencias con un nivel de pH más próximo al neutro (Tabla 2).
Por su parte, el fósforo (P) disponible para los cultivos presentó diferencias estadísticamente significativas entre las secuencias, resultando los valores más altos para S-S y S-T/S (Tabla 2). S-S registró 2,5 y 1,8 veces más P que M-S y M-T/S, respectivamente. En relación a la disponibilidad de potasio (K), la diferencia entre secuencias resultó estadísticamente significativa, pero a diferencia de P, los valores de K fueron superiores para las secuencias con cultivo de maíz (M-S y M-T/S) (Tabla 2). Del mismo modo que para las variables biológicas, los parámetros químicos de suelo se examinaron a través de un ACP (Figura 2a). El ACP generado evidenció diferencias entre las secuencias agrícolas, explicando las primeras dos componentes principales, CP1 y CP2, el 42,7% y 25,5% de la variabilidad de los datos, respectivamente. A la derecha del eje CP1 se agruparon la mayoría de las variables, diferenciando a M-T/S y S-T/S del resto de las secuencias. Este resultado se confirmó mediante un análisis de conglomerados (Figura 2b), donde se registraron las primeras asociaciones entre las secuencias M-S y S-S, y a posterior las secuencias que contienen al cultivo de invierno (trigo)
Tabla 2. Análisis estadístico de las variables químicas del suelo, en respuesta a las secuencias agrícolas incluyendo cultivos de soja, maíz y trigo en un ensayo de larga duración, siendo los resultados un promedio de tres campañas agrícolas (2010, 2011 y 2012).
Table 2. Statistical analysis of soil chemical variables, in response to agricultural sequences including soybean, maize and wheat crops in a long-term trial, the results being an average of three agricultural seasons (2010, 2011 and 2012).

Referencias: Materia orgánica (MO), potencial de hidrógeno (pH), conductividad eléctrica (Ce), nitratos (NO3 -), contenido de fósforo (P), potasio (K) y azufre (S). Soja (S), maíz (M), trigo (T). Letras distintas por parámetro (columna) indican diferencias significativas para * (p≤0,05), *** (p≤0,001). Ns (no significativo).

Referencias: Materia orgánica (MO), potencial de hidrógeno (pH), conductividad eléctrica (Ce), nitratos (NO3 -), contenido de fósforo (P), potasio (K) y azufre (S). Soja (S), maíz (M), trigo (T).
Figura 2. Análisis de componentes principales (ACP) (a) y análisis de conglomerados basado en la distancia Euclidea (b) para las variables químicas del suelo en respuesta a las secuencias agrícolas incluyendo cultivos de soja, maíz y trigo en un ensayo de larga duración, siendo los resultados un promedio de tres campañas agrícolas (2010, 2011 y 2012).
Figure 2. Principal component analysis (PCA) (a) and cluster analysis based on Euclidean distance (b) for soil chemical variables in response to agricultural sequences including soybean, maize and wheat crops in a long-term trial, the results being an average of three agricultural seasons (2010, 2011 and 2012).
Relación entre parámetros biológicos y químicos de suelo
Para identificar la secuencia agrícola que contribuya a incrementar la actividad microbiana del suelo, en sintonía con las variables químicas edáficas, se realizó un ACP (Figura 3a), análisis de conglomerados (Figura 3b) y análisis de Procrustes generalizado (Figura 4).
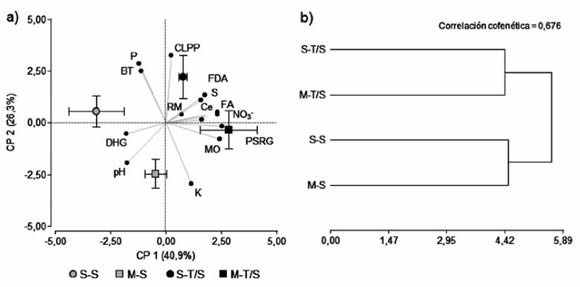
Referencias: Respiración microbiana (RM), perfiles fisiológicos a nivel de comunidad (CLPP), proteínas de suelo relacionadas con Glomalinas (PSRG), hidrólisis de diacetato de fluoresceína (FDA), actividad fosfatasa ácida (FA) y actividad deshidrogenasa (DHG).Materia orgánica (MO), potencial de hidrógeno (pH), conductividad eléctrica (Ce), nitratos (NO3-), contenido de fósforo (P), potasio (K) y azufre (S). Soja (S), maíz (M), trigo (T).
Figura 3. Análisis de componentes principales (ACP) (a) y análisis de conglomerados basado en la distancia Euclidea (b) para los parámetros generales y funciones de las comunidades microbianas, y las variables químicas del suelo en respuesta a las secuencias agrícolas incluyendo cultivos de soja, maíz y trigo en un ensayo de larga duración, siendo los resultados un promedio de tres campañas agrícolas (2010, 2011 y 2012).
Figure 3. Principal component analysis (PCA) (a) and cluster analysis based on Euclidean distance (b) for general parameters and functions of microbial communities, and soil chemical variables in response to agricultural sequences including crops of soybean, maize and wheat in a long-term trial, the results being an average of three agricultural seasons (2010, 2011 and 2012).
El análisis del conjunto de variables mediante el ACP evidenció diferencias entre las secuencias agrícolas. El ACP explicó mediante las primeras dos componentes principales, CP1 y CP2, el 40,9 % y 26,3 % de la variabilidad de los datos, respectivamente. A razón de la CP1 se observó que las secuencias S-T/S y M-T/S acompañadas por la mayoría de las variables con excepción de DHG, BT, pH y P se diferenciaron del resto de las secuencias (Figura 3a). Esto fue demostrado por medio del análisis de conglomerados, donde se observó en primer lugar la asociación entre las secuencias agrícolas conformadas por cultivos de verano, y posteriormente la asociación entre las secuencias con inclusión del cultivo invernal (trigo) (Figura 3b).
A su vez, la relación entre las variables microbiológicas y químicas fue explorada mediante análisis de Procrustes generalizado, el cual permite cuantificar el consenso entre la ordenación producida por la matriz de datos biológicos y la obtenida a partir de datos químicos (Figura 4). Como resultado de este análisis el consenso obtenido fue del 98%, dónde a partir de la CP1 (50,5%) se pudo diferenciar a S-T/S y M-T/S del resto de las secuencias consideradas de menor sustentabilidad agrícola. Mientras que la CP2 (49,5%) agrupó las secuencias que contienen al cultivo de maíz diferenciándolas del monocultivo (S-S) y de éste con la inclusión de trigo (S-T/S).

Figura 4. Análisis de Procrustes generalizado a partir de la ordenación de los parámetros biológicos y químicos del suelo en respuesta a las secuencias agrícolas incluyendo cultivos de soja, maíz y trigo en un ensayo de larga duración, siendo los resultados un promedio de tres campañas agrícolas (2010, 2011 y 2012). Referencias: soja (S), maíz (M), trigo (T).]
Figure 4. Procrustes analysis generalized from the ordering of soil biological and chemical parameters in response to agricultural sequences including soybean, maize and wheat crops in a long-term trial, the results being an average of three agricultural seasons (2010, 2011 and 2012). References: soybean (S), maize (M), wheat (T).
DISCUSIÓN
Parámetros biológicos de suelo La rotación agrícola es considerada una de las prácticas de cultivo más prometedoras en la mejora de la calidad del suelo, promoviendo la diversidad y actividad microbiana, como también la eficiencia en el ciclado de nutrientes (Pérez Brandan et al., 2014). Un bioindicador de calidad edáfica, es la respiración microbiana (RM), proporcionando una medida del potencial global de la actividad microbiana del suelo (Dick, 1994; Dutta et al., 2010). La mayor RM observada para la secuencia M-T/S, coincide con los resultados obtenidos por Pérez Brandan et al. (2014) donde la secuencia soja/maíz mostró 148 veces más actividad respiratoria que el monocultivo de poroto (Phaseolus vulgaris L.). Esto parece confirmar que la adición la mayor proporción de C proveniente del aporte de residuos en suelos bajo rotación estimula la oxidación biológica y con ello los niveles de RM.
Un método sencillo para estimar la diversidad funcional del suelo es examinar diferentes sustratos de C utilizados por la comunidad microbiana (Brackin et al., 2013). En nuestros resultados la utilización global de las fuentes de C por las comunidades microbianas del suelo (AWCD) fue superior para S-T/S. En un estudio realizado por Govaerts et al. (2007) el AWCD fue significativamente mayor para el manejo con retención de residuos y para el trigo en comparación con el maíz. Este estudio sugiere que un sistema de cultivo que incluya labranza cero y rotación de cultivos, puede aumentar la actividad y diversidad de la biomasa y microflora en general.
En el presente trabajo se evaluó la PSRG fácilmente extraíble, que suele asociarse a variaciones por efecto de las prácticas culturales. La glomalina es producida por los hongos micorrícicos arbusculares (Wright & Upadhyaya, 1996) y por sus características aglutinantes tiene íntima relación con la estabilidad de agregados del suelo, y además contribuye al secuestro de C en los agroecosistemas (Rillig et al., 2001; Rillig et al., 2002). En el ensayo se registraron los mayores valores de PSRG para M-T/S, mientras que los menores valores fueron registrados para el tratamiento en monocultivo (S-S). Del mismo modo, Preger et al. (2007) y Wright & Upadhyaya (1998) informaron que la inclusión de maíz en la rotación a largo plazo permitió un aumento en los niveles de PSRG. Además, Balota et al. (2014) observaron que el cultivo de gramíneas aumentó las PSRG en comparación con el tratamiento de leguminosas, al mismo tiempo que el menor valor de PSRG se observó en barbecho.
Los procesos biológicos son centrales para la función ecológica de los suelos, siendo un gran porcentaje de estos procesos reacciones enzimáticas. Por este motivo, el análisis de las actividades enzimáticas ha sido utilizado como un indicador de respuesta rápida a los cambios en el manejo (Benitez et al., 2006). La hidrólisis de FDA es un método ampliamente aceptado, preciso y simple para la cuantificación total de la actividad microbiana en muestras ambientales, incluyendo el suelo (Pérez Brandan et al., 2016). Por su parte, enzimas más específicas como la FA son las encargadas de la liberación de P, es decir, la transformación del P orgánico a su forma asimilable por las plantas y microorganismos, el P inorgánico (Nannipieri et al., 2011). La enzima DHG, se considera un buen exponente de las actividades oxidativas del suelo, en consecuencia tiene un papel fundamental en las etapas iniciales de descomposición de la materia orgánica. Con respecto a la cuantificación de actividades enzimáticas, FDA y FA registraron valores superiores para S-T/S y M-T/S, a diferencia de DHG que registró los mayores valores para S-S. Nuestros resultados coinciden parcialmente con los reportados por otros autores. Así por ejemplo, bajo rotación soja/maíz, FDA y DHG fueron marcadamente superiores respecto del monocultivo de la leguminosa (Pérez Brandan et al., 2016). Sobre la base de algunos ensayos (Ramos Vásquez & Zúñiga Dávila, 2008; Velmourougane et al., 2013), se conoce que la actividad DHG es sensible a pH bajos, lo que puede explicar los valores más bajos obtenidos para los tratamientos con rotación agrícola comparados con el monocultivo. Otros resultados demostraron que los cultivos de invierno aumentaron los parámetros de calidad microbiana como FA , en comparación con el barbecho, bajo una rotación de cultivos de verano (soja/maíz) (Balota et al., 2014).
El análisis de los perfiles de PLFA proporciona una información directa sobre la estructura de la comunidad microbiana activa, y se ha utilizado como método para determinar los cambios que acompañan a las diferentes perturbaciones del suelo agrícola (Hill et al., 2000). Nuestros resultados demostraron mayor BT en los sistemas agrícolas con mayor frecuencia de soja. Esta observación se contrapone a la de otros autores que registraron una BT superior en suelos con rotación agrícola en comparación con los de monocultivo de soja (Bossio et al., 2005; Pérez Brandan et al., 2016).
Parámetros químicos de suelo
El efecto de la rotación de cultivos en la MO está dado principalmente por el aporte de las raíces y la cantidad de rastrojos que se producen y se devuelven al suelo. Para la agricultura de la Pampa húmeda, Andriulo & Cordone (1998), destacaron el aporte cuantitativo de los rastrojos del cultivo de maíz frente a los de trigo y soja. En nuestro estudio se logró registrar un mayor contenido de MO en las secuencias con inclusión de gramíneas, mientras en la secuencia no diversificada (monocultivo de soja) se registró el menor valor. Estos resultados fueron coincidentes con los hallados por Pérez Brandan et al. (2014) donde el contenido de MO del suelo fue mayor en el sistema soja/maíz (144%) y monocultivo de maíz (121%) que en el monocultivo de poroto (leguminosa). A su vez, otros autores reportaron que el contenido de MO fue significativamente menor en el tratamiento con cultivo de soja continuo (Meriles et al., 2009) y con el aumento de la frecuencia del cultivo de soja en la secuencia agrícola (Novelli et al., 2011). Estos resultados se han atribuido al bajo retorno de residuos provenientes del cultivo de soja. Broder & Wagner (1988) encontraron que los residuos de soja se descomponían más rápidamente que los de maíz y trigo, lo que podría estimular la mineralización del resto de la MO del suelo (Andriulo et al., 1999). En consecuencia, la reducción o deterioro de la MO implica la posible degradación del suelo y la pérdida de su calidad, constituyendo una amenaza a la conservación de la biodiversidad y sostenibilidad de los agroecosistemas (García & Hernández, 1997).
El pH del suelo, es un importante parámetro que está relacionado con diversos aspectos químicos y biológicos de la fertilidad del suelo. El pH óptimo para la absorción de nutrientes y crecimiento de las plantas está entre 6 a 7, es decir, ligeramente ácido a neutro (Martínez et al., 2016). En general, nuestro estudio reflejo pH más ácido y un leve incremento de Ce en los suelos bajo rotación agrícola respecto al monocultivo. Otros estudios han reportado acidificación en la capa superficial bajo siembra directa y han atribuido esto a la retención de residuos en la superficie del suelo (Hickman, 2002; Houx et al., 2011). Por otra parte, el valor de pH hallado para la secuencia S-S, que fue el más cercano a la neutralidad, podría explicarse por el balance entre cationes y aniones definido como exceso de bases (EB) del material vegetal. En términos generales las monocotiledóneas (trigo y maíz) tienen menor EB que las dicotiledóneas (soja) (Pierre & Banwart, 1973). El efecto de alcalinización de los rastrojos de leguminosas fue demostrado por Tang & Yu (1999), a partir de la relación positiva hallada con el exceso de cationes y negativa con el valor de pH inicial del suelo.
Entre las propiedades químicas, el conocimiento de la disponibilidad de los nutrientes es una herramienta para evaluar el nivel de fertilidad del suelo y las relaciones suelo-planta. En Argentina y principalmente dentro de la región Pampeana, la producción agrícola se ha realizado durante casi un siglo aprovechando la fertilidad natural de sus tierras, con escasa reposición de nutrientes (Andriulo et al. 1996). Los requerimientos nutricionales de los cultivos están estrechamente relacionados con la composición del producto final. Los mayores requerimientos y extracción de nutrientes de las oleaginosas en comparación a los cereales se deben a un mayor contenido de proteínas en sus granos. Por ejemplo, el aporte de N vía fijación simbiótica cubre el 60% de las necesidades totales del cultivo de soja, mientras el 40% restante proviene del suelo en la forma aniónica de nitratos (NO3 -), siendo ésta la forma asimilable por las plantas. Para el caso del S, el menor índice de cosecha corresponde a los cereales, por sobre todo en trigo, representando los residuos orgánicos más del 90% del aporte de S en el suelo, el cual por medio de la mineralización de los residuos pasa a su forma inorgánica disponible para las plantas, los sulfatos. En nuestro estudio, los resultados obtenidos en las secuencias para NO3 - y S sin ser significativos, mostraron los mayores valores para S-T/S y M-T/S. Resultados hallados por Meriles et al. (2009), demostraron que las diferentes secuencias de cultivos estudiadas no influyeron en los NO3 - del suelo. Sin embargo, la tendencia observada en nuestro estudio podría deberse a la incorporación de las gramíneas en la rotación, ya que estas generan mayor cantidad de materia seca que sirve como reservorio de nutrientes, permitiendo por su calidad, ser mineralizados lentamente y retenidos en la materia orgánica del suelo.
En el caso de residuos con baja concentración de P, se deben a la translocación de una gran proporción de P de los tejidos vegetales al grano, por ejemplo en trigo, el 80% del contenido total de P de la planta puede trasladarse al grano durante la maduración (Batten & Khan, 1987). De esta manera, los rastrojos de cereales no harían una contribución agronómicamente significativa a la disponibilidad de P del suelo, y a su vez podrían reducir la disponibilidad de P debido a la asimilación en la biomasa microbiana (Damon et al., 2014). Lo contrario ocurre con el potasio (K), debido a que las semillas de soja son relativamente altas en K en comparación con el trigo, por lo tanto más K se elimina con el grano cosechado (Kelley et al. 2003). Esto explicaría los resultados de nuestro ensayo, dónde la disponibilidad de P resultó mayor para S-S y S-T/S, en contraposición a K que fue mayor en M-S y M-T/S. Kelley et al. (2003) observaron en los niveles de P del suelo pequeñas diferencias entre las rotaciones de cultivos, mientras que los valores finales de K del suelo fueron significativamente menores en rotaciones donde la soja se cultivaba con mayor frecuencia. Otro trabajo, registró que la disponibilidad de K presentó mayores valores en soja/maíz (178%) y en monocultivo de maíz (204%) que en el monocultivo de poroto (Pérez Brandan et al., 2014). En efecto, la contribución de los residuos de cultivos a la disponibilidad de ciertos nutrientes, es posible que sea significativa sólo en condiciones en las que se aplican grandes cantidades de residuos con concentración relativamente alta de esos nutrientes al suelo (Damon et al., 2014). De manera que, reconstruir y mantener el nivel de fertilidad del suelo implica tasas de reposición de acuerdo al ciclo y dinámica de los nutrientes, y deberá ser acompañado por una rotación de cultivos sustentable y ajustada a las condiciones de suelo, clima y prácticas como la siembra directa (Andriulo et al. 1996).
Relación entre parámetros biológicos y químicos de suelo
En el presente trabajo el análisis del conjunto de las variables demostró, a partir de la CP1 del ACP (Figura 3a), una asociación positiva entre los parámetros biológicos RM, PSRG, CLPP, FDA y FA , con el contenido de MO y la disponibilidad de los nutrientes del suelo. Éste resultado permitió diferenciar las secuencias agrícolas con inclusión del cultivo de trigo respecto de las secuencias con cultivos de verano. Por lo tanto, se puede decir que el mayor aporte de material vegetal suscitado por la rotación de cultivos tiene varios efectos positivos en el sistema productivo. A su vez, está ampliamente aceptado que los bajos contenidos en MO pueden reducir la RM y las actividades enzimáticas (Kaur et al., 2000). Esto se observó para las secuencias con cultivos de verano, principalmente el monocultivo, que se ubicaron del lado opuesto a los parámetros biológicos y químicos edáficos, con excepción de la actividad enzimática DHG, la BT, el pH y P del suelo. En consonancia con otros autores (Ramos Vásquez & Zúñiga Dávila, 2008), el ensayo realizado confirmó entre las variables DHG y pH una correlación significativa y positiva (datos no mostrados), con lo cual se puede afirmar que el pH influyó sobre la actividad de la enzima DHG, aumentando ésta a medida que el mismo se acercaba a la neutralidad. A su vez, otros autores encontraron que la abundancia relativa de taxones fúngicos estaba fuertemente relacionada con el P del suelo (Lauber et al., 2008) y que las bacterias fueron menos abundantes en suelos con pH ácido (Rousk et al., 2009).
En general los resultados obtenidos coinciden con los registrados por otros autores, por ejemplo, Nivelle et al. (2016) evaluaron los vínculos entre distintos sistemas de cultivo y la respuesta funcional de las comunidades microbianas utilizando una amplia gama de medidas químicas y biológicas del suelo. Sus resultados demostraron que cultivos de cobertura de invierno y/o labranza cero, son prácticas agrícolas sostenibles resultando en un mayor índice de calidad del suelo, con un efecto positivo en el contenido de C y N del suelo, la actividad enzimática y diversidad funcional microbiana.
CONCLUSIONES
Los parámetros biológicos y químicos del suelo evaluados por separado permitieron diferenciar el efecto mejorador de la inclusión de trigo en la rotación agrícola respecto de las secuencias basadas en cultivos de verano. El análisis en conjunto de las variables mostró también un alto consenso que ratificó la importancia de la incorporación del cultivo de invierno en la rotación, independientemente del cultivo de verano utilizado.
AGRADECIMIENTOS
Los autores agradecen al personal del laboratorio de química de suelo y agua de la EEA Marcos Juárez. A los proyectos INTA : PE PNSUELO 1134043, Convenio INTA AU DEAS CONADEV 940140, PR CORDO04 620040; extra-INTA : CONICET PIP Nº 11220150100061CO y SeCyTUNC por el aporte de los subsidios destinados al desarrollo de esta investigación.
BIBLIOGRAFÍA
1. Adam, G & H Duncan. 2001. Development of a sensitive and rapid method for measurement of total microbial activity using fluorescein diacetate (FDA) in a range of soils. Soil Biol. Biochem. 33: 943-951. [ Links ]
2. Alef, K. 1995. Soil respiration. In: Alef, K. & P Nanninpieri (eds.). Methods in Applied Soil Microbiology and Biochemistry. Pp. 214-219. Academic Press. Harcourt Brace and Company publishers, London U.K. [ Links ]
3. Andrade, JF & EH Satorre. 2015. Single and double crop systems in the Argentine Pampas: Environmental determinants of annual grain yield. Field Crop Res. 177: 137- 147. [ Links ]
4. Andriulo & Cordone. 1998. Impacto de labranzas y rotaciones sobre la materia orgánica de suelos de la región pampeana húmeda. In: Panigatti, J; H Marelli; D Buschiazzo & R Gil (eds.). Siembra directa. Pp. 65-96. Hemisferio Sur. Buenos Aires, Argentina. [ Links ]
5. Andriulo, A; J Galantini; F Abrego & F Martínez. 1996. Exportación y balance edáfico de nutrientes después de ochenta años de agricultura continua. Actas 13º Congreso Latinoamericano de la Ciencia del Suelo. Aguas de Lindoia, Sao Paulo, Brasil. [ Links ]
6. Andriulo, A; J Guérif & B Mary. 1999. Evolution of soil carbon with various cropping sequences on the rolling pampas. Determination of carbon origin using variations in natural 13C abundance. Agronomie, 19(5): 349-364. [ Links ]
7. Balota, EL; A Calegari; AS Nakatani & MS Coyne. 2014. Benefits of winter cover crops and no-tillage for microbial parameters in a Brazilian Oxisol: A long-term study. Agr. Ecosyst. Environ. 197: 31-40. [ Links ]
8. Balota, EL; A Colozzi Filho; DS Andrade & RP Dick. 2004. Long-term tillage and crop rotation effects on microbial biomass and C and N mineralization in a Brazilian Oxisol. Soil Till. Res. 77(2): 137-145. [ Links ]
9. Batten, GD & MA Khan. 1987. Uptake and utilization of phosphorus and nitrogen by bread wheats grown under natural rainfall. Aust. J. Exp. Agr. 27: 405-410. [ Links ]
10. BCR. 2017. Estimaciones de producción. Guía Estratégica para el Agro. Bolsa de Comercio de Rosario. http://www. bcr.com.ar/Pages/GEA/ (01/08/2017). [ Links ]
11. Benitez, E; R Nogales; M Campos & F Ruano. 2006. Biochemical variability of olive-orchard soils under different management systems. Appl. Soil Ecol. 32(2): 221-231. [ Links ]
12. Blanco-Canqui H; MM Mikha; DR Presley DR & MM Claassen. 2011. Addition of cover crops enhances no-till potential for improving soil physical properties. Soil Sci. Soc. Am. J. 75: 1471-1482. [ Links ]
13. Bossio DA; MS Girvan; L Verchot; J Bullimore; T Borelli; A Albrecht; KM Scow; AS Ball; JN Pretty & AM Osborn. 2005. Soil microbial community response to land use change in an agricultural landscape of western Kenya. Microb. Ecol. 49: 50-62. [ Links ]
14. Bossio, DA & KM Scow. 1998. Impacts of carbon and flooding on soil microbial communities: Phospholipid fatty acid profiles and substrate utilization patterns. Microb. Ecol. 35: 265-278. [ Links ]
15. Brackin, R; N Robinson; P Lakshmanan & S Schmidt. 2013. Microbial function in adjacent subtropical forest and agricultural soil. Soil Biol. Biochem. 57(0): 68-77. [ Links ]
16. Bray, RH & LT Kurtz. 1945. Determination of total, organic, and available forms of phosphorus in soils. Soil Sci. 59: 39-45. [ Links ]
17. Bremner, JM. 1965. Inorganic forms of nitrogen. In: CA Black (ed.). Methods of soil analysis. Part 2: Chemical and Microbiological properties. Pp 1179-1232. ASA. Madison, Wisconsin, USA. [ Links ]
18. Broder MW & GH Wagner. 1988. Microbial colonization and decomposition of corn, wheat and soybean residues, Soil Sci. Soc. Am. J. 52: 112-117. [ Links ]
19. Caviglia, OP & FH Andrade. 2010. Sustainable intensification of agriculture in the Argentinean pampas: Capture and use efficiency of environmental resources. Am. J. Plant Sci. Biotechnol. Vol 3: 1-8. [ Links ]
20. Damon, PM; B Bowden; T Rose & Z Rengel. 2014. Crop residue contributions to phosphorus pools in agricultural soils: A review. Soil Biol. Biochem. 74: 127-137. [ Links ]
21. Di Rienzo, JA; F Casanoves; MG Balzarini; L Gonzalez; M Tablada & CW Robledo. InfoStat versión 2015. Grupo Infostat, FCA, Universidad Nacional de Córdoba, Argentina. URL http://www.infostat.com.ar. [ Links ]
22. Dick, RP. 1992. A review: long-term effects of agricultural systems on soil biochemical and microbial parameters. Agr. Ecosyst. Environ. 40(1-4): 25-36. [ Links ]
23. Dick, RP. 1994. Soil enzyme activities as indicators of soil quality. In: Doran, JW; DC Coleman; DF Bezdicek & BA Stewart (eds.). Defining Soil Quality for a Sustainable Environment. SSSA Special publication Vol. 35. Pp. 107- 124. Madison, Wisconsin, USA. [ Links ]
24. Dutta, M; D Sardar; R Pal & RK Kole. 2010. Effect of chlorpyrifos on microbial biomass and activities in tropical clay loam soil. Environ. Monit. Assess. 160(1): 385-391. [ Links ]
25. Ferrari, M. 2010. ¿Nuestros actuales sistemas de producción agrícola son ambientalmente sustentables?. Informaciones Agronómicas del Cono Sur, 48: 6-10. [ Links ]
26. García, C & T Hernández. 1997. Biological and biochemical indicators in derelict soils subject to erosion. Soil Biol. Biochem. 29(2): 171-177. [ Links ]
27. García, C; MT Hernández & F Costa. 1997. Potential use of dehydrogenase activity as an index of microbial activity in degraded soils. Commun. Soil Sci. Plant Anal. 28: 123-134. [ Links ]
28. Garland, J.L & AL Mills. 1991. Classification and Characterization of Heterotrophic Microbial Communities on the Basis of Patterns of Community-Level Sole-Carbon- Source Utilization. Appl. Environ. Microb. 57(8): 2351- 2359. [ Links ]
29. Govaerts, B., M Mezzalama; Y Unno; KD Sayre; M Luna- Guido; K Vanherck; L Dendooven & J Deckers. 2007. Influence of tillage, residue management, and crop rotation on soil microbial biomass and catabolic diversity. Appl. Soil Ecol. 37(1-2): 18-30. [ Links ]
30. Hickman, MV. 2002. Long-term tillage and crop rotation effects on soil chemical and mineral properties. J. Plant Nutr. 25(7): 1457-1470. [ Links ]
31. Hill, GT; NA Mitkowski; L Aldrich-Wolfe; LR Emele; DD Jurkonie; A Ficke; S Maldonado-Ramirez; ST Lynch & EB Nelson. 2000. Methods for assessing the composition and diversity of soil microbial communities. Appl. Soil Ecol. 15: 25-36. [ Links ]
32. Houx, JH; WJ Wiebold & FB Fritschi. 2011. Long-term tillage and crop rotation determines the mineral nutrient distributions of some elements in a Vertic Epiaqualf. Soil Till. Res.112(1): 27-35. [ Links ]
33. Kaur B; SR Gupta & G Singh. 2000. Soil carbon, microbial activity and nitrogen availability in agroforestry systems on moderately alkaline soils in northern India. Appl. Soil Ecol. 15(3): 283-294. [ Links ]
34. Kelley, K; J Long & T Todd. 2003. Long-term crop rotations affect soybean yield, seed weight, and soil chemical properties. Field Crops Research, 83(1), 41-50. [ Links ]
35. Lupwayi, NZ; WA Rice & GW Clayton. 1998. Soil microbial diversity and community structure under wheat as influenced by tillage and crop rotation. Soil Biol. Biochem. 30(13): 1733-1741. [ Links ]
36. MAGYP. 2017. Ministerio de Agroindustria. Secretaría de Agricultura, Ganadería y Pesca. Estimaciones Agrícolas. Disponible en: https://datos.magyp.gob.ar/reportes. php?reporte=Estimaciones. [ Links ]
37. Martínez, I; A Chervet, A; P Weisskopf; WG Sturny; A Etana; M Stettler; J Forkman & T Keller. 2016. Two decades of no-till in the Oberacker long-term field experiment: Part I. Crop yield, soil organic carbon and nutrient distribution in the soil profile. Soil Till. Res. 163: 141-151. [ Links ]
38. Meriles, JM; S Vargas Gil; C Conforto; G Figoni; E Lovera; GJ March & CA Guzmán. 2009. Soil microbial communities under different soybean cropping systems: Characterization of microbial population dynamics, soil microbial activity, microbial biomass, and fatty acid profiles. Soil Till. Res. 103(2): 271-281. [ Links ]
39. Nannipieri P, Giagnoni L, Landi L, Renella G. 2011. Role of phosphatase enzymes in soil. In: Bünemann, E; A Oberson & E Frossard (eds.). Phosphorus in action: Biological processes in soil phosphorus cycling. Soil biology, Vol 26. Pp. 215-244. Springer, Heidelberg. [ Links ]
40. Nivelle, E; J Verzeaux; H Habbib; Y Kuzyakov; G Decocq; D Roger; J Lacouxa; J Duclercqa; F Spichera; J-E Nava- Saucedoa, M Catteroua, F Duboisa & T Tetu. 2016. Functional response of soil microbial communities to tillage, cover crops and nitrogen fertilization. Appl. Soil Ecol. 108: 147-155. [ Links ]
41. Norma IRAM- SAGyP 21322. 2006. Determinación de conductividad eléctrica en soluciones acuosas. [ Links ]
42. Norma IRAM- SAGyP 29574. 2009. Determinación del pH en suelo para uso agropecuario. [ Links ]
43. Norma IRAM-SAGyP 29570-1. 2010. Determinación de fósforo extraíble en suelos. Parte 1 - Método Bray & Kurtz 1 Modificado (Extracción con solución de fluoruro de amonio - ácido clorhídrico). [ Links ]
44. Norma IRAM-SAGyP 29571-3. 2011. Determinación de materia orgánica en suelos. Parte 3 - Determinación de carbono orgánico oxidable por mezcla oxidante fuerte y digestión en tubo de ensayo. [ Links ]
45. Novelli, LE; OP Caviglia & RJM Melchiori. 2011. Impact of soybean cropping frequency on soil carbon storage in Mollisols and Vertisols. Geoderma 167: 254-260. [ Links ]
46. Palm, C; H Blanco-Canqui, F DeClerck; L Gatere & P Grace. 2014. Conservation agriculture and ecosystem services: An overview. Agr. Ecosyst. Environ. 187: 87-105. [ Links ]
47. Pérez-Brandan, C; JL Arzeno, J Huidobro; C Conforto; B Grumberg; S Hilton; GD Bending; J Meriles & S Vargas- Gil. 2014. The effect of crop sequences on soil microbial, chemical and physical indicators and its relationship with soybean sudden death syndrome (complex of Fusarium species). Span. J. Agric. Res. 12(1): 252-264. [ Links ]
48. Pérez-Brandan, C; J Huidobro; M Galván; S Vargas-Gil & J Meriles. 2016. Relationship between microbial functions and community structure following agricultural intensification in South American Chaco. Plant Soil Environ. 62(7): 321-328. [ Links ]
49. Pierre, WH & WL Banwart. 1973. Excess-base and excessbase/ nitrogen ration of various crop species and parts of plant. Agron. J. 65: 91-96. [ Links ]
50. Power, JF. 1990. Legumes and crop rotations. In: Francis, CA; CB Flora & LD King (eds.). Sustainable agriculture in temperate zones. Pp 178-204. Wiley, NY. [ Links ]
51. Preger, AC; MC Rillig; AR Johns; CC Du Preez; I Lobe & W Amelun. 2007. Losses of glomalin-related soil protein under prolonged arable cropping: A chronosequence study in sandy soils of the South African Highveld. Soil Biol. Biochem. 39(2): 445-453. [ Links ]
52. Rillig, MC, SF Wright; KA Nichols; WF Schmidt & MS Torn. 2001. Large contribution of arbuscular mycorrhizal fungi to soil carbon pools in tropical forest soils. Plant Soil 233: 167-177. [ Links ]
53. Rillig, MC; SF Wright & V Eviner. 2002. The role of arbuscular mycorrhizal fungi and glomalin in soil aggregation: comparing effects of five plant species. Plant Soil 238: 325-333. [ Links ]
54. Rousk, J; PC Brookes & E Bååth. 2009. Contrasting soil pH effects on fungal and bacterial growth suggest functional redundancy in carbon mineralization. Appl. Environ. Microb. 75: 1589-1596. [ Links ]
55. Salado-Navarro, LR & TR Sinclair. 2009. Crop rotations in Argentina: Analysis of water balance and yield using crop models. Agr. Syst. 102: 11-16. [ Links ]
56. Satorre, EH. 2012. Recent changes in pampean agriculture: possible new avenues in coping with global change challenges. In: Slafer GA & JL Araus (eds). Crop Stress Management and Global Climate Change. Pp. 47-57. CABI Climate Change Series No. 2. [ Links ]
57. Smith, R; K Gross & G Robertson. 2008. Effects of crop diversity on agroecosystem function: Crop yield response. Ecosystems 11: 355-366. [ Links ]
58. Studdert GA & H Echeverria. 2000. Crop rotations and nitrogen fertilization to manage soil organic carbon dynamics. Soil Sci. Soc. Am. J. 64: 1496-1503. [ Links ]
59. Taboada, MA; FG Micucci; DJ Cosentino & RS Lavado. 1998. Comparison of compaction induced by conventional and zero tillage in two soils of the Rolling Pampa of Argentina. Soil Till. Res. 49: 57-63. [ Links ]
60. Tang C & Q Yu. 1999. Chemical composition of legume residues and initial soil pH determine pH change of a soil after incorporation of the residues. Plant Soil 215: 29-38. [ Links ]
61. Tang, C & Q Yu. 1999. Impact of chemical composition of legume residues and initial soil pH on pH change of a soil after residue incorporation. Plant Soil 215: 29-38. [ Links ]
62. Varela, MF; PL Fernandez; G Rubio & MA Taboada. 2011. Cover crops: effects on soil macroporosity and soil structural stability in a silt loam soil. Ciencia del Suelo 29: 99-106. [ Links ]
63. Vargas Gil, S & JR Vargas Gil. 2011. Sustainable Management of Agricultural Systems: Physical and Biological Aspects of Soil Health. In: JO Nriagu (ed.). Encyclopedia of Environmental Health. Vol. 5. Pp. 297-301. Elsevier. [ Links ]
64. Vargas Gil, S; A Becker; C Oddino; M Zuza; A Marinelli & G March. 2009. Field trial assessment of biological, chemical, and physical responses of soil to tillage intensity, fertilization, and grazing. Environ. Manage. 44(2): 378- 386. [ Links ]
65. Velmourougane, K; MV Venugopalan; T Bhattacharyya; D Sarkar; DK Pal; A Sahu; SK Ray; KM Nair; J Prasad & RS Singh. 2013. Soil dehydrogenase activity in agro-ecological sub regions of black soil regions in India. Geoderma 197: 186-192. [ Links ]
66. Walkley, A & IA Black. 1934. An examination of the Degtjareff method for determining soil organic matter, as a proposed modification of the chromic acid titration method. Soil Sci. 37: 29-38. [ Links ]
67. Wright, SF & A Upadhyaya. 1996. Extraction of an abundant and unusual protein from soil and comparison with hyphal protein of arbuscular mycorrhizal fungi. Soil Sci. 161: 575-586. [ Links ]
68. Wright, SF; A Upadhyaya & JS Buyer. 1998. Comparison of N-linked oligosaccharides of glomalin from arbuscular mycorrhizal fungi and soils by capillary electrophoresis. Soil Biol. Biochem. 30(13): 1853-1857. [ Links ]
69. Zak, JC; MR Willig; DL Moorhead & HG Wildman. 1994. Functional diversity of microbial communities: a quantitative approach. Soil Biol. Biochem. 26(9): 1101-1108. [ Links ]
70. Zelles, L. 1999. Fatty acid patterns of phospholipids and lipopolysaccharides in the characterisation of microbial communities in soil: a review. Biol. Fert. Soils 29(2): 111-129. [ Links ]














