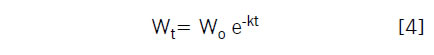Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ciencia del suelo
On-line version ISSN 1850-2067
Cienc. suelo vol.38 no.1 Ciudad Autónoma de Buenos Aires July 2020
BIOLOGÍA DEL SUELO
Dinámica de raíces y actividad biológica en secuencias de cultivos en dos tipos de suelo de la región semiárida central
Root dynamics and biological activity in different crop sequences in two soil types of the central semiarid region
María Florencia Gómez1; Elke Johanna Noellemeyer1; Ileana Frasier2-3*
1 Universidad Nacional de La Pampa. Argentina
2 INTA Anguil, Ruta 5 km 580 (6326), Anguil, La Pampa
3 Consejo Nacional de Investigaciones Científicas y Técnicas
* Autor de contacto: frasier.ileana@inta.gob.ar
Recibido: 06/05/2019
Recibido con revisiones: 29/09/2019
Aceptado: 29/09/2019
RESUMEN
El objetivo fue estudiar el efecto de la inclusión de cultivos de cobertura (CC) en la rotación sobre la dinámica de raíces y la actividad biológica en dos tipos suelo de la región semiárida central (Entisol y Molisol). Las actividades se realizaron en ensayos de larga duración establecidos en 2010 dentro de la Estación Experimental "Guillermo Covas" INTA Anguil bajo siembra directa. Los tratamientos fueron: maíz-centeno (C), maíz-centeno consociado con vicia (VC), maíz-vicia (V) y un testigo sin CC (T). El diseño experimental fue en bloques completamente aleatorizados con 4 réplicas. Se determinó la biomasa aérea (BA) y de raíces (BR) de los cultivos, su distribución y calidad, humedad edáfica, temperatura del suelo y actividad biológica en tres momentos de muestreo (momento de corte del maíz (tiempo 0), a los 129 y 174 días posteriores). Incluir CC representó un aporte extra de C al suelo. Los tratamientos con centeno aportaron más residuos aéreos y de raíces que la vicia. El contenido de Nraíces de los CC varió entre 21 y 108 kg ha-1. La pérdida de C de raíces de maíz ajustó a un modelo exponencial negativo con tasas de descomposición en los primeros 20 cm de 39,7 y 29,5 kg C ha-1 día-1 para el Entisol y Molisol. Los CC estimularon la actividad biológica a través del aporte de sus raíces y este efecto fue mayor cuando la vicia fue incluida en la secuencia de cultivos en ambos suelos.
Palabras claves: descomposición, actividad deshidrogenasa, cultivos de cobertura.
ABSTRACT
The objective was to study the effect of cover crop (CC) inclusion on root dynamic and biological activity in two soils with contrasting granulometry of the central semiarid pampa region (Entisol and Mollisol). The activities were carried out in long-term trials stablished in 2010 in the Experimental Station "Guillermo Covas" INTA Anguil under no-till. Treatments were: corn-rye (C), corn-vetch (V), corn-rye+vetch (VC) and a control without CC (corn-corn). Experimental design was completely randomized blocks with 4 replicates. Aerial biomass (BA), root biomass (BR), root distribution and quality, soil water content, soil temperature and biological activity were determined at three sampling moments: at the time of silage corn cutting (time 0), 129 and 174 days later. Including CC represented an extra C input into soil. Treatments with rye contributed with more aerial and root residues, and were more efficient in water use than vetch. Root N content of CC varied between 21 y 108 kg ha-1. Corn root-C dynamic fitted to a negative exponential model with decomposition rates in the first 20 cm of 39,7 y 29,5 kg C ha-1 day-1 for Entisol and Mollisol. Cover crops stimulated soil biological activity through their root inputs, and this effect was stronger when vetch which was included in the crop sequence in both soils.
Key words: decomposition, dehydrogenase activity, cover crops.
INTRODUCCIÓN
En Sudamérica, el proceso de agriculturización, definido como el uso creciente y continuo de las tierras para cultivos agrícolas en lugar de usos ganaderos o mixtos (Zach et al., 2006; Coutinho et al., 2014), y la intensificación de los sistemas productivos han impactado negativamente sobre la salud de los suelos. El desbalance entre las altas tasas de extracción de nutrientes (producto de la cosecha de los cultivos), la pérdida de carbono (C) por excesiva mineralización como consecuencia de las labranzas, y los escasos aportes de residuos ha disminuido los contenidos de materia orgánica y reducido la actividad biológica de los suelos (Figuerola et al., 2012; Kong & Six, 2012). Este escenario plantea como desafío la búsqueda de estrategias de manejo que mitiguen los efectos negativos de la agricultura para la recuperación y conservación del recurso suelo para las generaciones futuras.
Los actuales sistemas de producción agrícola producen la degradación de los suelos, con importantes pérdidas de materia orgánica, biomasa microbiana y diversidad de las poblaciones microbianas (Pereira da Silva et al., 2010; Figuerola et al., 2012; Frasier et al., 2016c). A pesar de la introducción de sistemas de siembra directa en los cuales se minimizan las pérdidas de materia orgánica por mineralización (Fernández et al., 2010), los aportes de residuos de los cultivos en estos sistemas de monocultura aparentemente no son suficientes para contrarrestar los procesos de degradación, especialmente en zonas semiáridas, donde dichos procesos se producirían a una tasa mayor que en zonas húmedas o subhúmedas (Quiroga et al., 2014). Los cultivos de cobertura han surgido como una alternativa para mitigar el efecto de la monocultura (Ding et al., 2006; Fernández et al., 2012; Poeplau & Don, 2015) suponiendo una intensificación más sustentable del sistema de producción (Duval et al., 2016; Pinto et al., 2017).
Recientemente se ha planteado que la biomasa de raíces contribuye en mayor proporción con la formación de materia orgánica de los suelos que la biomasa aérea (Kong & Six, 2010; Kätterer et al., 2011). Según plantean los nuevos modelos conceptuales, esto sería debido al íntimo contacto de las raíces con la matriz del suelo (Schmidt et al., 2011; Cotrufo et al., 2013) ya que los exudados radiculares constituyen la fuente de sustrato más importante para mantener o aumentar la biomasa microbiana (Kuseliene et al., 2014; Frasier et al., 2016c) y la diversidad microbiológica en el suelo (McDaniel et al., 2014; Frasier et al., 2016b), influyendo sobre el ciclado de nutrientes y la estructura del suelo (Kravchenko et al., 2015; Paul, 2016; Oderiz et al., 2017).
La inclusión de cultivos de cobertura en la rotación representa no sólo un aporte extra de C debido a su biomasa de raíces, sino también de los exudados liberados al suelo por rizodeposición que pueden ser equivalentes al 50% del C de la biomasa de raíces (Jones et al., 2009). En términos de N, el aporte por rizodeposición puede variar entre el 15 y 96% del contenido en la biomasa de raíces (Wichern et al., 2008) y representar una importante fuente de energía y N para los microorganismos del suelo (Kuzyakov & Domanski, 2000; Kong & Six, 2012; Frasier et al., 2016c). Por lo tanto, conocer la dinámica de las raíces resulta fundamental para una mejor comprensión del impacto de las estrategias de manejo sobre los procesos ecológicos que ocurren dentro del suelo.
La elección de la especie a utilizar como cultivo de cobertura condicionará la cantidad y calidad de los residuos aportados al sistema tanto sobre como dentro del suelo. En términos generales, las gramíneas aportan residuos con una concentración de N de 0,9 a 1,3% con relaciones C/N que pueden variar entre 25 y 40. Por el contrario, los residuos de leguminosas pueden presentar una concentración de N superior al 2%, dependiendo de la eficiencia de fijación biológica de N, logrando relaciones C/N de 12-16 (Decker et al., 1994; Ranells & Wagger, 1997). Estudios recientes han mostrado que la utilización de centeno como cultivo de cobertura podría favorecer la inmovilización de N en secuencias con sorgo o maíz, afectando la disponibilidad de N mineral para el cultivo sucesor (Poeplau & Don, 2015; Frasier et al., 2016b). En ese sentido, se han propuesto valores entre 25 y 30 de relación C/N como umbrales entre la mineralización neta y la inmovilización de N (Allison, 1966). Por el contrario, la inclusión de leguminosas estimularía los microorganismos del suelo facilitando la descomposición de los residuos aportados al suelo (Urquiaga et al., 2002; Frasier et al., 2016c), y con esto, la mineralización de N. Por este motivo la inclusión de leguminosas podría incrementar el riesgo de lixiviación de N si no se sincroniza su disponibilidad (mineralización) con la demanda del cultivo sucesor (Zotarelli et al., 2009).
La estrategia de manejo impactará directamente sobre la cantidad, calidad y distribución de raíces en el perfil. En ese sentido, la inclusión de vicia en la rotación contribuiría con raíces con alta concentración de nitrógeno por el aporte de fijación biológica, que estimularán aún más la actividad biológica, favoreciendo la transformación de los residuos de raíces del cultivo antecesor. Se ha comprobado una relación directa entre la biomasa de raíces y la biomasa microbiana del suelo (Liang et al., 2002; Frasier et al., 2016c). Por lo tanto, asegurar la presencia de raíces durante todo el año como consecuencia de intensificar la rotación por el uso de cultivos de cobertura, permitiría mantener una rizósfera activa en el suelo durante todo el año, con altos niveles biomasa microbiana y alta actividad biológica (Mbuthia et al., 2015; Ladoni et al., 2016). Además, estudios recientes evidencian una relación lineal y positiva entre el contenido de N de raíces y la disponibilidad de nitratos en el suelo en el muy corto plazo (Oderiz et al., 2017), poniendo de manifiesto la importancia del estudio de su contribución para el desarrollo del cultivo sucesor como también para la acumulación y estabilización de la materia orgánica del suelo (Kirkby et al., 2013, 2014). Estos antecedentes ponen en evidencia la necesidad de profundizar el estudio de las raíces y su contribución a la sustentabilidad de los sistemas agrícolas de la región semiárida pampeana.
El objetivo del trabajo fue estudiar el efecto de la inclusión de cultivos de cobertura en la rotación sobre la dinámica de raíces y la actividad biológica en dos tipos de suelo de la región semiárida central.
MATERIALES Y MÉTODOS
Sitios experimentales:
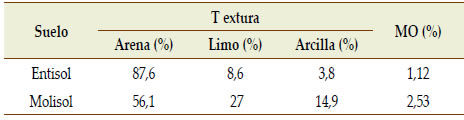
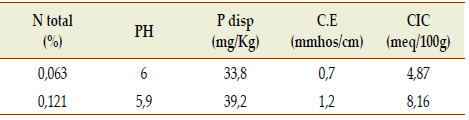
Las actividades se llevaron a cabo en el año 2017 dentro de la Estación Experimental "Guillermo Covas" INTA Anguil, ubicada en la Provincia de La Pampa, en dos tipos de suelo. El primer suelo fue un Ustipsamment típico de textura arenosa sin limitaciones en profundidad y con influencia de una capa freática somera. El segundo suelo fue un Paleustol petrocálcico de textura franco arenosa con limitaciones en profundidad por presencia de un manto calcáreo a partir de los 80 cm. Las principales características de los suelos se presentan en la Tabla 1.
Tabla 1. Propiedades edáficas de los suelos bajo estudio (Molisol y Entisol).
Table 1. Edaphic properties of soils under study (Mollisol and Entisol).
En ambos suelos se llevan a cabo ensayos de larga duración, desde el año 2010, con secuencias de cultivo que incluyen maíz para silo (Zea mays L.) sin y con inclusión de cultivos de cobertura a base de centeno (Secale cereale L.) y vicia (Vicia villosa sp. dasycarpa) bajo siembra directa. Los tratamientos evaluados corresponden a las siguientes secuencias de cultivo: maíz-centeno (maíz-C), maíz-vicia (maíz-V), maízcenteno+ vicia (maíz-VC), y un testigo sin cultivo de cobertura o barbecho largo (maíz-maíz). El diseño experimental es en bloques completamente aleatorizados con cuatro réplicas con un tamaño de parcela de 50 m2. La siembra de los cultivos de cobertura se realiza anualmente a mediados de abril con un distanciamiento entre hileras de 17 cm y una densidad de siembra de 200 semillas m-1 lineal. El secado de los cultivos de cobertura se realiza normalmente en octubre mediante una pulverización combinada con glifosato (3 L ha-1) y ácido 2,4-diclorofenoxiacético (400 gr 2,4 D ha-1 en 100 L de agua). El cultivo de maíz se siembra a principios de diciembre con una densidad de 55000 plantas ha-1, un distanciamiento entre hileras de 70 cm y su producción se destina para silo.
Determinaciones:
Se seleccionaron tres momentos diferentes del crecimiento de los cultivos de la rotación donde se esperaba la mayor contribución de raíces de las especies intervinientes:
a) el momento de corte del maíz para silo coincidente con la siembra de los cultivos de cobertura (tiempo 0).
b) al inicio de espigazón del centeno/ vicia en estado vegetativo ("roseta") (agosto) correspondiente a los 129 días posteriores a la siembra de los cultivos de cobertura, y
c) a la finalización del ciclo de crecimiento de los cultivos de cobertura/ vicia en inicio de floración (octubre) correspondiente a los 174 días posteriores a la siembra de los cultivos de cobertura.
Biomasa aérea y de raíces de los cultivos en la rotación
En las diferentes fechas de muestreo se realizaron cortes de biomasa aérea de los cultivos utilizando un aro de 0,25 m2. Las mismas se llevaron de inmediato al laboratorio donde fueron pesadas y colocadas en estufa a 60 ºC por 72 hs o hasta lograr su peso constante, y se calculó la producción de materia seca total de cada tratamiento en los diferentes momentos de muestreo. Las muestras fueron molidas y se determinó la concentración de C y N por combustión seca (LECO).
El muestreo de raíces se realizó de acuerdo con la metodología propuesta por Frasier et al. (2016a) hasta el metro de profundidad o la presencia de tosca en estratos de 20 cm. El mismo consiste en trazar una transecta al azar en cada parcela, perpendicular entre dos líneas de siembra donde se realizan 4 piques equidistantes utilizando un barreno tubular de 3,2 cm de diámetro interno, de manera tal que, el primer y último pique coincida con las líneas de siembra del cultivo. Las muestras de suelo recolectadas fueron colocadas inmediatamente en bolsas de plástico y conservadas a -20°C hasta el momento del lavado para la obtención de raíces. La separación de las raíces del suelo se realizó mediante el lavado con agua a presión a través de un tamiz de 250 μm, recuperando las raíces retenidas en dicho tamiz utilizando una pinza metálica. Las muestras fueron secadas en estufa a 40°C durante 48 hs y se registró su peso seco. Por otra parte, las muestras de raíces obtenidas se procesaron por molienda y se determinaron sus concentraciones de carbono y nitrógeno (C y N) por combustión seca (LECO).
Para el cálculo de la biomasa de raíces totales se determinó el porcentaje de influencia del entresurco (IES: 0,7) y la línea de siembra (ILS: 0,3) a partir del distanciamiento entre hileras de los cultivos y el diámetro de la barreno (Frasier et al., 2016a). La biomasa de raíces en el entresurco (BRES) y la línea de siembra (BRLS) se calcularon a partir de las siguientes ecuaciones:
La biomasa de raíces totales (BRT) se obtuvo a partir de la suma de la biomasa de raíces en la línea de siembra y el entresurco.
A partir de estos datos se calculó el cociente entre la biomasa de raíces y la biomasa aérea.
Dinámica de descomposición de raíces:
Se aplicó el modelo exponencial propuesto por Olson (1963) para describir la dinámica de descomposición de raíces en el perfil de suelo de la secuencia maíz-maíz.
Donde:
Wt= peso seco del residuo en el tiempo (t)
Wo= peso seco inicial
t = tiempo (días)
k = coeficiente de descomposición
El tiempo estimado para la descomposición del 50% del material vegetal se determinó mediante la siguiente ecuación (Chimney & Pietro, 2006):
Actividad biológica del suelo
Se determinó la actividad enzimática deshidrogenasa (DHA) mediante el método de Sajjad et al. (2002) adaptado de Casida (1977). El procedimiento constó de una incubación de 3 g de suelo con el agregado de 1 ml de la solución de 2,3,5-cloruro de trifeniltetrazolio (TTC) al 3% y 4 ml de buffer (buffer Tris 0,1M, pH= 7,6-7,8) a 37°C por 24 h. Al finalizar la incubación, se agregaron 10 ml de acetona para detener la reacción y se agitó durante 30 minutos a 300 rpm. Por último, las muestras se centrifugaron por 5-6 minutos a 2000 rpm y luego se realizó la filtración del sobrenadante con papel de filtro. Se midió la absorbancia a 485 nm para determinar la concentración de trifenilformazán (TPF) mediante un Espectrofotómetro Metrolab 1600 Plus, a partir de una curva de calibrado que fue preparada previamente y cuya concentración se optimizó para cada tipo de suelo (TPF 0,1%). La actividad deshidrogenasa se estimó utilizando la siguiente ecuación:
Dónde:
AS: absorbancia del suelo
AB: absorbancia del blanco
FC/A: factor que relaciona concentración (C) y absorbancia
(A) (FC/A= 1/pendiente de la recta) (μg TPF).
S: peso del suelo seco a estufa (105 ºC) (g)
T: tiempo de incubación (hs)
Temperatura y humedad del suelo:
Las mediciones de temperatura del suelo se realizaron utilizando termómetros digitales (-50 a 150 ºC, Luft Germany) a intervalos de 20 cm hasta el metro de profundidad o la presencia de tosca. La humedad edáfica se determinó por el método gravimétrico. A partir de ambas variables se calculó el cociente entre temperatura y humedad edáfica.
Análisis estadístico:
Los resultados fueron analizados mediante ANOVA utilizando modelos lineales mixtos. Las medias fueron comparadas mediante Test de Fisher (α < 0,05). La biomasa total de raíces fue transformada al logaritmo natural para asegurar la distribución normal de los datos. Los resultados presentados corresponden a las medias retransformadas. Se realizaron regresiones lineales simples entre la actividad enzimática y el cociente entre temperatura y humedad edáfica. La relación entre la actividad biológica y el contenido de C de las raíces se ajustó al modelo racional y= (a+bx)/(1+cx+dx2) (Archontoulis & Miguez, 2015). El software estadístico utilizado fue el InfoStat (Di Rienzo et al., 2017).
RESULTADOS Y DISCUSIÓN
Efecto acumulado de la secuencia de cultivos sobre los contenidos de C de raíces de maíz
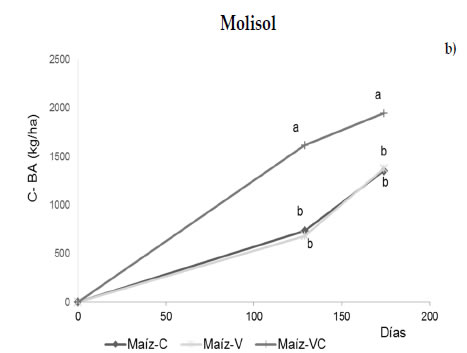
Los resultados muestran que no hubo diferencias significativas en la productividad radical de maíz luego de 7 años de efecto acumulado del manejo, excepto en la biomasa de raíces de la secuencia maíz-VC en el Molisol (Figura 1a y b). Los valores de stock de raíces de maíz encontrados, variaron entre 1460 y 3880 kg C ha-1, fueron consistentes con estudios previos (Dos Santos et al., 2011; Mazzilli et al., 2015). Además, la relación entre el C de raíces y C de la biomasa aérea (BR/BA) mostró cambios entre secuencias de cultivo con un valor promedio de 53% en el Molisol y del 50% en el Entisol (Figura 1). Este indicador presentó una tendencia en aumento cuando se incluyeron cultivos de cobertura, probablemente asociado a la presencia continua de raíces durante el año. En ese sentido, los valores más altos se encontraron en la secuencia maíz-VC con magnitudes promedio de 0,72 para el Entisol y 0,70 para el Molisol. Sin embargo, la determinación de raíces a campo supone una limitante para la interpretación de los factores condicionantes de esta variable (BR/BA) como indicador de partición en la planta como muchos estudios abordan bajo condiciones controladas (Poeplau & Kätterer, 2017), ya que no se puede identificar el origen de las raíces más finas que se recolectan y una gran proporción podrían no pertenecer al cultivo presente (Hirte et al., 2017). Se ha sugerido que el aporte continuo de raíces durante todo el año podría constituir una estrategia que se asemeje al efecto positivo que las especies perennes ejercen sobre el suelo de acuerdo con el paradigma de intensificación ecológica (Doré et al., 2011). Sin embargo, los resultados de esta experiencia no muestran un efecto acumulativo de residuos dentro del suelo. Si bien estudios previos realizados en los mismos sitios habían evidenciado un efecto acumulativo de raíces en los primeros 6 cm de suelo por incluir cultivos de cobertura en la rotación, con mejoras en los niveles de C del suelo, estos cambios no fueron observados cuando la profundidad de estudio fue 0-20 cm (Frasier et al., 2016c, 2019a). Los autores sugieren que el efecto acumulado de la inclusión de cultivos de cobertura en la rotación, en el mediano plazo, constituiría una estrategia para desacelerar la perdida de materia orgánica del suelo mitigando el impacto negativo de la monocultura.
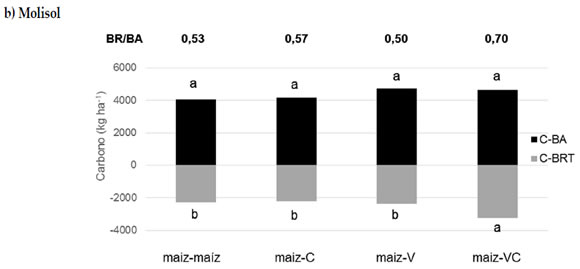
Figura 1. Contenidos de C de la biomasa aérea de maíz (C-BA, kg ha-1) y de sus raíces al metro de profundidad (C-BRT, kg ha-1) en diferentes secuencias de cultivo establecidas en 2010 para dos tipos de suelo: a) Entisol y b) Molisol. Los tratamientos corresponden a: maíz-centeno (C), maíz-vicia (V), maíz-vicia+centeno (VC) y un testigo sin cultivo de cobertura (maíz-maíz). Las letras indican diferencias significativas entre tratamientos para cada suelo (P < 0,05).
Figure 1. Corn aerial biomass-C (C-BA, kg ha-1) root-C up 1 m depth (C-BRT, kg ha-1) in different crop sequences stablished in 2010 and two soil types: a) Entisol and b) Mollisol. Treatments correspond to: corn-rye (C), corn-vetch (V), corn-vetch+rye (VC) and a control without cover crop (corn-corn). Letters indicate significant differences between treatments for each soil (P < 0,05).
Cambios en los stocks de C de raíces por inclusión de los cultivos de cobertura
Los resultados indicaron que el centeno fue la especie que aportó los mayores volúmenes de C de su biomasa aérea destacándose con los valores más altos cuando se utilizó consociado con la vicia. Además, la velocidad de desarrollo (pendiente de la acumulacion de biomasa) de la gramínea en los primeros 129 dias del ciclo fue superior en el Molisol comparado con el Entisol, asociado probablemente a su fertilidad física, química y biológica (Figura 2a y b). Estas diferencias en productividad entre las especies utilizadas como cultivos de cobertura y tipos de suelo ya han sido reportadas en trabajos anteriores (Ranells & Wagger, 1996; Zotarelli et al., 2009; Álvarez et al., 2013).
La inclusión de cultivos de cobertura también representó un aporte extra de C de su biomasa de raíces, así como también, de los exudados liberados al suelo por rizodeposición, que pueden ser equivalentes al 50% del C de la biomasa de raíces (Jones et al., 2009). Los resultados mostraron que la variación en el corto plazo del stock de C de raíces al metro de profundidad de suelo estuvo condicionada por la secuencia de cultivos mostrando una tendencia general a disminuir durante los primeros 129 días (Figura 2c y d). El monocultivo de maíz demostró una rápida caída del C de raíces durante los primeros 129 días del periodo de barbecho mientras que hacia los 174 días de dicho periodo se estabilizó en el Entisol y continuó disminuyendo a una tasa menor en el Molisol, observándose los valores más bajos de C en estos momentos. Por el contrario, incluir los cultivos de cobertura generó un aporte extra de C de raíces durante su ciclo de crecimiento, y los mayores contenidos de C de raíces se observaron cuando se incluyó centeno solo o consociado con vicia en la rotación. La caída de los contenidos de C de raíces observada a los 129 días de la cosecha de maíz también se vio reflejada en las otras secuencias de cultivo con excepción de la secuencia maíz-centeno, que en el Entisol mostró cambios mínimos en el tiempo. Esta variación del C de raíces reflejó un saldo neto en cada tiempo de muestreo y fue el resultado combinado del aporte por crecimiento radical y de la perdida por descomposición producto de la actividad biológica. En ese sentido, los resultados reflejaron una rápida dinámica de las raíces en el suelo que aun con el aporte de los cultivos de cobertura no resultó ser suficiente para alcanzar los niveles de C inicial que había dejado remanente por el maíz, excepto en la secuencia maíz-centeno en ambos tipos de suelo. Esta rápida dinámica de los residuos de raíces en el corto plazo podría explicar la falta de efectos acumulados por el aporte de raíces todo el año, y además refuerza el concepto de la relación directa entre la disponibilidad de sustrato proveniente de las raíces, la actividad microbiana y el secuestro de carbono (Loeppmann et al., 2016; Frasier et al., 2019b).
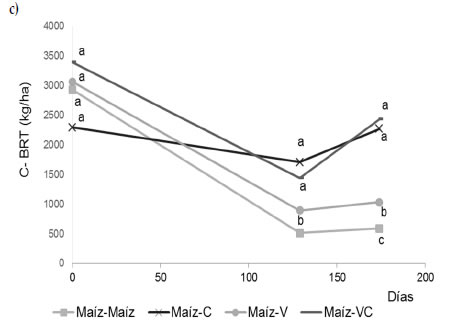
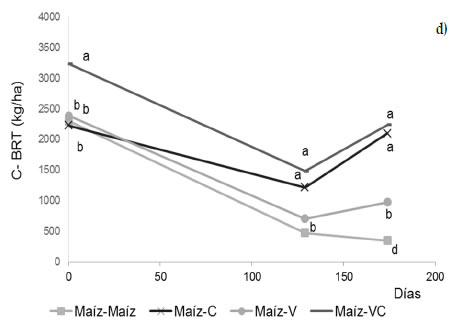
Figura 2. Carbono de la biomasa aérea (a, b) y de raíces (c, d) (kg ha-1) a los 0, 129 y 174 días desde la siembra de los cultivos de cobertura en dos tipos de suelo: Entisol (a, c) y Molisol (b, d). Los tratamientos corresponden a secuencias de cultivo establecidas en 2010: maíz-centeno (C), maíz-vicia (V), maíz-vicia+centeno (VC) y un testigo sin cultivo de cobertura (maíz-maíz). El tiempo 0 es coincidente con el momento de corte del maíz para silo. Las letras indican diferencias significativas entre tratamientos para cada suelo y fecha de muestreo (P < 0,05).
Figure 2. Aerial biomass-C (a, b) and root-C (c, d) (kg ha-1) at 0, 129 and 174 days from seeding of cover crops in two soils with contrasting granulometry: Entisol (a, c), and Mollisol (b, d). Treatments corresponded to crop sequences stablished in 2010: corn-rye (C), corn-vetch (V), corn-vetch+rye (VC) and a control without cover crop (corn-corn). Time 0 is coincident with corn cut for silage. Letters indicate significant differences between treatments for each soil type and sampling time (P < 0,05).
Cambios en los stocks de N de raíces al metro de profundidad en la rotación
Los resultados mostraron que las secuencias con vicia (maíz-V y maíz-VC) presentaron los niveles más altos de N de raíces en maíz en ambos tipos de suelo, comprobando mayores niveles de N el sistema (Figura 3a y b). En ese sentido, la inclusión de leguminosas en la rotación contribuiría con mayores niveles de N en el suelo como consecuencia del aporte de N a las raíces por fijación biologica. Para esta experiencia, la vicia presentó concentraciones superiores al 2,5% de N en sus tejidos respecto de la gramínea (0,8-1,2%). Estudios realizados recientemente indican que la contribución por fijación biológica de N en vicia puede alcanzar valores equivalentes al 60% del N total de la planta (Enrico et al., 2018). La mayor disponibilidad de N en el sistema también se vio reflejada en los mayores contenidos de N de la biomasa aérea de maíz cuando participó la vicia en la secuencia de cultivos (maíz-V) en el Molisol. Por otra parte, los contenidos más bajos de N de raíces de maíz se observaron en las secuencias con centeno sin diferencias significativas con la monocultura en el Entisol, asociado probablemente con una menor disponibilidad de N mineral en el sistema como consecuencia de la rotación de dos gramíneas (Frasier et al., 2017). Los mecanismos que explicarían esto serían una alta eficiencia de absorción de N de las gramíneas, la liberación de factores inhibidores de la nitrificación en centeno (Subbarao et al., 2007) y el aporte de residuos de baja calidad sobre y dentro del suelo, limitando la actividad biológica y favoreciendo el proceso de inmovilización de N en el suelo (Ocio et al., 1999; Hadas et al., 2004; Fernández et al., 2012). A los 129 días posteriores al corte del maíz, los contenidos de N de raíces mostraron variaciones mínimas entre secuencias de cultivo en el Entisol (60 kg N ha-1 en promedio; Figura 3c) mientras que en el Molisol las diferencias se observaron entre las secuencias maíz-VC (57 kg N ha-1) y maíz-maíz (33 kg N ha-1) (Figura 3d). A los 174 días, y coincidente con la finalización del ciclo de los cultivos de cobertura, el contenido de N de raíces varió entre 21 y 108 kg ha-1 con los valores más altos en las secuencias con centeno solo y consociado con vicia (Figura 3e y f).
Considerando que aproximadamente el 90% de la productividad aérea del maíz se exporta del sistema por cosecha mecánica, siendo equivalente a 80 kg N ha-1 en promedio para esta experiencia, los cultivos de cobertura a base de vicia podrían ser una estrategia para reponer la extracción de N del sistema en manejos intensificados (silaje continuo). Sin embargo, el uso de vicia sola plantea el desafío de lograr gestionar más eficientemente el N para los suelos de la región (Frasier et al., 2017; White et al., 2017).
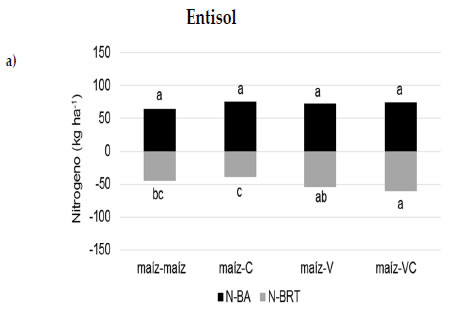

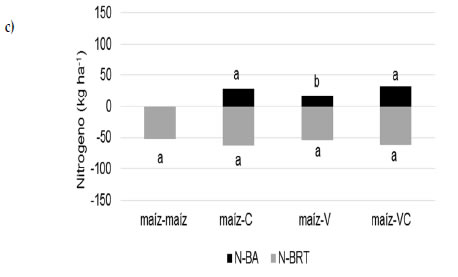

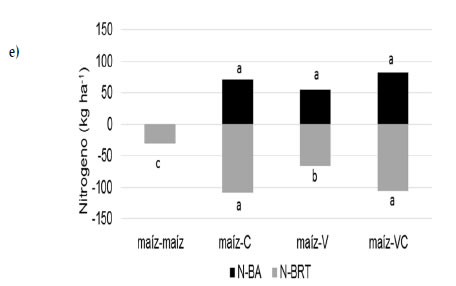

Figura 3. N-raíces (kg ha-1) a los 0 (A, B), 129 (C, D) y 174 días (e, f) desde la siembra de los cultivos de cobertura en el Entisol (a, c, e) y Molisol (b, d, f). Los tratamientos corresponden a secuencias de cultivo establecidas en 2010: maíz-centeno (C), maíz-vicia (V), maíz-vicia+centeno (VC) y un testigo sin cultivo de cobertura (maíz-maíz). El tiempo 0 es coincidente con el momento de corte del maíz para silo. Las letras indican diferencias significativas entre tratamientos para cada suelo (P<0,05).
Figure 3. Root-N (kg ha-1) at 0 (a, b), 129 (c, d) and 174 days (e, f) from cover crop seeding in the Entisol (a, c, e) and Mollisol (b, d, f). Treatments correspond to crop sequences stablished in 2010: corn-rye (C), corn-vetch (V), corn-vetch+rye (VC) and a control without cover crop (corn-corn). Time 0 is coincident with corn cut for silage. Time 0 is coincident with corn cut for silage. Letters indicate significant differences between treatments for each soil type P<0,05).
Patrones de distribución de C raíces en la rotación
Los resultados muestran cambios en el patrón de distribución superficial de raíces de maíz según el tipo de suelo (Figura 4a y b). El patrón más estratificado observado en el suelo de textura gruesa estaría asociado probablemente a una mayor macroporosidad del suelo (Kooistra et al., 1992). Además, las secuencias de cultivo presentaron diferentes contenidos de C de raíces de maíz en los primeros 20 cm, observándose los valores más altos en la rotación maíz-VC (el tratamiento es maiz-VC) en ambos suelos (2978 kg C ha-1 en el Entisol y 2651 kg C ha-1 en el Molisol). Por debajo de los 20 cm, no se observaron diferencias significativas entre secuencias de cultivo en ambos suelos. Si bien la profundidad efectiva de raíces de maíz puede superar los 2 m (Saks et al., 2014), no se observaron aparentes restricciones por la presencia del manto calcáreo en el Molisol siendo que el espesor de suelo explorado por las raíces podría ser otra de las variables condicionantes.



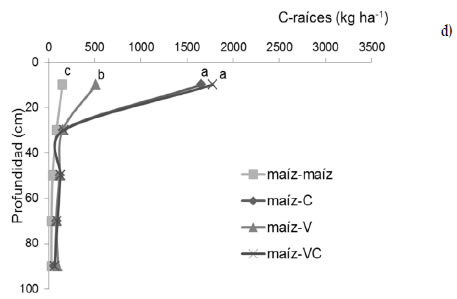
Figura 4: Distribución de C de las raíces al momento de corte del maíz para silo (a, b) y a los 174 días posteriores (c, d) en el Entisol (a, c) y Molisol (b, d). Los tratamientos corresponden a secuencias de cultivo establecidas en 2010: maíz-centeno (C), maíz-vicia (V), maíz-vicia+centeno (VC) y un testigo sin cultivo de cobertura (maíz-maíz). Las letras indican diferencias significativas entre tratamientos para cada suelo (P<0,05).
Figure 4: Root-C distribution in soil profile at corn cut for silage (a, b) and 174 days after (c, d) in the Entisol (a, c) and Mollisol (b, d). Treatments correspond to crop sequences stablished in 2010: corn-rye (C), corn-vetch (V), corn-vetch+rye (VC) and a control without cover crop (corn-corn). Letters indicate significant differences between treatments for each soil type (P<0,05).
La inclusión de los cultivos de cobertura generó cambios en el corto plazo en los contenidos de C de raíces en los primeros 20 cm del perfil producto del desarrollo de sus raíces (Figura 4 c y d). Para ambos suelos, el centeno solo o consociado presentó una mayor estratificación de raíces en los primeros 20 cm del perfil similar a lo observado para maíz. Estos resultados muestran la influencia que tienen las gramíneas en general sobre este estrato de suelo asociado a su típico sistema radical en cabellera.
Dinámica del C y N de raíces en el monocultivo de maíz en los diferentes estratos de profundidad
La descomposición del C de raíces en el monocultivo ajustó a un modelo exponencial negativo propuesto por Olson (1963) para los estratos 0-20, 20-40 y 40-60 cm de profundidad. Los resultados indicaron que los dos suelos partieron de niveles iniciales diferentes de C de raíces de maíz (2646 y 1848 kg ha-1 para el Entisol y Molisol, respectivamente) mostrando una caída durante el período de barbecho de 39,7 kg C ha-1 día-1 en el Entisol y 29,5 kg C ha-1 día-1 en el Molisol en los primeros 20 cm del perfil del suelo (Figura 5a). Sin embargo, las constantes de descomposición de raíces (k) para cada tipo de suelo fueron similares (0,015 y 0,016 días-1 para el Entisol y Molisol respectivamente), y, por lo tanto, también los tiempos estimados para que ocurra el 50% de la descomposición del C de raíces (46 días para el Entisol y 43 días para el Molisol). Aunque se esperaría que la descomposición fuera más acelerada en el Entisol, debido a su mayor macroporosidad y aireación, otros autores ya han reportado que no existiría diferencia entre tipos de suelos (Silver & Miya, 2001).

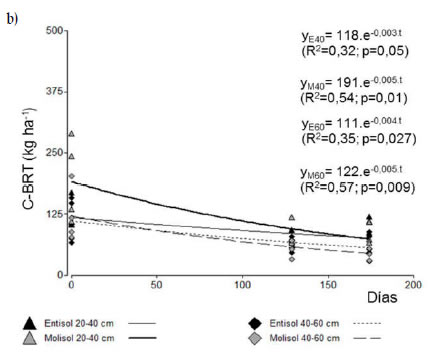
Figura 5. Variación temporal del C de las raíces de maíz en las profundidades 0-20 cm (a), 20-40 y 40-60 cm (b) para el Entisol y Molisol.
Figure 5. Corn root-C temporal variation in the soil at depths 0-20 cm (a), 20-40 y 40-60 cm (b) for the Entisol and Mollisol.
Por debajo de los 20 cm de profundidad las velocidades medias de descomposición de raíces fueron muy inferiores a las observadas en los primeros 20 cm, aunque superiores en el Molisol (0,95 y 0,73 kg C ha-1 día-1 en el estrato de 20- 40 y 40-60 cm) respecto del Entisol (0,35 y 0,44 kg C ha-1 día-1 en el estrato de 20-40 y 40-60 cm) (Figura 5b). Los tiempos estimados para que ocurra la descomposición del 50% del C de raíces aumentó considerablemente con la profundidad, registrándose valores de 118 y 111 kg C ha-1 para los estratos 20-40 cm y 40-60 cm en el Entisol, mientras que dichos valores fueron 191 y 122 kg C ha-1 en el Molisol respectivamente. Estas diferencias en profundidad en las constantes de descomposición de las raíces estarían asociadas a las características del ambiente edáfico con menor temperatura, aireación en profundidad y menor abundancia de la microbiota del suelo (Sanaullah et al., 2016).
La dinámica del nitrógeno de raíces de maíz también se ajustó a un modelo exponencial negativo, aunque solamente en los primeros 20 cm del perfil (Figura 6). Las constantes de descomposición (k) fueron similares entre suelos (0,01 y 0,012 dias-1 para el Entisol y Molisol) equivalentes a una velocidad media de descomposición de N de 0,61 kg N ha-1 día-1 para el Entisol y 0,5 kg N ha-1 día-1 para el Molisol. En ese sentido, el tiempo estimado para la descomposición del 50% del N de raíces fue superior al del C de raíces con valores de 69 días para el Entisol y 58 días para el Molisol. Las diferencias en las velocidades de descomposición de C y N de raíces, indicarían que el C se perdería más rápidamente que el N. Este efecto de enriquecimiento de N a medida que el residuo se descompone (disminuye la relación C/N) también ha sido observado en otros estudios de descomposición de residuos aéreos (Kriaučiuniene et al., 2012).

Figura 6: Variación temporal del contenido de N de raíces de maíz en los primeros 20 cm de profundidad para el suelo Entisol y Molisol.
Figure 6: Temporal variation of corn root N content in the first 20 cm depth for the Entisol and Mollisol.
Relación entre los contenidos de C y N de raíces, su distribución en el perfil y la actividad biológica del suelo
La actividad biológica del suelo estuvo condicionada por la disponibilidad de residuos dentro del suelo (raíces), así como también por la temperatura y la humedad del suelo. Se comprobó una relación no lineal entre la actividad deshidrogenasa y el C de las raíces en los primeros 20 cm del perfil de suelo (Figura 7). En ese sentido, la oxidación biológica de compuestos orgánicos en el suelo es un proceso de deshidrogenación mediado por diferentes enzimas intracelulares involucradas en el metabolismo respiratorio de los microorganismos, el ciclo del citrato y el metabolismo del N (Kumar et al., 2013). Los resultados mostraron que la actividad enzimática aumentó por el aporte de C de raíces hasta un valor óptimo, para luego estabilizarse en un nivel levemente inferior. A similar nivel de C de raíces, la actividad biológica fue superior en el Molisol, alcanzando valores óptimos y de saturación por encima de los registrados en el Entisol. Tanto el tipo de suelo como los niveles de materia orgánica constituyen factores que estimulan la actividad deshidrogenasa del suelo (García et al., 1997). Además, estas diferencias entre tipos de suelo podrían estar asociadas a la mayor biomasa microbiana que el suelo de textura fina puede sostener (Smith & Paul, 1990; Frasier et al., 2016c). Por otra parte, el cociente entre estas variables fue un buen indicador de la variación observada en la actividad biológica en ambos suelos, con mayores respuestas en el suelo de textura fina principalmente en el estrato de 0-20 cm (Figura 8). Estos factores abióticos son condicionantes de la actividad biológica y la descomposición de residuos (Stotzky, 1997).
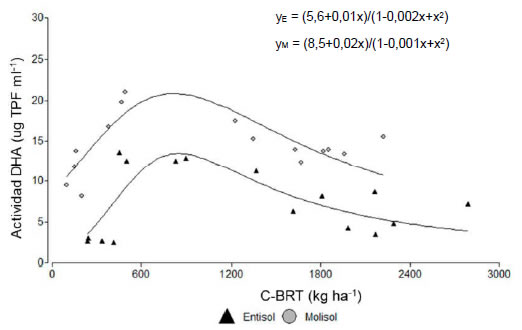
Figura 7: Relación entre la actividad enzimática deshidrogenasa (ug TPF ml-1) y el contenido de C de raíces (kg ha-1) al final del ciclo de los cultivos de cobertura en el Entisol y Molisol para la profundidad de 0-20 cm.
Figure 7: Relationship between enzymatic activity (ug TPF ml-1) and root C content (kg ha-1) at the end of cover crops growing season in the Entisol and Mollisol for soil depth 0-20 cm.
Los cultivos de cobertura fueron una alternativa que aportó C al suelo manteniendo una rizósfera continua y activa. Los resultados mostraron que la actividad biológica resultó superior cuando se incluyeron los cultivos de cobertura en la secuencia respecto del monocultivo de maíz en ambos tipos de suelo y en los primeros 20 cm del perfil (Figura 9). En el Molisol, este efecto se mantuvo también en el estrato de 20-40 cm. Además, la actividad biológica fue diferente entre secuencias con cultivos de cobertura en ambos suelos. En el Entisol, la actividad biológica fue mayor en la secuencia maíz-centeno+vicia respecto de maíz-centeno, mientras que en el Molisol, las secuencias maíz-centeno y maíz-centeno+vicia casi no mostraron diferencia entre sí. Estos resultados sugieren que la actividad microbiana estaría limitada por N en el Entisol, mientras que en el Molisol, la actividad microbiana respondió más al aporte de raíces.
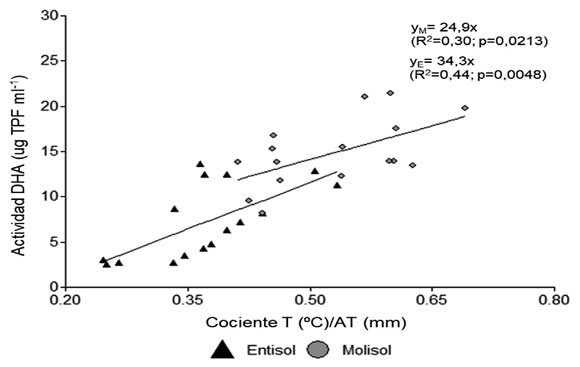
Figura 8: Relación entre la actividad deshidrogenasa del suelo (DHA, ug TPF ml-1) y el cociente entre la temperatura (°C) y el contenido de agua total del suelo (AT mm) a 0-20 cm en el Entisol y Molisol.
Figure 8: Relationship between soil dehydrogenase activity (DHA, ug TPF ml-1) and the ratio between soil temperature (°C) and soil water content (AT mm) at 0-20 cm in the Entisol and Mollisol.

Figura 9. Actividad deshidrogenasa del suelo hasta el metro de profundidad en el Molisol (a) y Entisol (b) al momento de finalización del ciclo de los cultivos de cobertura. Los tratamientos corresponden a secuencias de cultivo establecidas en 2010: maízcenteno (C), maíz-vicia (V), maíz-vicia+centeno (VC) y un testigo sin cultivo de cobertura (maíz-maíz). Las letras indican diferencias significativas entre tratamientos para cada suelo (P=0,0061).
Figure 9. Dehydrogenase activity at 1m depth in the Mollisol (a) and Entisol (b) at the end of cover crops growing season. Treatments corresponded to crop sequences stablished in 2010: corn-rye (C), corn-vetch (V), corn-vetch+rye (VC) and a control without cover crop (corn-corn). Letters indicate significant differences between treatment for each soil (P=0,0061).
CONCLUSIONES
Los cultivos de cobertura estimularon la actividad biológica a través del aporte de sus raíces, y este efecto fue mayor cuando la vicia fue incluida en la secuencia de cultivos en ambos suelos. Sin embargo, el aporte de los cultivos de cobertura dentro de la secuencia de cultivos, no resultó suficiente para alcanzar los niveles de stock de raíces que había dejado remanente el maíz, excepto en la secuencia maíz-centeno en ambos tipos de suelo. Este balance entre aportes (inclusión de cultivos de cobertura) y pérdidas (descomposición) de raíces estuvo condicionado no solo por su calidad sino también por factores abióticos como la temperatura y la humedad edáfica cuyo impacto varió entre tipo de suelo.
AGRADECIMIENTOS
Los autores agradecen al Programa Nacional de Suelos y Agua del Instituto Nacional de Tecnología Agropecuaria por el financiamiento y a la red de trabajo involucrada en el mantenimiento y seguimiento de los ensayos de larga duración de la Estación Experimental "Guillermo Covas" INTA Anguil.
BIBLIOGRAFIA
1. Allison, FE. 1966. The fate of nitrogen applied to soils. Adv. Agron. 18, 219-258. [ Links ]
2. Álvarez, C; A Quiroga; D Santos & M Bodrero. 2013. Contribuciones de los cultivos de cobertura a la sostenibilidad de los sistemas de producción. INTA, Anguil. [ Links ]
3. Archontoulis, SV & FE Miguez. 2015. Nonlinear Regression Models and Applications in Agricultural Research. Agron. J. 107, 786-798. doi:10.2134/agronj2012.0506 [ Links ]
4. Casida, LEJ. 1977. Microbial metabolic activity in soil as measured by dehydrogenase determinations. Appl. Environ. Microbiol. 34, 630. [ Links ]
5. Chimney, MJ & KC Pietro. 2006. Decomposition of macrophyte litter in a subtropical constructed wetland in south Florida (USA). Ecol. Eng. 27, 301-321. doi:10.1016/j. ecoleng.2006.05.016 [ Links ]
6. Cotrufo, MF; MD Wallenstein; CM Boot; K Denef & E Paul. 2013. The Microbial Efficiency-Matrix Stabilization (MEMS) framework integrates plant litter decomposition with soil organic matter stabilization: Do labile plant inputs form stable soil organic matter? Glob. Chang. Biol. 19, 988-995. doi:10.1111/gcb.12113 [ Links ]
7. Coutinho, HLC; E Noellemeyer; F de Carvalho-Balieiro; G Piñeiro; ECC Fidalgo; C Martius & C Figueira da Silva. 2014. Impacts of Land-use Change on Carbon Stocks and Dynamics in Central-southern South American Biomes: Cerrado, Atlantic Forest and Southern Grasslands, in: Banwart, SA; EJ Noellemeyer & E Milne (Eds.), Soil Carbon: Science, Management and Policy for Multiple Benefits. CABI Publishing, Wallingford, Oxon. [ Links ]
8. Decker, AM; AJ Clark; JJ Meisinger; FR Mulford & MS McIntosh. 1994. Legume Cover Crop Contributions to No-Tillage Corn Production. Agron. J. 86, 126. doi:10.2134/ agronj1994.00021962008600010024x [ Links ]
9. Di Rienzo, JA; F Casanoves; MG Balzarini; L González; M Tablada & CW Robledo. 2017. Grupo InfoStat. FCA, Universidad Nacional de Córdoba, Argentina. [ Links ]
10. Ding, G; X Liu; S Herbert; J Novak; D Amarasiriwardena & B Xing. 2006. Effect of cover crop management on soil organic matter. Geoderma 130, 229-239. doi:10.1016/j. geoderma.2005.01.019 [ Links ]
11. Doré, T; D Makowski; E Malézieux; N Munier-Jolain; M Tchamitchian & P Tittonell. 2011. Facing up to the paradigm of ecological intensification in agronomy: Revisiting methods, concepts and knowledge. Eur. J. Agron. 34, 197-210. doi:10.1016/j.eja.2011.02.006 [ Links ]
12. Dos Santos, NZ; J Dieckow; C Bayer; R Molin; N Favaretto; V Pauletti & JT Piva. 2011. Forages, cover crops and related shoot and root additions in no-till rotations to C sequestration in a subtropical Ferralsol. Soil Tillage Res. 111, 208-218. doi:10.1016/j.still.2010.10.006 [ Links ]
13. Duval, ME; JA Galantini; JE Capurro & JM Martínez. 2016. Winter cover crops in soybean monoculture: Effects on soil organic carbon and its fractions. Soil Tillage Res. 161, 95-105. doi:10.1016/j.still.2016.04.006 [ Links ]
14. Fernández, R; A Quiroga & E Noellemeyer. 2012. Cultivos de cobertura, ¿una alternativa viable para la región semiárida pampeana? Ciencia del suelo 30, 137-150. [ Links ]
15. Fernández, R; A Quiroga; C Zorati & E Noellemeyer. 2010. Carbon contents and respiration rates of aggregate size fractions under no-till and conventional tillage. Soil Tillage Res. 109, 103-109. doi:10.1016/j.still.2010.05.002 [ Links ]
16. Figuerola, ELM; LD Guerrero; SM Rosa; L Simonetti; ME Duval; JA Galantini; JC Bedano; LG Wall & L Erijman. 2012. Bacterial Indicator of Agricultural Management for Soil under No-Till Crop Production. PLoS One 7, e51075. doi:10.1371/journal.pone.0051075 [ Links ]
17. Frasier, I; E Noellemeyer; N Amiotti & A Quiroga. 2017. Vetch-rye biculture is a sustainable alternative for enhanced nitrogen availability and low leaching losses in a no-till cover crop system. F. Crop. Res. 214, 104-112. doi:10.1016/j.fcr.2017.08.016 [ Links ]
18. Frasier, I; E Noellemeyer; R Fernández & A Quiroga. 2016a. Direct field method for root biomass quantification in agroecosystems. MethodsX 3, 513-519. doi:10.1016/j. mex.2016.08.002 [ Links ]
19. Frasier, I; E Noellemeyer; E Figuerola; L Erijman; H Permingeat & A Quiroga. 2016b. High quality residues from cover crops favor changes in microbial community and enhance C and N sequestration. Glob. Ecol. Conserv. 6, 242-256. idem [ Links ]
20. Frasier, I; A Quiroga; R Fernández; C Álvarez; MF Gómez; E Scherger; A Gili & E Noellemeyer. 2019a. Soil type, land-use and -management as drivers of root-C inputs and soil C storage in the semiarid pampa region, Argentina. Soil Tillage Res. 192, 134-143. doi:10.1016/j. still.2019.05.010 [ Links ]
21. Frasier, I; A Quiroga & E Noellemeyer. 2016c. Effect of different cover crops on C and N cycling in sorghum NT systems. Sci. Total Environ. 562, 628-639. doi:10.1016/j. scitotenv.2016.04.058 [ Links ]
22. García, C; T Hernández & F Costa. 1997. Potential use of dehydrogenase activity as an index of microbial activity in degraded soils. Commun. Soil Sci. Plant Anal. 28, 123-134. doi:10.1080/00103629709369777 [ Links ]
23. Hadas, A; L Kautsky; M Goek & E Erman Kara. 2004. Rates of decomposition of plant residues and available nitrogen in soil, related to residue composition through simulation of carbon and nitrogen turnover. Soil Biol. Biochem. 36, 255-266. [ Links ]
24. Hirte, J; J Leifeld; S Abiven; HR Oberholzer; A Hammelehle & J Mayer. 2017. Overestimation of crop root biomass in field experiments due to extraneous organic matter. Front. Plant Sci. 8, 284. doi:10.3389/fpls.2017.00284 [ Links ]
25. Jobbágy, EG & RB Jackson. 2001. The distribution of soil nutrients with depth: Global patterns and the imprint of plants. Biogeochemistry 53, 51-77. [ Links ]
26. Jones, DL; C Nguyen & RD Finlay. 2009. Carbon flow in the rhizosphere: carbon trading at the soil-root interface. Plant Soil 321, 5-33. doi:10.1007/s11104-009-9925-0 [ Links ]
27. Kätterer, T; MA Bolinder; O Andrén; H Kirchmann & L Menichetti. 2011. Roots contribute more to refractory soil organic matter than above-ground crop residues, as revealed by a long-term field experiment. Agric. Ecosyst. Environ. 141, 184-192. doi:10.1016/j.agee.2011.02.029 [ Links ]
28. Kirkby, CA; AE Richardson; LJ Wade; GD Batten; C Blanchard & JA Kirkegaard. 2013. Carbon-nutrient stoichiometry to increase soil carbon sequestration. Soil Biol. Biochem. 60, 77-86. doi:10.1016/j.soilbio.2013.01.011 [ Links ]
29. Kirkby, CA; AE Richardson; LJ Wade; JB Passioura; GD Batten; C Blanchard & JA Kirkegaard. 2014. Nutrient availability limits carbon sequestration in arable soils. Soil Biol. Biochem. 68. doi:10.1016/j.soilbio.2013.09.032 [ Links ]
30. Kong, AY & J Six. 2012. Microbial community assimilation of cover crop rhizodeposition within soil microenvironments in alternative and conventional cropping systems. Plant Soil 356, 315-330. doi:10.1007/s11104-011-1120-4 [ Links ]
31. Kong, AYY & J Six. 2010. Tracing Root vs. Residue Carbon into Soils from Conventional and Alternative Cropping Systems. Soil Sci. Soc. Am. J. 74, 1201-1210. doi:10.2136/sssaj2009.0346 [ Links ]
32. Kravchenko, AN; WC Negassa; AK Guber & ML Rivers. 2015. Protection of soil carbon within macro-aggregates depends on intra-aggregate pore characteristics. Sci. Rep. doi:10.1038/srep16261 [ Links ]
33. Kriaučiuniene, Z; R Velička & S Raudonius. 2012. The influence of crop residues type on their decomposition rate in the soil: A litterbag study. Agriculture 99, 227-236. [ Links ]
34. Kumar, S; S Chaudhuri & SK Maiti. 2013. Soil Dehydrogenase Enzyme Activity in Natural and Mine Soil - A Review. Middle-East J. Sci. Res. 13, 898-906. doi:10.5829/ idosi.mejsr.2013.13.7.2801 [ Links ]
35. Kuo, SJS & EJ Jellum. 2002. Influence of winter cover crop and residue management on soil nitrogen availability and corn. Agron. J. 94, 501. [ Links ]
36. Kušlien, G; J Rasmussen; Y Kuzyakov & J Eriksen. 2014. Medium-term response of microbial community to rhizodeposits of white clover and ryegrass and tracing of active processes induced by 13C and 15N labelled exudates. Soil Biol. Biochem. 76, 22-33. doi:10.1016/j. soilbio.2014.05.003
37. Kuzyakov, Y & G Domanski. 2000. Carbon input by plants into the soil. Review. J. Plant Nutr. Soil Sci. 163, 421-431. doi:10.1002/1522-2624(200008)163:4<421::aidjpln421> 3.0.co;2-r [ Links ]
38. Ladoni, M; A Basir; PG Robertson & AN Kravchenko. 2016. Scaling-up: Cover crops differentially influence soil carbon in agricultural fields with diverse topography. Agric. Ecosyst. Environ. 225, 93-103. doi:10.1016/j. agee.2016.03.021 [ Links ]
39. Liang, BC; XL Wang & BL Ma. 2002. Maize root-induced change in soil organic carbon pools. Soil Sci. Soc. Am. J. 66, 845. doi:10.2136/sssaj2002.8450 [ Links ]
40. Loeppmann, S; M Semenov; E Blagodatskaya & Y Kuzyakov. 2016. Substrate quality affects microbial- and enzyme activities in rooted soil. J. Plant Nutr. Soil Sci. 179, 39- 47. doi:10.1002/jpln.201400518 [ Links ]
41. Mazzilli, SR; AR Kemanian; OR Ernst; RB Jackson & G Piñeiro. 2015. Greater humification of belowground than aboveground biomass carbon into particulate soil organic matter in no-till corn and soybean crops. Soil Biol. Biochem. 85, 22-30. doi:10.1016/j.soilbio.2015.02.014 [ Links ]
42. Mbuthia, LW; V Acosta-Martínez; J DeBryun; S Schaeffer; D Tyler; E Odoi; M Mpheshea; F Walker & N Eash. 2015. Long term tillage, cover crop, and fertilization effects on microbial community structure, activity: Implications for soil quality. Soil Biol. Biochem. 89, 24-34. doi:10.1016/j.soilbio.2015.06.016 [ Links ]
43. McDaniel, MD; LK Tiemann; AS Grandy; LK Tiemann; MN Weintraub & AS Grandy. 2014. Does agricultural crop diversity enhance soil microbial biomass and organic matter dynamics? A meta-analysis. Ecol. Appl. 24, 560-570. doi:10.1890/13-0616.1 [ Links ]
44. Ocio, JA; PC Brookes & DS Jenkinson. 1991. Field incorporation of straw and its effects on soil microbial biomass and soil inorganic N. Soil Biol. Biochem. 23, 171-176. doi:10.1016/0038-0717(91)90131-3 [ Links ]
45. Oderiz, A; M Uhaldegaray; I Frasier; AR Quiroga; N Amiotti & P Zalba. 2017. Raíces de cultivos de cobertura: cantidad, distribución e influencia sobre el N mineral. Cienc. del suelo 35, 249-258. [ Links ]
46. Olson, JS. 1963. Energy Storage and the Balance of Producers and Decomposers in Ecological Systems. Ecol. Soc. Am. 44, 322-331. [ Links ]
47. Paul, EA. 2016. The nature and dynamics of soil organic matter: Plant inputs, microbial transformations, and organic matter stabilization. Soil Biol. Biochem. 98, 109- 126. doi:10.1016/j.soilbio.2016.04.001 [ Links ]
48. Pereira da Silva, A; LC Babujia; JC Franchini; RA Souza & M Hungria. 2010. Microbial biomass under various soil- and crop-management systems in short- and longterm experiments in Brazil. F. Crop. Res. 119, 20-26. doi:10.1016/j.fcr.2010.06.012 [ Links ]
49. Pinto, P; ME Fernández Long & G Piñeiro. 2017. Including cover crops during fallow periods for increasing ecosystem services: Is it possible in croplands of Southern South America? Agric. Ecosyst. Environ. doi:10.1016/j. agee.2017.07.028 [ Links ]
50. Poeplau, C & A Don. 2015. Carbon sequestration in agricultural soils via cultivation of cover crops - A meta-analysis. Agric. Ecosyst. Environ. 200, 33-41. doi:10.1016/j. agee.2014.10.024 [ Links ]
51. Poeplau, C & T Kätterer. 2017. Is soil texture a major controlling factor of root:shoot ratio in cereals? Eur. J. Soil Sci. doi:10.1111/ejss.12466 [ Links ]
52. Quiroga, A; R Fernández; M Louise; I Frasier & E Noellemeyer. 2014. Efectos acumulados del manejo durante 20 años sobre un molisol de la región semiárida, En: XXIV Congreso Argentino de La Ciencia Del Suelo II Reunión Nacional "Materia Orgánica y Sustancias Húmicas." 5 - 9 mayo de 2014. Bahía Blanca, Argentina. [ Links ]
53. Ranells, NN & MG Wagger. 1997. Winter annual grass-legume bicultures for efficient nitrogen management in no-till corn. Agric. Ecosyst. Environ. 65, 23-32. doi:10.1016/ S0167-8809(97)00054-6 [ Links ]
54. Ranells, NN & MG Wagger. 1996. Nitrogen release from grass and legume cover crop monocultures and bicultures. Agron. J. 88, 777-782. doi:10.2134/agronj1996.0 0021962008800050015x [ Links ]
55. Saks, M; R Fernández; A Gili & AR Quiroga. 2014. Efecto de la fertilización con nitrógeno en distintos genotipos de maíz. https://inta.gob.ar/sites/default/files/inta-efecto_ de_la_fertilizacion_con_nitrogeno_en_distintos_genotipos_ de_maiz_0.pdf [ Links ]
56. Sainju, UM; BP Singh & WF Whitehead. 2005. Tillage, Cover Crops, and Nitrogen Fertilization Effects on Cotton and Sorghum Root Biomass, Carbon, and Nitrogen. Agron. J. 97, 1279-1290. doi:10.2134/agronj2004.0213 [ Links ]
57. Sajjad, LA. 2002. Change in enzyme activity during the decomposition of plant residues in soil. Pakistan J. Biol. Sci. 5, 952-955. [ Links ]
58. Sanaullah, M; A Chabbi; P Maron; K Baumann; V Tardy; E Blagodatskaya; Y Kuzyakov & C Rumpel. 2016. How do microbial communities in top- and subsoil respond to root litter addition under field conditions? Soil Biol. Biochem. 103, 28-38. [ Links ]
59. Schmidt, MWI; MS Torn; S Abiven; T Dittmar; G Guggenberger; IA Janssens; M Kleber; I Kögel-Knabner; J Lehmann; DAC Manning; P Nannipieri; DP Rasse; S Weiner & SE Trumbore. 2011. Persistence of soil organic matter as an ecosystem property. Nature 478, 49-56. doi:10.1038/nature10386 [ Links ]
60. Silver, WL & R Miya. 2001. Global patterns in root decomposition: comparisons of climate and litter quality effects. Oecologia 407-419. doi:10.3389/fpls.2017.00284 [ Links ]
61. Smith, JL & EA Paul. 1990. The significance of soil microbial biomass estimations, in: Bollag, JM & G Stotzky. (Eds.), Soil Biochemistry Vol. 6. Marcel Dekker, Inc., New York, pp. 357-396. [ Links ]
62. Stotzky, G. 1997. Soil as an environment for microbial life, in: van Elsas, JD; D Jan; JT Trevors & EMH Wellington (Eds.), Modern Soil Microbiology. Marcel Dekker, pp. 1-20. [ Links ]
63. Subbarao, GV; M Rondon; O Ito; T Ishikawa; IM Rao; K Nakahara; C Lascano & WL Berry. 2007. Biological nitrification inhibition (BNI) - is it a widespread phenomenon? Plant Soil 294, 5-18. doi:10.1007/s11104- 006-9159-3 [ Links ]
64. Urquiaga, S; CPJ Sisti; HD Santos; R Kochhann; BJR Alves & RM Boddey. 2002. Influence of crop rotation and soil tillage system in the organic C balance in na Oxisol (Typic Haplorthox)., in: XVII World Congress of Soil Science. Bangkok (Thailand), pp. 14-21. [ Links ]
65. White, CM; ST DuPont; M Hautau; D Hartman; DM Finney; B Bradley; JC LaChance & JP Kaye. 2017. Managing the trade-off between nitrogen supply and retention with cover crop mixtures. Agric. Ecosyst. Environ. 237, 121-133. [ Links ]
66. Wichern, F; E Eberhardt; J Mayer; RG Joergensen; T Müller; T Muller; R Georg &T Mu. 2008. Nitrogen rhizodeposition in agricultural crops: Methods, estimates and future prospects. Soil Biol. Biochem. 40, 30-48. doi:10.1016/j.soilbio.2007.08.010 [ Links ]
67. Zach, A; H Tiessen & E Noellemeyer. 2006. Carbon Turnover and Carbon-13 Natural Abundance under Land Use Change in Semiarid Savanna Soils of La Pampa, Argentina. Soil Sci. Soc. Am. J. 70, 1541. doi:10.2136/ sssaj2005.0119 [ Links ]
68. Zotarelli, L; L Avila; JMS Scholberg & BJR Alves. 2009. Benefits of Vetch and Rye Cover Crops to Sweet Corn under No-Tillage. Agron. J. 101, 252. doi:10.2134/ agronj2008.0033x [ Links ]