Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Intersecciones en antropología
versão On-line ISSN 1850-373X
Intersecciones antropol. vol.15 no.1 Olavarría jun. 2014
ARTÍCULOS
Caracterización anatómica de tallos de Chenopodium (Chenopodiaceae). Aportes al estudio de restos Arqueológicos
Marta Eugenia Arias, María Gabriela Aguirre, Ana Catalina Luque y Patricia Escola
Marta Eugenia Arias. Facultad de Ciencias Naturales (FCN) e Instituto Miguel Lillo (IML). Universidad Nacional de Tucumán. Miguel Lillo 205 (4000), S. M. de Tucumán. Tucumán. E-mail: eumart2003@yahoo.com.ar
María Gabriela Aguirre. FCN. IML. Universidad Nacional de Tucumán. Miguel Lillo 205 (4000), S. M. de Tucumán. Tucumán. E-mail: mgabaguirre@hotmail.com
Ana Catalina Luque. FCN. IML. Universidad Nacional de Tucumán. Miguel Lillo 205 (4000), S. M. de Tucumán. Tucumán. E-mail: anacatalinaluque@hotmail.com
Patricia Escola. Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET). Escuela de Arqueología, Universidad Nacional de Catamarca. 1° de Mayo 1502 (4700), San Fernando del Valle de Catamarca, E-mail: suyu@arnet.com.ar
Recibido 11 de octubre 2012.
Aceptado 16 de mayo 2013
RESUMEN
El género Chenopodium esta representado por 37 especies en Argentina. Son plantas cosmopolitas, herbáceas anuales o perennes. Tres especies son cultivadas como alimenticias, C. pallidicaule y C. quinoa Willd. en Sudamérica, y C. nuttalliae Safford en México. En este trabajo se describen anatómicamente fragmentos de tallos de ejemplares arqueológicos y se los compara con especies silvestres y cultivadas actuales de Chenopodium. Las muestras proceden de un sitio ubicado en Antofagasta de la Sierra, Puna meridional de Argentina; los especímenes actuales proceden de muestras de herbarios y de colecciones de campo. La epidermis se obtuvo empleando la técnica de Metcalfe y los cortes transversales se realizaron con micrótomo de mano. Las muestras fueron teñidas con colorantes y montadas en agua glicerina. Se describió la anatomía de los fragmentos arqueológicos y para el análisis comparativo entre aquellos y las especies silvestres y cultivadas de Chenopodium se seleccionaron caracteres diagnósticos: cutícula, forma de células epidérmicas, aparato estomático, apéndice exodérmico y cristales. Los ejemplares arqueológicos comparten más caracteres anatómicos con las variedades cultivadas de C. quinoa, por lo que se concluye que estos son una variedad de Chenopodium quinoa que no es utilizada actualmente en prácticas de cultivo en la zona.
Palabras clave: Anatomía vegetal; Arqueobotánica; Puna argentina; Chenopodium.
ABSTRACT
Anatomical characterization of stems of Chenopodium (Chenopodiaceae). contributions to the study of archaeological remains. The genus Chenopodium (Chenopodiaceae) is cosmopolitan and is represented by 37 species in Argentina. They are annual or perennial herbaceous plants that can be woody at the base. Three species are grown as food, C. pallidicaule and C. quinoa in South America and C. nuttalliae Safford in Mexico. In this paper we described anatomically the stem fragments of archaeological specimens that were compared with wild and cultivated species of current Chenopodium. The samples come from a site located in Antofagasta de la Sierra, southern Puna of Argentina; present specimens come from herbarium specimens and field collections. The epidermis was obtained using the technique of Metcalfe and transverse cuts were made with hand microtome. Samples were stained with dyes and mounted in glycerine water. The anatomy of archaeological fragments was described and diagnostic characters were selected by comparative analysis between archeological, wild and cultivated species of Chenopodium. The characters are: cuticle, epidermal cell shape, stomatal, exodermical appendix and crystals. The archeological specie has more anatomical characters similar to the cultivated species of C. quinua. We concluded that archaeological fragments are a variety of Chenopodium quinoa not currently used in cultivation practices in the area.
Keywords: Plant anatomy; Archaeobotany; Argentinian Puna; Chenopodium.
INTRODUCCIÓN
En América, el género Chenopodium L. está integrado por distintas especies; algunas son consideradas malezas de campos de cultivo (Planchuelo 1975), y otras especies, como la Quínoa (Chenopodium quinoa Willd.) y la Cañahua (Chenopodium pallidicaule Aellen), representan recursos importantes para la subsistencia de comunidades andinas actuales.
La quínoa forma parte de los denominados granos andinos, nombre que responde a la posibilidad de obtener sustancias harinosas de ellos. Las características de sus granos han recibido atención por parte de botánicos, agrónomos y arqueólogos. Se conoce que el estudio de los caracteres externos de las semillas permite identificar especies (Planchuelo 1975) y discriminar entre especies silvestres y domesticadas (Bruno 2006) y variedades (Hunziker 1952).
El pequeño tamaño de los granos de quínoa, sus colores claros y las modificaciones que sufren al ser procesados para el consumo dificultan en muchos casos la preservación en contextos arqueológicos, sin embargo, se han recuperado ejemplares antiguos disecados (Rodríguez et al. 2006), contenidos en artefactos (Hunziker y Planchuelo 1971) y carbonizados (Bruno 2005).
Para sitios arqueológicos de Argentina se dispone de datos acerca del hallazgo de semillas de especies de este género (Hunziker 1943; Hunziker y Planchuelo 1971; Hernández et al. 1999-2000; Lagiglia 2001; Gambier 2002; Llano 2005; Caló 2010) pero los registros sobre tallos o partes completas de estas plantas son escasos. La mención sobre otros órganos, diferentes a las semillas, forma parte de trabajos etnobotánicos que describen prácticas actuales de cultivo, cosecha y poscosecha (Tapia et al. 1979; Tagle y Planella 2002; López 2010). A su vez, en la microrregión de Antofagasta de la Sierra (Catamarca, Argentina) se identificaron restos de tallos de Chenopodium aff. quinoa en el sitio Peñas Chicas 1.3 (Holoceno medio) (Hocsman 2006; Aguirre 2007), mientras que en Punta de la Peña 4 (Holoceno tardío), Rodríguez et al. (2006) mencionan el hallazgo de semillas, ramificación de la inflorescencia y tallo florífero de Chenopodium quinoa. Además de macrorestos vegetales, también se dispone para la misma microrregión de evidencia de microrrestos pertenecientes a la Familia Chenopodiaceae. Babot (2004) registró granos de polen de Chenopodiaceae/Amaranthaceae en un artefacto de molienda para Peñas Chicas 1.3 e identificó granos de almidón de semillas de C. quinoa en artefactos líticos en los sitios Quebrada Seca 3 (Holoceno temprano) y Peñas Chicas 1.1 (Holoceno medio). Por su parte, en el Sector I del sitio Punta de la Peña 9 (Holoceno tardío) se registraron granos de polen de Chenopodiaceae/Amaranthaceae y fitolitos de calcio de semilla de C. quinoa, y granos de almidón de semillas de C. quinoa/Amaranthus sp. en el Sector II del mismo sitio (Babot 2004). La preservación diferencial de partes de esta planta en el área de Antofagasta motivó la indagación en las características anatómicas de fragmentos de tallos recuperados en el sitio El Aprendiz (Quebrada Miriguaca, Antofagasta de la Sierra), para lo cual fue necesario elaborar una colección de referencia de especies actuales del género. La metodología de trabajo implementada permitió describir las características anatómicas de los especímenes actuales y arqueológicos, como así también distinguir los principales caracteres anatómicos que permiten diferenciar a las especies silvestres de las domesticadas.
CARACTERÍSTICAS AMBIENTALES DEL ÁREA DE ESTUDIO
La Puna de Atacama o Altiplano andino es uno de los ecosistemas más destacados de América del Sur. Se extiende desde el sur de Perú, atraviesa el altiplano de Bolivia, el norte de Chile y el noroeste de Argentina hasta la provincia de Mendoza, ocupando una faja latitudinal entre los 14º y 32º 40´Sur (Martínez Carretero 1995). En territorio argentino, el límite oriental de la Puna está dado por las Sierras de Santa Victoria, Zenta y Aguilar, los Nevados de Chañi, del Castillo, del Acay, de Cachi, Cerro Blanco y Sierra de Laguna Blanca. Hacia el oeste, está separada de la Puna chilena y boliviana por una serie de cerros y volcanes, mientras que el límite sur está dado por la cordillera de Buenaventura (Cabrera 1947).
El clima puneño puede describirse como seco y frío, las lluvias son escasas y se producen prácticamente en verano. De acuerdo con los regímenes pluviales, es posible diferenciar dos sectores: Norte o "Puna de Jujuy", más húmedo, con arroyos, lagunas y ciénagas; y Sur, más seco, con escasos cursos de agua y numerosos salares (Cabrera 1947). El sector sur recibe también el nombre de Puna meridional o austral (Olivera 1989). Los suelos de la puna, propios de ambientes desérticos (entisoles y aridisoles), son inmaduros y pobres en materia orgánica (Cabrera 1994; Martínez Carretero 1995).
El departamento de Antofagasta de la Sierra, ubicado en el extremo noroeste de la provincia de Catamarca, forma parte del sector meridional o sur de la Puna argentina. Limita hacia el oeste con la frontera argentino-chilena, al norte y al este con la provincia de Salta, al sur con la cordillera de San Buenaventura y al sureste con la sierra de Laguna Blanca (Olivera 1989). El área está atravesada por una serie de cordones montañosos: Quebrada Honda, Sierra de Antofalla, Sierra de Toconquis, Sierra de Calalaste y Sierra de Laguna Blanca. La red hidrográfica es cerrada y se destacan los cursos de los ríos Calalaste-Mojones-Antofagasta que, al unirse al río Punilla, que recibe los aportes de los ríos Toconquis, Miriguaca y Las Pitas, forman un sistema hídrico que llega a la laguna de Antofagasta (Olivera 1989).
El paisaje se caracteriza por planicies onduladas interrumpidas por cordones montañosos y por la presencia de numerosos volcanes, entre los que se destacan: Alumbrera, Antofagasta, Antofalla, Hombre Muerto y Carachi Pampa. Se reconocen para el área tres sectores que difieren en cuanto a los recursos naturales disponibles: A) Fondo de Cuenca (3400-3500 msnm), B) Sectores Intermedios (3550-3900 msnm) y C) Quebradas de Altura (3900-4600 msnm) (Olivera 1992; Olivera y Podestá 1993). El material vegetal arqueológico analizado en este trabajo procede de un sitio ubicado en la provincia fitogeográfica puneña (Cabrera 1994), emplazado en los Sectores Intermedios (Olivera 1992) (Figura 1). La vegetación que rodea al sitio corresponde a especies forrajeras, leñosas y las que pueden destinarse a fines tecnológicos; por otra parte, los recursos vegetales se distribuyen en forma lineal o dispersa, siendo las unidades vegetacionales principales las Vegas, el Tolar y el Campo (Olivera 2006).

Figura 1. Microrregión de Antofagasta de la Sierra (Provincia de Catamarca). Vista general del sitio El Aprendiz.
En la actualidad, en el área de estudio se han registrado los siguientes taxones: Chenopodium sp., C. pallidicaule, C. ambrosioides y C. quinoa (Cuello 2006; Olivera 2006). Cabe destacar que C. ambrosioides actualmente ha sido reubicada en el género Dysphania como D. ambrosioides (Ci Li Shu 2003). En recientes trabajos de campo se registró C. quinoa var. melanospermum en el poblado de Antofagasta de la Sierra.
TAXONOMÍA Y CARACTERÍSTICAS GENERALES DE LAS PLANTAS DE CHENOPODIUM
El género Chenopodium L. está presente en casi todas las regiones del planeta (Giusti 1967). De acuerdo con la clasificación tradicional de Aellen y Just (1943), este género está integrado por diez secciones: Roubieva, Orthosporum, Ambrina, Botryoides, Degenia, Eublitum, Pseudolitum, Thellungia, Agathophyton y Chenopodia.
En la Argentina, se encuentra representado por 37 especies (Zuloaga y Morrone 1999), que corresponden a plantas herbáceas, anuales, bienales o perennes, que pueden ser leñosas en la base, aromáticas o con olor desagradable o bien inodoras con flores pequeñas dispuestas en glomérulos, reunidas a su vez en espigas o panojas axilares o terminales (Dimitri 1987; Giusti 1997). El fruto es un aquenio rodeado por el cáliz, pericarpio membranáceo, semilla lenticular, oblicua u horizontal con radícula centrífuga o vertical, con radícula inferior; usualmente, la semilla está contenida por el perianto y el embrión es de tipo anular a hipocrepiforme (Scott 1978; Dimitri 1987).
Descripciones sobre la anatomía de la hoja, el leño y la raíz de especies del género han sido realizadas por Solereder (1908), Metcalke y Chalk (1950), Balfour (1965), Fahn (1974) y Alonso Beato y Cuadrado Rodríguez (1985).
En nuestro país, el género ha sido estudiado por Giusti (1967, 1984, 1987, 1997), Planchuelo (1975), Múlgura (1994) y por Hunziker (1943, 1952), quien realizó una síntesis de los géneros Chenopodium y Amaranthus a partir de muestras arqueológicas procedentes de la región Noroeste. La anatomía del fruto y de la semilla de C. quinoa ha sido abordada por Gallardo et al. (1997) y Prego et al. (1998). También se han realizado estudios ontogénicos de inflorescencias (Bertero et al. 1996).
Dentro del género, tres especies son cultivadas como plantas alimenticias: C. pallidicaule y C. quinoa, en Sudamérica, y C. nuttalliae Safford, en México (Heiser y Nelson 1974).
C. pallidicaule (Cañihua, Cañahua, Kañiwua) es una especie diploide con 2n=2x=18 cromosomas (Mujica y Jacobsen 2006). Es resistente al frío y sirve a los agricultores andinos como un reaseguro cuando el resto de los alimentos falla; es más resistente que cualquier otro cultivo y otros cereales a la combinación de heladas, sequía, sal y plagas (Gordon 1989). La especie es muy variable, alcanza entre 20 y 60 cm de alto, su raíz es pivotante, erguida, semipostrada y muy ramificada en la base. El tallo se caracteriza por presentar manchas rojas, amarillas o verdes y estrías; las hojas aumentan en tamaño y anchura hacia la base de la planta. Las flores son hermafroditas. Los aquenios, vulgarmente llamados semillas, son numerosos, de aproximadamente 1 mm de diámetro, y su color varía desde castaño a negro. El embrión es grande en relación con el tamaño de la semilla. Los granos, a diferencia de los de quínoa, contienen poca o escasa saponina y se pueden comer sin procesamiento elaborado (Gordon 1989).
C. quinoa (Quínoa) es un alotetraploide (2n=4x=36) y muestra herencia disómica para muchos rasgos cualitativos (Simmonds 1971). Su importancia económica, agronómica y alimenticia actual ha motivado el estudio sistemático de diferentes aspectos de la planta. Se han abordado temas de fisiología de la especie y sus variedades, tales como los efectos de la temperatura y la salinidad sobre la germinación y crecimiento de plántulas de distintas variedades (Chilo et al. 2009), también es un tema recurrente de investigación el grano y sus propiedades nutritivas (Thoufeek Ahamed et al. 1998; Torres et al. 2002; Jancurová et al. 2009), al igual que las plagas y enfermedades que afectan a la planta (Danielsen 2002; Danielsen y Munk 2004), pero quizás uno de los campos de estudio que más se ha desarrollado es el genético (Maughan et al. 2004; Anabalón Rodríguez y Thomet Isla 2009; Fuentes et al. 2009). Análisis moleculares confirman una relación muy estrecha entre C. quinoa y el tetraploide C. berlandieri (Kolano et al. 2008). Wilson (1990) considera como hipótesis que un progenitor salvaje tetraploide del norte de América (C. berlandieri) viajó a México y América del Sur a través de migraciones humanas o dispersiones de aves. Así, las poblaciones de cada región fueron domesticadas posteriormente en forma independiente: C. berlandieri var. jonesianum en el este de Norteamérica, C. berlandieri ssp. nuttalliae en México y C. quinoa en los Andes.
Las relaciones genealógicas entre las especies domesticadas no son aún del todo claras. Durante mucho tiempo, C. pallidicaule fue considerada una variedad de la quínoa pero en 1929 fue clasificada como una especie distinta (Gade 1970). La historia de la domesticación de cañahua es todavía especulativa; antes de su cultivo pudo haber sido una maleza en los campos de cultivo de quínoa o de papa. Eventualmente, sus propiedades fueron valoradas y comenzó a cultivarse. No hay datos arqueológicos para cañahua y no se conoce en qué momento, antes de la llegada de los españoles, comenzó su cultivo (Gade 1970). Sus parientes más cercanos morfológicamente son C. carnosulum Moq. y C. scabricaule Speg. La mayor diversidad de especies relacionadas en Sudamérica se desarrolla alrededor de las pampas en la Argentina y en las tierras altas occidentales. Sin embargo, la especie más común y relacionada es C. quinoa, que ha sido tradicionalmente cultivada desde el norte de Colombia hasta el sur de Chile, desde el nivel del mar hasta los 4000 msnm; aunque el rango altitudinal es el de 2500 a 3800 msnm (Mujica y Jacobsen 2006).
De acuerdo con la forma seminal, Hunziker (1952) distingue dos variedades de C. quinoa: var. quinoa (semillas blancuzcas a castañas) y var. melanospermum Hunz. (semillas negras de bordes subredondeados). A estas variedades debemos agregar otras mencionadas por Dimitri (1987): var. viridescens Moq., var. rubescens Moq. y var. lutescens A. T. Hunz. Gandarillas (1979), por su parte, considera que la clasificación de la quínoa en variedades y formas tiene poco sentido y cae fuera de la realidad taxonómica ya que, bajo las condiciones actuales de la agricultura andina, en un campo de cultivo se encontrarían muchas variedades preferentemente diferenciadas.
En cuanto al origen de la quínoa, Hunziker (1952) considera que su centro fueron las montañas de Ecuador, de Perú y Bolivia, y que C. hircinum Schrad fue la especie silvestre más afín, y C. quinoa var. melanospermum, un eslabón entre Quínoa y C. hircinum. La forma espontánea de Quínoa, denominada C. quinoa var. melanospermum o Ashpa quínoa, es común en el rango de cultivo de quínoa y es posible que represente una reversión de la forma cultivada, ya que se han identificado híbridos naturales entre ambas en campos de cultivo de Ecuador (Heiser y Nelson 1974).
MATERIALES Y MÉTODOS
El material arqueológico analizado procede del sitio El Aprendiz, ubicado en la quebrada del río Miriguaca, Antofagasta de la Sierra (Catamarca). De acuerdo con Escola et al. (2013), el sitio comprende un conjunto de tres estructuras circulares de pirca seca. Se ubica sobre el curso medio del río, a 25° 59,051' Latitud Sur y 67° 20,461' Longitud Oeste, y su altura sobre el nivel del mar es de 3587 msnm. Se dispone de una datación radiocarbónica sobre madera que ubica al sitio en los 1550 ± 70 años AP (LP 1797). Los tallos recuperados en estratigrafía se presentaron en buen estado general de preservación (Figura 2); algunos se recuperaron enteros y otros, segmentados siguiendo el eje longitudinal. Del total de tallos se tomaron aquellos que presentaban buena consistencia al momento de ser cortados y cuyo diámetro estuviera completo.

Figura 2. Aspecto general de los tallos recuperados en el sitio El Aprendiz.
Las especies actuales estudiadas se seleccionaron teniendo en cuenta los siguientes criterios: especies nativas de Sudamérica, principalmente aquellas que habitan en el NO argentino entre los 1000 y 4000 msnm, y especies que figuran en la literatura botánica y arqueológica como posibles ancestros de las formas domesticadas quínoa y cañahua (Hunziker 1952; Heiser y Nelson 1974; Gordon 1989; Mujica y Jacobsen 2006).
Los ejemplares actuales estudiados proceden de muestras de los herbarios Fundación Miguel Lillo (LIL) y Darwinion (SI). También se incluyó a C. pallidicaule y a cultivares actuales obtenidos de la localidad de Antofagasta de la Sierra (C. quinoa var. quinoa -Blanca1-) y de campos de cultivo de la región de Lípez2 (Potosí, Bolivia). Los especímenes que proceden de esta última región son C. quinoa var. quinoa -Morada- y C. quinoa var. quinoa -Rosada-. La inclusión de estos cultivares permitió observar características anatómicas de individuos que en la actualidad se encuentran formando parte de distintas prácticas tradicionales de cultivo.
Material actual de herbario examinado
-Chenopodium frigidum Phil. ARGENTINA. Catamarca. Dpto. Tinogasta, Tres Quebradas. III-1951. Leg. Vervoorst 3233. 364797 (LIL)
-Chenopodium frigidum Phil. ARGENTINA. Catamarca. Dpto. Tinogasta, Tambería. 3700 msnm. Año 1951. Leg. Vervoorst 3194. 364788 (LIL)
-Chenopodium frigidum Phil. ARGENTINA. La Rioja, Famatina, La Mesada. 3500 msnm. Año 1951. Leg. Sparre 8880. 420329 (LIL)
-Chenopodium frigidum Phil. ARGENTINA. Mendoza, San Rafael, El Alfarcito. Leg. Rossi 148. Det. L. Giusti. Año 1946. 163360 (LIL)
-Chenopodium frigidum Phil. ARGENTINA. Mendoza, Las Heras, Cruz Del Paramillo. 3000 msnm. Año 1950. Leg. Cuezzo y Balegno 2014. Det. L. Giusti. 299088 (LIL)
-Chenopodium graveolens Willd. var. bangii (Murr). ARGENTINA. Catamarca. Dpto. Andalgalá, Cuesta Mina Capillitas. III-1960. Leg. Ledda y Türpe. 505305 (LIL)
-Chenopodium graveolens Willd. var. bangii (Murr). ARGENTINA. Jujuy. Humahuaca, Iturbe. Año 1960. Leg. T. Meyer, Cuezzo y Legname. 518429 (LIL)
-Chenopodium graveolens Willd. var. bangii (Murr). ARGENTINA. Salta. Cafayate. Año 1969. Leg. Vervoorst 7508. 562414 (LIL)
-Chenopodium graveolens Willd. var. bangii (Murr). ARGENTINA. Tucumán. Tafí Del Valle, El Infiernillo. 3100 msnm. Año 1951. Leg. Sparre 8639. 420330 (LIL)
-Chenopodium graveolens Willd. var. bangii (Murr). ARGENTINA. Jujuy. Humahuaca. Año 1960. 518429 (LIL)
-Chenopodium hircinum Schrad. subsp. catamarcensis. ARGENTINA. Catamarca. Dpto. Santa María, Cerro Aconquija. 1927. 10427 (LIL)
-Chenopodium hircinum Schrad. subsp. catamarcensis. ARGENTINA. Puente Del Inca, Mendoza. Leg. B. Sporre. 245660 (LIL)
-Chenopodium hircinum Schrad. subsp. catamarcensis. ARGENTINA. Tucumán. Chicligasta. 3600 msnm. Año 1926. Leg. S. Venturi. 10484 (LIL)
-Chenopodium hircinum Schrad. subsp. catamarcensis. ARGENTINA. Tucumán. Tafí Del Valle, Cerro Muñoz. 3700 msnm. Año 1908. Leg. Lillo. 10425 (LIL)
-Chenopodium hircinum Schrad. subsp. catamarcensis. ARGENTINA. Tucumán. Las Pavas. 3300 msnm. Año 1924. Leg. S. Venturi. 10485 (LIL)
-Chenopodium quinoa Willd var. melanospermum. ARGENTINA. Catamarca. Dpto. Capayán, La Cuestecilla. I-1947. Leg. Risso 1024. 195533 (LIL)
-Chenopodium quinoa Willd var. melanospermum. ARGENTINA. Catamarca. Dpto. Capayán. 32873 (LIL)
-Chenopodium quinoa Willd var. melanospermum. ARGENTINA. Catamarca. Dpto. Capayán, El Arenal. Leg. L. Risso. Det. H. Wilson. 193786 (LIL)
-Chenopodium quinoa Willd var. melanospermum. ARGENTINA. Catamarca. Dpto. Capayán. Los Ángeles. Año 1947. Leg Risso 492. 207577 (LIL)
-Chenopodium quinoa Willd var. melanospermum. ARGENTINA. Catamarca. El Rodeo. Año 1960. Leg. Ledda y Turpe. 505301 (LIL)
-Chenopodium pallidicaule. BOLIVIA. La Paz, Huarina- Omasuyos. V-1947. Leg.: Cárdenas 3813. (SI)
-Chenopodium pallidicaule. BOLIVIA. La Paz. Det. A. Burkart. 82234 (SI)
-Chenopodium pallidicaule. BOLIVIA. La Paz. Achacachi. 3800 msnm. Año 1947. Leg. Cárdenas 3809. 530419 (LIL)
-Chenopodium pallidicaule. BOLIVIA. La Paz. Huarina. 3800 msnm. Leg. Cárdenas. 530413 (LIL)
-Chenopodium quinoa Willd. BOLIVIA. La Paz. Det. L. Giusti. Año 1919. 10718 (LIL)
-Chenopodium quinoa Willd. ARGENTINA. Salta. San Antonio de Los Cobres. 3800 msnm. Año 1946. Leg. A. Krapovickas. Det. H. Wilson. 433228 (LIL)
Se menciona que Chenopodium graveolens Willd. var. bangii actualmente ha sido reubicada como C. mandonii (Zuloaga y Morrone 1999).
Para el análisis anatómico de ejemplares arqueológicos y actuales se implementaron las siguientes técnicas: cortes transversales de tallo con micrótomo de mano del material previamente hervido en agua (D´Ambrogio de Argüeso 1986). Para la obtención de epidermis se trabajó bajo lupa Nikon, utilizando la técnica de "raspado" o de Metcalfe (D´Ambrogio de Argüeso 1986). La coloración se realizó con azul de toluidina, azul de anilina, azul de cresilo brillante. Se realizaron preparados semipermanentes empleando como medio de montaje agua glicerina (1:1 v/v). Para las observaciones de preparados se empleó microscopio óptico Leica DM 500, y las fotos fueron tomadas con cámara digital Samsung Digimax A50. La descripción de los tipos de estomas se basó en la terminología propuesta por Leaf Architecture Working Group (1999) con algunas modificaciones tomadas de Metcalfe y Chalk (1950).
RESULTADOS
Se describen anatómicamente los tallos de los ejemplares arqueológicos colectados en el sitio.
Epidermis de tallo
Presenta cutícula estriada. Epidermis con células rectangulares cortas de 57 μm x 15 μm en costilla y células isodiamétricas de disposición desordenada en surcos. Aparato estomático tipo anficiclocítico con dos ciclos de 4 a 5 células subsidiarias cada ciclo. Estoma de forma redondeada con disposición irregular en el tejido epidérmico y células oclusivas con granos de almidón. No se observan apéndices exodérmicos (Figura 3).

Figura 3. Epidermis de tallo de muestras arqueológicas de Chenopodium sp. A. Zona de surcos con células epidérmicas rectangulares cortas. B. Cutícula estriada. C. Zona de costillas con células epidérmicas isodiamétricas de disposición desordenada y aparato estomático de tipo Anficiclocítico. D. Detalle de la forma redondeada del estoma y del contenido de almidón (Alm.) en células oclusivas.
Corte transversal de tallo
La sección transversal es circular a hexagonal con surcos y costillas muy marcados. Se observa el tallo con crecimiento de tipo "anómalo". La epidermis es uniestratificada con cutícula delgada, estriada. El colénquima es de tipo angular, subepidérmico en la zona de costillas y ausente en sector de surcos. El parénquima cortical presenta abundantes drusas (9,32 drusas /mm2) y areniscas cristalinas. El sistema vascular está formado por un anillo continuo de xilema y floema externo con haces colaterales de diferentes tamaños en contacto con el anillo de xilema. Se observan grupos de células esclerenquimáticas dispuestas en forma discontinua asociadas al floema. En la médula del tallo se encuentra el parénquima con células de mayor tamaño que el cortical (Figura 4).
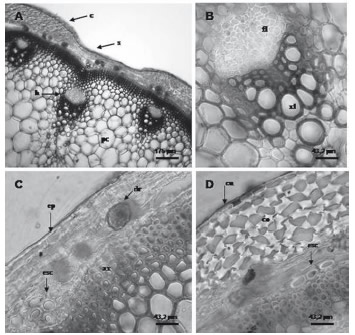
Figura 4. Corte transversal de tallo de muestras arqueológicas de Chenopodium sp. A. Aspecto general de tallo con crecimiento primario con zonas de surcos y costillas, haces y anillo de xilema. B. Detalle del haz vascular de tipo colateral. C. Detalle de la zona de surco. D. Detalle de la zona de costillas; s: surco; c: costilla; h: haz vascular; pc: parénquima del córtex; xl: xilema; fl: floema; ep: epidermis; cu: cutícula; co: colénquima angular; dr: drusa en parénquima; esc: esclerénquima; ax: anillo de xilema.
A los fines de estudiar comparativamente la especie arqueológica con las actuales se analizaron anatómicamente los tallos de las especies silvestres y cultivadas. Se seleccionaron caracteres anatómicos relevantes que permitieran establecer semejanzas y diferencias entre cada especie analizada (Tablas 1 y 2).
Tabla 1. Especies silvestres del género Chenopodium. Tipos de tricomas glandulares: tipo 1- pie unicelular y cabeza globosa; tipo 2- pie bicelular y cabeza globosa; tipo 3- pie pluricelular y cabeza globosa. Densidad de drusas en parénquima cortical: alta (47 - 37 drusas x mm2), media (17 - 12 drusas x mm2), baja (5 - 1 drusas x mm2).
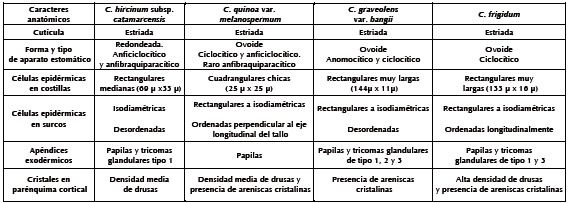
Tabla 2. Variedades domésticas del género Chenopodium y muestra arqueológica. Densidad de drusas en parénquima cortical: alta (47,4 - 36,7 drusas x mm2), media (17,3 - 12,2 drusas x mm2), baja (5,4-0,2 drusas x mm2).

En el caso del sistema vascular, si bien las especies del género Chenopodium presentan un sistema de conducción con desarrollo poco usual, se observó -en el caso de las especies silvestres- un mayor desarrollo del xilema formando un anillo continuo sin la presencia de haces vasculares, mientras que en las especies domesticadas se observó un anillo de xilema de menor espesor, con numerosos haces vasculares. Esta última disposición del xilema es la que se describe para el tallo de la muestra arqueológica.
DISCUSIÓN Y CONCLUSIONES
Desde un enfoque anatómico sólo se cuenta con antecedentes mencionados por Solereder (1908) y Metcalfe y Chalk (1950) para la familia Chenopodiaceae. Estos autores citan la presencia de estomas tipo ranunculáceo y rubiáceo que se ubican de modo transversal a la vena media de la hoja. Dada la ausencia del análisis detallado de la epidermis y de la anatomía del tallo de Chenopodium, el presente estudio constituye un aporte al conocimiento de la anatomía de este género.
El tipo morfológico de aparato estomático no arroja diferencias significativas para las especies silvestres, domesticadas y arqueológicas estudiadas. En cuanto a los estomas, las especies silvestres presentan forma ovalada con la relación largo/ ancho mayor que la que se observa en las especies domésticas y la arqueológica, cuya forma es redondeada. Las células estomáticas muestran carácter exclusivo en C. quinoa var. quinoa (quínoa rosada), la que presenta apéndices a modo de proyecciones redondeadas, en los extremos de las células oclusivas (Tabla 1). La presencia de almidón fue otro carácter distintivo encontrado en las células oclusivas de los ejemplares arqueológicos.
Solereder (1908) y Metcalfe y Chalk (1950) señalan la importancia diagnóstica que tienen los apéndices exodérmicos, siendo el tipo de tricoma simple uniseriado con paredes delgadas un carácter importante para Chenopodium. Citan para C. botrys, C. ambrosioides y Chenopodium glaucum la presencia de pelos uniseriados con cabeza esférica. Se señala que actualmente C. glaucum corresponde a Oxybasis glauca (Zuloaga y Morrone 1999).
En el presente trabajo se identificaron tricomas glandulares con pie uniseriado con número variable de células de 1-3 y cabeza unicelular globosa solamente en las especies silvestres. Además se observaron papilas, en especies silvestres y domesticadas (Figura 5), carácter no mencionado en la bibliografía analizada. Sin embargo, se ha podido observar especies glabras, como es el caso de variedad quínoa rosada y del ejemplar arqueológico analizado (Tabla 2).
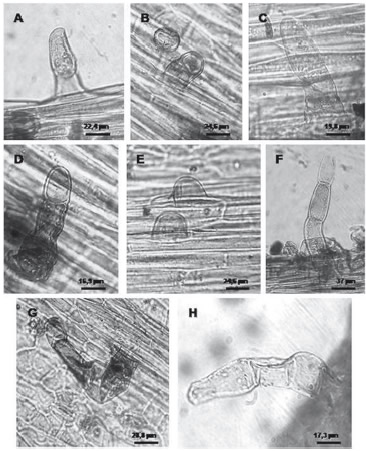
Figura 5. Apéndices exodérmicos de especies actuales de Chenopodium sp. A-B Tricoma glandular con pie y cabeza unicelular. C-D. Tricoma glandular con pie bicelular y cabeza unicelular. E. Papilas. F, G, H. Tricoma glandular con pie pluricelular y cabeza unicelular.
Con respecto a la presencia de cristales, en las especies estudiadas se encontraron abundantes drusas y arenas cristalinas. Este carácter es coincidente con las citas de Solereder (1908) y Metcalfe y Chalk (1950) para especies de la familia Chenopodiaceae. Sin embargo, Barboza et al. (2001) sólo citan areniscas cristalinas para C. ambrosioides, C. chilense y C. multifidum. Actualmente, estas dos últimas especies se reubicaron en el género Dysphania como D. chilensis y D. multifida (Zuloaga y Morrone 1999).
La presencia de drusas en el parénquima del córtex se observó en la mayoría de las especies silvestres y domésticas, aunque en la especie silvestre C. graveolens var bangii sólo se encontraron areniscas cristalinas. Si bien existen algunos estudios sobre la anatomía del tallo de especies de Chenopodium, estas no son coincidentes con las tratadas en este trabajo (Metcalfe y Chalk 1950, Barboza et al. 2001). Todos los ejemplares aquí analizados presentaron tallos con crecimiento de tipo anómalo o poco usual, carácter citado para el género Chenopodiun (Metcalfe y Chalk 1950). Sin embargo, en las especies domésticas y ejemplares arqueológicos, a diferencia de la silvestre, no se ha observado desarrollo de crecimiento secundario de xilema y floema, aun en aquellos tallos de diámetro considerable.
Resulta interesante mencionar que C. quinoa var. melanospermum, considerada como un escape de cultivo o como un eslabón intermedio entre las variedades domesticadas de Chenopodium y la especie silvestre (C. hircinum), mostró mayores semejanzas con los ejemplares domésticos que con la especie silvestre. Estos caracteres son: formas de células epidérmicas en los surcos y costillas, forma de estomas, ausencia de pelos y presencia de dos tipos de cristales.
Se puede concluir que las muestras arqueológicas comparten mayor cantidad de caracteres con las variedades domesticadas que con especies silvestres de Chenopodium. La forma redondeada de estomas, la ausencia de tricomas (caracteres de alto valor diagnóstico) y las características del sistema vascular son caracteres que asemejan a la muestra arqueológica con las especies domesticadas. Sólo comparte con las especies silvestres la forma y disposición de las células epidérmicas. Los caracteres analizados comparativamente entre las especies silvestres y las domésticas actuales de Chenopodium sugieren que las muestras analizadas serían fragmentos de alguna variedad de Chenopodium quinoa, cultivados en este sector de la Puna argentina.
El trabajo realizado posibilita la diferenciación de caracteres útiles para distinguir entre especies silvestres y cultivadas para el género Chenopidium cuando sólo se disponga de restos de tallos debido a la ausencia de semillas en el registro arqueológico. Futuras identificaciones de tallos para el área permitirán ampliar el conocimiento generado desde la línea de investigación anatómica, como también contribuir a comprender las prácticas antiguas de manejo de este recurso andino.
Agradecimientos
A los Herbarios de la Fundación Miguel Lillo y Darwinion por haber puesto a disposición el material vegetal actual consultado. A la Dra. Laura López por suministrar algunos de los tallos analizados en este estudio. A los evaluadores por los comentarios emitidos.
1 Material cedido por Lic. Carlos Aschero.
2 Material suministrado por Dra. Laura López.
REFERENCIAS CITADAS
1. Aellen, P. y T. Just 1943 Key and sinopsis of de american species of de genus Chenopodium L. American Midland Naturalist 30 (1): 47-76. [ Links ]
2. Aguirre, M. G. 2007 Arqueobotánica del sitio Peñas Chicas 1.3 (Antofagasta de la Sierra, Catamarca, Argentina). En Paleoetnobotánica del Cono Sur: estudios de casos y propuestas metodológicas, compilado por B. Marconetto, M. P. Babot y N. Oliszewski, pp. 179- 195. Museo de Antropología, Facultad de Filosofía y Humanidades, Universidad Nacional de Córdoba, Córdoba. [ Links ]
3. Alonso Beato, M. T. y M. I. Cuadrado Rodríguez 1985 Hipótesis sobre la ontogenia del sistema vascular en las raíces de los géneros Chenopodium L. y Atriplex L. Stvdia botánica 4: 89-96. [ Links ]
4. Anabalón Rodríguez, L. y M. Thomet Isla 2009 Comparative analysis of genetic and morphologic diversity among quinoa accessions (Chenopodium quinoa Willd.) of the South of Chile and highland accessions. Journal of Plant Breeding and Crop Science 1 (5): 210-216. [ Links ]
5. Babot, M. P. 2004 Tecnología y utilización de artefactos de molienda en el Noroeste Prehispánico. Tesis Doctoral inédita, Facultad de Ciencias Naturales e Instituto Miguel Lillo, Universidad Nacional de Tucumán, Tucumán. [ Links ]
6. Balfour, E. 1965 Anomalous secondary thickening in Chenopodiaceae, Nyctaginaceae and Amaranthaceae. Phytomorphology 15 (2): 111-122. [ Links ]
7. Barboza, G., E. N. Bonzani, E. M. Filippa, M. C. Luján, R. Moreno, M. Bugatti, N. Decolatti y L. Ariza Espinar 2001 Atlas histomorfológico de plantas de interés medicinal de usos corrientes en Argentina. Museo Botánico Córdoba, Córdoba. [ Links ]
8. Bruno, M. 2005 ¿Domesticados o silvestres? Resultados de la investigación de semillas de Chenopodium Chiripa, Bolivia (1500-10 A.C.). Textos Antropológicos 15 (2): 39-50. [ Links ]
9. Bruno, M. 2006 A morphological approach to documenting the domestication of Chenopodium in the Andes. En Documenting domestication: new genetic and archaeological paradigms, editado por M. Zeder, E. Emshwiller, D. Bradley y B. Smith, pp. 32-45. University of California Press, Berkeley. [ Links ]
10. Bertero, D., D. Medan y A. J. Hall 1996 Changes in Apical Morphology during Floral Initiation and Reproductive Development in Quinoa (Chenopodium quinoa Willd.). Annals of Botany 78: 317-324. [ Links ]
11. Cabrera, A. L. 1947 Notas sobre la vegetación de la Puna argentina. Anales de la Academia Nacional de Ciencias Exactas, Físicas y Naturales 12: 15-38. [ Links ]
12. Cabrera, A. L. 1994 Regiones fitogeográficas argentinas. Enciclopedia Argentina de Agricultura y Jardinería, t. II. Acme, Buenos Aires. [ Links ]
13. Caló, C. M. 2010 Plantas útiles y prácticas cotidianas entre los aldeanos al sur de los Valles Calchaquíes (600 aC- 900 dC). Tesis Doctoral inédita. Facultad de Ciencias Naturales y Museo, Universidad Nacional de la Plata, Argentina. [ Links ]
14. Chilo, G., M. Vacca Molina, R. Carabajal y M. Ochoa 2009 Efecto de la temperatura y salinidad sobre la germinación y crecimiento de plántulas de dos variedades de Chenopodium quinoa. Agriscientia 26 (1): 15-22. [ Links ]
15. Ci Li Shu 2003. Dysphania. Flora of China 5: 376-378. [ Links ]
16. Cuello, A. S. 2006 Guía ilustrada de la flora de Antofagasta de la Sierra-Catamarca (Puna Meridional Argentina). Curso de entrenamiento para la obtención del grado de Licenciatura en Ciencias Biológicas (orientación Botánica). Facultad de Ciencias Naturales e IML. Universidad Nacional de Tucumán. MS. [ Links ]
17. D'Ambrogio de Argüeso, A. 1986 Manual de técnicas en Histología vegetal. Hemisferio Sur, Buenos Aires. [ Links ]
18. Danielsen, S. 2002 Heterothallism in Peronospora farinosa f.sp. chenopodii, the causal agent of downy mildew of quinoa (Chenopodium quinoa). Journal of Basic Microbiology 41 (5): 305-308. [ Links ]
19. Danielsen, S. y L. Munk 2004 Evaluation of disease assessment methods in quinoa for their ability to predict yield loss caused by downy mildew. Crop Protection 23: 219-228. [ Links ]
20. Dimitri, M. 1987 Enciclopedia argentina de agricultura. Acme, Buenos Aires. [ Links ]
21. Escola, P. S., S. M. L. López Campeny, A. R. Martel, A. S. Romano, S. Hocsman y C. Somonte 2013 Re-conociendo un espacio. Prospecciones en la Quebrada de Miriguaca (Antofagasta de la Sierra, Catamarca). Andes 24: 397-423. [ Links ]
22. Fahn, A. 1974 Anatomía vegetal. H. Blume, Madrid. [ Links ]
23. Fuentes, F. F., E. A. Martínez, P. V. Hinrichsen, E. N. Jellen y P. J. Maughan 2009 Assessment of genetic diversity patterns in Chilean quinoa (Chenopodium quinoa Willd.) germplasm using multiplex fluorescent microsatellite markers. Conservation Genetics 10: 369-377. [ Links ]
24. Gade, D. W. 1970 Ethnobotany of cañihua (Chenopodium pallidicaule) rustic seed crop of the altiplano. Economic Botany 24: 55-61. [ Links ]
25. Gallardo, M., J. González y G. Ponessa 1997 Morfología del fruto y semilla de Chenopodium quinoa Wild. Chenopodiaceae. Lilloa 39 (1): 71-80. [ Links ]
26. Gandarillas, H. 1979 Botánica. En Quínua y la Kaniwa: cultivos andinos, compilado por M. Tapia, H. Gandarillas, S. Alandia, A. Cardozo y A. Mujica, pp. 20-44. IICA, Bogotá [ Links ].
27. Gambier, M. 2002 Las Quinas: un nuevo sitio de la Cultura de La Aguada en San Juan. Estudios Atacameños 24: 83-88. [ Links ]
28. Giusti, L. 1967 Chenopodiaceae. En Flora de la Provincia de Buenos Aires, editado por A. L. Cabrera, pp. 81-127. Instituto Nacional de Tecnología Agropecuaria (INTA), Buenos Aires. [ Links ]
29. Giusti, L. 1984 Chenopodiaceae. En Flora patagónica, editado por M. N. Correa, pp. 99-137. Instituto Nacional de Tecnología Agropecuaria (INTA), Buenos Aires. [ Links ]
30. Giusti, L. 1987 Chenopodiaceae. En Flora. II. Entre Ríos, editado por N. S. Troncoso y N. M. Bacigalupo, pp. 137-159. CONICET. [ Links ]
31. Giusti, L. 1997 Chenopodiaceae. En Flora fanerogámica argentina, editado por A. T. Hunziker, pp. 1-52. CONICET, Argentina. [ Links ]
32. Gordon, W. (editor) 1989 Lost Crops of the Incas: Little-Known Plants of the Andes with Promise for Worldwide Cultivation. Report of an Ad Hoc Panel of the Advisory Committee on Technology Innovation Board on Science and Technology for International Development. National Research Council, Washington. [ Links ]
33. Heiser, C. B. y D. C. Nelson 1974 On the origin of the cultivated chenopods (Chenopodium). Genetics 78: 503-505. [ Links ]
34. Hernández, A. M., H. Lagiglia y A. Gil 1999-2000 El registro arqueobotánico en el sitio Agua de Caballos-1 (San Rafael, Mendoza). Anales de Arqueología y Etnología 54-55: 181-203. [ Links ]
35. Hocsman, S. 2006 Producción lítica, variabilidad y cambio en Antofagasta de la Sierra -ca. 5500-1500 AP-. Tesis Doctoral inédita. Facultad de Ciencias Naturales y Museo, Universidad Nacional de La Plata, La Plata. [ Links ]
36. Hunziker, A. 1943 Las especies alimenticias de Amaranthus y Chenopodium cultivadas por los indios de América. Revista Argentina de Agronomía 10 (4): 297-354. [ Links ]
37. Hunziker, A. 1952 Los pseudocereales de la agricultura indígena de América. Acme, Universidad Nacional de Córdoba, Córdoba. [ Links ]
38. Hunziker, A. T. y A. M. Planchuelo 1971 Sobre un nuevo hallazgo de Amaranthus caudatus en tumbas indígenas de Argentina. Kurtziana 6: 63-67.
39. Jancurová, M., L. Minarovičová y A. Dandár 2009 Quinoa-a Review. Czech Journal of Food Sciences 27 (2): 71-79. [ Links ]
40. Kolano, B., A. Plucienniczak, M. Kwasniewski y J. Maluszynska 2008 Chromosomal localization of a novel repetitive sequence in the Chenopodium quinoa genome. Journal of Applied Genetics 49 (4): 313-320. [ Links ]
41. Lagiglia, H. 2001 Los orígenes de la agricultura en la Argentina. En Historia argentina prehispánica, editado por E. Berberián y A. Nielsen, pp. 41-81. Brujas, Córdoba. [ Links ]
42. Leaf Architecture Working Group 1999 Manual of leaf architecture-morphological description and categorization of dicotyledonous and net-veined monocotyledonous angiosperms. Leaf Architecture Working Group, Washington. [ Links ]
43. Llano, C. L. 2005 Recursos vegetales y ocupaciones humanas: perspectivas arqueobotánicas en el sur de Mendoza. Tesis de Licenciatura inédita. Universidad del Aconcagua. San Rafael, Mendoza. [ Links ]
44. López, M. L. 2010 Desgranando las panojas: aproximación etnobotánica y etnoarqueológica del procesamiento de quínoa en Nor Lipez (Potosí, Bolivia). Presentado en el 17° Congreso Nacional de Arqueología Argentina. Mendoza. [ Links ]
45. Martínez Carretero, E. 1995 La Puna argentina: delimitación general y división en distritos florísticos. Boletín de la Sociedad Argentina de Botánica 31 (1-2): 27-40. [ Links ]
46. Maughan, P. J., A. Bonifacio, E. N. Jellen, M. R. Stevens, C. E. Coleman, M. Ricks, S. L. Mason, D. E. Jarvis, B. W. Gardunia y D. J. Fairbanks 2004 A genetic linkage map of quinoa (Chenopodium quinoa) based on AFLP, RAPD, and SSR markers. Theoretical and Applied Genetics 109: 1188-1195. [ Links ]
47. Metcalfe, C. R. y L. Chalk 1950 Anatomy of the dicotyledons, vol. II. Oxford Press, Oxford. [ Links ]
48. Mujica, A y S. E. Jacobsen 2006 La quinua (Chenopodium quinoa Willd.) y sus parientes silvestres. Botánica Económica de los Andes Centrales, editado por M. Moraes R., B. Øllgaard, L. P. Kvist, F. Borchsenius & H. Balslev, pp. 449-457. Universidad Mayor de San Andrés, La Paz. [ Links ]
49. Múlgura, M. E. 1994 Chenopodiaceae. En Flora de San Juan 1, dirigido por R. Kiesling, pp. 86-109. Vázquez Mazzini, Buenos Aires. [ Links ]
50. Olivera, D. E. 1989 Prospecciones arqueológicas en Antofagasta de la Sierra (Puna Argentina), Provincia de Catamarca. Informe preliminar. Shincal 1: 7-23. [ Links ]
51. Olivera, D. E. 1992 Tecnología y Estrategias de Adaptación en el Formativo (Agro-alfarero Temprano) de la Puna Meridional Argentina. Un Caso de Estudio: Antofagasta de la Sierra (Provincia de Catamarca, R. A.). Tesis Doctoral inédita. Facultad de Ciencias Naturales y Museo, Universidad Nacional de La Plata, La Plata. [ Links ]
52. Olivera, D. E. 2006 Recursos bióticos y subsistencia en sociedades agropastoriles de la Puna Meridional Argentina. Comechingonia 9: 19-55. [ Links ]
53. Olivera, D. y M. Podestá 1993 Los recursos del arte: arte rupestre y sistemas de asentamiento-subsistencia formativos en la Puna meridional argentina. Arqueología 3: 93-141. [ Links ]
54. Planchuelo, A. M. 1975 Estudio de los frutos y semillas del género Chenopodium en la Argentina. Darwiniana19: 528-565. [ Links ]
55. Prego, I., S. Maldonado y M. Otegui 1998 Seed structure and localization of reserves in Chenopodium quinoa. Annals of Botany 82: 481-488. [ Links ]
56. Rodríguez, M. F., Z. E. Rúgolo de Agrasar y C. A. Aschero 2006 El uso de las plantas y el espacio doméstico en la Puna meridional argentina a comienzos del Holoceno Tardío. Sitio arqueológico Punta de la Peña 4, capa 3x/y. Chungara 38 (2): 253-267. [ Links ]
57. Scott, A. J. 1978 A review of the classification of Chenopodium L. and related genera (Chenopodiaceae). Botanische Jahrbücher für Systematik 100 (2): 205-220. [ Links ]
58. Simmonds, N. D. 1971 The breeding system of Chenopodium quinoa. Heredity 27: 73-82. [ Links ]
59. Solereder, H. 1908 Systematic anatomy of the dicotyledons, vol. II. Oxford Press, Oxford. [ Links ]
60. Tagle, B. y M. T. Planella 2002 La Quínoa en la zona central de Chile. Supervivencia de una Tradición Prehispana. IKU, Santiago, Chile. [ Links ]
61. Tapia, M., H. Gandarillas, S. Alandia, R. Ortiz, V. Otazu, J. Rea, B. Salas y E. Zanabria 1979 La quínoa y la kañiwa. Cultivos andinos. IICA, Bogotá [ Links ].
62. Thoufeek Ahamed, N., R. S. Singhal, P. R. Kulkarni y M. Pal 1998 A lesser-known grain, Chenopodium quinoa: Review of the chemical composition of its edible parts Food and Nutrition Bulletin 19 (1): 61-70. [ Links ]
63. Torres, M. O., A. A. Guzmán y R. Carvajal 2002 Valor nutricional de 10 variedades de quínoa (Chenopodium quinoa Willd.) del altiplano boliviano. Biofarbo 10: 55-60. [ Links ]
64. Wilson, H. D. 1990 Quinoa and relatives (Chenopodium sect. Chenopodium subsect. Cellulata). Economic Botany 44 (3 Supplement): 92-110. [ Links ]
65. Zuloaga, F. y O. Morrone 1999 Catálogo de plantas vasculares de la República Argentina, vol. II, Dicotyledoneae. Missouri Botanical Garden, Buenos Aires. [ Links ]














