Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista argentina de cardiología
versão On-line ISSN 1850-3748
Rev. argent. cardiol. v.73 n.6 Buenos Aires nov./dez. 2005
CONSENSOS
Consenso de Fibrilación Auricular
Coordinador
Dr. Marcelo V. Elizari
Secretario
Dr. Jorge Galperín
Integrantes
Dr. Rafael S. Acunzo
Dr. Marcelo G. Casey
Dr. Tomás Cianciulli
Dr. Pablo A. Chiale
Dr. Marcelo V. Elizari
Dr. Osvaldo Fustinoni
Dr. Eduardo Gabe
Dr. Jorge Galperín
Dr. Hugo Garro
Dra. Graciela Gimeno
Dr. Alberto Giniger
Dr. Luis A. Girotti
Dr. Eduardo Guevara
Dr. Marcelo Helguera
Dr. Carlos Labadet
Dr. Héctor A. Machain
Dr. Eleno Martínez Aquino
Dr. Claudio Militello
Dr. Julio Pastori
Dr. Claudio Pensa
Dr. Ricardo Pesce
Dr. Raúl Rey
Dr. Rubén A. Sánchez
Dr. Jorge Schmidberg
Dr. Eduardo Szwarcer
Dra. Elina Valero de Pesce
Dr. Manuel Vázquez Blanco
Dr. Alejandro M. Villamil
Dr. Ernesto Weinschelbaum
Dr. Eduardo A. Sampó
(por Comité Organizador, Área de Normatizaciones y Consensos SAC)
El avance más significativo en la disminución de la mortalidad y la morbilidad de la FA se debe a la terapéutica anticoagulante bien indicada y controlada. En conclusión, los avances en el manejo de la FA en esta última década han sido muy importantes y por ello, la razón de este consenso.
Como Coordinador de este Consenso, deseo agradecer a los cardiólogos, cardiocirujanos, neurólogos y hematólogos que contribuyeron de manera incondicional y desinteresada. Asimismo, mi agradecimiento al Área de Normatizaciones y Consensos de la Sociedad Argentina de Cardiología, que me confiaron esta tarea, que fue llevada a cabo con la invalorable colaboración del Dr. Jorge Galperín en su función de secretario.
Marcelo V. Elizari
LA FIBRILACIÓN AURICULAR EN LA CARDIOLOGÍA ACTUAL
Los avances en el conocimiento de la epidemiología, la etiopatogenia, las nuevas terapias y los resultados de los grandes ensayos clínicos han modificado sustancialmente el conocimiento y el manejo de la fibrilación auricular (FA), que es la causa más frecuente de internaciones cardiológicas por arritmias en la práctica clínica.
Estos avances han mejorado nuestra conducta sobre el control de la frecuencia, las diferentes formas de conversión al ritmo sinusal y su mantenimiento, así como las medidas más apropiadas para evitar los fenómenos tromboembólicos relacionados con la FA. La ablación por radiofrecuencia de la FA (y la cirugía en casos especiales) ocupan en la actualidad un lugar cada vez más destacado.
Varios ensayos clínicos han demostrado que el control de la frecuencia, comparado con el control del ritmo, es una alternativa adecuada en un grupo importante de pacientes en lugar de utilizar tratamientos farmacológicos y no farmacológicos agresivos para mantener el ritmo sinusal. Desde el punto de vista farmacológico, existen nuevas drogas y nuevas modalidades para la conversión de la FA aguda a ritmo sinusal.
Para destacar, la amiodarona, intravenosa u oral, se ha incorporado de manera definitiva al armamentario terapéutico para la reversión de la FA aguda o persistente con ventajas sobre las otras drogas antiarrítmicas disponibles en la actualidad, en términos de seguridad y eficacia. Asimismo, los calcioantagonistas, los IECA y los bloqueantes de los receptores de la angiotensina parecen contribuir a la atenuación de los efectos de la FA sobre la remodelación de las aurículas.
FIBRILACIÓN AURICULAR
Epidemiología
La fibrilación auricular (FA) es la arritmia sostenida más frecuente en el hombre. Su prevalencia es de alrededor del 0,5% según la población en estudio y alcanza el 8% para los mayores de 80 años. En el estudio Framingham se señaló una prevalencia de FA del 12% en los mayores de 70 años en comparación con el 5% entre los 60 y 70 años. A cualquier edad, la incidencia de FA es 1,5 vez mayor en el hombre que en la mujer. (1) Existen factores asociados en forma independiente con el desarrollo de esta arritmia: la edad, el sexo, la cardiopatía isquémica, la hipertensión arterial, la insuficiencia cardíaca y la enfermedad reumática. El riesgo de desarrollar FA en el resto de la vida a partir de los 40 años es del 26% para los varones y del 23% para las mujeres. En los casos en los que no se detecta ninguna cardiopatía asociada, la FA recibe el nombre de solitaria.
Un estudio reciente realizado en la Argentina mostró que la edad media de la población estudiada con FA crónica fue de 71 años, con predominio del sexo masculino, y las patologías prevalecientes fueron la hipertensión arterial y la insuficiencia cardíaca. (2)
Pronóstico de la fibrilación auricular
La información epidemiológica más importante es la comunicada por el estudio Framingham, que evaluó más de 5.000 pacientes en un seguimiento de más de 20 años. Información reciente de este estudio mostró que la mayor mortalidad atribuible a la FA fue independiente de otras variables, como la hipertensión arterial, la cardiopatía isquémica y la insuficiencia cardíaca y fue significativamente mayor en la mujer que en el hombre. Una de las falencias de este estudio consistió en la falta de datos acerca de otras variables pronósticas de importancia, como el grado de disfunción ventricular y los tratamientos indicados.
La FA agrava el pronóstico a través de dos mecanismos básicos, la embolia sistémica y el desarrollo o empeoramiento de la disfunción ventricular.
El riesgo de accidente cerebrovascular (ACV) es 17 veces mayor en la FA con enfermedad reumática y 5 veces en la FA no reumática. La proporción de ACV asociado con FA se incrementa del 1,5% entre los 50 y 59 años hasta el 23,5% en aquellos de entre 80 y 89 años. En este último grupo etario, la arritmia es un predictor independiente para ACV además de la hipertensión o la insuficiencia cardíaca.
La incidencia de la FA aumenta entre 8 y 20 veces en pacientes con insuficiencia cardíaca, pero su valor como variable independiente de mortalidad es discutible.
En fecha reciente presentamos datos de un seguimiento a dos años de 752 pacientes con FA crónica en nuestro país. (2) La prevalencia de hipertensión fue del 41% y la de diabetes, del 12%. Un 89% tenía cardiopatía de base definida y sólo el 50% recibió tratamiento anticoagulante. La mortalidad total fue del 23%, tasa que resultó elevada, pero que se explica en parte por la edad avanzada de los pacientes y por la presencia de cardiopatía subyacente. Cabe destacar que la mortalidad fue significativamente mayor en los pacientes no anticoagulados (28% versus 16%) al igual que el ACV (9,5% versus 4,9%). En el análisis multivariado, la ausencia de anticoagulación se vinculó en forma independiente a estos eventos. (2)
ETIOPATOGENIA Y MECANISMOS ELECTROFISIOLÓGICOS DE LA FIBRILACIÓN AURICULAR
En la génesis de la FA intervienen factores múltiples de carácter anatómico y funcional que condicionan la aparición de las anormalidades electrofisiológicas que favorecen la instalación y/o la perpetuación de la arritmia.
Diversas cardiopatías que comprometen de manera directa o indirecta al miocardio auricular y la propia FA producen anormalidades estructurales, como fibrosis intersticial parcelar y yuxtaposición de fibras auriculares normales y dañadas, que explican la heterogeneidad de la refractariedad auricular, una de las alteraciones electrofisiológicas subyacentes fundamentales. También se observa infiltración grasa y fibrosis a nivel del nódulo sinusal, como una reacción a procesos inflamatorios o degenerativos de detección difícil. La edad, por sí sola, determina cambios estructurales de las fibras auriculares que conforman el sustrato de la FA. (3) Aunque no se ha evaluado el papel de la miocarditis, las anomalías histológicas compatibles con esta patología se hallaron en el 66% de las biopsias endomiocárdicas auriculares de pacientes con FA solitaria. (4) Más aún, en estudios recientes se halló una relación estadística entre niveles elevados de proteína C reactiva y fibrilación auricular y el marcador de inflamación sistémica sería un nuevo predictor del riesgo de padecer la arritmia.
La hipertrofia y la dilatación auricular pueden ser la causa o la consecuencia de la FA persistente. La participación de anormalidades inmunorreguladoras en pacientes predispuestos genéticamente se sugirió por el hallazgo de niveles séricos elevados de anticuerpos antimiosina de cadena pesada en casos de FA paroxística sin cardiopatía estructural. (5)
Los mecanismos electrofisiológicos básicos de la FA son la reentrada y las descargas rápidas de focos auriculares ectópicos. (6) La hipótesis de las reentradas múltiples propone que el fraccionamiento de los frentes de ondas reentrantes genera ondas reentrantes "hijas" que se autoperpetúan. El número de ondas reentrantes depende de la duración del período refractario, de la masa de tejido y de la velocidad de conducción en diferentes sectores de las aurículas. Una masa auricular considerable puede albergar un número mayor de ondas reentrantes y favorecer la perpetuación de la FA. (7)
La existencia de una masa crítica de tejido auricular parece imprescindible para mantener la FA, hecho que explica la eficacia de la cirugía del "laberinto" y de las lesiones lineales creadas por radiofrecuencia en el miocardio auricular.
La FA "focal" obedece a la presencia de focos auriculares que descargan impulsos a frecuencias muy rápidas y cuya irregularidad se presume que se debe a interacciones entre los frentes de onda de frecuencia elevada producidos por el generador primario y las propiedades variables del período refractario auricular (conducción "fibrilatoria"). Esos focos se localizan, con frecuencia, en las venas pulmonares superiores y el mecanismo "focal" parece operar sobre todo en la FA paroxística.
Un aspecto fisiopatogénico relevante es la denominada "remodelación auricular". La propensión creciente para sostener la arritmia en la medida en que ésta se prolonga en el tiempo se relaciona con una abreviación progresiva del potencial de acción y de los períodos refractarios efectivos auriculares causados por las alteraciones de las corrientes iónicas (remodelación eléctrica). Los períodos prolongados de FA pueden provocar alteraciones de la contractilidad auricular, cuya normalización ulterior depende de la duración de la arritmia. (8)
Los pacientes con FA presentan niveles elevados de cinasa auricular relacionada con las señales extracelulares y de enzima convertidora de la angiotensina, con un incremento de la demanda de los receptores tipo 2 de la angiotensina II y una reducción del número de receptores tipo 1 de la angiotensina II. La concentración elevada de la enzima apoptótica caspasa 3 sugiere la participación de la apoptosis. (9)
Otros factores que intervienen en la inducción o el mantenimiento de la FA son las extrasístoles auriculares y otras taquiarritmias supraventriculares que pueden transformarse en FA, la actividad del sistema nervioso autónomo, la isquemia, la elongación de las fibras, la conducción anisotrópica auricular y, como ya se mencionó, los cambios estructurales causados por el envejecimiento. (10, 12) La conducción lenta está involucrada en la dispersión de la refractariedad auricular, en especial en los corazones con enfermedades estructurales.
La hipervagotonía es responsable de episodios de FA nocturnos o posprandiales en individuos sin cardiopatías orgánicas. La hipersimpaticotonía (por ejercicio, emociones, estrés quirúrgico o administración de catecolaminas exógenas) también interviene en la génesis de la arritmia. (11, 13)
Es sabido que los portadores del síndrome de Wolff- Parkinson-White presentan una incidencia elevada de FA, que varía según las estadísticas entre el 21% y el 56%. (13)
CLÍNICA DE LA FIBRILACIÓN AURICULAR
Clasificación
La forma de presentación de la fibrilación auricular (FA) es heterogénea; ocurre en presencia o en ausencia de enfermedad cardíaca detectable o de síntomas relacionados. Se han propuesto varias clasificaciones y, en este sentido, los términos utilizados son muchos e incluyen las formas aguda, crónica, paroxística, intermitente, constante, persistente y permanente. El informe de la Task Force recomienda una clasificación basada en la búsqueda de simplicidad y relevancia clínica. (14)
Primer episodio: se deberá distinguir un primer episodio, ya sea sintomático o no o autolimitado, aunque puede haber dudas respecto de su duración y de episodios previos no detectados.
1. Paroxística: se designa así a la FA que se presenta con episodios de corta duración (segundos, minutos u horas) que se interrumpen espontáneamente. No importa el tiempo de evolución, pero es más frecuente en las arritmias de hasta 7 días de evolución (en su mayoría menos de 24 horas).

Fig. 1. Fibrilación auricular. Clasificación (las flechas indican los cambios posibles entre las diferentes formas).
2. Persistente: generalmente se prolonga por días (7 o más), meses o años; en este caso, la arritmia sólo se interrumpe por medicación o por cardioversión eléctrica.
3. Permanente: se designa así cuando por decisión médica no se intentó la reversión de la arritmia o ésta no revirtió con la terapéutica administrada, o bien cuando luego de una o varias recidivas se decide no intentar nuevas cardioversiones.
4. Recurrente: Si hubo dos o más episodios. Las formas paroxística y persistente pueden ser recurrentes.
Cabe destacar que esta terminología se aplica a los episodios de FA que duran más de 30 segundos y no se relacionan con causas reversibles. Cuando existen causas reversibles, la FA se considera en forma separada, dado que la recurrencia es poco probable una vez que se resuelve la condición de base y se produce la reversión de la FA.
Etiología
Las enfermedades cardiovasculares específicas que se asocian con FA son las valvulopatías, en especial la mitral, la hipertensión arterial, en particular cuando existe hipertrofia ventricular izquierda y la enfermedad arterial coronaria. Estas patologías (solas o asociadas) están presentes en más del 50% de los casos.
Otras asociaciones posibles son las miocardiopatías (hipertrófica, dilatada y restrictiva), las enfermedades congénitas (especialmente los defectos septales en adultos), el corazón pulmonar, los tumores cardíacos y la dilatación idiopática de la aurícula derecha y el hipertiroidismo. Con frecuencia se encuentra en pacientes con apnea del sueño (mayor incidencia en obesos e hipertensos).
La FA solitaria ocurre en individuos jóvenes (en general menores de 60 años) sin evidencias clínicas o ecocardiográficas de enfermedad cardiopulmonar. Estos pacientes tienen un pronóstico bueno con respecto a la tromboembolia cerebral y la mortalidad. Entre el 30% y el 45% de las FA paroxísticas y del 10% al 25% de las formas persistentes ocurren en pacientes más jóvenes y sin enfermedad demostrable.
El sistema nervioso autónomo puede disparar la FA en pacientes susceptibles a través del incremento del tono vagal o simpático. (11, 15) A pesar de que los casos con FA puramente vagal o adrenérgica son infrecuentes, cuando la historia clínica revela las características de uno de estos dos síndromes se pueden seleccionar mejor los agentes que pueden evitar las recurrencias.
Manifestaciones clínicas
La fibrilación auricular puede ser sintomática o asintomática, aun en el mismo sujeto.
Los síntomas varían con la respuesta ventricular, el estatus clínico, la duración de la FA y la percepción individual del paciente.
La mayoría de los individuos refieren palpitaciones, mientras que el dolor de pecho, la disnea, los mareos o el síncope dependen de la patología subyacente. La embolia, la exacerbación o la aparición de la insuficiencia cardíaca pueden ser la primera manifestación de la arritmia.
La respuesta ventricular en una FA (por lo general rápida) depende de las propiedades electrofisiológicas del nódulo AV, del nivel del tono vagal y simpático y de la acción de los fármacos. El ritmo puede ser regular en presencia de bloqueo AV completo o de alto grado (ritmos de la unión AV o idioventricular). Las frecuencias extremadamente rápidas (más de 200 lpm) sugieren la presencia de una vía accesoria.
El riesgo de ACV y de embolias periféricas es mayor en pacientes con FA no anticoagulados.
En pacientes con cardiopatías estructurales e insuficiencia cardíaca, el volumen minuto cae como resultado de la pérdida de la secuencia de contracción auricular y ventricular y del acortamiento de la diástole ventricular.
La evaluación clínica debe incluir en todos los casos: 1) historia clínica, 2) examen físico y 3) estudios complementarios (electrocardiograma, radiografía de tórax, estudios Holter, ecocardiograma y estudios de laboratorio).
UTILIDAD DE LA ECOCARDIOGRAFÍA EN LA FIBRILACIÓN AURICULAR
El ecocardiograma transtorácico (ETT) está indicado en todos los pacientes con FA. El ecocardiograma transesofágico (ETE) se indica en un subgrupo especial de pacientes para la pesquisa de trombos auriculares o como guía para una cardioversión precoz.
Evaluación de la causa de la fibrilación auricular
El ETT puede detectar las causas o los factores predisponentes de la FA.
Evaluación anatómica de las aurículas
a) Diámetro anteroposterior de la aurícula izquierda (AI) en nivel IV del modo M o en la vista del eje largo paraesternal izquierdo en el fin de la sístole ventricular.
b) Área de ambas aurículas en la vista apical de 4 cámaras.
La presencia de aneurisma a nivel del SIA se asocia con taquiarritmias supraventriculares y con eventos isquémicos cerebrales.
La permeabilidad del foramen oval tiene especial significación cuando se asocia con aneurismas del septum interauricular y otros factores predisponentes (trombosis venosa profunda, tromboembolia pulmonar con hipertensión pulmonar y síndromes procoagulantes).
A mayor dimensión de las aurículas (en especial la AI), menor probabilidad de mantener el ritmo sinusal.
Evaluación de la función sistólica auricular
Modo M
● Índice de vaciamiento auricular.
2D
● Fracción de acortamiento del área auricular.
● Contribución auricular al llenado ventricular Eco-Doppler
● Velocidad e integral de la onda A (influida por las presiones diastólicas de los ventrículos) de ambos flujos auriculoventriculares.
● Evaluación del incremento de la velocidad de la onda A en pacientes poscardioversión como indicador de la recuperación de la actividad mecánica auricular y predictor independiente del mantenimiento del ritmo sinusal.
● El Doppler tisular aporta índices de función de ambas aurículas y de la orejuela de la AI.
ETE
● Detección de trombos y/o ecogenicidad espontánea.
● Fracción de acortamiento de la orejuela de la AI como predictor de ecogenicidad espontánea y/o trombosis a ese nivel.
● Velocidad de eyección de la orejuela de la AI como predictor de ecogenicidad espontánea y/o trombosis a ese nivel.
Identificación de trombos
La FA está presente en el 45% de los pacientes con accidentes cerebrovasculares embólicos.
El 85% de los trombos auriculares se asientan en la AI y el 15% en la AD.
El método de elección para detectar trombos intraauriculares es el ETE con transductor omniplanar. Su detección es una contraindicación de cardioversión electiva inmediata. El ETE precardioversión revela la presencia de trombos en la AI o en su orejuela en el 5% a 15% de los pacientes.
El ETE permite abreviar el período de anticoagulación precardioversión si se descartan trombos, pero debe mantenerse 4 semanas después de realizada para evitar los enventuales accidentes embólicos poscardioversión.
Flujo de las venas pulmonares
El análisis del flujo de las venas pulmonares por ETT o ETE es útil para estimar las presiones de llenado del ventrículo izquierdo (VI), así como para la detección precoz de signos de estenosis de las venas pulmonares luego de la ablación por radiofrecuencia de los focos responsables de la FA. El seguimiento ulterior puede hacerse mediante resonancia magnética.
Evaluación de la función ventricular
En la disfunción sistólica moderada o severa se duplica el riesgo de ACV en relación con pacientes con función normal o levemente disminuida.
PREVENCIÓN PRIMARIA Y SECUNDARIA DE ACV EN LA FIBRILACIÓN AURICULAR NO VALVULAR (FANV)
Los estudios Atrial Fibrillation Investigators (AFI), (16) SPAF (17) y el American College of Chest Physicians (ACCP) (18) analizaron la relación entre factores de riesgo (FR) y grado de riesgo de eventos embólicos en pacientes con FANV y sus resultados se expresan en la Tabla 1.
TABLA 1
Prevención primaria de ACV en pacientes con FANV

HTA: Hipertensión arterial. VI: Ventrículo izquierdo. DBT: Diabetes. FR: Factores
de riesgo.
Nota: El antecedente de AIT o de ACV se relacionó con alto riesgo embólico en estos tres análisis (en este caso se trató de prevención secundaria).
El estudio observacional Framingham Heart (19) analizó prospectivamente una cohorte de 866 participantes que habían tenido FANV de comienzo reciente. Se desarrollaron índices de riesgo de ACV o ACV y muerte, con un seguimiento de la población a 4 años. Los FR de ACV fueron edad avanzada, sexo femenino, aumento de la TA sistólica, accidente isquémico transitorio (AIT) o ACV previo y diabetes. El Score de Riesgo de ACV de Framingham atribuye un puntaje para predecir riesgo de ACV a los 5 años analizando esos factores de riesgo (Véase: www.nhlbi.nih.gov/about/framingham/stroke.htm).
En un análisis del Registro Nacional Estadounidense (20) de pacientes con FANV se comparó la frecuencia de episodios embólicos a lo largo del tiempo de los pacientes no anticoagulados y controlados evolutivamente, clasificados de alto riesgo (AR), riesgo intermedio (RI) o bajo riesgo (BR) acorde con la definición de los estudios AFI y SPAF contra un Score de Riesgo denominado CHADS2, que surge de: C [congestive heart failure (insuficiencia cardíaca)], H (HTA), A [age: (edad)], D (diabetes), stroke (AIT-ACV). Todos estos factores de riesgo recibieron un puntaje de 1, a excepción de las isquemias neurológicas que tuvieron 2 puntos; es decir que el puntaje máximo era 6. Un puntaje de 3 o más resultó de alto riesgo. El Score CHADS2 se relacionó muy bien con la frecuencia de eventos por 100 pacientes/año de los estudios AFI y SPAF y se concluyó que los dos esquemas de calificación de riesgo y el CHADS2 son útiles para cuantificar el riesgo de ACV en pacientes con FA y que pueden ser de utilidad en la selección de la terapéutica anticoagulante.
Antitrombosis en prevención primaria
Anticoagulación oral (ACO)
La warfarina (W) es útil en prevención primaria de tromboembolismo (TE) en pacientes con FA. Dos metaanálisis muestran una reducción de riesgo relativo (RRR) del 62% (IC 95% del 48% al 72%) en comparación con el placebo. El RIN osciló entre 2 y 3,5. La ACO redujo significativamente la mortalidad: RRR 26%; IC 95% del 4% al 43%; RRA 1,6%/año.
Aspirina (AAS).Comparación con warfarina (W)
Un metaanálisis con AAS comparada con placebo (n = 3.337) mostró una reducción en la tasa de ACV del 22% (IC 95% del 2% al 38%). La reducción de riesgo absoluto (RRA) anual de ACV en prevención primaria fue del 1,5% (el número de pacientes necesario a tratar por año para prevenir un ACV fue de 67). La reducción de riesgo de ACV invalidante fue del 17% (p = NS) y la de ACV no invalidante fue del 62% (p = 0,008). La aspirina no modificó la incidencia de muerte: RRR 16%, IC 95% del -5% al 32%. Otro metaanálisis (n = 2.837) confirmó que la W en dosis ajustada redujo significativamente la incidencia de ACV total.
El mayor riesgo de la ACO es la hemorragia. El nivel de complicación hemorrágica es cercano al 1,4%, pero en los pacientes octogenarios llega al 3%-4% pacientes/ año. Una publicación de una cohorte importante de pacientes con ACV isquémico y FA mostró que cuando el RIN estaba por debajo de 2,0 el riesgo de ACV isquémico severo y la mortalidad aumentan significativamente. El aumento del RIN se asoció con una tasa mayor de hemorragias. Estudios recientes mostraron que la tasa de hemorragias intracerebrales por cien personas/año aumentó del 0,5% al 2,7% (IC 95%: 1,0-7,3) con un RIN mayor de 3. (21)
Recomendaciones
Clase I. Nivel de evidencia A
1. Dar ACO o AAS a todos los pacientes con FANV, excepto la FA solitaria, de menos de 60 años.
2. Individualizar el antitrombótico, acorde a los riesgos absolutos de ACV o hemorragia y riesgo relativo y beneficio para cada paciente.
3. Usar ACO en dosis ajustadas (RIN de 2 a 3) en pacientes con alto riesgo de ACV, salvo contraindicación. Evaluar con regularidad la necesidad de ACO.
4. La aspirina (325 mg/d) es una alternativa para pacientes con FA de bajo riesgo y para pacientes con contraindicaciones firmes para ACO.
Clase I. Nivel de evidencia B
- Pacientes con FA con enfermedad valvular mitral o prótesis valvular cardíaca mecánica o biológica: ACO (RIN 2 a 3).
Clase II. Nivel de evidencia B
- Seleccionar antitrombosis con el mismo criterio para la FA paroxística, persistente o permanente.
Clase IIa. Nivel de evidencia C
1. RIN cercano a 2 para prevención de TE en pacientes mayores de 75 años, con riesgo alto de hemorragias, sin contraindicación clara para ACO.
2. Pacientes con aleteo auricular: tratamiento similar al de los pacientes con FA con factores de riesgo similares.
Clase IIb. Nivel de evidencia C
1. Interrumpir la ACO una semana para cirugía o procedimientos diagnósticos con riesgo de sangrado sin sustituir por heparina (pacientes sin prótesis valvular cardíaca).
2. Administrar heparina no fraccionada (HNF) o heparina de bajo peso molecuar (HBPM) en pacientes electivos de alto riesgo si hay que interrumpir la ACO, o cuando ésta debe interrumpirse por un período mayor de una semana.
3. Enfermedad coronaria: ACO (RIN 2-3), del mismo modo que a los pacientes no coronarios. Pueden adicionarse 100 mg de aspirina. El clopidogrel (75 mg/d) no se ha evaluado suficientemente.
4. La aspirina es opcional para la prevención primaria de ACV en menores de 60 años sin enfermedad cardíaca o factores de riesgo embólicos (FA aislada).
Clase III. Nivel de evidencia C
- ACO a largo plazo para prevención de ACV o TE en pacientes con FA solitaria.
Antitrombóticos en prevención secundaria (FANV y antecedentes de AIT o de ACV cardioembólico)
La ACO redujo los eventos embólicos el 68%. La RRA anual de ACV fue del 8,4% (NNT = 12). La RRA anual de ACV con aspirina fue del 2,5% (NNT = 40).
Estudios clínicos: el EAFT (ACO RIN 2,5-4,0 versus AAS 300 mg/d o placebo) analizó recurrencia de eventos vasculares en pacientes con FANV y antecedentes de isquemia cerebral (n = 1.007). Edad media: 73 años. Los pacientes no elegibles para ACO recibieron aspirina (300 mg/d) o placebo.
La tasa de eventos isquémicos cuando el RIN estaba entre 2,0 y 3,9 fue del 3,5% anual.
El AAS redujo la tasa de eventos primarios en un 19%; en el grupo placebo la reducción fue del 15% (p = 0,12). La aspirina previene 40 ACV isquémicos por 1.000 pacientes tratados por año. La W redujo el riesgo de eventos vasculares serios a la mitad en relación con el AAS (OR 0,55; IC 95% 0,36-0,83) (50 eventos vasculares por mil pacientes tratados/año) y el riesgo de ACV en dos tercios (OR 0,35, IC 95% 0,22-0,59) (disminución de 60 ACV por mil pacientes tratados). La ACO se relacionó con mayor frecuencia de hemorragias mayores, pero la diferencia anual absoluta fue pequeña (2,8% versus 0,9%).
Recomendaciones para la prevención secundaria en pacientes con FANV
Clase I. Nivel de evidencia A
- ACO (RIN 2,0-3,0).
Clase II. Nivel de evidencia B
- Reducción del nivel del RIN en pacientes mayores de 74 años (entre 2,0-2,5?).
Cardioversión (CV) y fibrilación auricular
En pacientes sometidos a CV eléctrica (CVE) que no recibieron tratamiento anticoagulante, la incidencia de ACV fue del 6,8% versus el 1,1% en los que lo recibieron.
Se recomienda ACO (RIN 2-3) para pacientes con FANV > 48 horas desde la aparición de la FA (o FANV de duración incierta), 3 semanas pre-CV y 4 semanas pos-CV.
Para disminuir el tiempo de ACO puede usarse eco transesofágico (ETE) (en ausencia de trombo se puede cardiovertir) y reducir la anticoagulación a sólo 4 semanas pos-CV, con una incidencia menor de hemorragias.
En el grupo de pacientes con FANV < 48 horas de duración, el beneficio de la anticoagulación es menos claro, aunque para la CV eléctrica en pacientes con inestabilidad hemodinámica con historia previa de ACV, disfunción severa del VI o episodios previos de FA parecería lógica la estrategia de usar HNF o HBPM peri-CV más ACO oral durante sólo 4 semanas.
Usar igual criterio para el aleteo auricular.
El riesgo de embolias en pacientes con FA paroxística es similar al de los pacientes con FA continua, por lo que se recomienda la misma conducta terapéutica en ambos casos.
Recomendaciones
Clase I. Nivel de evidencia B
1. ACO (RIN 2-3) tanto en CVE como farmacológica.
2. Para pacientes con FA > 48 horas (o desconocida): ACO 3 semanas previas y 4 semanas pos-CV RIN > 2.
3. FA crónica con ETE previo: si no hay trombo, usar HNF IV y 4 semanas de ACO pos-CVE.
Clase I. Nivel de evidencia C
- FA con ETE con trombo: anticoagular con HNF en bolo e IV y seguir con ACO 4 semanas antes y 4 semanas pos-CV.
Clase II. Nivel de evidencia B 1
. Anticoagular igual que a pacientes con FA.
2. Cardioversión en las primeras 48 horas de FA sin control con ETE. En estos casos, la anticoagulación antes de la CV y después de ella es opcional, con dependencia del riesgo.
Clase II. Nivel de evidencia C
1. HNF IV y 4 semanas de ACO para pacientes con antecedentes de ACV, disfunción severa del VI o estenosis mitral sin contraindicaciones para anticoagulación.
2. FA aguda con inestabilidad hemodinámica que produce angina de pecho, IAM, shock o edema agudo de pulmón: se puede hacer CV sin ACO previa. Administrar heparina IV seguida de anticoagulación oral (RIN 2 a 3) por 4 semanas por lo menos.
FIBRILACIÓN AURICULAR Y STROKE
En los países desarrollados, la enfermedad cerebrovascular ocupa el tercer lugar como causa de muerte y el primero como causa de discapacidad permanente en los adultos. Las embolias de origen cardíaco producen el 6% a 34% de los infartos cerebrales y la FANV es su causa más frecuente, la cual origina aproximadamente el 45% de todos los infartos cerebrales cardioembólicos. La FA es un factor de riesgo independiente importante de ACV que aumenta con la edad. En pacientes con FA, el riesgo de ACV es del 1,5% en pacientes de 50 a 59 años y asciende al 23,5% en el grupo de pacientes de 80 a 89 años. La frecuencia de ACV isquémico en pacientes con FA incluidos en ensayos clínicos de prevención primaria y no tratados con terapia antitrombótica promedia el 5% por año. (22)
El 75% de los ACV isquémicos asociados con FA probablemente se deben a embolia de origen cardíaco y el 25% restante corresponde a otras causas.
La ACO es más eficaz que la aspirina, la aspirina es más segura que la ACO, la aspirina es más eficaz que el placebo y se desconoce la eficacia del clopidogrel, sólo o asociado con la aspirina, lo cual se está evaluando en la actualidad.
La hemorragia intracraneana (HIC) es sin lugar a dudas la complicación más temible de la ACO, porque a menudo es fatal o causa de discapacidad permanente. Con niveles convencionales de anticoagulación, en pacientes seguidos por ataques isquémicos transitorios o infartos de miocardio, el riesgo de hemorragia cerebral se incrementa 8 veces (cerca del 1% anual), además del 2% anual que experimenta hemorragias severas extracerebrales.
Hay evidencia de que el anciano puede tener un riesgo mayor de hemorragia cerebral (evaluados con secuencias de ecogradiente), por la presencia de angiopatía amiloide, y aumento de la fragilidad vascular. (23) Los niveles prefijados elevados de anticogulación (RIN de 4 o mayores) incrementan el riesgo de HIC. Asimismo, el riesgo de sangrado cerebral es mayor si hay enfermedad cerebrovascular arterial coexistente o presencia de leucoaraiosis (desmielinización periventricular) en la TC. La asociación con hipertensión arterial, el uso de múltiples drogas y la historia de tromboembolia son marcadores de riesgo de hemorragia en pacientes bajo tratamiento con warfarina en prevención del ACV.
El antecedente de ACV hemorrágico, la presencia de crisis convulsivas, una alteración en la marcha, la ataxia, una secuela motora severa y en general todo riesgo de caídas frecuentes aumentan el riesgo de complicaciones hemorrágicas y son contraindicaciones neurológicas aceptadas de ACO.
El candidato ideal para la anticoagulación es hipotéticamente aquel paciente con alto riesgo de ACV embólico y bajo riesgo de complicaciones hemorrágicas. Pero, lamentablemente, los factores de riesgo de infarto cerebral se superponen con los de hemorragia en muchos pacientes (edad avanzada, hipertensión arterial, ACV previo), por lo cual la decisión de indicar ACO debe ser individualizada.
RECOMENDACIONES PARA LA CARDIOVERSIÓN FARMACOLÓGICA DE LA FIBRILACIÓN AURICULAR
La cardioversión farmacológica es más simple que la eléctrica (no requiere anestesia), pero es menos efectiva.
El tratamiento farmacológico temprano para restaurar el ritmo sinusal se plantea para los pacientes con FA de menos de 48 horas de evolución o para quienes, cualquiera que sea la duración de la arritmia, reciben tratamiento ACO crónico. Se sabe que entre el 50% y el 70% de los pacientes con FA de reciente instalación presentan reversión espontánea en las primeras horas del comienzo de la arritmia. Sin embargo, ello es infrecuente en la FA con más de 7 días de duración. El tratamiento farmacológico, instituido en forma precoz y en dosis adecuadas, aumenta las probabilidades de reversión hasta un 90%.
Cuando la duración de la FA supera las 48 horas o se desconoce, se debe controlar la frecuencia cardíaca, si fuese necesario, e iniciar la ACO, que se mantendrá durante por lo menos tres semanas antes de intentar la reversión farmacológica o eléctrica de la arritmia. Otra opción es efectuar un ecocardiograma transesofágico para descartar la presencia de trombosis y luego efectuar la cardioversión eléctrica e instituir la ACO.
1. Agentes antiarrítmicos con eficacia probada
Amiodarona
La amiodarona no sólo puede revertir la FA y prevenir sus recidivas sino que, además, disminuye la respuesta ventricular.
La tasa de reversión de la FA de iniciación reciente con amiodarona intravenosa varía entre el 70% y el 90% y es el agente de primera elección para el tratamiento de la FA en los pacientes con inestabilidad hemodinámica. La amiodarona es eficaz como coadyuvante de la cardioversión eléctrica, para revertir la FA persistente. (24) Administrada por vía oral (600 mg diarios) por 4 a 6 semanas, se logra la reversión de más del 50% de los pacientes con FA de duración menor o igual a un año. (24) Además, podría ser el fármaco de elección para la FA recurrente en presencia de una cardiopatía estructural, en especial si ésta se acompaña de deterioro de la función ventricular izquierda. (25) Se debe considerar su indicación en los pacientes sin cardiopatía estructural en quienes la arritmia es refractaria a otros fármacos.
Flecainida
Su efecto se manifiesta alrededor de 3 horas después de la administración oral y de 1 hora de la intravenosa. Puede convertir la FA en aleteo auricular con conducción auriculoventricular 1:1, con el deterioro hemodinámico consiguiente, como puede ocurrir también con la propafenona. El efecto proarrítmico en los pacientes con FA tratados con flecainida guarda una relación estrecha con la severidad de la patología cardíaca subyacente.
Propafenona
Administrada por vía intravenosa u oral es altamente eficaz para revertir las FA con menos de 48 horas de evolución; en cambio, la tasa de reversión en los pacientes con FA de más larga data es mucho menor. En los pacientes sin cardiopatía estructural, la utilización de una dosis única de 600 mg por vía oral logra porcentajes de reversión similares a los obtenidos con amiodarona pero en un tiempo menor.
Quinidina
La tasa de reversión de la FA de reciente instalación con quinidina varía entre el 40% y el 86%. Por lo general se usa en combinación con la digoxina (eventualmente con los antagonistas cálcicos o los bloqueantes betaadrenérgicos) para contrarrestar su efecto vagolítico sobre el nódulo AV. En la actualidad su uso es limitado por sus efectos adversos cardíacos y extracardíacos.
2. Agentes menos eficaces
Bloqueantes betaadrenérgicos
Se han utilizado con éxito en la reversión y la prevención de la FA poscirugía cardíaca y para el control de la frecuencia ventricular.
Los bloqueantes de los canales del calcio, verapamilo y diltiazem, tienen como indicación principal el control de la respuesta ventricular.
La digoxina sólo es útil para el control de la frecuencia en reposo o con esfuerzos leves.
El d-l sotalol no se utiliza para la reversión de la FA aguda.
Recomendaciones para la cardioversión eléctrica de la fibrilación auricular
El éxito de la CVE depende de la densidad de corriente liberada al miocardio auricular, condicionada por el voltaje del capacitor del desfibrilador, la forma de la onda de choque, el tamaño y la posición de las paletaselectrodos y la impedancia transtorácica.
La localización de las paletas-electrodos en posición anteroposterior demostró que es más eficaz y requirió menos energía que la posición anterolateral.
Los niveles de energía requeridos para lograr la reversión de la FA varían entre 150 y 360 joules.
Los desfibriladores con capacidad de liberar choques con ondas de corriente bifásica al igual que la cardioversión eléctrica interna (entre catéteres electrodo multipolares) mejoraron la tasa de reversión con requerimientos menores de energía que aquellos con corriente monofásica.
Recomendaciones para la reversión farmacológica o eléctrica
Clase I
1. CVE inmediata en pacientes con FA paroxística y respuesta ventricular rápida en el curso de un infarto agudo de miocardio o síntomas de hipotensión, angina o insuficiencia cardíaca cuando no respondan rápidamente al tratamiento farmacológico o en presencia de una vía accesoria.
2. Cardioversión farmacológica o eléctrica en pacientes con estabilidad hemodinámica cuando los síntomas de la FA no se toleran.
Clase IIa
1. Cardioversión farmacológica o eléctrica para acelerar la restauración del ritmo sinusal en pacientes con un primer episodio de FA de una duración de menos de 48 horas.
2. CVE o farmacológica en pacientes con FA persistente cuando una recurrencia temprana es poco probable.
3. Nueva CVE o farmacológica seguida de profilaxis antiarrítmica en pacientes con recidiva de la FA, sin medicación antiarrítmica, luego de una cardioversión inicial exitosa.
Clase IIb -
Reversión a ritmo sinusal mediante la administración de drogas antiarrítmicas por vía oral a pacientes ambulatorios, sin cardiopatía estructural, para la reversión de episodios de FA aguda, cuando la seguridad de la droga se hubiera probado en ese paciente en particular o la droga tuviera bajo efecto proarrítmico.
Clase III
1. CV en pacientes que alternan ritmo sinusal con FA en períodos cortos.
2. Nueva CV en pacientes con períodos cortos de ritmo sinusal que recidiva a FA a pesar de múltiples cardioversiones previas seguidas de profilaxis antiarrítmica (nivel de evidencia C).
Recomendaciones para cardioversión farmacológica
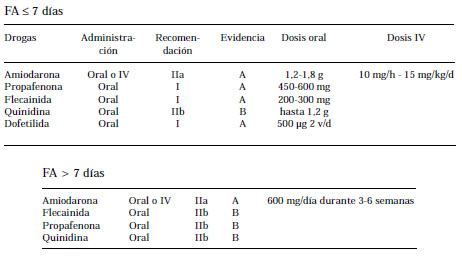
CONTROL DEL RITMO VERSUS CONTROL DE LA FRECUENCIA
En los pacientes con FA persistente se plantean dos enfoques terapéuticos, uno tendiente a restaurar y mantener el ritmo sinusal y el otro, a controlar en forma adecuada la frecuencia ventricular.
Cuatro estudios compararon estas estrategias e incluyeron cerca de 5.000 pacientes. Sus conclusiones fueron que el control de la frecuencia mostró resultados similares a los del control del ritmo. (26) Una conclusión del estudio AFFIRM (27) fue que la anticoagulación debe continuarse, cualquiera que sea la estrategia elegida, en el grupo de pacientes de alto riesgo tromboembólico. En un subestudio del AFFIRM se comprobó que la mortalidad fue significativamente menor con amiodarona que con las drogas de la clase I y el d-l sotalol.
El control de la frecuencia estaría reservado para aquellos pacientes en quienes, luego de más de un intento de reversión, resulta imposible mantener el ritmo sinusal a largo plazo o bien cuando los efectos colaterales con las drogas antiarrítmicas obligan a discontinuar el tratamiento. Lo mismo se aplica a los pacientes muy añosos y asintomáticos.
Mantenimiento del ritmo sinusal
Terapia farmacológica
Antes de administrar un antiarrítmico se deben controlar los posibles factores precipitantes cardíacos y extracardíacos. Para la elección del antiarrítmico se debe considerar la enfermedad de base, la circunstancia de aparición de la FA, etc. Por ejemplo, en la FA generada por mecanismos vagales la amiodarona es la droga de elección y la flecainida o la propafenona quedan como drogas de segundo orden. Los bloqueantes betaadrenérgicos pueden agravar esta condición, mientras que en los pacientes con FA mediada por aumento del tono simpático son la primera elección. Con las drogas de clase IA, IC y III debe monitorizarse la duración del intervalo QT y del QRS que, salvo para el caso de la amiodarona, no debe exceder los 520 mseg.
Amiodarona
Entre el 60% y el 70% de los pacientes mantienen el ritmo sinusal a largo plazo con esta droga después de la reversión con una dosis de 200 mg/día. (24, 25, 28) En los pacientes con insuficiencia cardíaca, la amiodarona es la droga de mayor seguridad y eficacia para mantener el ritmo sinusal.
Flecainida
Se ha señalado su utilidad para evitar las recurrencias en dosis diarias de 200 mg, aunque su uso está limitado a las formas de FA solitaria. No se debe administrar en pacientes con alteración manifiesta de la función ventricular por su efecto proarrítmico e inotrópico negativo y en los portadores de cardiopatía isquémica.
Quinidina
Se ha señalado su potencial proarrítmico e incremento de la mortalidad bajo su acción, en particular en los pacientes con insuficiencia cardíaca.
Propafenona
Es menos eficaz que la amiodarona para preservar el ritmo sinusal en dosis de 450 mg/día. Por su efecto depresor del inotropismo y proarrítmico no debe emplearse en pacientes con insuficiencia cardíaca y/o cardiopatía isquémica.
Sotalol
Varios estudios demostraron una reducción importante de la recurrencia de la FA con el d-l sotalol: en dosis de entre 160 mg y 320 mg diarios es una droga segura y eficaz para el mantenimiento del ritmo sinusal poscardioversión, especialmente en pacientes con cardiopatía isquémica y/o hipertensión arterial.
En FA persistente de primera vez se puede intentar la reversión farmacológica o eléctrica. Sin tratamiento farmacológico luego de la reversión, sólo un 25% de los pacientes se encuentran en ritmo sinusal al año. Ante una recidiva, puede volver a intentarse la reversión, seguida de tratamiento antiarrítmico.
Frente a recidivas reiteradas es aconsejable cambiar de estrategia y controlar farmacológicamente la frecuencia cardíaca.
En la Tabla 2 se resumen las drogas que pueden elegirse inicialmente en pacientes con o sin cardiopatía estructural para la FA recidivante.
TABLA 2
Drogas antiarrítmicas para la prevención de recurrencias de fibrilación auricular teniendo en cuenta su seguridad y eficacia

(*) No disponible en la Argentina.
Recomendaciones para el tratamiento farmacológico en el mantenimiento del ritmo sinusal
Clase I
1. Tratar las causas reversibles de la FA antes de iniciar tratamiento antiarrítmico.
2. Seleccionar la terapéutica antiarrítmica para mantener el ritmo sinusal en pacientes sintomáticos durante la FA basados de manera especial en la seguridad.
Clase IIa
1. Efectuar tratamiento farmacológico en pacientes con FA recidivante asintomática u oligosintomática para mantener el ritmo sinusal.
2. Efectuar tratamiento antiarrítmico para mantener el ritmo sinusal en pacientes con miocardiopatía inducida por taquicardia debida a FA para prevenir su progresión. El tratamiento antiarrítmico ambulatorio puede iniciarse en determinados pacientes con drogas de seguridad comprobada.
Clase IIb
1. Efectuar tratamiento antiarrítmico para mantener el ritmo sinusal para prevenir la insuficiencia cardíaca en pacientes seleccionados.
2. Efectuar combinaciones de drogas antiarrítmicas para mantener el ritmo sinusal cuando la terapéutica con una droga no fue eficaz.
Clase III
1. Utilizar un antiarrítmico determinado para mantener el ritmo sinusal en pacientes con factores de riesgo proarrítmicos.
2. Utilizar tratamiento antiarrítmico para mantener el ritmo sinusal en pacientes con disfunción del nódulo sinusal o del nódulo AV en ausencia de marcapasos activo.
Control de la frecuencia ventricular durante la fibrilación auricular
El control de la frecuencia cardíaca en la FA es imperativo para mejorar la función ventricular y los síntomas y prevenir el desarrollo de una taquicardiomiopatía.
Se consideran márgenes útiles frecuencias de entre 60 y 80 latidos por minuto en reposo y de entre 90 y 115 durante el ejercicio.
Tratamiento farmacológico
Digoxina
Es útil en pacientes con disfunción ventricular izquierda o insuficiencia cardíaca y en los añosos con escasa actividad física. Puede asociarse con los bloqueantes betaadrenérgicos o con los antagonistas del calcio.
Bloqueantes de los canales del calcio
Los más empleados son el verapamilo y el diltiazem. Ejercen un efecto adecuado en el control de la frecuencia tanto en reposo como durante el esfuerzo y son las drogas de elección en los pacientes sin falla de bomba y con enfermedad pulmonar obstructiva crónica (EPOC).
Betabloqueantes
Se utilizan en forma aislada o asociados con otras drogas.
Recomendaciones para el control de la frecuencia cardíaca en pacientes con fibrilación auricular
Clase I
1. En pacientes con hipotensión e insuficiencia cardíaca, su uso debe ser muy cuidadoso o evitarse.
2. Evaluar la frecuencia cardíaca en reposo y en ejercicio en pacientes con FA persistente o permanente y controlarla con fármacos en forma individual llevándola a rangos fisiológicos.
Clase IIa
1. Administrar una combinación de digoxina y un bloqueante betaadrenérgico o calcioantagonista para controlar la frecuencia cardíaca en reposo y en esfuerzo en pacientes con FA.
2. Utilizar medidas no farmacológicas para controlar la frecuencia cardíaca (modulación o ablación del nódulo AV) cuando los fármacos son insuficientes.
Clase IIb
1. Administrar digoxina como único agente para controlar la frecuencia cardíaca en pacientes con FA persistente con nivel bajo de actividad física.
2. Administrar amiodarona intravenosa en pacientes hemodinámicamente estables con FA y conducción a través de una vía accesoria.
Clase III
1. Administrar digital como único agente para controlar una respuesta ventricular rápida en pacientes con FA paroxística.
2. Ablación con catéter sin haber intentado previamente tratamiento médico para controlar la respuesta ventricular en la FA persistente o permanente.
FIBRILACIÓN AURICULAR EN EL POSOPERATORIO DE CIRUGÍA CARDIOVASCULAR
La FA es una complicación frecuente en el posoperatorio de cirugía cardiovascular y su incidencia es del 20% al 40%, según el tipo de cirugía considerado. Su prevalencia supera el 90% entre las otras arritmias auriculares (taquicardia auricular y aleteo auricular).
La edad de los pacientes ha sido el elemento predictor más fuerte en todas las series analizadas (3% a 4% en menores de 40 años y 30% a 40% en mayores de 65 años).
La FA se presenta dentro de los cinco a seis días del posoperatorio con una incidencia mayor entre el segundo y el tercer día. El porcentaje de reversión es de más del 80% en el período intrahospitalario y alcanza el 90% dentro de un período de 4 a 6 semanas. Estas cifras corresponden a pacientes que se encuentran en ritmo sinusal en el preoperatorio. Los enfermos con FA previa y que después de la cirugía revierten a ritmo sinusal tienen una tasa alta de recidivas. (29)
Si bien la FA es una complicación frecuente, no se asocia con peor evolución o mayor mortalidad. Sólo se relaciona con mayor estadía intrahospitalaria y con costos más elevados de internación. La complicación tromboembólica es infrecuente.
La recidiva de la arritmia no es frecuente. Si ello ocurre, se deberá evaluar si es conveniente un nuevo intento de reversión o bien controlar la frecuencia cardíaca e indicar la anticoagulación oral.
Recomendaciones para la prevención y el tratamiento de la fibrilación auricular en el posoperatorio de cirugía cardiovascular
Clase I
1. Betabloqueantes en forma oral para prevenir FA posoperatoria en ausencia de contraindicaciones.
2. En la FA del posoperatorio, iniciar tratamiento farmacológico con drogas con acción bloqueante a nivel del nodo AV (B).
3. Anticoagulación luego de 48 horas de iniciada la FA (B).
4. CVE en los pacientes con insuficiencia cardíaca, isquemia miocárdica o en las primeras horas del posoperatorio en pacientes bajo efecto anestésico y ventilación mecánica (C).
Clase II
1. Tratamiento preventivo con amiodarona, tanto oral (preoperatorio) como parenteral (posoperatorio), en pacientes con alto riesgo de desarrollar FA (B).
2. Amiodarona o CVE para restaurar RS. Las condiciones para el tratamiento son similares a las de los pacientes no sometidos a cirugía cardiovascular (B).
3. La FA posoperatoria refractaria o recidivante se abordará con tratamiento farmacológico al igual que en los pacientes no sometidos a cirugía cardiovascular (B).
4. Pacientes con alta probabilidad de reversión a ritmo sinusal, control con ETE entre los días 7 y 10 de evolución intrahospitalaria para realizar CVE (C).
FIBRILACIÓN AURICULAR EN EL INFARTO AGUDO DE MIOCARDIO
La frecuencia ventricular elevada y la pérdida de la sístole auricular pueden determinar una caída acentuada del volumen minuto cardíaco con deterioro hemodinámico e incrementar la isquemia miocárdica. Ambas situaciones obligan a la CVE inmediata. (30)
En la FA bien tolerada, la amiodarona puede reducir significativamente la respuesta ventricular con la ventaja adicional de la reversión de la arritmia en un número importante de los casos. Se debe administrar un goteo IV de una dosis de 5 a 7 mg/kg de peso durante 30 a 60 minutos y se continúa con 800 a 1.000 mg en las siguientes 24 horas.
Frente a una buena función ventricular y en ausencia de enfermedad broncopulmonar severa o trastornos de la conducción auriculoventricular, la frecuencia cardíaca se puede controlar con agentes betabloqueantes como el atenolol (2,5 a 5 mg en 2 min IV y hasta 10 mg en 15 min).
También es recomendable el uso de la digoxina IV, inicialmente 0,25 mg, dosis que debe repetirse a las 4 horas.
Aun cuando la fibrilación auricular haya sido transitoria, se debe indicar heparina durante la hospitalización.
Recomendaciones
Clase I
1. CVE en pacientes con compromiso hemodinámico severo o isquemia incontrolable (C).
2. Amiodarona IV en ausencia de compromiso hemodinámico (C).
3. Digital IV para disminuir la frecuencia ventricular rápida (C).
4. Betabloqueantes IV para reducir una respuesta ventricular acelerada en ausencia de signos clínicos de disfunción ventricular izquierda, broncoespasmo, enfermedad pulmonar crónica o bloqueo auriculoventricular (C).
5. Anticoagulación (C).
Clase IIa
- Diltiazem o verapamilo IV para disminuir una frecuencia ventricular elevada cuando la amiodarona y los betabloqueantes están contraindicados o han sido ineficaces (C).
Clase III
- Antiarrítmicos tipo IC en infarto agudo (C).
LA FIBRILACIÓN AURICULAR EN EL SÍNDROME DE WOLFF-PARKINSON-WHITE
La presencia de FA en el síndrome de Wolff-Parkinson- White (WPW) es una complicación que puede llevar a la muerte súbita (MS) con una incidencia del 0% al 0,6%. La incidencia global de FA o AA en estos pacientes varía entre el 21% y el 56%. (13)
El mayor riesgo de MS por FA se ha señalado en pacientes que poseen vías de preexcitación múltiples o de localización posteroseptal y en aquellos con período refractario de la vía accesoria menor de 250 mseg.
Los pacientes con síndrome de WPW, FA y descompensación hemodinámica se deben tratar con CVE en forma inmediata. Cuando el paciente se presenta hemodinámicamente estable es posible utilizar amiodarona IV o drogas de la clase I con la intención de revertir la taquiarritmia auricular. No deben utilizarse la digoxina o el verapamilo.
Recomendaciones
Clase I
1. Ablación por radiofrecuencia de la vía accesoria AV en pacientes sintomáticos, en especial en los que han presentado síncope, respuesta ventricular rápida o en aquellos con período refractario corto de la vía accesoria (B).
2. CVE inmediata para prevenir la fibrilación ventricular en pacientes con WPW y FA de alta respuesta ventricular, asociados con inestabilidad hemodinámica (B).
3. FA y WPW con buena tolerancia hemodinámica y QRS ≥ 120 mseg, tratamiento con amiodarona IV (C).
Clase IIb
1. Administración de amiodarona, quinidina IV en pacientes con FA hemodinámicamente estables (B).
2. La CVE inmediata en caso de que la taquiarritmia se torne hemodinámicamente inestable (B).
Clase III
- Administración IV de drogas betabloqueantes, digitálicos, diltiazem o verapamilo (B).
FIBRILACIÓN AURICULAR E HIPERTIROIDISMO
La fibrilación auricular es una arritmia que acompaña con frecuencia al hipertiroidismo; su incidencia oscila entre el 10% y el 25% de los pacientes. Es más frecuente en hombres y en menores de 75 años. El tratamiento debe estar dirigido en forma primordial a normalizar la función tiroidea y controlar la frecuencia ventricular. Por lo general se asocia con la reversión espontánea a ritmo sinusal; si esto no sucede, se recurre a la CVE. Otras estrategias son innecesarias mientras persiste el estado de tirotoxicosis. (31)
Recomendaciones
Clase I 1. Betabloqueantes para el control de la respuesta ventricular si no hay contraindicaciones (B).
2. Si no pueden administrarse betabloqueantes, antagonistas de los canales del calcio (diltiazem o verapamilo) (B).
3. ACO con una RIN entre 2 y 3 para prevenir la tromboembolia (C).
4. En eutiroidismo, la profilaxis antitrombótica es la misma que para los pacientes sin hipertiroidismo (C).
FIBRILACIÓN AURICULAR y EMBARAZO
La fibrilación auricular es excepcional sin causa aparente durante la gestación.
El tratamiento no difiere del que debe efectuarse fuera de la gestación, con excepción del tratamiento anticoagulante, que requiere una consideración especial.
Control de la frecuencia
Digoxina
Droga de elección para control de la frecuencia. (32- 34) No es teratogénica, no tiene efectos adversos en el recién nacido y es compatible con la lactancia (32, 33) (categoría C)(*). (35)
Betabloqueantes
No existen diferencias apreciables con respecto a sus efectos fetales según el compuesto, con excepción del atenolol por mayor riesgo (categoría D) (35) (retardo del crecimiento, hipoglucemia, bradicardia y depresión respiratoria en el recién nacido). Se excretan en la leche materna sin que esto contraindique la lactancia (categoría B, C) (35) (según el compuesto).
Bloqueantes cálcicos
Diltiazem: hay poca experiencia durante el embarazo y se ha utilizado por períodos breves, sin efectos adversos (categoría C). (35) Verapamilo Se ha utilizado para el tratamiento intraútero de arritmias fetales y no se han comunicado efectos adversos (categoría C). (35)
Reversión farmacológica y control del ritmo
Quinidina
Es una droga segura y sin efecto teratogénico. (32- 34) Atraviesa la barrera placentaria y alcanza niveles fetales similares a los maternos. (32, 33) Se han informado plaquetopenia y lesión del VIII par en el recién nacido. (32) Se excreta en la leche en concentraciones bajas. (33, 34) Es compatible con la lactancia (categoría C). (35)
Flecainida
Atraviesa la placenta y si bien es teratogénica en animales, no se han comunicado efectos adversos en seres humanos (33, 34) (categoría C). (35)
Amiodarona
Alcanza niveles fetales inferiores a los maternos, tiene escaso efecto proarrítmico y no es teratogénica. (35) Con el uso prolongado puede producir hipotiroidismo o hipertiroidismo y bocio. Debe utilizarse por vía oral o intravenosa cuando otros agentes han fracasado. Se excreta en la leche en concentraciones mayores. Su uso en la lactancia no es aconsejable (categoría D).
Cardioversión eléctrica
Puede efectuarse en cualquier momento de la gestación, tomando las precauciones habituales de esta práctica.
Recomendaciones
Clase I
1. Digoxina, betabloqueantes o bloqueantes cálcicos para control de la frecuencia (C).
2. CVE en pacientes hemodinámicamente inestables (C).
3. Anticoagulación en pacientes con FA crónica y riesgo embolígeno aumentado (A).
4. Anticoagulación en pacientes con FA persistente antes y después de la CVE o farmacológica (C).
Clase IIa
1. Reversión farmacológica en la FA que aparece durante el embarazo (asociación digital-quinidina, flecainida, propafenona o amiodarona) (C).
2. CVE en la FA sintomática que se presenta durante el embarazo seguida de tratamiento profiláctico para mantenimiento del RS (C).
FIBRILACIÓN AURICULAR EN LA MIOCARDIOPATÍA HIPERTRÓFICA
Entre el 15% y el 50% de los portadores de miocardiopatía hipertrófica (MCH) presentan taquiarritmias auriculares y/o FA paroxística en el ECG de Holter. (37) La mayoría de los episodios son asintomáticos, pero cuando son sostenidos y/o con frecuencias ventriculares elevadas pueden causar tromboembolia sistémica o una reducción crítica del volumen minuto cardíaco, con presíncope o síncope. (36) No existen estudios sistemáticos para el tratamiento de la FA con fármacos antiarrítmicos en la MCH, pero como la incidencia de ACV isquémicos es alta, se justifica tratar de restaurar y mantener el RS y realizar ACO.
Recomendaciones
Clase I
1. La CVE para la FA aguda con respuesta ventricular elevada y descompensación hemodinámica (C).
2. ACO (RIN 2 a 3) para la prevención de la tromboembolia (B).
Clase IIa
1. Reversión farmacológica o eléctrica en pacientes con FA sin síntomas u oligosintomáticos (C).
2. Medicación antiarrítmica para la prevención de las recidivas. Los datos disponibles son insuficientes para recomendar un agente sobre otro, pero la amiodarona y la disopiramida son los preferidos (C).
FIBRILACIÓN AURICULAR EN LA ENFERMEDAD PULMONAR
La FA es una complicación frecuente en pacientes con enfermedad pulmonar obstructiva crónica (EPOC) y aumenta el riesgo de padecerla durante las exacerbaciones. (14) El tratamiento de la enfermedad pulmonar subyacente, el de la hipoxia y del desequilibrio ácido-base constituye la primera línea terapéutica. La teofilina y los agonistas betaadrenérgicos son drogas que, si bien disminuyen el broncoespasmo, pueden iniciar el episodio de FA e incrementar la respuesta ventricular.
El control de la frecuencia ventricular se logra, por lo general, con antagonistas de los canales del calcio y la digoxina. La terapia antiarrítmica y la cardioversión eléctrica en el intento de revertir el episodio de FA deben estar precedidas por la compensación respiratoria.
Recomendaciones Clase I
1. En pacientes que desarrollan FA durante una enfermedad pulmonar o exacerbación de su enfermedad pulmonar crónica: la corrección de la hipoxia y la acidosis deben ser las primeras medidas terapéuticas (C).
2. Los bloqueantes de los canales del calcio están indicados para disminuir la respuesta ventricular (C). 3. La cardioversión eléctrica se indicará si la FA desencadena descompensación hemodinámica (C).
Clase III
1. La teofilina y los estimulantes beta adrenérgicos (C).
2. Betabloqueantes, sotalol, propafenona y adenosina (C).
LA PREVENCIÓN DE LA FIBRILACIÓN AURICULAR MEDIANTE LA ESTIMULACIÓN AURICULAR PERMANENTE
La estimulación auricular (EA) es una terapéutica alternativa en la FA e incluye: 1) la EA convencional en forma permanente, 2) la EA multisitio, 3) la EA dinámica y 4) la desfibrilación auricular interna. Las tres primeras opciones se utilizan en la prevención de la FA mientras que la desfibrilación auricular constituye una alternativa terapéutica de la FA aún no bien establecida.
La estimulación auricular permanente (EAP)
Los datos aportados por varios estudios prospectivos (37-39) demuestran claramente una disminución de la incidencia de FA en pacientes con enfermedad del nódulo sinusal (ENS) y EAP. Se ha demostrado que la modalidad de estimulación AAI es mejor que la estimulación DDD en pacientes con ENS.
La estimulación auricular multisitio
A pesar del discreto efecto favorable a favor de la resincronización auricular no hay evidencias que convaliden su indicación.
La estimulación auricular dinámica o "antifibrilatoria"
La EA dinámica incorpora en los marcapasos convencionales algoritmos opcionales con el fin de estabilizar la frecuencia auricular mediante la sobrestimulación auricular y previene de esta manera la dispersión de la refractariedad cuyas consecuencias arritmogénicas son bien conocidas. Los estudios a largo plazo todavía no permiten realizar recomendaciones.
Efectos deletéreos de la estimulación del VD en pacientes con ICC y fibrilación auricular
Varios estudios han postulado que la resincronización ventricular disminuye la remodelación ventricular izquierda y la incidencia de FA. Dos estudios prospectivos en curso permitirán aclarar su utilidad.
Recomendaciones de la EA como tratamiento preventivo de la fibrilación auricular
La utilidad de la estimulación auricular como tratamiento preventivo de la FA en pacientes sin indicaciones convencionales de marcapasos aún no se ha comprobado en estudios controlados y aleatorizados para establecer recomendaciones.
Recomendaciones
- Pacientes con episodios de FA con indicación de marcapasos por:
- Enfermedad del nódulo sinusal La modalidad de estimulación (AAI) o bicameral (DDD) se recomienda en pacientes con ENS y episodios de fibrilación auricular (clase IIa).
Bloqueo AV completo
En pacientes con indicación de marcapasos por bloqueo auriculoventricular completo, los beneficios de la estimulación bicameral en la prevención de la FA aún son controversiales.
ABLACIÓN POR RADIOFRECUENCIA DE LA FIBRILACIÓN AURICULAR
La identificación del mecanismo electrofisiológico de la FA de origen focal en forma predominante en las venas pulmonares (VP) y la descripción de múltiples ondas reentrantes en su mantenimiento llevó al desarrollo de intervenciones quirúrgicas y a la ablación por radiofrecuencia para el tratamiento de esta arritmia. El entusiasmo inicial con la ablación de estos focos fue atenuado por la frecuente recurrencia de la FA y por el riesgo de estenosis de las VP. (40) Esta estrategia se ha reemplazado en los últimos años por técnicas destinadas a aislar anatómicamente las VP mediante la interrupción de la conducción entre ellas y la aurícula izquierda. (41)
Indicaciones
Debido a que la ablación de las venas pulmonares es un procedimiento relativamente nuevo, aún no se han establecido indicaciones de clase I, II o III existentes para otras arritmias por falta de estudios controlados. Una publicación reciente (41) muestra la experiencia en un número importante de pacientes con FA sometidos al aislamiento de las VP por radiofrecuencia (n = 589) versus un grupo de características clínicas similares seguido con medicación antiarrítmica (n = 582). En dicho trabajo se observó una diferencia significativa a favor del grupo con ablación en lo que respecta a sobrevida, morbilidad (insuficiencia cardíaca y eventos embólicos isquémicos), recurrencias de FA y calidad de vida. Un análisis de 14 estudios que incluyó 2.352 pacientes en quienes se efectuó aislamiento de las VP refiere un éxito del 66% en un seguimiento de 13 meses.
Indicaciones de la ablación por radiofrecuencia
Paciente "ideal" (equivalente a clase I)
1. Joven (menor de 50 años).
2. Corazón estructuralmente normal (aurícula izquierda < 45 mm) (FA "solitaria").
3. FA paroxística frecuente y/o sintomática.
4. Recurrencias a pesar del uso de drogas antiarrítmicas.
Paciente "aceptable" (equivalente a clase II)
1. Edad intermedia (55 a 75 años).
2. Cardiopatía estructural con AI < 60 mm.
3. Enfermedad pulmonar asociada.
4. FA persistente o recurrente.
5. Recurrencias a pesar del uso de drogas antiarrítmicas.
Paciente "no aceptable" (equivalente a clase III)
1. Añoso (mayor de 75 años).
2. Cardiopatía estructural severa con AI > 60 mm y/o patología asociada severa (p. ej., EPOC grave).
3. FA crónica de larga evolución (> 5 años).
4. Presencia de trombo en la AI, a pesar de anticoagulación apropiada.
TRATAMIENTO QUIRÚRGICO DE LA FIBRILACIÓN AURICULAR
Hasta el presente se han desarrollado múltiples procedimientos para el tratamiento quirúrgico de la FA con el propósito de realizar una terapia curativa.
La hipótesis de reentradas múltiples permitió el desarrollo de técnicas como la del "corredor", orientadas a la recuperación del RS. A pesar de restaurarlo inicialmente, se observaron nuevos episodios de arritmias y/o la necesidad de colocación de marcapasos por disfunción del nódulo sinusal (DNS).
Con posterioridad se desarrolló la técnica del "laberinto", que consistía en múltiples incisiones sobre ambas aurículas para interrumpir las reentradas (42) y es la técnica más efectiva para prevenir la recurrencia de la arritmia y recuperar la sístole auricular (aproximadamente en el 95% de los casos). Lo complejo de su técnica y la necesidad de tiempos prolongados de circulación extracorpórea han hecho que su difusión y aplicación sea muy limitada.
A pesar de la baja incidencia de complicaciones mayores (accidentes cerebrovasculares, infarto perioperatorio y aun la muerte), el tratamiento quirúrgico de la FA se reserva para los pacientes que deben ser sometidos a otro procedimiento de cirugía cardíaca.
Otra técnica alternativa es la de Sueda, que se limita a la compartimentalización de la pared posterior de la AI. (43)
Se han desarrollado técnicas quirúrgicas menos invasivas, por diferentes tipos de ablación mediante el aislamiento de las venas pulmonares con crioablación, láser (44) o radiofrecuencia unipolar con catéteres flexibles endocárdicos y/o epicárdicos. (45) Con el advenimiento de la cirugía coronaria sin circulación extracorpórea y de catéteres epicárdicos bipolares, la radiofrecuencia se puede utilizar para el tratamiento de la FA crónica asociada con la enfermedad coronaria (46) y, por último, también se ha sugerido el uso de microondas. (47)
Para la prevención de ACV se ha propuesto la resección u obliteración de la orejuela izquierda durante el tratamiento quirúrgico de los pacientes sometidos a cirugía coronaria y/o valvular, así como procedimiento único en pacientes de alto riesgo de ACV e imposibilidad de efectuar ACO. El procedimiento se puede efectuar por toracoscopia o por vía endovascular para la obliteración de la orejuela.
(*) La categoría hace referencia a la toxicidad de las drogas en el embarazo, según la FDA. (35)
BIBLIOGRAFÍA
1. Kannel WB, Abbott RD, Savage DD, McNamara PM. Coronary heart disease and atrial fibrillation: the Framingham Study. Am Heart J 1983;106:389-96. [ Links ]
2. Labadet C, Liniado G, Ferreirós ER, Molina Viamonte V, Di Toro D, Cragnolino R y col. Resultados del Primer Estudio Nacional, Multicéntrico y Prospectivo de Fibrilación Auricular Crónica en la República Argentina. Rev Argent Cardiol 2001;69:49-67. [ Links ]
3. Reardon M, Camm AJ. Atrial fibrillation in the elderly. Clin Cardiol 1996;19:765-75. [ Links ]
4. Frustaci A, Caldarulo M, Buffon A, Bellocci F, Fenici R, Melina D. Cardiac biopsy in patients with "primary" atrial fibrillation. Histologic evidence of occult myocardial diseases. Chest 1991;100:303-6. [ Links ]
5. Maixent JM, Paganelli F, Scaglione J, Levy S. Antibodies against myosin in sera of patients with idiopathic paroxysmal atrial fibrillation. J Cardiovasc Electrophysiol 1998;9:612-7. [ Links ]
6. Haissaguerre M, Jais P, Shah DC, Takahashi A, Hocini M, Quiniou G, et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998;339:659-66. [ Links ]
7. Allessie M, Rensma P, Brugada J. Pathophysiology of atrial fibrillation. En: Zipes P, Jalife J, editors. Cardiac electrophysiology: from cell to bedside. Philadelphia: WB Saunders; 1990. p. 548. [ Links ]
8. Allessie MA. Atrial electrophysiologic remodeling: another vicious circle? J Cardiovasc Electrophysiol 1998;9:1378-93. [ Links ]
9. Simpson RJ. Clinical electrophysiology of the normal and diseased human atria. En: Falk R, Podrid PJ, editors. Atrial fibrillation, mechanism and management. New York: Raven Press; 1992. [ Links ]
10. Militello C. La fibrilación auricular. Significación clínica, mecanismos y estrategias terapéuticas. En: Elizari MV, Chiale PA, editores. Arritmias Cardíacas. Fundamentos celulares y moleculares, diagnóstico y tratamiento. 2ª ed. Buenos Aires: Editorial Médica Panamericana; 2003. p. 543. [ Links ]
11. Coumel P, Attuel P, Lavallee J, Flammang D, Leclercq JF, Slama R. The atrial arrhythmia syndrome of vagal origin. Arch Mal Coeur Vaiss 1978;71:645-56. [ Links ]
12. Chiale PA, Contreras L. El síndrome de Wolff-Parkinson-White en individuos asintomáticos. En: Elizari MV, Chiale PA, editores. Arritmias Cardíacas. Fundamentos celulares y moleculares, diagnóstico y tratamiento. 2ª ed. Buenos Aires: Editorial Médica Panamericana; 2003. p. 471. [ Links ]
13. Villacastin JP, Farré J, Torrecilla EG, Asso A. Características Clínicas y Determinantes Electrofisiológicos de la FA en Pacientes con Vías Accesorias. En: Farré J, Moro C. Arritmias Cardíacas: Fundamentos y Opciones Terapéuticas. Barcelona; 1992. p. 151. [ Links ]
14. Fuster V, Ryden LE, Asinger RW, Cannom DS, Crijns HJ, Frye RL; American College of Cardiology; American Heart Association; European Society of Cardiology; North American Society of Pacing and Electrophysiology. ACC/AHA/ESC guidelines for the management of patients with atrial fibrillation. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines and Policy Conferences (Committee to Develop Guidelines for the Management of Patients with Atrial Fibrillation) developed in collaboration with the North American Society of Pacing and Electrophysiology. Eur Heart J 2001;22:1852-923. [ Links ]
15. Coumel P. Neural aspects of paroxysmal atrial fibrillation. En: Falk RH, Podrid PJ, editors. Atrial Fibrillation: Mechanisms and Management. New York: Raven Press; 1992. p. 109-25. [ Links ]
16. Risk factors for stroke and efficacy of antithrombotic therapy in atrial fibrillation. Analysis of pooled data from five randomized controlled trials. Arch Intern Med 1994;154:1449-57. [ Links ]
17. Hart RG, Pearce LA, McBride R, Rothbart RM, Asinger RW. Factors associated with ischemic stroke during aspirin therapy in atrial fibrillation: analysis of 2012 participants in the SPAF I-III clinical trials. The Stroke Prevention in Atrial Fibrillation (SPAF) Investigators. Stroke 1999;30:1223-9. [ Links ]
18. Fihn SD, Callahan CM, Martin DC, McDonell MB, Henikoff JG, White RH. The risk for and severity of bleeding complications in elderly patients treated with warfarin. The National Consortium of Anticoagulation Clinics. Ann Intern Med 1996;124:970-9. [ Links ]
19. Wang TJ, Massaro JM, Levy D, Vasan RS, Wolf PA, D'Agostino RB, et al. A risk score for predicting stroke or death in individuals with new-onset atrial fibrillation in the community: the Framingham Heart Study. JAMA 2003;290:1049-56. [ Links ]
20. Gage BF, Waterman AD, Shannon W, Boechler M, Rich MW, Radford MJ. Validation of clinical classification schemes for predicting stroke: results from the National Registry of Atrial Fibrillation. JAMA 2001;285:2864-70. [ Links ]
21. Fuster V, Ryden LE, Asinger RW, Cannom DS, Crijns HJ, Frye RL; American College of Cardiology/American Heart Association/ European Society of Cardiology Board. ACC/AHA/ESC guidelines for the management of patients with atrial fibrillation: executive summary. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines and Policy Conferences (Committee to Develop Guidelines for the Management of Patients with Atrial Fibrillation): developed in collaboration with the North American Society of Pacing and Electrophysiology. J Am Coll Cardiol 2001;38:1231-66. [ Links ]
22. Fisher M, Bogousslavsky J. Epidemiology. En: Fisher M, Bogousslavsky J, editors. Current Reviews of Cerebrovascular Disease. 3rd ed. Boston, Mass: Butterworth-Heinemann; 1997. Chapter 20. [ Links ]
23. Rosand J, Hylek EM, O'Donnell HC, Greenberg SM. Warfarinassociated hemorrhage and cerebral amyloid angiopathy: a genetic and pathologic study. Neurology 2000;55:947-51. [ Links ]
24. Galperin J, Elizari MV, Chiale PA, Molina RT, Ledesma R, Scapin AO; GEFACA Investigators-GEMA Group, Buenos Aires, Argentina. Efficacy of amiodarone for the termination of chronic atrial fibrillation and maintenance of normal sinus rhythm: a prospective, multicenter, randomized, controlled, double blind trial. J Cardiovasc Pharmacol Ther 2001;6:341-50. [ Links ]
25. Roy D, Talajic M, Dorian P, Connolly S, Eisenberg MJ, Green M, et al. Amiodarone to prevent recurrence of atrial fibrillation. Canadian Trial of Atrial Fibrillation Investigators. N Engl J Med 2000; 342:913-20. [ Links ]
26. McNamara RL, Tamariz LJ, Segal JB, Bass EB. Management of atrial fibrillation: review of the evidence for the role of pharmacologic therapy, electrical cardioversion, and echocardiography. Ann Intern Med 2003;139:1018-33. [ Links ]
27. AFFIRM Investigators. Atrial Fibrillation Follow-up Investigation of Rhythm Management. Baseline characteristics of patients with atrial fibrillation: the AFFIRM Study. Am Heart J 2002;143:991-1001. [ Links ]
28. Galperin J, Elizari MV, Chiale PA, Molina RT, Ledesma R, Scapin AO; Grupo de Estudio de Fibrilacion Auricular Con Amiodarona (GEFACA) Investigators. Pharmacologic reversion of persistent atrial fibrillation with amiodarone predicts long-term sinus rhythm maintenance. J Cardiovasc Pharmacol Ther 2003;8:179-86. [ Links ]
29. Asher CR, Chung MK, Eagle KA, et al. Atrial fibrillation following cardiac surgery. Falk RH, Podrid PJ, editors. Atrial fibrillation mechanisms and management. New York: Lippincott Raven; 1997. p. 183-204. [ Links ]
30. Eldar M, Canetti M, Rotstein Z, Boyko V, Gottlieb S, Kaplinsky E, et al. Significance of paroxysmal atrial fibrillation complicating acute myocardial infarction in the thrombolytic era. SPRINT and Thrombolytic Survey Groups. Circulation 1998;97:965-70. [ Links ]
31. Klein I, Becker DV, Levey GS. Treatment of hyperthyroid disease. Ann Intern Med 1994;121:281-8. [ Links ]
32. Tan HL, Lie KI. Treatment of tachyarrhythmias during pregnancy and lactation. Eur Heart J 2001;22:458-64. [ Links ]
33. Chow T, Galvin J, McGovern B. Antiarrhythmic drug therapy in pregnancy and lactation. Am J Cardiol 1998;82:58I-62I. [ Links ]
34. Briggs GG, Freeman RK, Yaffe SJ. Drugs in pregnancy and lactation. Williams & Wilkins; 1990. [ Links ]
35. Conti JB, Curtis AB. La evaluación y el manejo de las arritmias cardíacas durante el embarazo. En: Elizari MV, Chiale PA, editores. Arritmias Cardíacas. Bases celulares y moleculares, diagnóstico y tratamiento. 1ª ed. Buenos Aires: Propulsora Literaria; 1999. p. 931-46. [ Links ]
36. Acunzo RS. Las manifestaciones clínicas y electrocardiográficas, la estratificación del riesgo y el tratamiento de la miocardiopatía hipertrófica. En: Elizari MV, Chiale PA, editores. Arritmias Cardíacas. Bases celulares y moleculares, diagnóstico y tratamiento. 2ª ed. Editorial Médica Panamericana; 2003. Cap 38, p. 753-74. [ Links ]
37. Andersen HR, Nielsen JC, Thomsen PE, Thuesen L, Mortensen PT, Vesterlund T, et al. Long-term follow-up of patients from a randomised trial of atrial versus ventricular pacing for sick-sinus syndrome. Lancet 1997;350:1210-6. [ Links ]
38. Connolly SJ, Kerr CR, Gent M, Roberts RS, Yusuf S, Gillis AM, et al. Effects of physiologic pacing versus ventricular pacing on the risk of stroke and death due to cardiovascular causes. Canadian Trial of Physiologic Pacing Investigators. N Engl J Med 2000; 342:1385-91. [ Links ]
39. Lamas GA, Orav EJ, Stambler BS, Ellenbogen KA, Sgarbossa EB, Huang SK, et al. Quality of life and clinical outcomes in elderly patients treated with ventricular pacing as compared with dualchamber pacing. Pacemaker Selection in the Elderly Investigators. N Engl J Med 1998;338:1097-104. [ Links ]
40. Haissaguerre M, Jais P, Shah DC, Garrigue S, Takahashi A, Lavergne T, et al. Electrophysiological end point for catheter ablation of atrial fibrillation initiated from multiple pulmonary venous foci. Circulation 2000;101:1409-17. [ Links ]
41. Pappone C, Rosanio S, Augello G, Gallus G, Vicedomini G, Mazzone P, et al. Mortality, morbidity, and quality of life after circumferential pulmonary vein ablation for atrial fibrillation: outcomes from a controlled nonrandomized long-term study. J Am Coll Cardiol 2003;42:185-97. [ Links ]
42. Cox JL. The surgical treatment of atrial fibrillation. IV. Surgical technique. J Thorac Cardiovasc Surg 1991;101:584-92. [ Links ]
43. Sueda T, Nagata H, Orihashi K, Morita S, Okada K, Sueshiro M, et al. Efficacy of a simple left atrial procedure for chronic atrial fibrillation in mitral valve operations. Ann Thorac Surg 1997;63: 1070-5. [ Links ]
44. Haissaguerre M, Gencel L, Fischer B, Le Metayer P, Poquet F, Marcus FI, et al. Clementy J. Successful catheter ablation of atrial fibrillation. J Cardiovasc Electrophysiol 1994;5:1045-52. [ Links ]
45. Khargi K, Deneke T, Haardt H, Lemke B, Grewe P, Muller KM, et al. Saline-irrigated, cooled-tip radiofrequency ablation is an effective technique to perform the maze procedure. Ann Thorac Surg 2001; 72:S1090-5. [ Links ]
46. Damiano RJ Jr.Transmural epicardial radiofrecuency ablation on the beating heart: progress towards a minimaly invasive operation for atrial fibrillation. Surg Forum 2001;52:107-8. [ Links ]
47. Spitzer SG, Richter P, Knaut M, Schuler S. Treatment of atrial fibrillation in open heart surgery- the potential role of microwave energy. Thorac Cardiovasc Surg 1999;47:374-8. [ Links ]














