Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de cardiología
versión On-line ISSN 1850-3748
Rev. argent. cardiol. v.74 n.3 Buenos Aires mayo/jun. 2006
Consenso de Estenosis Carotídea
Sociedad Argentina de Cardiología
Sociedad Neurológica Argentina
Filial de la Federación Mundial de Neurología
INTRODUCCIÓN
La estenosis u oclusión carotídea aterosclerótica causa alrededor del 30% de las isquemias cerebrovasculares. También puede evolucionar asintomáticamente. La gravedad de los síntomas es variable. Son atribuibles a ateroembolia cerebral o hipoflujo distal (estenosis hemodinámicamente significativa u oclusión). Se presentan como ataque isquémico transitorio (AIT) o accidente cerebrovascular constituido (ACV). Los AIT se definen como déficit cerebrovasculares focales que clínicamente se recuperan en menos de 24 horas, aunque en su mayoría lo hacen en menos de 1 hora. Los AIT de origen carotídeo pueden ser visuales o hemisféricos. Los visuales se deben a isquemia oftálmica y se manifiestan como amaurosis fugaz (ceguera monoocular transitoria): pérdida visual monoocular brusca, típicamente "en cortina" o "telón" horizontal o vertical, según la hemodinamia de la isquemia. Los hemisféricos se manifiestan por hemiparesia transitoria con predominio braquial, por involucrar generalmente al territorio silviano. En el ACV constituido se produce hemiparesia-plejía faciobraquiocrural, con afasia en las isquemias hemisféricas dominantes; el déficit puede ser máximo desde su instalación o progresivo, pero persiste más de 24 horas.
No sugieren estenosis carotídea cuadros como síncope, pérdida visual monoocular concéntrica, mareovértigo, hemianopsia, diplopía, inestabilidad en la marcha, ataxia, crisis convulsiva o confusión.
El riesgo anual de ACV en la estenosis carotídea sintomática precedida de AIT es del 12-13%. Es mayor si el AIT es hemisférico, reciente, in crescendo o con estenosis severa. Precedida de ACV, el riesgo anual de nuevo ACV es del 5-9%. El riesgo aumenta si hay placa ecolúcida, ulcerada o acompañada de trombo. Si la estenosis sintomática se somete a endarterectomía, el riesgo posendarterectomía es del 1-3%, similar al riesgo natural de la estenosis carotídea asintomática.
El riesgo anual de ACV en la estenosis carotídea asintomática > 75% es del 2-3%, similar al riesgo posendarterectomía. Sin embargo, el 83% de los ACV no tienen síntomas de advertencia, lo cual dificulta la decisión terapéutica frente a una estenosis asintomática. La ulceración, que aumenta el riesgo, es infrecuente en esta estenosis. Cuando la estenosis supera el 80%, el riesgo anual aumenta a alrededor del 5%, pero cuando es suboclusiva (95%) parece retrogradar. En una estenosis asintomática, su progresión acelerada, el colesterol LDL o el fibrinógeno elevados y la asociación de enfermedad coronaria o hipoflujo hemisférico (Doppler transcraneano) apuntarían a un riesgo mayor de ACV.
En los textos siguientes se revisan los métodos diagnósticos para la determinación de la estenosis carotídea y se establecen recomendaciones para su indicación, la determinación del riesgo quirúrgico previo a endarterectomía, la medición del grado de estenosis para la toma de decisiones terapéuticas y las indicaciones de tratamiento médico, endarterectomía y tratamiento endovascular.
El consenso es el resultado de un trabajo conjunto entre miembros de la Sociedad Argentina de Cardiología y de la Sociedad Neurológica Argentina (SNA).
Osvaldo Fustinoni
VALOR DEL ULTRASONIDO CAROTÍDEO
El ultrasonido es el método más utilizado para el diagnóstico de la enfermedad carotídea. Sus aportes han permitido medir el espesor miointimal, caracterizar la morfología de la placa, determinar el grado de obstrucción y permeabilidad carotídeos y valorar el riesgo cerebrovascular en múltiples estudios epidemiológicos y de intervención. (1-5)
Se estima que en los Estados Unidos el 80% de los pacientes evaluados por ultrasonido son operados sin otro estudio de control. Esta conducta aún es controversial y no sustentada por evidencia científica suficiente, por lo que es de suma importancia que la información suministrada por la ultrasonografía sea confiable y reproducible.
Es un método dependiente del operador y requiere entrenamiento y experiencia para la interpretación de sus resultados.
La angiografía digital es el estándar de referencia en el diagnóstico de la enfermedad carotídea, pero el ultrasonido tiene múltiples ventajas. Es preciso, no invasivo, menos costoso, puede repetirse múltiples veces y no requiere material de contraste.
La sensibilidad y la especificidad difieren entre distintos centros y así se describen sensibilidad buena o excelente (82-100%) y especificidad regular a excelente (52%-100%) según el grado de estenosis y el umbral de velocidad considerados.
El examen ultrasónico no está estandarizado entre los diferentes centros e incluso dentro de una misma institución, por lo que se sugiere:
Recomendaciones
Clase I (nivel de evidencia C)
- Realizar los estudios de ultrasonido en escala de grises, Doppler pulsado y Doppler color de una manera sistemática y normatizada.
- Los errores en la ubicación del volumen de muestra y en el ángulo del Doppler son frecuentes y condicionarán el diagnóstico de severidad, por lo que se sugiere que el ángulo de la muestra sea ≤ 60º; es preferible utilizar el ángulo de 60º en forma habitual para que los resultados puedan ser repetibles.
- El volumen de la muestra debe colocarse en el sitio de mayor estenosis y desde allí recorrer toda la longitud de la placa para ubicar el lugar de máxima velocidad. También deben considerarse dificultades técnicas relacionadas con el paciente: placa extensa, placa cálcica, tortuosidad acentuada, obstrucciones en tándem y cuello corto. Estas situaciones deben consignarse en el informe.
- Son bien conocidas las diferencias obtenidas en los resultados de control de calidad de los estudios realizados entre diferentes operadores y con diferentes aparatos (entre equipo y equipo y también entre fabricante y fabricante) descriptos en el estudio ACAS, por lo que se sugiere que en casos de seguimiento frecuente el estudio lo efectúe en lo posible el mismo operador con el mismo equipo.
Siempre se debe:
a) Analizar la morfología (superficie y estructura) de la placa.
b) Cuantificar el grado de obstrucción.
c) Verificar las consecuencias de la estenosis sobre la circulación cerebral.
Si bien la decisión de cirugía o de angioplastia carotídea se toma sobre la base del porcentaje de estenosis y la presencia o la ausencia de síntomas focales, tanto la progresión como la morfología de la placa carotídea podrían desempeñar un papel importante.
La placa carotídea puede clasificarse según los siguientes criterios:
Según su ecogenicidad:
- Uniformemente anecoica o ecolúcida (placa tipo I).
- Predominantemente hipoecoica (placa tipo II) (> 50% hipoecogénica).
- Predominantemente hiperecoica (placa tipo III) (> 50% isoecogénica o hiperecogénica).
- Uniformemente isoecogénica o hiperecogénica (placa tipo IV).
- No clasificable (placa tipo V) (placas cálcicas).
Según su textura:
- Homogéneas.
- Heterogéneas.
Según su superficie:
- Regular.
- Irregular.
- Ulcerada.
Clase II (nivel de evidencia B)
- La placa debería describirse en función de su textura para disminuir en lo posible la variabilidad intraobservador e interobservador.
Clase I (nivel de evidencia C)
- Existe acuerdo en que la ultrasonografía tiene muy baja sensibilidad, especificidad y seguridad diagnóstica para el diagnóstico de úlcera de placa.
El diagnóstico de estenosis carotídea por Doppler pulsado aporta información hemodinámica acerca de la lesión obstructiva por:
a) Hallazgos directos.
b) Hallazgos indirectos.
Hallazgos directos
Son los fenómenos locales de alta velocidad y turbulencia espectral generados por la estenosis. Así, el incremento de la velocidad de flujo es directamente proporcional al grado de obstrucción, hasta llegar a un 90% y a partir de ese porcentaje la velocidad puede disminuir en grado variable.
Hallazgos indirectos
Puede observarse:
1. Un patrón de flujo de alta resistencia en la carótida primitiva en casos de estenosis superiores al 80%.
2. Fenómenos de colateralización detectables en las arterias comunicantes del polígono de Willis y en la arteria oftálmica, en estenosis superiores al 80%.
El grado de estenosis se determina en casos de obstrucción por placa no estenosante o con obstrucción crítica, por modo B, Doppler color y en modo power. Se debe tener en cuenta que la estenosis habitualmente es irregular, por lo que puede ser difícil (salvo en cortes axiales) obtener una insonación adecuada.
Existen amplios rangos de velocidad alrededor de la media de la velocidad sistólica pico (VSP) (obtenida en los diferentes estudios) que hacen difícil clasificar el porcentaje de estenosis con variaciones del 10%.
Clase I (nivel de evidencia C)
- Teniendo en cuenta que el Doppler, cuando se utiliza en forma aislada, es inadecuado para estratificar el grado de obstrucción menor del 50%, se recomienda hacerlo basándose en la imagen en modo B, el Doppler pulsado y la imagen color.
- Se recomienda estratificar el grado de estenosis en las siguientes categorías:
- Normal.
- < 50% (placa no estenosante).
- 50% a < 70%.
- ≥ 70% (estenosis severa).
- Estenosis crítica o suboclusiva.
- 100% (oclusión).
- El diagnóstico de las últimas dos categorías de estenosis, crítica o preoclusiva y 100% (oclusión), se debe basar principalmente en las imágenes en modo B, en las del Doppler color y en las del modo power o angio, con la visualización del desfiladero de la estenosis preoclusiva. Los valores de velocidad obtenidos por Doppler pulsado (en la que incluso pueden detectarse flujos de muy baja velocidad) no se consideran de importancia, por su gran variabilidad.
Se seleccionó un umbral del 70% teniendo en cuenta que es el grado de estenosis utilizado por cirujanos y hemodinamistas para decidir una intervención en pacientes sintomáticos y podría ser también el que se considere en pacientes asintomáticos, a la luz del estudio ACST recientemente publicado. (4)
Se sugiere utilizar la velocidad sistólica de la carótida interna (VSCI) para categorizar el grado de estenosis carotídea.
Otros criterios para utilizar son el índice de velocidad sistólica de la carótida interna/carótida primitiva (VSCI/CP) y la velocidad de fin de diástole obtenida en la carótida interna (VDCI).
Estos últimos deberían emplearse en casos en que la obtención de la velocidad fuera dificultosa o en determinados casos clínicos, como estenosis en tándem, estenosis por placa larga, oclusión (100%), estenosis de la carótida interna contralateral de alto grado, en estados hiperdinámicos con VS alta en la carótida primitiva, bajo gasto sistólico por insuficiencia cardíaca, y en situaciones de discordancia entre la imagen en modo B y la VSCI.
Hay numerosos artículos en los que se mencionan diferentes velocidades de corte para estimar el grado de estenosis. Los criterios que se exponen a continuación son un resumen de los diferentes trabajos analizados. Se debe tener en cuenta que el panel está de acuerdo en que en otros centros pueden llegar a utilizar parámetros diferentes para determinar el grado de estenosis, basados en su experiencia.
Desde el punto de vista práctico, se sugieren aplicar los siguientes criterios en modo B, Doppler pulsado y color para clasificar los diferentes grados de obstrucción carotídea:

Recomendación
Clase I
(nivel de evidencia C)
- Frente a la presencia de signos clínicos y a un diagnóstico ultrasonográfico de oclusión carotídea, se sugiere corroborar este dato con angiorresonancia o angiografía digital.
- El informe final de un estudio por ultrasonido debería incluir la mención de las velocidades obtenidas, la descripción de la morfología de la placa observada y comentarios sobre las limitaciones del estudio, sobre todo si hubo dificultades de tipo técnico que pudieran reducir su precisión diagnóstica, y la comparación con estudios anteriores si existieran.
Teniendo en cuenta que la estenosis es un área de obstrucción producida por una placa donde se observa alta velocidad y turbulencia en el segmento posestenótico, no existe una correlación exacta entre los estudios angiográficos y los ultrasonográficos. La angiografía mide diámetros, el ultrasonido, con la estimación de la velocidad, mide indirectamente el área de estenosis. Esto significa una subestimación del grado de estenosis por la angiografía, salvo en los casos de obstrucción de muy alto grado, donde área y diámetro tienen valores más cercanos.
Existen interrogantes y áreas en etapas de investigación como:
- ¿Debe efectuarse un estudio por ultrasonido en pacientes asintomáticos con múltiples factores de riesgo?
- ¿Cuál es la importancia de la medición del espesoríntima-media en un paciente aislado?
- ¿Qué importancia tiene la caracterización de la morfología de una placa carotídea?
- En pacientes en seguimiento, ¿cuál es el cambio en la velocidad o en el grado de estenosis para considerarlo relevante?
VALOR DE LA ANGIORRESONANCIA MAGNÉTICA
La información que debe obtenerse de un estudio que evalúe la enfermedad carotídea incluye:
1) Determinar el grado de estenosis.
2) Determinar la causa de la estenosis.
3) Evaluar las características de la placa ateromatosa.
4) Evaluar la presencia de lesiones en tándem.
5) Evaluar la circulación colateral.
En función de estos puntos se evaluarán los grados de acuerdo y los tipos de evidencia para la angiorresonancia magnética (ARM). (6-13)
La ARM es el método no invasivo más sensible para estimar grado de estenosis en la enfermedad carotídea, aunque menor que la angiografía digital (AD). Es por esto que está indicada en aquellos pacientes que presentan alguna contraindicación para la AD (clase II, tipo A).
Una ventaja importante es la escasa morbimortalidad, incluso cuando se utiliza el contraste paramagnético endovenoso.
Existen varias técnicas que explotan distintos principios físicos para generar las imágenes angiográficas, cada uno de ellos con ventajas y desventajas.
La dependencia de la técnica y del equipamiento hace muy difícil la realización de estudios comparables. Incluso, en la práctica diaria, esta situación implica que los resultados que se obtienen en cada centro dependen del equipamiento y de las técnicas utilizadas, recordando que la fuerza del campo magnético, la potencia de los gradientes, las características de las bobinas y la actualización de los softwares influyen directamente sobre la sensibilidad y la especificidad. Sin duda, el análisis de todas estas variables excluye a gran parte del equipamiento nacional para lograr los estándares adecuados que permitan acercarse a las conclusiones que posteriormente se detallan.
Las técnicas más utilizadas para obtener imágenes angiográficas del cuello por resonancia magnética son:
1) Contraste de fase: se basa en los cambios en la fase provocados por las distintas velocidades y direcciones de flujo dentro del vaso. Mide velocidad y dirección de flujo (Clase I, tipo A). Tiene poca utilidad para medir estenosis debido a su gran sensibilidad a la velocidad del flujo (Clase I, tipo A).
2) Tiempo de vuelo: se basa en la presencia misma del flujo, ya que el tejido estacionario es saturado. Los cortes deben ser perpendiculares a la dirección del flujo (axiales en el caso de las carótidas). Sus limitaciones son el flujo lento, el flujo turbulento y el flujo paralelo al plano de adquisición. Para resolver estas dificultades se apela a la adquisición 3D y a la utilización de contraste paramagnético endovenoso. Éste debe inyectarse en bolo y la adquisición debe coincidir con la concentración máxima del contraste en la arteria en estudio. Cuando el gadolinio está en el espacio intravascular, la ARM ya no depende del flujo, dado que el T1 de la sangre se reduce lo suficiente como para producir una señal mucho mayor que la de los elementos no vasculares.
· Tiempo de vuelo 2D (Clase III):
- Sobrestima el grado de estenosis (tipo A).
- Impide medir el grado de estenosis cuando hay pérdida de señal por flujo turbulento, lo cual ocurre con estenosis mayores del 70% (tipo A).
- Mucha dificultad para valorar el flujo paralelo al plano de adquisición (tipo A).
- La cobertura anatómica es limitada (5-6 cm).
·Tiempo de vuelo 3D (Clase II):
- Mayor resolución que la técnica 2D (tipo A).
- Sobrestima el grado de estenosis (tipo A).
- Impide medir el grado de estenosis cuando hay pérdida de señal por flujo turbulento, lo cual ocurre con estenosis mayores del 70% (tipo A).
- Mejor valoración del flujo paralelo al plano de adquisición (tipo A).
·Tiempo de vuelo 3D con contraste (Clase I):
- Menor tiempo de adquisición (menor sensibilidad a movimientos del paciente) (tipo A).
- Mejora la representación del flujo lento (tipo A).
- Mejora la representación del flujo turbulento (tipo A).
- Mejora la valoración del flujo paralelo al plano de adquisición (tipo A).
- Mejora la valoración de la estenosis de alto grado (tipo A).
- Mayor confiabilidad para el diagnóstico de oclusión (tipo A).
- Permite delinear las características de la placa (tipo B).
- Permite estudiar mayores distancias y, de esta manera, evaluar la presencia de lesiones en tándem (tipo C).
- Menor limitación por la presencia de calcio (tipo A).
- Permite obtener imágenes por sustracción (tipo C).
- Permite la adquisición en el plano coronal (tipo C).
Además, existen algoritmos que mejoran la resolución y la representación (MOTSA, transferencia de magnetización, etc.).
Las mediciones del grado de estenosis se realizan siguiendo los criterios de NASCET sobre la reconstrucción MIP (proyección de máxima intensidad) que muestra el mayor grado de estenosis (Clase I, nivel de evidencia A).
En los casos de angiodisplasia, la morfología de la luz (similar a la que presenta en la AD) permite sugerir el diagnóstico.
Una ventaja adicional de la resonancia magnética es que además de las técnicas angiográficas ofrece otras técnicas, útiles en ciertas situaciones (presencia de disección, evaluación de las características de la placa).
Ante la sospecha de disección carotídea, el examen debe incluir cortes axiales potenciados para T1 con supresión grasa (Clase I, nivel de evidencia A).
Para evaluar la morfología y las características de la placa se recomienda la utilización de técnicas de alta resolución con bobinas específicas, cortes axiales ponderando T1, T2 y T2* con supresión grasa, así como inyección endovenosa de material de contraste paramagnético a fin de identificar placas inestables neovascularizadas (Clase II, nivel de evidencia B).
La presencia de un stent carotídeo dificulta la valoración del diámetro del vaso a ese nivel. Esta dificultad es menor en las técnicas con contraste paramagnético endovenoso, por lo que pueden alcanzarse mediciones confiables (Clase II, nivel de evidencia C).
Existen contraindicaciones absolutas para la realización de resonancia magnética (marcapasos, cierto tipo de clips para aneurismas, algunos implantes electrónicos, etc.).
Conclusión
En los ensayos clínicos para indicación de endarterectomía se establece el grado de estenosis mediante AD, que es el estándar de referencia en la selección de pacientes para la cirugía. Sin embargo, conlleva cierta morbimortalidad (4% de AIT o ACV menor, 1% de ACV mayor, < 1% de riesgo de muerte).
Por este motivo hay creciente interés en los métodos no invasivos, entre ellos la ARM, que cuando se realiza en condiciones técnicas ideales (hardware y software de última generación) logra una sensibilidad del 92% y una especificidad del 83%, con una exactitud del 85%. Estas cifras no son suficientes para sustituir a la AD.
Sin embargo, en combinación con la ecografía Doppler dúplex (y cuando existe concordancia entre ambas) se alcanza una sensibilidad del 100% y una especificidad del 91%, con una exactitud del 94%. Estas cifras permiten obviar la AD en más del 70% de los casos (Clase I, nivel de evidencia B).
VALOR DE LA ANGIOGRAFÍA INVASIVA
En la actualidad, el internista que actúe dentro del marco de la medicina moderna y que esté frente a un paciente que ha tenido un accidente cerebrovascular (ACV) o que tenga alto riesgo de padecerlo enfrenta también la posibilidad de utilizar una gran variedad de métodos de diagnóstico, la mayoría no invasivos y uno invasivo: la angiografía. (14-17)
La angiografía radiológica convencional cerebrovascular es el referente diagnóstico para identificar las lesiones carotídeas quirúrgicamente accesibles o remediables, ya que se ha utilizado como metro patrón en los trabajos NACET, ACAS y ECST (multicéntricos, aleatorizados) que aportaron la evidencia para discernir entre el tratamiento médico y el quirúrgico de dichas obstrucciones.
Pese a ello, si bien existen guías prácticas y recomendaciones de expertos, no se han publicado a la fecha consensos para el uso de la angiografía cerebral en el diagnóstico de la enfermedad carotídea cervical tanto en pacientes sintomáticos como asintomáticos ni trabajos aleatorizados que ofrezcan evidencia de cuándo realizarla.
Las publicaciones existentes provienen de estudios comparativos entre:
- Métodos no invasivos y angiografía.
- Guías de cómo estudiar y tratar entidades como el AIT o el ACV.
- Opinión de expertos.
Todos estos aportes hacen que la angiografía se considere el patrón oro para el diagnóstico de la enfermedad carotídea, ya que permite:
a) Evaluar objetivamente tanto el territorio extracraneano como el intracraneano.
b) Discriminar entre obstrucción severa y oclusión total.
c) Localizar la enfermedad (¿intracraneana-extracraneana?; ¿circuito anterior-posterior?).
d) Cuantificar en forma precisa el grado de obstrucción (¿es severa o no?).
e) Identificar patologías vasculares (¿aterosclerosis?; ¿disección?; ¿DFM?; ¿otras?).
f) Diagnosticar enfermedad aortoostial de troncos supraaórticos.
g) Objetivar características anatómicas y permeabilidad del polígono de Willis.
Del mismo modo se acepta la incapacidad de la angiografía convencional para identificar cambios en las paredes vasculares que puedan intervenir en el desarrollo de manifestaciones neurológicas, como:
a) La hemorragia intraplaca.
b) La presencia de trombos adheridos a la pared arterial.
c) La composición de la placa aterosclerótica.
El desafío del diagnóstico por imágenes en el futuro inmediato es el de identificar las regiones cerebrales que estén amenazadas por un alto riesgo de ACV.
Recomendaciones de angiografía invasiva en pacientes sintomáticos
Clase I
1. Pacientes con AIT o ACV menor (escala Rankin < 3) y estenosis carotídea ≥ 70%, homolateral al hemisferio cerebral sintomático, hallada en métodos de evaluación no invasivos (nivel de evidencia B).
2. Pacientes hombres con AIT o ACV menor y estenosis carotídea del 50-69%, homolateral al hemisferio cerebral sintomático, hallada con métodos de evaluación no invasivos (nivel de evidencia B).
3. Pacientes con antecedentes de síntomas relacionados con estenosis carotídea, con indicación de cirugía de revascularización miocárdica, y que por estudios no invasivos presentan estenosis carotídea del 50-69% homolateral al hemisferio cerebral sintomático (nivel de evidencia B).
Clase II
1. Pacientes mujeres con AIT o ACV menor y estenosis del 50-69%, homolateral al hemisferio cerebral sintomático, hallada con métodos de evaluación no invasiva (nivel de evidencia A).
2. Pacientes con ACV progresivo y estenosis carotídea ≥ 50% homolateral al hemisferio cerebral sintomático (nivel de evidencia B).
3. Pacientes con AIT o ACV menor y oclusión total de la arteria carótida homolateral al hemisferio cerebral sintomático, hallada con métodos de evaluación no invasivos (nivel de evidencia B).
4. Pacientes con AIT o ACV menor con sospecha de estenosis carotídea, homolateral al hemisferio cerebral sintomático, en sus segmentos ostiales o aortoostiales (nivel de evidencia C).
5. Pacientes con sospecha de enfermedad carotídea extracraneana no aterosclerótica por estudios no invasivos, como disección, vasculitis, aneurisma (nivel de evidencia B).
6. Pacientes con AIT o ACV menor y estenosis ≥ 50%, homolateral al hemisferio cerebral sintomático, hallada con más de un método de evaluación no invasivo y resultados discordantes (nivel de evidencia C).
7. Imposibilidad de efectuar métodos de evaluación no invasivos (nivel de evidencia C).
Clase III
1. Pacientes con AIT o ACV menor (escala Rankin < 3) y estenosis carotídea < 50% según métodos de evaluación no invasivos (nivel de evidencia A).
2. Fase aguda del stroke (nivel de evidencia C).
Recomendaciones de angiografía invasiva en pacientes asintomáticos
Clase I
1. Pacientes hombres con estenosis carotídea ≥ 70%, según estudios no invasivos, con expectativa de vida mayor a los 5 años (nivel de evidencia A).
Clase II
1. Pacientes mujeres con estenosis carotídea ≥ 70%, según estudios no invasivos, con expectativa de vida mayor a los 5 años (nivel de evidencia A).
2. Pacientes con oclusión total de la arteria carótida hallada en métodos de evaluación no invasivos (nivel de evidencia B).
3. Pacientes con estenosis ≥ 50% hallada en más de un método de evaluación no invasivo y resultados discordantes (nivel de evidencia C).
4. Pacientes con indicación de cirugía de revascularización miocárdica y con estenosis carotídea≥ 50% según métodos de evaluación no invasivos (nivel de evidencia B).
5. Imposibilidad de emplear métodos de evaluación no invasivos (nivel de evidencia C).
Clase III
1. Pacientes con estenosis carotídea < 50% según métodos de evaluación no invasiva (nivel de evidencia A).
¿CÓMO MEDIR EL GRADO DE ESTENOSIS CAROTÍDEA PARA LA TOMA DE DECISIONES TERAPÉUTICAS?
I. El método más preciso ("metro patrón") para medir el grado de estenosis carotídea (EC) para la toma de decisiones terapéuticas es la angiografía invasiva por sustracción digital (AID) (Clase I, nivel de evidencia B). (18) Las recomendaciones para la indicación de AID se efectúan en el capítulo Valor de la angiografía invasiva de este consenso.
II. La AID debe efectuarse por cateterización selectiva, con al menos dos proyecciones de cada vaso, que permite evaluar todo el árbol arterial, la morfología radiológica de placa, la circulación colateral y la presencia de lesiones en tándem (Clase I, nivel de evidencia B). (19)
III. En la AID, la medición debe efectuarse correlacionando el diámetro de la arteria carótida interna en el lugar de estenosis máxima, con el de su segmento distal, en el que ambas paredes se hacen paralelas (método NASCET) (Clase I, nivel de evidencia A), o bien el diámetro de la arteria en el lugar de estenosis máxima con el estimado como normal en el mismo lugar (método europeo) (Clase I, nivel de evidencia A). La fórmula para la medición es:
% estenosis = (1 - diámetro estenosis /
diámetro arteria normal) × 100
IV. Si bien se han subrayado disparidades entre uno y otro método, a largo plazo no surgen diferencias relevantes al remensurarse con el método NASCET estenosis medidas con el método europeo. Aun así, el ultrasonografista debe conocer cuál es el método utilizado en su institución para evitar discordancia en los resultados. El método NASCET, que se sugiere adoptar, no refleja la carga aterosclerótica, pero disminuye la variabilidad interobservador.
V. Como el beneficio buscado con el tratamiento invasivo puede no ser el esperado si el grado de estenosis no está bien establecido, no debería decidirse intervenir una EC sobre la base de, como único estudio, ultrasonografía (US) o angiorresonancia magnética (ARM) con técnicas de 2D y/o 3D TOF sin contraste (Clase II, nivel de evidencia B). Algunos estudios muestran que así el 18-28% de las mediciones resultarán incorrectas, porcentaje que disminuye al 7,9% si se efectúan ambos estudios (US + ARM) y sus resultados son concordantes. (20, 21)
VI. Algunos investigadores señalan que efectuar angiografía invasiva puede agregar morbimortalidad (MM) al manejo de la estenosis carotídea, sobre todo si es asintomática. En el estudio ACAS, la MM de la angiografía fue del 1,2% y la de la endarterectomía, del 1,5% (MM total: 2,7%). (18) Por el contrario, en el reciente estudio ACST, en el que la endarterectomía se decidió sobre la base de US sola, sin angiografía, la MM quirúrgica fue mayor que la MM combinada del ACAS: 3,1%. (4) Ello aporta evidencia a favor de que la angiografía puede incrementar la MM total, pero también puede contribuir a una mejor selección de pacientes para endarterectomía, con el resultado de una MM menor de ésta y total; al contrario, intervenir sin angiografía puede causar una MM quirúrgica aún mayor que la que se pretende evitar obviándola. Por ello, intervenir sobre la base de US sola, si bien es de práctica en algunas instituciones por su relación costo-eficacia, (22) es controvertido, más aún si la US no está validada. (20, 23) Además, aunque el diagnóstico ultrasonográfico de oclusión es más confiable si el equipo utilizado dispone de power angio, ello no descarta estenosis suboclusiva, sólo certificable mediante AID.
VII. Como la AID se considera el "metro patrón" para la medición del grado de EC para la toma de decisiones terapéuticas, debe emplearse en cada institución para validar en forma adecuada la US y la ARM (Clase I, nivel de evidencia B).
VIII.En metaanálisis recientes, la ARM ha sido más discriminante que la US para evaluar la EC ≥ 70%. Para la ARM, la sensibilidad fue del 95% y la especificidad del 90% y para la US, del 86% y el 87%. La diferencia en la determinación del grado de estenosis de ARM versus AID, con software de última generación y empleo de proyecciones similares, es de sólo el 0,4%. (24) El uso creciente de ARM contrastada probablemente mejore estos resultados. La US, con características técnicas de última generación y power angio, muestra sensibilidad y especificidad elevadas en relación con especímenes de endarterectomía carotídea causantes de estenosis significativas. (25)
IX. En la EC asintomática < 70% determinada con US + ARM, de buen nivel técnico y resultados concordantes, la AID puede obviarse, más aún si el riesgo vascular está aumentado (Clase II, nivel de evidencia B), ya que estos casos probablemente no tendrán indicación de tratamiento invasivo (Clase I, nivel de evidencia A). (4)
X. Si se decide no efectuar AID, algunos aconsejan repetir la US en no más de 3 semanas, por un explorador distinto, ciego para el resultado previo, con la infraestructura técnica antes referida, y confirmar su concordancia con la ARM (Clase II, nivel de evidencia C). (23)
XI. El empleo del Doppler transcraneano, junto con la US carotídea, es útil para evaluar la repercusión hemodinámica de la estenosis extracraneana, ya que mejora la especificidad para establecer el grado de estenosis con luz residual < 1,5 mm, evalúa circulación colateral y detecta reversión de flujo en las arterias oftálmica y cerebral anterior, reducción de velocidad y pulsatilidad en la arteria cerebral media o aumento de velocidad en la arteria cerebral posterior (Clase I, nivel de evidencia C). (26)
XII. El progreso en las técnicas de AID (p. ej., el diseño de catéteres) hacen prever menor morbimortalidad potencial para este método. Por otro lado, con el progreso técnico paralelo de los estudios no invasivos (US y ARM), la necesidad de AID para medir el grado de estenosis carotídea está decreciendo progresivamente y es probable que se reduzca más en el futuro. (23)
EVALUACIÓN DEL RIESGO QUIRÚRGICO PREVIO A UNA ENDARTERECTOMÍA CAROTÍDEA
El infarto agudo de miocardio (IAM) y el accidente cerebrovascular (ACV) comparten factores de riesgo y presentan mecanismos fisiopatológicos comunes. La enfermedad carotídea sintomática representa alrededor del 20% de los ACV isquémicos. Por otra parte, la coronariopatía (CORO) es una causa de muerte importante en pacientes con enfermedad cerebrovascular.
¿Cuál debería ser entonces el manejo de los pacientes con enfermedad carotídea que no tienen CORO reconocida pero que tienen factores de riesgo que indican una probabilidad mayor de IAM o de muerte de causa cardíaca en el futuro?
Estenosis carotídea asintomática y enfermedad coronaria asintomática
Distintos estudios han revelado que los pacientes con enfermedad carotídea tienen una frecuencia mayor de CORO asintomática.
Globalmente, estos ensayos muestran que el 25- 60% de los pacientes con enfermedad carotídea sin síntomas de CORO tienen resultados anormales en las pruebas provocadoras de isquemia o evidencia angiográfica de CORO grave. Los pacientes con placas coronarias no limitantes de flujo presentan igualmente riesgo de IAM o de muerte súbita (MS) por ruptura de dichas placas, pero no se cuenta en la actualidad con técnicas no invasivas confiables para identificar a este importante subgrupo de pacientes.
La falta de estudios clínicos controlados y aleatorizados ha llevado a algoritmos basados en datos observacionales y opinión de expertos. Su objetivo es identificar el estudio más apropiado para así encarar la mejor terapéutica, valorar el riesgo cardíaco a corto y a largo plazos y evitar estudios y costos innecesarios. (27-31)
Se propone combinar marcadores clínicos de riesgo con las características de la cirugía por realizar. Las cirugías se dividen en aquellas de riesgo alto de eventos duros cardiovasculares (> 5%), intermedio (< 5%) y bajo (< 1%).
La endarterectomía carotídea (EAC) está catalogada como de riesgo intermedio, ya que se presume que la probabilidad de eventos cardíacos perioperatorios es < 5%. De más está decir que una probabilidad de riesgo mayor en un paciente asintomático contraindicaría la EAC.
El primer paso sería conocer si presenta antecedente de una revascularización miocárdica dentro de los últimos 5 años, que en caso afirmativo y de no haber presentado el paciente nuevos eventos coronarios, haría innecesaria una evaluación funcional y se procedería con la EAC.
Si no hubo revascularización previa, si el paciente presenta una evaluación coronaria reciente (< 2 años) y si ésta es de bajo riesgo y el paciente no ha presentado nuevos síntomas desde la evaluación, se procede a la EAC. En caso de que no se cuente con ésta, deberán considerarse los distintos predictores clínicos, que pueden dividirse en mayores, intermedios o menores.
En caso de que el paciente presente alguno de los predictores clínicos mayores (síndromes coronarios agudos, insuficiencia cardíaca [IC] descompensada, arritmias graves o valvulopatías graves) se deberá intentar compensarlo hasta mejorar sus condiciones clínicas (caso de IC o arritmias graves) o incluso se planteará suspender la EAC. En presencia de síndromes coronarios inestables, una vez compensado se planteará la realización de una cinecoronariografía (CCG). Si el paciente presentó un IAM reciente y cuenta con una evaluación funcional de bajo riesgo, la probabilidad de reinfarto luego de EAC es baja, aunque sería prudente esperar 4-6 semanas hasta emprenderla.
Si se hallan predictores clínicos intermedios (angina CF I-II, IAM previo, IC compensada, diabetes e insuficiencia renal) y el paciente presenta buena capacidad funcional (> 4 mets), se podría realizar la EAC sin una evaluación funcional de acuerdo con estas guías, aunque muchos grupos evalúan funcionalmente a estos pacientes. En cambio, si presenta una capacidad funcional baja, se debería evaluar al paciente y si esta prueba es de alto riesgo, se le indica una CCG.
Si el paciente sólo presenta predictores de riesgo menores (edad, alteraciones del electrocardiograma basal, hipertrofia ventricular izquierda, bloqueo de rama izquierda, anormalidades del ST-T, ritmo no sinusal, capacidad funcional baja o hipertensión arterial no controlada) o no los presenta, cualquiera que sea su capacidad funcional, podría indicarse la EAC sin necesidad de una prueba para detectar isquemia.
Recomendaciones para una prueba de estrés con ejercicio o farmacológico previo a una EC
Clase I (nivel de evidencia B)
- Evaluación pronóstica en pacientes con sospecha o antecedentes de CORO.
- Evaluación de pacientes con cambios significativos en su cuadro clínico.
- Evaluación pronóstica luego de un síndrome coronario agudo.
Recomendaciones para CCG previo a una EC
Clase I (nivel de evidencia B)
En pacientes con CORO sospechada o conocida:
- Con estudios no invasivos de alto riesgo.
- Con angina que no responde al tratamiento médico.
- Con angina inestable.
Clase II (nivel de evidencia B)
- Múltiples marcadores de riesgo intermedio.
- Isquemia moderada a severa en pruebas no invasivas sin marcadores de alto riesgo, pero con deterioro de la función ventricular.
Clase III (nivel de evidencia B)
- Paciente asintomático luego de revascularización miocárdica y con excelente capacidad funcional (> 7 mets).
- Angina leve con buena capacidad funcional y sin datos de alto riesgo en la evaluación funcional.
Estenosis carotídea sintomática.
Evaluación del riesgo cardíaco luego de un ACV
Varios estudios pequeños han mostrado que los pacientes con ACV o accidente isquémico transitorio (AIT) presentan una prevalencia mayor de CORO asintomática y no son infrecuentes los resultados anormales en pruebas provocadoras de isquemia en pacientes con isquemia cerebral. Pero no todos los ACV tienen el mismo riesgo. Consideremos tres grupos de riesgo:
A. A corto plazo.
B. A plazo intermedio.
C. A largo plazo.
Los datos de estudios de pacientes con ACV isquémico agudo que reunieron cerca de 30.000 pacientes seguidos por 90 días muestran que alrededor del 2-5% de ellos presentaron eventos cardíacos fatales en el corto plazo. La prevalencia de enfermedad cardíaca en esta población está en el rango del 20- 30% y considerando que los ensayos no registran si los eventos cardíacos ocurrieron predominantemente en pacientes con CORO previa, es probable que una mayoría de los eventos cardíacos haya ocurrido en aquellos pacientes con antecedentes cardiovasculares previos, lo cual hace que la estimación del riesgo de muerte por enfermedad cardíaca en pacientes con ACV sin historia de CORO posiblemente sea menor que la registrada en estos estudios.
La estimación del riesgo en tiempo intermedio pos- ACV (30 días a 2 años) se puede obtener de los grandes estudios de prevención secundaria pos-ACV. En estos ensayos, los pacientes fueron ingresados entre los 30 y los 90 días pos-ACV y la mayoría fueron tratados con aspirina, que disminuyó tanto el riesgo de ACV como el de IAM. En general, los pacientes con muerte temprana pos-ACV fueron excluidos. Estos estudios en general excluyeron pacientes con ACV cardioembólico, que es un subgrupo de mayor riesgo. Aproximadamente el 30% de los pacientes ingresados en estos estudios presentaban antecedentes de CORO. Y es razonable presumir que la mayoría de los eventos cardíacos registrados en estos pacientes hayan ocurrido en aquellos con antecedentes cardiovasculares previos.
Por lo tanto, el riesgo de eventos cardíacos pos- ACV reciente -hasta 2 años- en pacientes tratados con agentes antiplaquetarios que no presentaban antecedentes de enfermedad cardiovascular es bajo, en el rango del 2-3% por año, por lo que no se justifica realizar estudios para investigar isquemia durante la internación (que podría prolongarla).
Debe tenerse en cuenta que los ensayos tienden a subestimar el riesgo ya que se suele ingresar pacientes más sanos.
El riesgo de CORO a largo a plazo pos-ACV no es tan benigno y el riesgo de muerte es dos veces mayor que el de la población de igual edad sin antecedentes de ACV.
Las guías de ACC/AHA de prueba de ejercicio consideran una recomendación de Clase II, nivel de evidencia B, la evaluación de pacientes asintomáticos con múltiples factores de riesgo como orientación para terapia de reducción de riesgo.
Aunque el ACV no se ha identificado específicamente como factor de riesgo, los datos antes expuestos sugieren que algunos tipos de ACV comparten una probabilidad preprueba de enfermedad coronaria intermedia a alta y requerirían una evaluación funcional.
Subtipos de ACV isquémico y riesgo cardíaco
La aterosclerosis es invariablemente la causa de la CORO. Es entonces muy probable que los subtipos de ACV isquémico relacionados con aterosclerosis subyacente (carotídeo, vertebral, estenosis intracraneana) se asocien con mayor riesgo de CORO que los subtipos no ateroscleróticos de ACV.
La evidencia indica que el subtipo de ACV isquémico provee información importante acerca del riesgo de enfermedad cardíaca concomitante, especialmente en tres situaciones: 1) estenosis carotídea sintomática o asintomática (riesgo alto), 2) ACV de pequeños vasos o lacunar (riesgo bajo), 3) embolia cardíaca como causa de ACV (riesgo muy alto).
Un comité conjunto de la American Heart Association y la American Stroke Association para evaluar el riesgo coronario en pacientes con AIT o ACV propone, ante la ausencia de estudios grandes aleatorizados, realizar una evaluación funcional no invasiva en pacientes con enfermedad carotídea (Clase I, nivel de evidencia B). (31)
TRATAMIENTO MÉDICO Y CONTROL DE LOS FACTORES DE RIESGO
Los factores de riesgo se clasifican en no modificables y modificables:
Factores no modificables
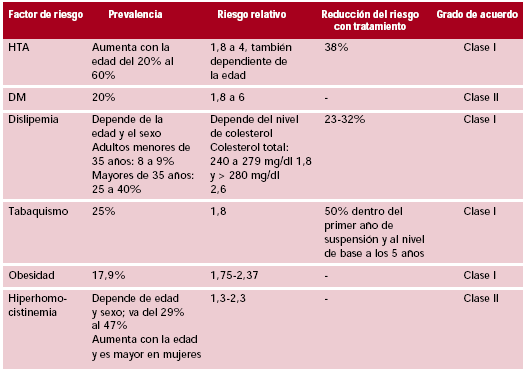
Edad: cada 10 años de incremento en la edad a partir de los 55 años se duplica el riesgo de accidente cerebrovascular (ACV).
Raza: la incidencia de ACV en la raza negra es de 233/100.000 habitantes, en hispánicos de 196/100.000 habitantes y en blancos de 93/100.000 habitantes.
Sexo: los hombres tienen una incidencia mayor de ACV en comparación con las mujeres.
La historia familiar de ACV o ataque isquémico transitorio (AIT) se asocia con un riesgo relativo de 2,4 (IC 95% 0,96-6,03) para la historia paterna y de 1,4 (IC 95% 0,60-3,25) para la materna.
Factores modificables
La hipertensión es el principal factor de riesgo de la enfermedad vascular y su prevalencia aumenta con la edad; el descenso de 5 a 10 mm de Hg de la TA reduce el riesgo de ACV en un 42%.
Datos provenientes del estudio SHEP (Systolic Hypertension in the Elderly Program) demuestran que por cada disminución de 1 mm de Hg de TA sistólica (TAS) la incidencia de ACV se reduce un 1%. (32)
Los pacientes con menos de 150 mm de Hg de (TAS) tuvieron una reducción de la tasa de riesgo de 0,66 (95% IC 0,48-0,90). El Framingham Heart Study demostró que valores menores de 140/90 mm de Hg reducen el riesgo de ACV en un 38%. El beneficio de tratar la TA en pacientes de más de 65 años con valores normales altos (130 a 139 de TAS y 85 a 89 de diastólica) debe demostrarse. Estudios con diferentes inhibidores de la enzima convertidora mostraron que la reducción de la TAS disminuyó el riesgo de ACV fatal y no fatal. (33)
La diabetes mellitus (DM) es un factor de riesgo importante para el desarrollo de enfermedad ateromatosa. La incidencia por 1.000 personas/año de ACV tromboembólico se incrementa a medida que aumenta el nivel de glucosa en sangre. El riesgo relativo de desarrollar un ACV asociado con DM es de 1,4 a 1,7. La reducción de los niveles de glucemia no disminuye el riesgo de ACV, pero el control de la TA y la glucemia en pacientes con DM tipo II disminuyó el riesgo de ACV en un 44%.
La dislipemia es un factor de riesgo creciente para el desarrollo de enfermedad ateromatosa. Datos de estudios recientes con estatinas muestran una reducción del 25% al 32% del riesgo de ACV en los pacientes tratados. La pravastatina demostró una reducción del riesgo de ACV del 32% en pacientes con infarto de miocardio y nivel de colesterol de más de 240 mg/dl según datos del estudio CARE. El estudio LIPID, también con pravastatina, demostró una reducción del 19% del riesgo de ACV en pacientes con enfermedad coronaria y nivel basal de colesterol de entre 155 y 270 mg/dl.
El Heart Protection Study (HPS) evaluó 20.536 pacientes aleatorizados a placebo o simvastatina 40 mg/día con nivel de colesterol LDL de 135 mg/dl e historia de enfermedad coronaria, ACV, AIT, endarterectomía carotídea, enfermedad vascular periférica, DM o HTA tratada (34) y demostró una reducción del 25% de la tasa de primer ACV (4,3% versus 5,7%, p< 0,0001) con un 30% de reducción de ACV isquémico (2,8 versus 4,0). Cuando desde la clínica no hay evidencia de manifestaciones de ateroesclerosis o DM, se recomienda llevar el nivel de colesterol LDL a menos de 130 mg/dl y en pacientes con ateroesclerosis o DM se recomienda llevar el nivel de colesterol LDL a menos de 100 mg/dl.
El tabaquismo se asocia con un 50% de incremento del riesgo de ACV.
Cuando el índice de masa corporal es mayor de 24,9 kg/m2, la persona se considera obesa y con mayor riesgo de desarrollar enfermedad ateromatosa. En estos casos se recomienda reducir el consumo de grasas saturadas a menos del 10% del consumo calórico diario y aumentar el de frutas, vegetales, granos y pescados.
Con el incremento de los niveles de homocisteína aumenta el riesgo de ACV. En el caso de la estenosis carotídea, la relación de probabilidad (odds ratio, OR) es de 8,7 para los niveles altos de homocisteína (más de 13,8 µmol/L). El estudio Vitamin Intervention for Stroke Prevention (VISP) no pudo demostrar beneficio en la evolución a 2 años de los pacientes tratados con vitamina B12 y ácido fólico.
Tratamiento con drogas antitrombóticas
Antiagregantes plaquetarios
En prevención secundaria, el uso de aspirina en dosis de 50 a 300 mg/día demostró una reducción de la recurrencia de ACV del 20 al 25% según datos de los estudios Swedish Aspirin Low Dose Trial (SALT) y el Dutch TIA trial.
La asociación aspirina 50 mg/día y dipiridamol de liberación prolongada 400 mg/día, estudiada en el European Stroke Prevention Study, mostró una reducción del riesgo de ACV del 37%, en comparación con placebo (p < 0,001), y del 23% cuando se comparó con aspirina (p = 0,006).
El clopidogrel es moderadamente más eficaz que la aspirina (13%) para la prevención de eventos aterotrombóticos según datos del estudio CAPRIE (Clopidogrel versus Aspirin in Patients at Risk of Ischemic Events). No hay datos que avalen el uso de la asociación aspirina/clopidogrel para la prevención secundaria; el estudio MATCH no demostró beneficio. (35)
Anticoagulación
No hay trabajos que avalen el uso de anticoagulantes en la estenosis carotídea.
Recomendaciones para factores de riesgo
TRATAMIENTO QUIRÚRGICO: ENDARTERECTOMÍA CAROTÍDEA
Estudios aleatorizados en pacientes sintomáticos
Varios ensayos demostraron la eficacia de la endarterectomía carotídea (EAC) en la estenosis carotídea sintomática. El estudio NASCET enroló a 1.415 pacientes con AIT hemisférico o retinal o ACV no invalidante, dentro de los 120 días, con estenosis carotídea del 70-99%. (36) Mostró el 17% de reducción absoluta del riesgo (RAR) de ACV en favor de la EAC. La tasa de muerte y de ACV a los 2 años fue del 2,5% (grupo quirúrgico) versus el 13% (grupo médico). Dentro del grupo quirúrgico, 92 pacientes desarrollaron un evento perioperatorio (mortalidad global 1,1%, ACV incapacitante 1,8%, ACV no incapacitante 3,7%). Las variables de alto riesgo para ACV fueron síntomas hemisféricos, obstrucción carotídea izquierda, oclusión carotídea contralateral, presencia de lesión tomográfica isquémica y placa carotídea ulcerada o irregular.
Hubo el 6,5% de RAR en los 1.087 pacientes que recibieron EAC para estenosis del 50-69%. Aunque el riesgo perioperatorio de ACV y muerte a los 30 días fue mayor que con tratamiento médico (5,8% versus 3,3%), el seguimiento de dichos pacientes reveló:
- Menor riesgo acumulativo a los 2 años de ACV homolateral (9% versus 26%, p < 0,001).
- Menor riesgo de ACV grave/fatal (2,5% versus 13,1%, p < 0,001).
En un seguimiento de estos pacientes a 3 años, el 15% de los no operados desarrollaron ACV, en el 80% de los casos debido a estenosis carotídea. (37) A los 3 años, el riesgo de ACV fue del 28,3% para el grupo médico y del 8,9% para el quirúrgico. El subgrupo de pacientes > 75 años operados por estenosis del 50- 99% tuvo más beneficio que los pacientes operados más jóvenes.
De los pacientes del estudio NASCET tratados médicamente, 198 con amaurosis fugaz tuvieron un tercio del riesgo de ACV homolateral anual respecto de 417 pacientes con AIT hemisférico. Seis factores se asociaron con riesgo mayor de ACV en los pacientes con amaurosis fugaz:
- Edad > 75 años.
- Sexo masculino.
- Historia de AIT o ACV hemisférico.
- Historia de claudicación intermitente.
- Estenosis carotídea del 80-94%.
- Ausencia de circulación colateral.
El riesgo de ACV a los 3 años con tratamiento médico para pacientes con 0-1, 2 y 3 o más factores de riesgo fue del 1,8%, 12,3% y 24,2%. La RAR asociada con EAC fue del 2,2%, 4,9% y 14,3% (número que es necesario tratar [NNT] para prevenir un ACV en 2 años: 7 en el grupo de riesgo mayor y 20 en el grupo con dos factores de riesgo).
El ECST aleatorizó 2.518 pacientes con ACV isquémico, AIT o infarto retinal por estenosis carotídea homolateral. (38) Incluyó 374 pacientes con estenosis leve (0%-29%) y 778 con estenosis severa (70%- 90%). Después de tres años:
- Los pacientes con estenosis leve tenían bajo riesgo de ACV isquémico homolateral; los posibles beneficios de EAC eran pequeños.
- A los 30 días pos-EAC, la incidencia de ACV o muerte fue del 7,5% en los pacientes con estenosis severa, pero sin relación con la gravedad de la estenosis.
- A los 3 años, los pacientes operados mostraron reducciones significativas en la incidencia de ACV homolateral, que fue del 2,8% versus el 16,8% con aspirina sola (p < 0,0001) y en el riesgo total de muerte quirúrgica, ACV operatorio o cualquier otro ACV (12,3% versus 21,9%). El riesgo varió con la edad y el sexo.
Recomendaciones de tratamiento quirúrgico en pacientes sintomáticos
Clase I (nivel de evidencia A)
- Estenosis carotídeas sintomáticas del 70-99% siempre que el riesgo quirúrgico no exceda el 6% (valores NASCET). Los mejores beneficios de la cirugía se logran si se realiza dentro de las 2 semanas de ocurrido el AIT o el ACV no discapacitante.
Clase II (nivel de evidencia A)
- La EAC es aceptable, pero con un margen moderado de beneficio, en pacientes, particularmente varones, con estenosis sintomáticas del 50-69%.
Clase III (nivel de evidencia A)
- La EAC no es beneficiosa en pacientes sintomáticos con estenosis del 0-49%.
En pacientes sintomáticos, los NNT para estenosis del 70-90%, 50-69% y < 50% son 8, 20 y 67 (estudios NASCET y ECST).
Estudios aleatorizados en pacientes asintomáticos
El ACAS (Asymptomatic Carotid Atherosclerosis Study) constituye una fuerte evidencia a favor de la EAC en estenosis asintomática > 60%. (39) Este estudio multicéntrico, prospectivo y aleatorizado comparó la combinación de EAC y mejor tratamiento médico por entonces (aspirina 325 mg/día y control de factores de riesgo) con el tratamiento médico exclusivo. Se aleatorizaron pacientes con estenosis carotídeas asintomáticas > 60%, con seguimiento promedio de 2,7 años. Se asignaron 825 pacientes a EAC y 834 a tratamiento médico. La incidencia real de ACV secundario a cirugía fue del 1,38% (muerte: 0,14%, morbimortalidad combinada: 1,52%). Aun con una morbimortalidad baja del grupo médico (2,2%/año), los beneficios se manifestaron a favor de la EAC, con la que la tasa total de ACV/muerte alcanzó el 2,3%. Las complicaciones relacionadas con la EAC incluyeron IAM, ACV perioperatorio, lesión de pares craneanos o problemas asociados con la herida quirúrgica en proporciones acumulativas del 12% al 21%. En el grupo quirúrgico, el ACAS demostró, a los 5 años, el 6% de RAR de ACV, con una incidencia anual cercana al 2,2% (versus el 3,2% de ACV para la carótida contralateral en el estudio NASCET). En relación con la expectativa de vida, los pacientes más añosos con estenosis asintomáticas son poco beneficiados por la EAC. Sin embargo, dentro de este subgrupo, de aquellos que mostraron una progresión secuencial de la enfermedad (16%), el 16% se tornó sintomático y el 7% desarrolló un ACV. Los pacientes con placas heterogéneas también presentaron más ACV. Ambos grupos se beneficiarían con la EAC aun en presencia de una expectativa de vida más corta. Distinta evolución tienen los pacientes añosos con estenosis sintomáticas, en los que aunque la incidencia de complicaciones perioperatorias es mayor, la posibilidad de desarrollar un ACV también lo es (reducción de la incidencia de ACV: 28,9% en > 75 años versus 15,1% en < 75 años). En el grupo quirúrgico, la RRR de ACV o muerte a los 5 años fue del 66% para hombres y sólo del 17% para mujeres. El porcentaje de mujeres en el ACAS fue del 34%. Si bien la diferencia por sexo no resultó significativa, parecería que sugiere menor beneficio de la EAC en mujeres. Éstas presentaban una incidencia menor de enfermedad coronaria pero, por el contrario, mayor frecuencia de hipertensión y diabetes. La proporción de complicaciones perioperatorias en mujeres fue del 3,6% versus el 1,7% en hombres. La reducción del riesgo de ACV fue más importante en hombres e independiente del grado de estenosis carotídea (a diferencia de lo publicado en el estudio NASCET) o de la enfermedad carotídea contralateral.
Un riesgo sustancial en el grupo quirúrgico fue atribuido a la angiografía (1,2% en el ACAS y 0,7% en el NASCET) y el riesgo inicial por angiografía y endarterectomía combinadas fue equilibrado con la tasa constante de ACV del 2,2% por año del grupo no quirúrgico. En otras palabras, el beneficio de la cirugía se hace aparente luego de 10 meses y estadísticamente significativo luego de 3 años de la EAC, otro dato importante al momento de indicar una EAC en relación con la expectativa de vida del paciente.
Dejando de lado los ACV preoperatorios y relacionados con angiografías, la incidencia real secundaria a cirugía fue del 1,5% a los 30 días. Sin embargo, la incidencia de ACV en pacientes asintomáticos fue del 2,2%/año versus el 10% en sintomáticos con estenosis carotídeas severas.
Con estos resultados se deberían realizar 19 EAC en pacientes asintomáticos para prevenir un ACV en 5 años, en comparación con las 5-6 cirugías necesarias para prevenir un ACV en 2 años en sintomáticos.
La angioplastia con parche es la forma habitual de arteriorrafia para disminuir la incidencia de estenosis residuales, reestenosis o trombosis aguda. El estudio ACAS demostró una diferencia estadísticamente significativa a favor del cierre con parche en relación con reestenosis antes de los 3 meses (21,2% versus 7%), entre los 3 y los 18 meses (16,7% versus 4,6%) y luego de 18 meses (27,4% versus 8,2%) respecto de los cierres simples de arteriotomía.
El ACST (Asymptomatic Carotid Surgery Trial), publicado en 2004, analiza la evolución de 3.120 pacientes con estenosis carotídeas asintomáticas > 70% aleatorizados a grupos quirúrgico o mejor tratamiento médico. (4) El riesgo de ACV posoperatorio a los 30 días fue del 3,1%. Excluyendo las complicaciones perioperatorias, la tasa de ACV a los 5 años fue del 3,8% para el grupo quirúrgico versus el 11% para el médico (6,4% versus 11,8% complicaciones totales; 3,5% versus 6,1% para ACV fatal/gravemente invalidante; 2,1 versus 4,2% para ACV fatal). Dichos beneficios fueron constantes para hombres y mujeres, con indistinto grado de estenosis pero especialmente para < 75 años.
A diferencia de lo ocurrido en el estudio ACAS, un punto clave en este estudio es que en ambos grupos fue importante el control de los factores de riesgo: al término del seguimiento entre 2002 y 2003, > 90% de los pacientes estaban antiagregados, el 81% recibían antihipertensivos y 70%, hipolipemiantes.
Recomendaciones de tratamiento quirúrgico en pacientes asintomáticos
Clase I (nivel de evidencia A)
- Estenosis carotídeas asintomáticas del 70-99% siempre que el riesgo quirúrgico no exceda el 3% (valores del estudio ACAS).
Clase II (nivel de evidencia A)
- Estenosis carotídeas asintomáticas del 60-69% siempre que el riesgo quirúrgico no exceda el 3%.
Clase III (nivel de evidencia A)
- La EAC no es beneficiosa en pacientes asintomáticos con estenosis < 60%.
Conclusiones
La EAC tiene indicaciones definidas y resultados excelentes a corto y largo plazos para prevenir el ACV isquémico. Dos puntos clave para la obtención de un resultado adecuado son una selección correcta de los pacientes y una técnica quirúrgica adecuada, con una tasa de morbimortalidad que resulte beneficiosa frente a otras alternativas terapéuticas.
TRATAMIENTO ENDOVASCULAR: ANGIOPLASTIA CAROTÍDEA
El accidente cerebrovascular isquémico debido a enfermedad aterosclerótica carotídea puede ser un evento clínico devastador. La endarterectomía carotídea demostró que es un método eficaz de tratamiento cuando la obstrucción carotídea fue sintomática > 50% al mostrar mayor eficacia que el tratamiento médico (NASCET, ECST) y > 60% en los pacientes asintomáticos (ACAS, ACST). Lamentablemente, la endarterectomía demostró eficacia en un subgrupo de pacientes estrictamente seleccionados, ya que se dejaron de lado pacientes considerados de alto riesgo quirúrgico y los centros tratantes debían demostrar experiencia acreditada en el método. De esta forma, de los trabajos aleatorizados se excluyó una población de pacientes, frecuente en la vida diaria, considerados de alto riesgo por la presencia de comorbilidades.
El perfeccionamiento de los procedimientos terapéuticos endovasculares ha podido enfrentar con éxito dicha dificultad, como lo demuestran múltiples series y trabajos aleatorizados recientes como el SAPPHIRE. (40-46) En la actualidad, gracias a los sistemas de protección cerebral y al aprendizaje e idoneidad de los equipos tratantes, se obtienen tasas aceptables de complicaciones (muerte, infarto agudo de miocardio, accidente cerebrovascular isquémico) a los 30 días del 5,8% en pacientes de alto riesgo.
Demostrado está que para obtener los beneficios descriptos en la literatura se hace también extensible el concepto del riesgo del equipo actuante, como en la endarterectomía carotídea, donde debe ser menor del 6% en las carótidas sintomáticas y menor del 3% en las asintomáticas para que se logre el beneficio del método. Un punto relevante en este aspecto es que no está claro cuál es el riesgo de complicaciones en los pacientes con alto riesgo quirúrgico (NASCET no elegibles, seguidos con tratamiento médico), por lo que se acepta que en este grupo de pacientes la tasa de complicaciones dentro de los 30 días de sometidos al tratamiento endovascular no debería superar el 6% en sintomáticos y el 3% en asintomáticos.
Es fundamental que los equipos intervinientes documenten experiencia acreditada (no menos de 50 procedimientos realizados) y demuestren tasas de eficacia (98% en la literatura), de complicaciones y de reestenosis aceptables para poder tratar esta patología.
En la actualidad están en curso grandes estudios controlados que comparan la endarterectomía con la angioplastia carotídea con colocación de stent y sistema de protección cerebral, que esperamos que sus resultados permitan definir aún más los alcances del método y la población de pacientes que más se beneficiaría con dicho procedimiento (CREST, ICSS [CAVATAS-2], SPACE).
Recomendaciones
Clase I (nivel de evidencia A)*
1. Estenosis carotídea sintomática (ECS) ≥ 50% (altamente recomendado ≥ 70%) en pacientes con alto riesgo quirúrgico NASCET no elegibles.
Clase II (nivel de evidencia A)
2. ECS ≥ 50% (altamente recomendado ≥ 70%) asociada con alguna de las siguientes condiciones:
- Estenosis posradiación.
- Reestenosis de una endarterectomía.
- Estenosis severa en tándem.
- Estenosis proximal o distal a la bifurcación.
- Radioterapia y/o cirugía previa de cuello.
Clase II (nivel de evidencia B)
3. ECS ≥ 50% (altamente recomendado ≥ 70%) de difícil acceso quirúrgico.
- Bifurcación alta que requiere dislocación del maxilar.
- Cuello corto.
- Placa > 3 cm en la arteria carótida interna (ACI) distal o placa > 5 cm en ACI proximal.
Clase II (nivel de evidencia B)
4. ECS ≥ 50% (altamente recomendado ≥ 70%) asociada con alguna de las siguientes condiciones:
- Negación del paciente a endarterectomía carotídea.
- Estenosis secundaria a disección carotídea.
- Estenosis secundaria a fibrodisplasia.
- Estenosis secundaria a arteritis de Takayasu.
Clase II (nivel de evidencia A)
5. Angioplastia carotídea con protección cerebral en paciente asintomático con estenosis ≥ 80% que cumpla los puntos 1 a 4.
Clase II (nivel de evidencia B)
6. Pacientes con estenosis ≥ 70% asociada con oclusión contralateral en paciente que requiera cirugía cardíaca.
7. Pacientes con estenosis residual ≥ 70% luego de recanalización con tratamiento fibrinolítico en stroke agudo.
8. Pacientes con estenosis sintomática ≥ 70% con riesgo moderado o bajo para endarterectomía.
Clase II (nivel de evidencia C)
9. Estenosis sintomática asociada con una malformación vascular intracraneana.
10.Estenosis sintomática en pacientes con stroke isquémico subagudo.
Clase III (nivel de evidencia B)
1. Angioplastia carotídea sin protección cerebral.
Clase III (nivel de evidencia C)
2. Una estenosis que no pueda ser atravesada por los dispositivos endovasculares en forma segura (p. ej., estenosis severamente calcificada).
3. Asintomáticos con estenosis carotídea menor del 80%.
4. Contraindicación para utilizar material de contraste.
5. Contraindicaciones para antiagregación.
6. Estenosis carotídea con dificultad de acceso endovascular.
7. Dilatación y calcificación severa del cayado aórtico.
8. Extrema tortuosidad aortoilíaca.
9. Trombo fresco carotídeo.
* Esta recomendación se clasificó Clase II al momento de la discusión llevada a cabo durante el desarrollo del consenso. Luego de la publicación del estudio SAPPHIRE y de la aprobación por parte de la FDA de la angioplastia carotídea con implante de stent para pacientes con estenosis carotídea y alto riesgo quirúrgico en los Estados Unidos, en octubre 2004, se consideró apropiado reclasificar la recomendación como Clase I.
1. Grant EG, Benson CB, Moneta GL, Alexandrov AV, Baker JD, Bluth EI, et al. Carotid Artery Stenosis: Gray-scale and Doppler US Diagnosis. Society of Radiologists in Ultrasound. Consensus Conference. Radiology 2003;229:340-6.
2. Jogestrand T, von Arbin M, Bergqvist D, Lilja A, Lindqvist M, Matzsch T, et al. Recommendations by the Swedish Quality Board for Carotid Surgery. Ultrasound good preoperative method for evaluation degree of carotid stenosis. Lakartidningen 2003;100:2443-5.
3. Nicolaides A, Sabetai M, Kakkos SK, Dhanjil S, Tegos T, Stevens JM, et al; ACSRS Study Group. The Asymptomatic Carotid Stenosis and Risk of Stroke (ACSRS) study. Aims and results of quality control. Int Angiol 2003;22:263-72.
4. Halliday A, Mansfield A, Marro J, Petto C, Petto R, Porter J, et al. MRC ACST Collaborative group Prevention of disabling and fatal strokes by successful carotid endarterectomy in patients without recent neurological symptoms: Randomized controlled trial. Lancet 2004;363:1491-502.
5. Grant EG, Duerinckx AJ, El Saden SM, Melany ML, Hathout GM, Zimmerman PT, et al. Ability to use duplex US to quantify internal carotid arterial stenoses: fact or fiction? Radiology 2000;214:247-52.
6. Westwood ME, Kelly S, Berry E, Bamford JM, Gough MJ, Airey CM, et al. Use of magnetic resonance angiography to select candidates with recently symptomatic carotid stenosis for surgery: systematic review. BMJ 2002;324:198-201.
7. Johnson MB, Wilkinson ID, Wattam J, Venables GS, Griffiths PD. Comparison of Doppler ultrasound, magnetic resonance angiographic techniques and catheter angiography in evaluation of carotid stenosis. Clin Radiol 2000;55:912-20.
8. Nederkoorn PJ, Elgersma OE, van der Graaf Y, Eikelboom BC, Kappelle LJ, Mali WP. Carotid artery stenosis: accuracy of contrastenhanced MR angiography for diagnosis. Radiology 2003;228:677-82.
9. El-Saden SM, Grant EG, Hathout GM, Zimmerman PT, Cohen SN, Baker JD. Imaging of the internal carotid artery: the dilemma of total versus near total occlusion. Radiology 2001;221:301-8.
10. Carr JC, Ma J, Desphande V, Pereles S, Laub G, Finn JP. Highresolution breath-hold contrast-enhanced MR angiography of the entire carotid circulation. Am J Roentgenol 2002;178:543-9.
11. Cappendijk VC, Cleutjens KB, Heeneman S, Schurink GW, Welten RJ, Kessels AG, et al. In vivo detection of hemorrhage in human atherosclerotic plaques with magnetic resonance imaging. J Magn Reson Imaging 2004;20:105-10.
12. Yuan C, Mitsumori LM, Beach KW, Maravilla KR. Carotid atherosclerotic plaque: noninvasive MR characterization and identification of vulnerable lesions. Radiology 2001;221:285-99.
13. Yuan C, Kerwin WS, Ferguson MS, Polissar N, Zhang S, Cai J, et al. Contrast-enhanced high resolution MRI for atherosclerotic carotid artery tissue characterization. J Magn Reson Imaging 2002;15:62-7.
14. Moore WS, Barnett HJ, Beebe HG, Bernstein EF, Brener BJ, Brott T, et al. Guidelines for carotid endarterectomy. A multidisciplinary consensus statement from the ad hoc Committee, American Heart Association. Stroke 1995;26:188-201. Update Stroke 1998;29:554-62.
15. Culebras A, Kase CS, Masdeu JC, Fox AJ, Bryan RN, Grossman CB, et al. Practice guidelines for the use of imaging in transient ischemic attacks and acute stroke. A report of the Stroke Council, American Heart Association. Stroke 1997;28:1480-97.
16. Chaturvedi S, Policherla PN, Femino L. Cerebral angiography practices at US teaching hospitals. Implications for carotid endarterectomy. Stroke 1997;28:1895-7.
17. Lee VS, Hertzberg BS, Workman MJ, Smith TP, Kliewer MA, DeLong DM, et al. Variability of Doppler US measurements along the common carotid artery: effects on estimates of internal carotid arterial stenosis in patients with angiographically proved disease. Radiology 2000;214:387-92.
18. Endarterectomy for asymptomatic carotid artery stenosis. Executive Committee for the Asymptomatic Carotid Atherosclerosis Study. JAMA 1995;273:1421-8.
19. Barnett HJ, Meldrum HE, Eliasziw M; North American Symptomatic Carotid Endarterectomy Trial (NASCET) collaborators. The appropriate use of carotid endarterectomy. CMAJ 2002 Apr 30;166:1169-79.
20. Norris JW, Rothwell PM. Noninvasive carotid imaging to select patients for endarterectomy: is it really safer than conventional angiography? Neurology 2001;56:990-1.
21. Johnston DC, Goldstein LB. Clinical carotid endarterectomy decision making: noninvasive vascular imaging versus angiography. Neurology 2001;56:1009-15.
22. Buskens E, Nederkoorn PJ, Buijs-Van Der Woude T, Mali WP, Kappelle LJ, Eikelboom BC, et al. Imaging of carotid arteries in symptomatic patients: cost-effectiveness of diagnostic strategies. Radiology 2004;233:101-12.
23. Norris JW, Halliday A. Is ultrasound sufficient for vascular imaging prior to carotid endarterectomy? Stroke 2004;35:370-1.
24. Nederkoorn PJ, van der Graaf Y, Hunink MG. Duplex ultrasound and magnetic resonance angiography compared with digital subtraction angiography in carotid artery stenosis: a systematic review. Stroke 2003;34:1324-32.
25. Suwanwela N, Can U, Furie KL, Southern JF, Macdonald NR, Ogilvy CS, et al. Carotid Doppler ultrasound criteria for internal carotid artery stenosis based on residual lumen diameter calculated from en bloc carotid endarterectomy specimens. Stroke 1996;27:1965-9.
26. Can U, Furie KL, Suwanwela N, Southern JF, Macdonald NR, Ogilvy CS, et al. Transcranial Doppler ultrasound criteria for hemodynamically significant internal carotid artery stenosis based on residual lumen diameter calculated from en bloc endarterectomy specimens. Stroke 1997;28:1966-71.
27. Eagle KA, Berger PB, Calkins H, Chaitman BR, Ewy GA, Fleischmann KE, et al; American College of Cardiology; American Heart Association. ACC/AHA guideline update for perioperative cardiovascular evaluation for noncardiac surgery- executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee to Update the 1996 Guidelines on Perioperative Cardiovascular Evaluation for Noncardiac Surgery). J Am Coll Cardiol 2002;39:542-53.
28. Gates P, Peppard R, Kempster P, Harris A, Pierce M. Clinically unsuspected cardiac disease in patients with cerebral ischaemia. Clin Exp Neurol 1987;23:75-80.
29. The International Stroke Trial (IST): a randomised trial of aspirin, subcutaneous heparin, both, or neither among 19435 patients with acute ischaemic stroke. International Stroke Trial Collaborative Group. Lancet 1997;349:1569-81.
30. Dexter DD Jr, Whisnant JP, Connolly DC, O'Fallon WM. The association of stroke and coronary heart disease: a population study. Mayo Clin Proc 1987;62:1077-83.
31. Adams RJ, Chimowitz MI, Alpert JS, Awad IA, Cerqueria MD, Fayad P, et al; Stroke Council and the Council on Clinical Cardiology of the American Heart Association; American Stroke Association. Coronary risk evaluation in patients with transient ischemic attack and ischemic stroke: a scientific statement for healthcare professionals from the Stroke Council and the Council on Clinical Cardiology of the American Heart Association/American Stroke Association. Circulation 2003;108:1278-90.
32. Perry HM Jr, Davis BR, Price TR, Applegate WB, Fields WS, Guralnik JM, et al. Effect of treating isolated systolic hypertension on the risk of developing various types and subtypes of stroke: the Systolic Hypertension in the Elderly Program (SHEP). JAMA 2000;284:465-71.
33. Chalmers J, Todd A, Chapman N, Beilin L, Davis S, Donnan G, et al; International Society of Hypertension Writing Group. International Society of Hypertension (ISH): statement on blood pressure lowering and stroke prevention. J Hypertens 2003;21:651-63.
34. Collins R, Armitage J, Parish S, Sleight P, Peto R; Heart Protection Study Collaborative Group. Effects of cholesterol-lowering with simvastatin on stroke and other major vascular events in 20536 people with cerebrovascular disease or other high-risk conditions. Lancet 2004;363:757-67.
35. Diener HC, Bogousslavsky J, Brass LM, Cimminiello C, Csiba L, Kaste M, et al; MATCH investigators. Aspirin and clopidogrel compared with clopidogrel alone after recent ischaemic stroke or transient ischaemic attack in high-risk patients (MATCH): randomised, doubleblind, placebo-controlled trial. Lancet 2004;364:331-7.
36. Beneficial effect of carotid endarterectomy in symptomatic patients with high-grade carotid stenosis. North American Symptomatic Carotid Endarterectomy Trial Collaborators. N Engl J Med 1991;325:445-53.
37. Barnett HJ, Taylor DW, Eliasziw M, Fox AJ, Ferguson GG, Haynes RB, et al. Benefit of carotid endarterectomy in patients with symptomatic moderate or severe stenosis. North American Symptomatic Carotid Endarterectomy Trial Collaborators. N Engl J Med 1998; 339:1415-25.
38. Randomised trial of endarterectomy for recently symptomatic carotid stenosis: final results of the MRC European Carotid Surgery Trial (ECST) Lancet 1998;351:1379-87.
39. Young B, Moore WS, Robertson JT, Toole JF, Ernst CB, Cohen SN, et al. An analysis of perioperative surgical mortality and morbidity in the asymptomatic carotid atherosclerosis study. ACAS Investigators. Asymptomatic Carotid Artheriosclerosis Study. Stroke 1996;27:2216-24.
40. Roubin GS, New G, Iyer SS, Vitek JJ, Al-Mubarak N, Liu MW, et al. Immediate and late clinical outcomes of carotid artery stenting in patients with symptomatic and asymptomatic carotid artery stenosis: a 5-year prospective analysis. Circulation 2001;103:532-7.
41. Wholey MH, Wholey M, Mathias K, Roubin GS, Diethrich EB, Henry M, et al. Global experience in cervical carotid artery stent placement. Catheter Cardiovasc Interv 2000;50:160-7.
42. Yadav JS, Wholey MH, Kuntz RE, Fayad P, Katzen BT, Mishkel GJ, et al; Stenting and Angioplasty with Protection in Patients at High Risk for Endarterectomy Investigators. Protected carotid-artery stenting versus endarterectomy in high-risk patients. N Engl J Med 2004;351:1493-501.
43. Kastrup A, Groschel K, Krapf H, Brehm BR, Dichgans J, Schulz JB. Early outcome of carotid angioplasty and stenting with and without cerebral protection devices: a systematic review of the literature. Stroke 2003;34:813-9.
44. Al-Mubarak N, Colombo A, Gaines PA, Iyer SS, Corvaja N, Cleveland TJ, et al. Multicenter evaluation of carotid artery stenting with a filter protection system. J Am Coll Cardiol 2002;39:841-6.
45. Mas JL, Chatellier G, Beyssen B; EVA-3S Investigators. Carotid angioplasty and stenting with and without cerebral protection: clinical alert from the Endarterectomy Versus Angioplasty in Patients With Symptomatic Severe Carotid Stenosis (EVA-3S) trial. Stroke 2004; 35:e18-20.
46. Barr JD, Connors JJ 3rd, Sacks D, Wojak JC, Becker GJ, Cardella JF, et al; American Society of Interventional and Therapeutic Neuroradiology; American Society of Neuroradiology; Society of Interventional Radiology. Quality improvement guidelines for the performance of cervical carotid angioplasty and stent placement. J Vasc Interv Radiol 2003;14:S321-35.
CONSENSO DE ESTENOSIS CAROTÍDEA
ÁREA DE NORMATIZACIONES Y CONSENSOS
Director
Dr. Ricardo M. Iglesias
Coordinador general
Dr. Miguel A. González
Secretario
Dr. Eduardo Sampó
Vocales
Dr. Alejandro Hershson
Dr. Jorge Ubaldini
Dr. Eduardo Esteban
Dr. Pablo Schygiel
Dr. Alejandro J. Lakowsky
Asesores
Dr. José L. Barisani
Dr. Jorge C. Trainini
Dr. Horacio Pomés Iparraguirre
COMITÉ ORGANIZADOR
Director
Dr. Osvaldo Fustinoni
Secretarios
Dres. Ana Atallah, Juan J. Cirio, Alejandro Hershson Dr. Horacio Pomés Iparraguirre (por Comité Organizador, Área de Normatizaciones y Consensos)
COMISIONES DE TRABAJO
Ultrasonido carotídeo
Dres. Ricardo Beigelman, Jorge Cors, Roberto Lagos
Angiorresonancia magnética
Dres. Alfredo Buzzi, Héctor Lambre, Daniel Muñoz, Raúl Simonetto
Angiografía invasiva
Dres. Carlos Gadda, Daniel Paolantonio
¿Cómo medir el grado de estenosis para la toma de decisiones terapéuticas?
Dres. Ricardo Beigelman, Jorge Cors, Osvaldo Fustinoni
Riesgo quirúrgico previo a una endarterectomía carotídea
Dres. Jorge Cors, Alejandro Hershson
Tratamiento médico y control de los factores de riesgo
Dres. José Milei, María Cristina Zurrú
Tratamiento quirúrgico: endarterectomía carotídea
Dres. Mariano Ferreira, Ricardo Lamura
Tratamiento endovascular: angioplastia carotídea
Dres. Juan J. Cirio, Oscar Mendiz, Carlos Vozzi
COMITÉ ASESOR
Dr. Gregorio Abiusi
Dr. Sebastián Ameriso
Dr. Lorenzo Bauso Toselli
Dr. Raúl Domínguez
Dr. Manuel Fernández Pardal
Dr. Horacio Gori
Dr. Hugo Londero
Dr. Pedro Lylyk
Dr. Juan C. Parodi
Dr. Raúl Rey
Dr. Roberto Rotta Escalante
Dr. Carlos Rugilo
Dr. José F. Vila














