Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista argentina de cardiología
versão On-line ISSN 1850-3748
Rev. argent. cardiol. v.75 n.1 Buenos Aires jan./fev. 2007
Introducción a las complicaciones graves de la quimioterapia que debe enfrentar un cardiólogo
Patricia Avellana, Daniel Santos, Laura Antonietti, Tulio SampereMTSAC, Antonio PocovíMTSAC, Eduardo Domenichini, Susana Lipshitz, Reynaldo Chacón, Carlos D. TajerMTSAC
Instituto Médico Alexander Fleming
MTSAC Miembro Titular de la Sociedad Argentina de Cardiología
Dirección para separatas:
Dr. Carlos D. Tajer Instituto Alexander Fleming Cramer 1180 - Buenos Aires, Argentina Tel. 6323-2900
e-mail: ctajer@fibertel.com.ar
RESUMEN
La aplicación de diferentes esquemas farmacológicos para el tratamiento oncológico ha tenido en los últimos años un gran crecimiento, en muchos casos con efectos curativos o clara mejoría de la sobrevida y la calidad de vida. Algunos esquemas incluyen drogas que pueden provocar efectos cardiotóxicos graves, lo que motiva la consulta a los cardiólogos que en la mayor parte de los casos no hemos tenido entrenamiento en esta complicación. En esta revisión se resumen mecanismos de acción y efectos adversos de diferentes drogas de uso frecuente en patología oncológica y se exponen casos clínicos con reacciones adversas graves, con dificultades en la toma de decisiones. Finalmente, se discuten los aspectos para tener en cuenta para la prevención, el control y el tratamiento de la cardiotoxicidad por agentes quimioterapéuticos.
Palabras clave:Antraciclinas; Fluorouracilo; Gemcitabina; Cardiotoxicidad
SUMMARY
Severe Cardiac Complications of Chemotherapy: A Review
In recent years, there has been an increase in the use of various pharmacological protocols for the treatment of oncological disorders, often with curative effects or a clear improvement in survival and quality of life. Some schemes include drugs that may cause severe cardiotoxic effects. Such effects prompt patients to consult the cardiologist, who generally has no previous experience in dealing with these complications. Hence, in this review, we summarize the mechanisms of action and adverse effects of various drugs that are frequently used in neoplastic diseases, and we also present clinical cases with serious adverse reactions, which complicate the decision-making process. Finally, we discuss several issues that need to be considered for the prevention, control and treatment of cardiotoxicity due to chemotherapeutic agents.
Key words: Antracyclines; Fluorouracil; Gemcitabine; Cardiotoxicity
INTRODUCCIÓN
La aplicación de diferentes esquemas farmacológicos para el tratamiento oncológico ha tenido en los últimos años un gran crecimiento, en muchos casos con efectos curativos o clara mejoría de la sobrevida y la calidad de vida. La potencial cardiotoxicidad de los diferentes agentes terapéuticos (antimetabolitos, antraciclinas, agentes biológicos, hormonales, alquilantes y antimicrotúbulos) es reconocida y se han propuesto diferentes esquemas para su tratamiento y prevención. (1) La circunstancia de constituir un Instituto Cardiovascular dentro de una institución con alta complejidad oncológica nos ha permitido presenciar las formas "extremas" de complicaciones cardiológicas y, a su vez, ha requerido un agitado debate sobre las estrategias por adoptar en cada caso particular. La intención de esta revisión es discutir mecanismos fisiopatológicos, conductas y evolución clínica a través de cinco casos clínicos de complicaciones graves asociadas con el uso de tres agentes de amplia aplicación actual (el 5-fluorouracilo, las antraciclinas y la gemcitabina).
5-FLUOROURACILO
El 5-fluorouracilo pertenece al grupo de los antimetabolitos cuyo efecto cardiotóxico más frecuente es el dolor precordial de tipo anginoso. El espectro puede abarcar desde la angina de pecho, muy común, hasta el caso muy poco frecuente de infarto agudo de miocardio, con una incidencia de 11 por 1.000 casos tratados en pacientes sin antecedentes coronarios y 45 por 1.000 en pacientes con enfermedad coronaria previa. (2) Se debería a un efecto vasoconstrictor coronario por acción directa de la proteincinasa C sobre el músculo liso. (3, 4) El cuadro más frecuente con esta droga es el dolor precordial, habitualmente sin cambios electrocardiográficos y que cede al suspender la medicación. En casos de mayor gravedad puede requerir tratamiento con nitroglicerina y bloqueantes cálcicos. (4) Sin embargo, algunos episodios pueden ser prolongados y debe explorarse la eventualidad de un síndrome coronario agudo, incluso con cinecoronariografía (CCG) para evaluar la presencia de una placa accidentada con trombosis local.
Caso 1
Paciente de sexo femenino de 39 años, sin antecedentes cardiovasculares, portadora de un carcinoma de cuello uterino epidermoide escasamente diferenciado con metástasis óseas en la columna lumbosacra y las crestas ilíacas. Como otros antecedentes presentaba cefalea crónica en tratamiento con ergotamina. Durante el primer ciclo de quimioterapia con 5- fluorouracilo evolucionó con dolor precordial intenso. En el electrocardiograma (ECG) se observó elevación del ST en la cara anterior, que no respondió a la nitroglicerina y sólo luego del agregado de diltiazem endovenoso se resolvieron los síntomas y los cambios eléctricos. Posteriormente evolucionó con nuevos episodios anginosos recurrentes y refractarios al tratamiento, con nueva alteración en el ECG, sin elevación de troponina T (Figura 1 A y B). El ecocardiograma fuera de los episodios de dolor era normal. Ante la persistencia de la sintomatología y los cambios del ECG, se decidió realizar CCG que evidenció arterias coronarias angiográficamente normales.
Fig. 1. A.
ECG basal de la paciente.
Fig.1. B.
ECG durante la infusión de 5-fluorouracilo. Se observa
elevación del segmento ST y de la onda T en la cara anterior y lateral.
Caso 2
Paciente de 60 años, con múltiples factores de riesgo (hipertensión arterial, dislipidemia y ex tabaquismo), antecedentes de angina crónica estable, clase funcional II y dos neoplasias e intervenciones: nefrectomía por carcinoma renal derecho, esofagectomía total y gastrectomía parcial por cáncer de la unión esofagogástrica. A los dos días posteriores del inicio del tratamiento con 5-fluorouracilo presentó dolor precordial intenso opresivo, sin cambios en el ECG ni marcadores enzimáticos, asociado con hipotensión. Se realizó estudio de perfusión miocárdica que no evidenció alteraciones y fue tratado con atenolol, clopidogrel, diltiazem, aspirina y alopurinol. Al reiniciar la infusión presentó un nuevo episodio de dolor, en este caso con cambios en el ECG (elevación del ST en cara lateral), con troponina T negativa. Se interpretó como una angina inestable progresiva de moderado riesgo, asociada con el uso de fluorouracilo. En la coronariografía se observaron lesión severa, que impresionaba accidentada en el tercio medio de la descendente anterior (DA), y múltiples lesiones en otras arterias. Por la gravedad de su enfermedad oncológica se descartó la cirugía y se decidió realizar angioplastia en la DA. Medicado con dosis altas de bloqueantes cálcicos pudo continuar luego con el tratamiento quimioterapéutico. Al año presentó nuevamente episodio de angor prolongado con cambios similares a los de los episodios previos y marcadores enzimáticos negativos. Se realizó CCG que evidenció stent permeable en la DA, sin cambios en el resto de las lesiones.
ANTRACICLINAS
Las drogas antracíclicas (adriamicina, doxorrubicina) se utilizan en tumores comunes (mama, linfomas), incluso en niños. Su efecto tóxico más temido en cardiología es la aparición de daño miocárdico que lleve a la insuficiencia cardíaca (IC). El mecanismo de inducción del daño y la disfunción contráctil ventricular es complejo. En él interactúan diferentes mecanismos, como alteraciones del equilibrio electrolítico asociadas con el calcio, de la síntesis de proteínas contráctiles, de los receptores adrenérgicos ß1, apoptosis celular y edema intersticial. (5) Curiosamente, la incidencia de daño agudo detectable es baja, pero en la evolución el porcentaje de pacientes con depresión de la fracción de eyección (Fey) aumenta progresivamente, en particular si han recibido dosis altas. En diferentes series pediátricas, el 7-8% de los pacientes tratados presentan disfunción sistólica y en adultos se han descripto cifras de hasta el 40%.
La cardiotoxicidad producida por estas drogas se ha estratificado en aguda, subaguda y crónica.
Cardiotoxicidad aguda: ocurre durante los ciclos de administración y se puede detectar por los esquemas de evaluación clásicos. La expresión clínica de IC sintomática es infrecuente, con una incidencia de 1,7 casos cada 1.000 pacientes tratados. Los síntomas más frecuentes detectados durante los ciclos se relacionan con arritmias poco complejas, dolor precordial secundario a pericarditis y cambios inespecíficos del ST. Cardiotoxicidad subaguda y crónica: en la fase crónica, la incidencia de disfunción ventricular se incrementa mucho, hasta representar un problema clínico frecuente, meses o años después de la administración de la droga. La aparición de IC se asocia con una mortalidad del 50% a los 2 años. El síntoma es una manifestación tardía y de alto riesgo.
Los factores asociados con el potencial efecto cardiotóxico son la edad, el sexo femenino, la irradiación previa, los antecedentes de enfermedad cardíaca y un elemento de difícil predicción, que es la susceptibilidad individual de ciertos pacientes a la droga, independientemente de la dosis acumulada.
La detección de cardiotoxicidad por antraciclinas habitualmente se encara con una evaluación de la Fey ventricular izquierda previa al tratamiento y controles posteriores durante éste, al finalizarlo y en el seguimiento alejado, con intervalos anuales. La biopsia miocárdica ha permitido documentar daño en forma temprana, pero se reserva para pacientes con síntomas de IC y/o caída significativa de la Fey que requieran continuar con el tratamiento con expectativas de curación. (6, 7, 8)
Por otro lado, la medición de la función diastólica permite detectar cambios precoces en la relajación ventricular. Aun cuando en algunos casos predicen caída de la Fey, en la mayoría de los pacientes es un fenómeno reversible luego de finalizado el tratamiento citostático. En la Tabla 1 se resume la estrategia recomendada actualmente para la prevención, la detección precoz y el tratamiento de la cardiotoxicidad asociada con estos fármacos. A continuación se discute un caso clínico grave.
Tabla 1.
Antracíclicos y cardiotoxicidad

Caso 3
Paciente de 53 años, sin factores de riesgo coronario positivos ni antecedentes cardiovasculares, portadora de metástasis en la columna lumbar de un adenocarcinoma de mama, tratada previamente con mastectomía y quimioterapia con antraciclinas. Presentó en su evolución reiteradas internaciones por edema agudo de pulmón. Los ecocardiogramas realizados evidenciaron diámetros, función ventricular y motilidad conservados y disfunción diastólica e insuficiencia mitral moderadas. Cuando la frecuencia cardíaca superaba 110-120 por minuto, la función sistólica se deterioraba notoriamente. Al comienzo respondió de manera favorable al tratamiento médico pero posteriormente evolucionó con refractariedad al tratamiento médico y requirió asistencia respiratoria mecánica (ARM) y catéter de Swan-Ganz para monitorización, con cifras muy elevadas de presión capilar pulmonar. Se realizó tratamiento con vasodilatadores, diuréticos e inotrópicos. La CCG fue normal y en la biopsia endomiocárdica no se observaron miocarditis ni toxicidad por antracíclicos. Luego de una evolución tórpida, con varios días de ARM, la presión capilar fue descendiendo y la paciente evolucionó favorablemente. La particularidad de este caso es la evidencia de una rara forma de toxicidad aguda, en la que incluso por biopsia no se detectó lesión miocárdica, pero que muestra un grave compromiso de la función diastólica que llevó a la paciente a una situación cercana a la muerte.
Caso 4
Paciente de 73 años, portador de linfoma no Hodgkin, en tratamiento con antraciclinas (adriamicina y ciclofosfamida). Comenzó con disnea en CF II y el ecocardiograma evidenció miocardiopatía dilatada. Se indicó tratamiento con enalapril, carvedilol y espironolactona. Posteriormente evolucionó con caída progresiva de la Fey en diferentes controles con meses de diferencia, que comenzó a evidenciarse a los 6 meses de la finalización del tratamiento quimioterapéutico (60%, 51%, 36%, 30%). También presentó alteraciones de la motilidad en el ecocardiograma (hipocinesia septoapical y medial, inferomedial, inferoapical, posteromedial y posteroapical), con CCG normal. Este caso es el más clásico de disfunción ventricular progresiva tiempo después de finalizado el tratamiento, con la particularidad de una afectación segmentaria sin relación con enfermedad coronaria.
GEMCITABINA
Es un antimetabolito utilizado como droga de primera línea en el tratamiento del cáncer de pulmón. Actúa por inhibición de la síntesis de DNA y producción de apoptosis celular. Sus efectos adversos más frecuentes son los hematológicos. Entre ellos se encuentra la microangiopatía trombótica, que ocurre en 1 de cada 6.000 pacientes tratados. La inducción de trombosis involucra diferentes mecanismos, como aumento de la actividad procoagulante, reducción de la síntesis de anticoagulantes, estimulación de la agregación plaquetaria y daño endotelial. Este efecto adverso es infrecuente. (9-16) Otros efectos adversos son las arritmias cardíacas, edemas periféricos y efectos dermatológicos y gastrointestinales.
Caso 5
Paciente de sexo masculino de 53 años, sin antecedentes cardiovasculares, portador de carcinoma pulmonar, tratado con neumonectomía derecha con posterior adyuvancia con quimioterapia con carboplatino-gemcitabina. Ingresó por dolor abdominal acompañado de diarrea y proctorragia. Fue tratado con antibióticos. La tomografía evidenció engrosamiento de la pared colónica derecha y el laboratorio mostró hiperplaquetosis (800.000 p/mm3). Evolucionó 48 horas después con dolor en el primero y el segundo dedo del pie derecho, con hipoestesia, disestesia, disminución de los pulsos periféricos y disminución de la temperatura. Ante la ausencia de señal de Doppler en las arterias tibiales anterior y posterior, se interpretó que se trataba de trombosis arterial aguda. Se le realizó una arteriografía del miembro inferior derecho y se observó oclusión de la arteria poplítea distal y del tronco tibial-peroneo. Se efectuó cirugía de urgencia (trombectomía y fasciotomía). Evolucionó con mejoría inicial, pero posteriormente presentó signos de reoclusión. Bajo control hemodinámico se efectuó tromboaspiración, infusión intraarterial de activador tisular del plaminógeno, anticoagulación con heparina y antiagregación con clopidogrel. El paciente evolucionó con sangrado en la herida quirúrgica, shock hipovolémico, requerimientos de ARM, inotrópicos y múltiples transfusiones. Ante la falta de viabilidad del miembro y la inestabilidad hemodinámica se decidió la amputación supracondílea del miembro inferior derecho. El estudio de la coagulación evidenció anticuerpos anticardiolipinas e inhibidor lúpico negativos, con valores normales de proteína C reactiva, proteína S libre, antitrombina, factor V, homocisteína y resistencia a proteína C activada. Posteriormente evolucionó con mejoría del cuadro clínico y se le otorgó el egreso sanatorial. La anatomía patológica evidenció en la microscopia un estado trombótico en las arterias de mediano y gran calibre relacionado con presencia de inmunocomplejos. En las arterias tibiales se evidenció una estructura trombótica conformada por fibrina (predominante) y escasos leucocitos, vinculable a trombo en vías de organización temprana o inicial (Figuras 2 y 3). El paquete vasculonervioso mostró estructuras vasculares con miohiperplasia (leve a moderada) y microtrombos recientes. La trombosis resistente a los tratamientos aplicados tuvo un sustrato anatomopatológico similar al descripto por Virmani en coronarias como "erosión", es decir, la ausencia de lesión endotelial del tipo de la rotura de placa, con una amplia adhesividad del trombo a su superficie activada.
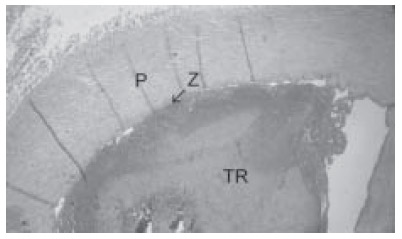
Fig. 2.
Vista panorámica. Estructura arterial de mediano calibre con trombo reciente adherido parcialmente a la pared vascular. P: Pared vascular. TR: Trombo reciente. Flecha: La zona de mayor adherencia. Véase detalle histopatológico del trombo en la Figura 3. Hematoxilina-eosina x50.
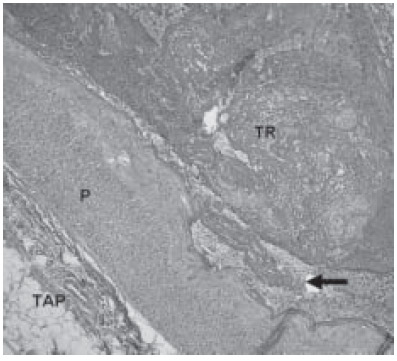
Fig. 3.
Vista semipanorámica de una arteria de reducido calibre con un trombo reciente en vías de recanalización. P: Pared vascular. TR: Trombo reciente. TAP: Tejido adventicio perivascular. Flecha: Zona de mayor adherencia con anomalías en la superficie endotelial e incremento del componente inflamatorio asociado. Se observa adherencia laxa del trombo con depósito de material fibrinoide. Hematoxilina-eosina x200.
CONCLUSIONES
El cardiólogo clínico se enfrenta actualmente con problemas nuevos de la especialidad vinculados a los tratamientos quimioterapéuticos, que se aplican en un número cada vez mayor de tumores con expectativas de éxito y sobrevida prolongada. En forma creciente se nos solicita opinión sobre la oportunidad de tratamientos en pacientes con cardiopatías primarias, o sobre la posibilidad de reiteración de dosis en casos con algún grado de afectación derivada de la aplicación de estos fármacos. En esta revisión hemos intentado reflejar a través de cinco casos clínicos una parte del espectro y la diversidad del problema, que será creciente, dado que incluso nuevos agentes como los inmunomoduladores también se asocian con nuevas formas de cardiotoxicidad. (17)
En el caso del 5-fluorouracilo, quizás la mejor recomendación es no subestimar la relevancia del dolor precordial. Es prudente efectuar un trazado electrocardiográfico durante el dolor y, ante la presencia de cambios, actuar como en un paciente coronario convencional.
Las patologías oncológicas se asocian con riesgo de trombosis y las estrategias de su prevención y tratamiento se han debatido en extenso. (18) El caso relatado asociado con gemcitabina es en este sentido excepcional y, a pesar de la agresividad con que fue encarado y la disponibilidad de recursos complejos, su tratamiento fue extremadamente dificultoso. El sustrato fisiopatológico en este caso es de interés en relación con las diferentes hipótesis sobre trombosis en la enfermedad aterosclerótica, en este caso, sin evidencias de alteración de la continuidad endotelial (rotura o disrupción de placa).
La consulta más frecuente por cardiotoxicidad se debe a las antraciclinas. Hemos relatado un caso agudo, estudiado en detalle incluso con biopsia miocárdica, para resaltar la complejidad fisiopatológica, en esta circunstancia con predominio de una disfunción diastólica aguda grave. Sin embargo, el mayor desafío (y misterio) de esta afectación está en las formas subaguda y crónicas, reflejadas en el segundo caso clínico de presentación más frecuente. El modelo no se parece a una cardiopatía convencional: al cabo de meses o años de una agresión aguda habitualmente indetectable (sin elevación de troponina ni afectación de la motilidad parietal) comienza un deterioro progresivo. Quizás la mejor comprensión de esta secuencia nos ayude a avanzar en el conocimiento sobre algunas formas de miocardiopatía de deterioro progresivo y etiología inaparente (idiopática). La actitud de prevención y tratamiento de esta forma es cada vez motivo de mayor debate, y se han publicado recientemente dos revisiones de la base Cochrane en las que se resalta la escasa información sólida al respecto. (19, 20) Por el momento, nuestro principal papel consiste en la detección precoz de deterioro contráctil o disfunción diastólica acentuada, para colaborar en la decisión de nuevas aplicaciones terapéuticas y el tratamiento precoz. Publicaciones recientes sobre experiencias en un número reducido de pacientes señalan que el tratamiento con inhibidores de la enzima convertidora logra revertir la caída de la Fey por antraciclinas y permite alcanzar con sólo tres meses de medicación niveles normales de función ventricular. No existe experiencia publicada con el uso de betabloqueantes. En el nivel actual del conocimiento, no cabe duda acerca de la utilidad de las evaluaciones periódicas, cada 6 meses el primer año y luego cada 12 meses, después del tratamiento. La evaluación es sencilla: consulta clínica y evaluación de la función ventricular por ecocardiografía o ventriculograma. Asimismo, debería iniciarse una terapéutica con inhibidores de la enzima convertidora de la angiotensina lo antes posible cuando se detecte algún grado de deterioro de la función ventricular y en forma urgente si aparecen síntomas de IC. La aparición de sintomatología se ha asociado con mala evolución, incluso con mayor malignidad que estadios equivalentes de la miocardiopatía dilatada de otras etiologías. Existe una medicación que ha demostrado en reiterados ensayos clínicos prevención de la cardiotoxicidad por antracíclicos, el dexrazoxane. (21) Sin embargo, algunas dudas no confirmadas sobre la posibilidad de interferencia en la eficacia terapéutica antitumoral han llevado a que su uso sea muy restringido y aún permanezca en debate. (22)
Tenemos un desafío abierto para el desarrollo de nuevas modalidades de intervención en la prevención y la terapéutica de estas complicaciones graves, que merecerán seguramente ensayos clínicos en los próximos años. Por el momento, nuestra contribución puede ser relevante para los pacientes, aun con la sencillez de las medidas relatadas.
BIBLIOGRAFÍA
1. Santos D, Chacón R. Efectos adversos de la quimioterapia. En: Doval H, Tajer C. Evidencias en Cardiología IV. Ediciones GEDIC; 2005. p. 97-129. [ Links ]
2. de Forni M, Malet-Martino MC, Jaillais P, Shubinski RE, Bachaud JM, Lemaire L, et al. Cardiotoxicity of high-dose continuous infusion fluorouracil: a prospective clinical study. J Clin Oncol 1992;10: 1795-801. [ Links ]
3. Shoemaker LK, Arora U, Rocha Lima CM. 5-Fluorouracil-induced coronary vasospasm. Cancer Control 2004;11:46-9. [ Links ]
4. Lestuzzi C, Viel E, Picano E, Meneguzzo N. Coronary vasospasm as a cause of effort-related myocardial ischemia during low-dose chronic continuous infusion of 5-fluorouracil. Am J Med 2001;111: 316-8. [ Links ]
5. Shan K, Lincoff AM, Young JB. Anthracycline-induced cardiotoxicity. Ann Intern Med 1996;125:47-58. [ Links ]
6. Jensen BV, Skovsgaard T, Nielsen SL. Functional monitoring of anthracycline cardiotoxicity: a prospective, blinded, long-term observational study of outcome in 120 patients. Ann Oncol 2002;13:699-709. [ Links ]
7. Felker GM, Thompson RE, Hare JM, Hruban RH, Clemetson DE, Howard DL, et al. Underlying causes and long-term survival in patients with initially unexplained cardiomyopathy. N Engl J Med 2000;342:1077-84. [ Links ]
8. Cardinale D, Sandri MT, Martinoni A, Borghini E, Civelli M, Lamantia G, et al. Myocardial injury revealed by plasma troponin I in breast cancer treated with high-dose chemotherapy. Ann Oncol 2002;13:710-5. [ Links ]
9. Kremer LC, Bastiaansen BA, Offringa M, Lam J, van Straalen JP, de Winter RJ, et al. Troponin T in the first 24 hours after the administration of chemotherapy and the detection of myocardial damage in children. Eur J Cancer 2002;38:686-9. [ Links ]
10. Nadir Y, Hoffman R, Brenner B. Drug-related thrombosis in hematologic malignancies. Rev Clin Exp Hematol 2004;8:E4. [ Links ]
11. Barcelo R, Munoz A, Lopez-Vivanco G. Prospective evaluation of major vascular events in patients with nonsmall cell lung carcinoma treated with cisplatin and gemcitabine. Cancer 2005;104:1110-1. [ Links ]
12. Blaise S, Appeltants H, Carpentier PH, Debru JL. Digital ischaemia and gemcitabine. Two new cases. J Mal Vasc 2005;30:53-7. [ Links ]
13. Numico G, Garrone O, Dongiovanni V, Silvestris N, Colantonio I, Di Costanzo G, et al. Prospective evaluation of major vascular events in patients with nonsmall cell lung carcinoma treated with cisplatin and gemcitabine. Cancer 2005;103:994-9. [ Links ]
14. Humphreys BD, Sharman JP, Henderson JM, Clark JW, Marks PW, Rennke HG, et al. Gemcitabine-associated thrombotic microangiopathy. Cancer 2004;100:2664-70. [ Links ]
15. Kuenen BC, Levi M, Meijers JC, van Hinsbergh VW, Berkhof J, Kakkar AK, et al. Potential role of platelets in endothelial damage observed during treatment with cisplatin, gemcitabine, and the angiogenesis inhibitor SU5416. J Clin Oncol 2003;21:2192-8. [ Links ]
16. Teixeira L, Debourdeau P, Zammit C, Estival JL, Pavic M, Colle B. Gemcitabine-induced thrombotic microangiopathy. Presse Med 2002;31:740-2. [ Links ]
17. Piccart-Gebhart MJ, Procter M, Leyland-Jones B, Goldhirsch A, Untch M, Smith I, et al; Herceptin Adjuvant (HERA) Trial Study Team. Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer. N Engl J Med 2005;353:1659-72. [ Links ]
18. Altman R, Rouvier J, Scazziota A. Prevención de la Trombosis Venosa y la Tromboembolia de Pulmón. En: Reussi R, Mercado J, Tajer C. Evidencias en Medicina Interna. Buenos Aires: Edición Fundación Reussi; 2002. p. 367-88. [ Links ]
19. van Dalen EC, van der Pal HJ, Caron HN, Kremer LC. Different dosage schedules for reducing cardiotoxicity in cancer patients receiving anthracycline chemotherapy. Cochrane Database Syst Rev 2006;CD005008. [ Links ]
20. van Dalen EC, Michiels EM, Caron HN, Kremer LC. Different anthracycline derivates for reducing cardiotoxicity in cancer patients. Cochrane Database Syst Rev 2006;CD005006. [ Links ]
21. Cvetkovic RS, Scott LJ. Dexrazoxane: a review of its use for cardioprotection during anthracycline chemotherapy. Drugs 2005;65:1005-24. [ Links ]
22. Yeh ET, Tong AT, Lenihan DJ, Yusuf SW, Swafford J, Champion C, et al. Cardiovascular complications of cancer therapy: diagnosis, pathogenesis, and management. Circulation 2004;109:3122-31. [ Links ]














