Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de cardiología
versión On-line ISSN 1850-3748
Rev. argent. cardiol. v.75 n.2 Buenos Aires mar./abr. 2007
Valor del ECMO en el tratamiento del shock cardiogénico refractario posoperatorio
Nicolás K. Doll, Ardawan Rastan, Roberto R. Battellini, Denis R. Merk, Friedrich W. Mohr
Servicio de Cirugía Cardíaca, Herzzentrum Leipzig, Leipzig, Alemania
Dirección para separatas: Dr. Roberto R. Battellini Servicio de Cirugía Cardíaca, Herzzentrum Leipzig Strümpellstrasse 39 - 04289 Leipzig, Alemania
Recibido: 13/12/2006
Aceptado: 03/01/2007
RESUMEN
Este estudio presenta los resultados del uso de circulación extracorpórea con oxigenador de membrana (ECMO) para el tratamiento del shock cardiogénico posoperatorio en 219 pacientes operados en el Herzzentrum Leipzig entre 1997 y 2002. Durante la hospitalización, el 61% de los pacientes fueron desconectados exitosamente y el 24% fueron dados de alta. Las variables predictoras de sobrevida hospitalaria fueron la edad, la ausencia de infarto preoperatorio, la ausencia de diabetes, el uso de balón de contrapulsación intraaórtico (BCIA) y el tipo de cirugía realizada. A pesar de que el ECMO está asociado con una morbimortalidad significativa, se ofrece a pacientes que de otra manera fallecerían.
Palabras clave: Shock cardiogénico; Circulación extracorpórea; Oxigenación de la membrana extracorpórea.
Abreviaturas:
ACT Tiempo de coagulación activado
BCIA Balón de contrapulsación intraaórtico
CABG Bypass coronario
CEC Circulación extracorpórea
ECMO Oxigenador extracorpóreo de membrana
IC Índice cardíaco
RVA Reemplazo valvular aórtico
SUMMARY
Value of ECMO in the Treatment of Refractory Postoperative Cardiogenic Shock
This study reports the results of the use of extracorporeal circulation with a membrane oxygenator (ECMO) for the treatment of postoperative cardiogenic shock in 219 patients operated at the Leipzig Herzzentrum between 1997 and 2002. During hospitalization, 61% of patients could be weaned successfully and 24% were discharged from the hospital. Variables predictive of hospital survival were: age, absence of postoperative myocardial infarction, absence of diabetes, use of an intraaortic balloon pump (IABP) and the type of surgery performed. Although ECMO is associated to significant morbidity and mortality, it is offered to patients who would otherwise die.
Key words: Shock, Cardiogenic; Extracorporeal Circulation; Extracorporeal Membrane; Oxygenation.
INTRODUCCIÓN
El bajo gasto cardíaco posoperatorio es una complicación devastadora que ocurre en aproximadamente el 1-5% de los pacientes después de operaciones cardíacas. (1) Las causas subyacentes pueden ser isquemia previa -como en la cirugía del infarto en agudo- o isquemia de reperfusión, u otras, por ejemplo fallas táctico-técnicas inadvertidas, o corregidas que luego de serlo determinen una circulación extracorpórea prolongada. (2, 3)
Aunque las primeras comunicaciones sobre circulación extracorpórea con oxigenador de membrana (ECMO) en adultos no mostraron buenos resultados, a partir de 1999 (4) los informes fueron mejores y ahora parece una alternativa válida para estos casos; las experiencias de Cleveland (5) y de Leipzig (6) son las más importantes en número hasta el momento. Existe además una organización que reúne a los científicos y centros que trabajan con ECMO, la Extracorporeal Life Support Organization (ELSO, www.elso.med.umich.edu), que lleva un registro internacional y ha editado un "Red Book", con protocolos de manejo, indicaciones y control de calidad.
El propósito de esta revisión es el de evaluar nuestra experiencia a través de cinco años de seguimiento, más el análisis de 78 autopsias realizadas en pacientes con ECMO, para determinar predictores de sobrevida y analizar fallas y aciertos y acceder al análisis de la literatura sobre el tema.
MATERIAL Y MÉTODOS
De un total de 18.150 pacientes operados entre noviembre de 1997 y julio de 2002, se analizaron 219 pacientes que recibieron ECMO por shock refractario posoperatorio (1,2%).
Además, se estudiaron prospectivamente 78 autopsias en pacientes fallecidos bajo asistencia de ECMO entre enero de 2000 y diciembre de 2004.
Se consideró indicada la colocación de ECMO si los pacientes no eran factibles de ser desconectados de la circulación extracorpórea (CEC) manteniendo un índice cardíaco (IC) menor de 2,0 L/min/m2, recibiendo volúmenes de llenado adecuados, dosis altas de inotrópicos y la inserción de balón de contrapulsación intraaórtico (BCIA).
Descripción del sistema
Consta de una cánula arterial, una venosa, una bomba centrífuga (Figura 1) y un oxigenador-intercambiador de calor. El ECMO se diferencia de la CEC por: 1) no tener reservorio venoso, 2) manejarse con un tiempo de coagulación activado (ACT) de 150-180 segundos en lugar de 600, 3) no poseer filtro arterial ni aspiradores de CEC, 3) provocar una hemólisis mínima. Ambos sistemas usan una membrana como intercambiador de gases y tienen intercambiador de calor. La membrana utilizada en esta experiencia fue la D905 EOS ECMO (DIDECO, Sorin GroupMR).

Fig. 1. ECMO. Bomba centrífuga
El ajuste del gasto cardíaco bajo ECMO se hace por ajuste del flujo en la centrífuga (Vortex CN 80 Biomedicus TM, Medtronic Inc, Englewood, CA) y depende de la resistencia total del oxigenador y de la resistencia vascular sistémica (p. ej., el oxigenador Quadrox de Jostra tiene un flujo máximo de 7 L/min, una superficie de membrana de 1,8-3,5 m2 y un área de intercambio de calor de 0,6 m2; el Affinity TM, Omnis AOT Gmbh, Bad Oyenhausen, Alemania, cuenta con una superficie de membrana de 2,5 m2 y un flujo máximo de 7,0 L/min).
La monitorización del sistema es la habitual para todo paciente grave: línea arterial, catéter de Swan-Ganz, gases en sangre arterial y venosa y SvO2. El ACT se mantiene en 150-180 segundos. El flujo, inicialmente de 4,5 L/min, se ajusta de acuerdo con las necesidades hemodinámicas y los requerimientos de oxigenación del paciente. En pacientes con insuficiencia renal se puede integrar al circuito una unidad de hemofiltración creando contrapresión contra la presión de filtración, aunque es más sencillo hacerlo por separado ya que es difícil monitorizar el volumen filtrado y el riesgo de microembolia arterial es alto.
El ECMO tiene algunos aspectos negativos, que son: 1) hemólisis a causa de shear stress, aunque menor que en la CEC, 2) trombocitopenia, 3) activación de la cascada de la coagulación, 4) activación del complemento C3 y C5 que lleva a un aumento de la permeabilidad capilar y síndrome de distrés respiratorio (SDRA).
La implantación de las cánulas puede ser: 1) dejando la cánula inicial en la aorta ascendente (tórax abierto), 2) canulación femoral con perfusión distal (Figura 2 A) o a través de una prótesis Haemashield 6 mm (Textile Development Ass, Inc, New York, NY), 3) canulación axilar, siempre a través de una prótesis (7) (Figura 2 B).
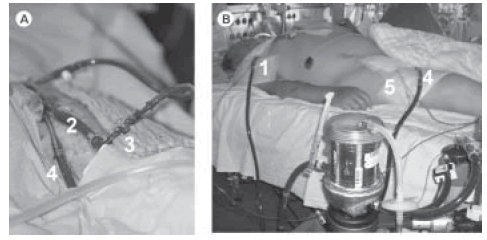
Fig. 2. A y B. 1: Canulación arterial axilar. 2: Canulación arterial femoral. 3: Conexión en Y para perfusión distal. 4: Canulación venosa femoral. 5: Balón de contrapulsación.
Casuística
La población en análisis estuvo constituida por 219 pacientes, con un 73% del sexo masculino. La edad promedio fue de 61,3 ± 12,1 años. La fracción de eyección preoperatoria alcanzó a 43,8% ± 18,4%.
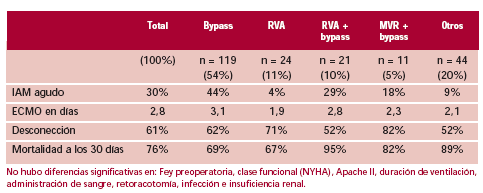
Los pacientes se agruparon por el tipo de cirugía previa a la implantación del ECMO, según se detalla en la Tabla 1. De los 219 pacientes, en 41 (18,7%) se trató de reoperaciones, de las cuales las más frecuentes fueron el bypass coronario (n = 26) y el RVA (n = 5). La puntuación (score) del Apache II alcanzó a 23,7 ± 9,3.
Tabla 1. Grupos de pacientes según operación previa al ECMO (n = 219)

La canulación arterial se realizó en la aorta ascendente en 159 pacientes (72,5%), en la arteria femoral en 54 (24,5%) y en la arteria subclavia en 6 (3%). La implantación de la cánula venosa con un calibre de 21 o 28 F se hizo en la aurícula derecha (n =133; 61%) o en la vena femoral con colocación de la punta controlada por eco transesofágico en la aurícula derecha (n = 86; 39%). En tres casos (1,5%) se agregó una cánula en la aurícula izquierda para mejorar el drenaje.
En el caso de la canulación femoral, la perfusión retrógrada es efectiva solamente con el ventrículo izquierdo vacío y la válvula aórtica cerrada; de otro modo, pueden aparecer alteraciones en la distribución del flujo sanguíneo con peligro de isquemia cerebral o miocárdica.
Estrategia de manejo
El flujo de oxígeno se ajustó para lograr una saturación venosa mixta (SvO2) del 70%; la fracción inspirada de O2 (FiO2) se ajustó para mantener una presión parcial de O2 posoxigenador de 300 mm Hg o mayor. La tensión arterial de CO2 se mantuvo en el nivel habitual de 37 a 42 mm Hg. Durante el soporte con ECMO se administró heparina EV monitorizada continuamente para lograr un ACT de 150- 180 seg. Se monitorizó el oxigenador para detectar desarrollo de coágulos y se cambió de inmediato si la presión de perfusión aumentaba. Se administraron plaquetas para mantener un recuento de 150.000. La administración de plasma fresco congelado, factores de la coagulación y antitrombina III se realizó según necesidad.
La ventilación mecánica se mantuvo a través del soporte con ECMO con presión positiva bifásica. El volumen corriente se llevó a 7 ml/kg, 8 respiraciones/minuto, PEEP de 10 cm H2O, un máximo de presión ventilatoria de 20 cm H2O y una FiO2 de 0,3.
Los inotrópicos se redujeron al mínimo para permitir una recuperación miocárdica óptima manteniendo una eyección ventricular óptima. Se usó noradrenalina para corregir la resistencia vascular periférica baja y mantener una TA media de 70-75 mm Hg. El uso del BCIA en 144 pacientes se efectivizó para disminuir la poscarga, aumentar la perfusión coronaria diastólica e incrementar la pulsatilidad. No se utilizó de rutina vent (cánula de drenaje) en el ventrículo izquierdo.
Pacientes seleccionados que no mostraron suficiente recuperación fueron convertidos a un sistema de asistencia mecánica. Otros fueron trasplantados después de la desconexión del ECMO o de la colocación de un ventrículo mecánico.
Desconección
Los pacientes fueron desconectados lo antes posible; el máximo soporte previsto fue de 4-5 días. Los criterios de desconección fueron mejoría de la saturación venosa mixta, aumento de la amplitud de la curva de presión y, sobre todo, mejoría de la función ventricular por eco transesofágico. Al reducir el flujo, el ACT se ajustó a 180 segundos y el destete se realizó en el curso de varias horas cuando con un flujo del 20% la hemodinamia se mostró estable e inmediatamente después se efectuó la descanulación. La ventilación se ajustó a 12/min, la PEEP a 5 mbar y la FiO2 a 0,5, con una presión inspiratoria pico de 25 mbar, para lograr un volumen corriente mínimo de 10 ml/kg.
Seguimiento
Después de 5 años, los pacientes que fueron dados de alta se examinaron por consultorio externo para evaluar su estado clínico, la capacidad de ejercicio y la calidad de vida.
Análisis estadístico
Todos los análisis estadísticos se realizaron con el sistema SAS (SAS Institute, Cary, NC). Las variables categóricas se expresan como porcentajes y se evaluaron con la prueba de chi cuadrado o la prueba exacta de Fisher. Las variables continuas se expresan como media ± DE y se evaluaron con la prueba de la t de Student o el Wilcoxon rank sum test. Se empleó el análisis de regresión logística para determinar los predictores independientes de mortalidad hospitalaria. La sobrevida a largo plazo se calculó de acuerdo con el método de Kaplan-Meier. Los predictores independientes de sobrevida alejada se determinaron por el Cox proportional hazards modeling. Se consideró con significación estadística una p ≤ 0,05.
RESULTADOS
El ECMO se inició en el quirófano en 194 pacientes (89%) y en la UTI en los 25 restantes (11%). Los resultados por grupos se muestran en las Tablas 2 y 3.
Tabla 2. Resultados (n = 219)

Tabla 3. Complicaciones (n = 219)

En 86 pacientes (39%) sin mejoría de la función cardíaca se debió retirar el sistema porque carecía de sentido proseguir o por complicaciones y fallecimiento consecuente. De los 133 pacientes que fueron desconectados, 52 (39%) fueron dados de alta luego de una estadía media de 29,9 ± 24,0 días.
El ECMO estuvo asociado con una morbilidad significativa (Tabla 3): el 62% (136 casos) debieron ser retoracotomizados por sangrado (generalmente en la UTI); éste muchas veces fue difuso y en pacientes con tórax abierto. El promedio de sangre transfundida fue de 24,5 ± 21,0 unidades. Se produjo insuficiencia renal en 127 pacientes (58%), de los cuales 122 (56%) requirieron hemofiltración. La isquemia de miembros secundaria a canulación femoral (n = 16) ya no ocurrió luego de utilizar interposición de prótesis o perfusión distal (Figura 2 A). El porcentaje de infección fue del 24%. Se presentaron complicaciones neurológicas en 34 pacientes (16%), debidas a edema en 13 casos, a hemorragia en 11 y a infarto en 10.
Los resultados según los grupos quirúrgicos se muestran en la Tabla 4.
Tabla 4. Resultados de acuerdo con operación previa (n = 219)
El balón de contrapulsación intraaórtico (BCIA) se colocó en 144 pacientes (66%). En la Figura 3 se muestra la relación entre balón de contrapulsación y mortalidad/desconección.
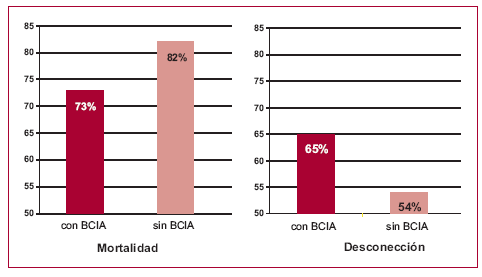
Fig. 3. Relación entre balón de contrapulsación (BCIA) y mortalidad/ desconección.
Ocho pacientes pudieron ser pasados a un sistema de circulación asistida: dos a Heartmate (Thoratec, USA) y seis al Berlin Heart (Mediport, Berlín). De éstos, dos fueron trasplantados, uno fue desconectado de un Berlin Heart y los restantes fallecieron.
Mortalidad
Las causas de mortalidad están consignadas en la tabla 5. La mortalidad global a los 30 días fue del 76% (167 pacientes). El ECMO en pacientes con bypass coronario más reemplazo aórtico estuvo asociado con una mortalidad significativamente más elevada que la de los otros grupos: 95% de ellos fallecieron por insuficiencia cardíaca refractaria (Tabla 4).
Tabla 5. Causas de mortalidad (n = 219)

Luego de 5 años, de los 52 pacientes dados de alta, 37 (74%) se encontraban vivos y en clase II de la NYHA; 2 no fueron contactados. La mortalidad a los 5 años fue del 82%.
Los predictores independientes de sobrevida hospitalaria fueron edad menor de 60 años, ausencia de IAM preoperatorio, ausencia de diabetes, uso de BCIA y procedimientos operatorios no definidos como "otros".
DISCUSIÓN
El síndrome de bajo volumen minuto posoperatorio es una complicación grave que ocurre en el 1% de los pacientes luego de cirugía cardíaca convencional. (2, 3) Las causas subyacentes pueden ser isquemia por desequilibrio protección miocárdica-tiempo de isquemia, fallas técnico-tácticas, daño de reperfusión (especialmente la cirugía del IAM) o alteraciones de la respuesta inflamatoria que llevan a activación del complemento, neutrófilos, plaquetas y citocinas. (8) El uso del ECMO para resolverlo es una tecnología simple y rápida de instalar (± 45 minutos), aplicable a pacientes de todo tipo y puede revertir rápidamente la isquemia. El ideal es iniciarlo antes del colapso hemodinámico completo.
Luego de las experiencias iniciales, a partir de 1999 las comunicaciones reflejan mejores resultados y hoy en día es un método practicable universalmente para rescate de pacientes que no pueden ser desconectados de la CEC por medios convencionales. (3, 5, 9) Los predictores de mortalidad son edad avanzada, evidencia de disfunción orgánica, operaciones extensas, eventos neurológicos y el no uso del BCIA. (5) En nuestro grupo hubo una mortalidad sustancialmente elevada: 75% intrahospitalaria y 82% a los 5 años, o sea con un rescate del 24% y el 18%, respectivamente, menor que en la serie de Smedira, (5) probablemente debido a que no hubo selección en nuestro grupo de pacientes.
Cabe destacar que los pacientes que recibieron RVA y CABG tuvieron una mortalidad del 95%, peor que en otros grupos quirúrgicos. Falta investigar la diferencia intragrupo entre pacientes que fueron programados para RVA y CABG con intención de tratar (intention to treat) contra los que fueron programados para RVA y al no salir de CEC fueron sometidos a CABG luego de un tiempo de reperfusión. La razón puede deberse también a la combinación de isquemia ventricular en hipertrofias ventriculares severas.
La canulación para ECMO se puede establecer cómodamente manteniendo las cánulas aórtica y venosa de la circulación extracorpórea inicial. Ello es ventajoso en el sentido de perfundir en forma anterógrada y evitar isquemia del miembro, pero el tórax permanece abierto y, aunque con cobertura estéril, las posibilidades de infección mediastínica son mayores. Por otra parte, al no cerrar el esternón, hay más sangrado difuso medular. La canulación femoral requiere una pequeña cánula distal para evitar isquemia o la canulación a través de una prótesis anastomosada a la femoral común. En caso de perfusión femoral retrógrada, si el ventrículo eyecta, puede competir con el ECMO y aparece un aumento de la poscarga que se debe tratar con BCIA. (10-12) Por otro lado, en estos casos, si la circulación cerebral es mantenida por el corazón, y su oxigenación por los pulmones, mientras que el ECMO perfunde la parte inferior del cuerpo la oxigenación cerebral depende de la función pulmonar. Hemos visto en varios pacientes que la oxigenación tomada de la arteria radial era baja y de la femoral opuesta era alta. Los pacientes con falla respiratoria deberían incuestionablemente ser perfundidos en forma anterógrada. Este último grupo debería analizarse nuevamente por separado.
La canulación por vía axilar la hemos utilizado a partir de 2002 en 30 pacientes. (7) Permite cerrar el tórax y al mismo tiempo perfundir en forma anterógrada. Creemos que es una mejora sustancial en el uso del ECMO, ya que optimiza la oxigenación cerebral.
El uso de BCIA para mantener la pulsatilidad con mejoría de la perfusión orgánica y coronaria, y disminución de la poscarga durante el ECMO, permitió una sobrevida mayor. (5, 12, 13)
Los protocolos de anticoagulación actuales no son ideales a pesar de reducir la trombosis clínicamente demostrada, ya que el sangrado permanece excesivo. Así, Rastan, (14) en 78 autopsias en pacientes con ECMO en el Herzzentrum Leipzig, encontró un riesgo aumentado de embolia arterial en casos con cirugía de válvulas izquierdas, ECMO más de 2 días y diabetes.
Es probable que el algoritmo de desconección se deba modificar para pacientes más jóvenes con buena función cerebral y razonable situación orgánica, puenteándolos más temprano a una asistencia mecánica. La sobrevida fue del 85% en este grupo en la Cleveland Clinic. (5)
CONCLUSIONES
A pesar de que el ECMO está asociado con una morbimortalidad significativa, creemos que mediante una implementación apropiada y más temprana y una selección mejor de pacientes, sobre todo más jóvenes, es una alternativa justificada para pacientes que no pueden ser desconectados de la CEC luego de operaciones cardíacas.
Los pacientes que se recuperan lo hacen en general dentro de los dos días, por lo que tiene poco sentido continuar el soporte más allá de los tres días.
Es mejor la canulación axilar. El uso de BCIA es recomendable. Los protocolos de anticoagulación se deben mejorar, ya que a pesar de existir sangrado, el análisis de las autopsias ha revelado igualmente trombosis arteriales y venosas.
BIBLIOGRAFÍA
1. Golding LA. Postcardiotomy mechanical support. Semin Thorac Cardiovasc Surg 1991;3:29-32. [ Links ]
2. Muehrcke DD, McCarthy PM, Stewart RW, Seshagiri S, Ogella DA, Foster RC, et al. Complications of extracorporeal life support systems using heparin-bound surfaces. The risk of intracardiac clot formation. J Thorac Cardiovasc Surg 1995;110:843-51. [ Links ]
3. Smith C, Bellomo R, Raman JS, Matalanis G, Rosalion A, Buckmaster J, et al. An extracorporeal membrane oxygenation-based approach to cardiogenic shock in an older population. Ann Thorac Surg 2001;71:1421-7. [ Links ]
4. Magovern GJ Jr, Simpson KA. Extracorporeal membrane oxygenation for adult cardiac support: the Allegheny experience. Ann Thorac Surg 1999;68:655-61. [ Links ]
5. Smedira NG, Moazami N, Golding CM, McCarthy PM, Apperson- Hansen C, Blackstone EH, et al. Clinical experience with 202 adults receiving extracorporeal membrane oxygenation for cardiac failure: survival at five years. J Thorac Cardiovasc Surg 2001;122:92-102. [ Links ]
6. Doll N, Kiaii B, Borger M, Bucerius J, Kramer K, Schmitt DV, et al. Five-year results of 219 consecutive patients treated with extracorporeal membrane oxygenation for refractory postoperative cardiogenic shock. Ann Thorac Surg 2004;77:151-7. [ Links ]
7. Navia JL, Atik FA, Beyer EA, Ruda Vega P. Extracorporeal membrane oxygenation with right axillary artery perfusion. Ann Thorac Surg 2005;79:2163-5. [ Links ]
8. Taylor KM. Brain damage during cardiopulmonary bypass. Ann Thorac Surg 1998;65:S20-6. [ Links ]
9. Ko WJ, Lin CY, Chen RJ, Wang SS, Lin FY, Chen YS. Extracorporeal membrane oxygenation support for adult postcardiotomy cardiogenic shock. Ann Thorac Surg 2002;73:538-45. [ Links ]
10. Bavaria JE, Furukawa S, Kreiner G, Gupta KB, Streicher J, Edmunds LH Jr. Effect of circulatory assist devices on stunned myocardium. Ann Thorac Surg 1990;49:123-8. [ Links ]
11. Bavaria JE, Ratcliffe MB, Gupta KB, Wenger RK, Bogen DK, Edmunds LH Jr. Changes in left ventricular systolic wall stress during biventricular circulatory assistance. Ann Thorac Surg 1988;45: 526-32. [ Links ]
12. Rastan AJ, Krämer K, Doll NK und Mohr FW. Kardiale Indication zur extracorporale Membranoxygenierung (ECMO). En: Empfehlungen zum Einsatz und zur Verwendung der Herz-Lungen Maschine. Steinkopf Verlag; 2006. Cap. 14, p. 243-6. [ Links ]
13. Lazar HL, Treanor P, Yang XM, Rivers S, Bernard S, Shemin RJ. Enhanced recovery of ischemic myocardium by combining percutaneous bypass with intraaortic balloon pump support. Ann Thorac Surg 1994;57:663-7. [ Links ]
14. Rastan AJ, Lachmann N, Walther T, Doll N, Gradistanac T, Mohr FW. Autopsy findings in patients on postcardiotomy extracorporeal membrane oxygenation (ECMO). Deutsches Gessellschaft für Herzchirurgie, Jahrestagungen, Feb 2006. [ Links ]














