Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de cardiología
versión On-line ISSN 1850-3748
Rev. argent. cardiol. v.75 n.2 Buenos Aires mar./abr. 2007
Aspectos fisiopatológicos y moleculares en la remodelación de la matriz extracelular vascular
Mauricio O. ErijmanMTSAC, Silvio Litovsky1
MTSAC Miembro Titular de la Sociedad Argentina de Cardiología
1 Associate Professor, Pathology Department, University of Alabama, USA
Dirección para separatas: Mauricio Erijman Juncal 1695 - Piso 6, Dpto. K (1062) Buenos Aires
e-mail: moerijman@intramed.net.ar
RESUMEN
En la remodelación arterial, como en otros tejidos del organismo, la matriz extracelular cumple un papel importante. La complejidad en la constitución de la matriz hace de la remodelación un fenómeno difícil de reproducir experimentalmente. En el caso de las arterias es clave la modificación de la relación músculo liso-matriz que produzca el cambio en el músculo liso del fenotipo contráctil al secretor. Para que ocurran los cambios en la matriz y en el músculo liso es determinante la activación de los genes productores de las proteasas que modificarán las relaciones célula-célula y célula-matriz.
Palabras clave: Matriz extracelular; Remodelación; Arterias.
SUMMARY
Remodeling of the Vascular Extracellular Matrix: Physiopathological and Molecular Aspect
In arterial remodeling, as well as in various body tissues, the extracellular matrix plays an important role. Remodeling is a phenomenon which is difficult to reproduce experimentally because the makeup of the matrix is complex. In the case of arteries, a key factor is the change in the smooth muscle-matrix relation, which causes the phenotype of the smooth muscle to change from contractile to secretory. For the changes to occur in the matrix and smooth muscle, the activation of protease-encoding genes is essential, since they modify the cell-cell and cell-matrix relations.
Key words: Extracelar Matrix; Remodeling; Arteries.
INTRODUCCIÓN
La vasculatura es capaz de detectar cambios dentro de su medio e integrar esos signos a través de la comunicación intercelular y transformarse a sí misma con la producción local de mediadores que influyen en su estructura y función.
La remodelación vascular es un proceso activo de alteraciones estructurales que incluyen cambios al menos en cuatro procesos celulares: proliferación, muerte, migración y multiplicación, para lo cual la célula necesita degradar y producir la matriz extracelular. Este último proceso depende de la interacción dinámica entre factores de crecimiento locales, sustancias vasoactivas y estímulos hemodinámicos como la fricción y la presión de la sangre.
Todas las células de la pared vascular pueden participar en el proceso de remodelación, al actuar el endotelio como sensor y transductor de la información que llega a la matriz extracelular, donde se producirán las transformaciones que afectarán principalmente a la íntima.
CONCEPTO DE REMODELACIÓN
La remodelación de la matriz extracelular interviene en el inicio y la progresión de una gran variedad de condiciones fisiológicas, como el desarrollo embrionario y la reparación de tejidos, pero también ocurre en situaciones patológicas como el cáncer y las enfermedades vasculares, entre otras, en este último caso con afección de toda la pared arterial. (1-3)
Existen varias clasificaciones de la remodelación de la pared vascular, de acuerdo con su carácter expansivo o constrictivo en relación con la luz de la arteria durante los cambios en la matriz extracelular que se producen como respuesta inflamatoria en diferentes etapas durante la aterosclerosis y la reestenosis posangioplastia (Tabla 1). (4-11)
Tabla 1. Diferentes denominaciones de la remodelación (15)

La presencia de las células inflamatorias es importante por su producción de metaloproteinasas, factor importante en la heterogenicidad de la remodelación y estaría relacionado con el polimorfismo en la expresión genética de ellas. (12-15)
Esta novedad en la remodelación se hace de manera diferente según el sector del sistema arterial en cuestión, o si surge, por ejemplo, una tendencia constrictiva o inadecuadamente expansiva en las arterias ileo-femorales, y no así en las arterias renales. La remodelación varía con la edad y el sexo y siempre es modulada por los factores de riesgo. (16-18)
Así, en la reestenosis posangioplastia existiría una remodelación hacia adentro, debido a mecanismos oxidativos y de bajo flujo, mientras que en los corazones trasplantados se produce una remodelación interna o remodelación inadecuada externa, debido a un engrosamiento progresivo de la íntima de naturaleza inmunológica. (10, 19, 20)
En los casos de síndromes inestables, en presencia de una placa grande se produce una remodelación externa en el área correspondiente del vaso rica en macrófagos y linfocitos y pobre en músculo liso y colágeno, lo cual la hace susceptible de rotura. (21-23)
En todos los casos, el músculo liso es determinante en la remodelación de la pared vascular cuando en respuesta a estímulos mecánicos y de sustancias vasoactivas cambia su fenotipo contráctil al tipo secretor (rico en retículo sarcoplasmático) que predomina en el período fetal y posnatal inmediato y conforma así la matriz extracelular. (19, 24-28)
El papel secretor del músculo liso como respuesta a factores de crecimiento afecta principalmente el desarrollo en la pared arterial de la íntima, cuyos límites son el endotelio y la lámina elástica interna. (29-31)
ARTERIA NORMAL
Las arterias pueden ser de tres tipos: grandes o elásticas (aorta, sus ramas y arteria pulmonar), medianas o musculares (algunas ramas específicas de la aorta como las coronarias y renales) y pequeñas (menores de 2 mm de diámetro que están en los tejidos y los órganos).
La pared vascular normal está constituida básicamente por células endoteliales, células del músculo liso, matriz extracelular y adventicia (Figura 1).

Fig. 1. A. Corte transversal de una arteria coronaria intramiocárdica de características normales. B. Corte de una aorta con paredes normales. Se utilizó tinción con rojo "O" y aumento de x40.
En el caso de las arterias elásticas, éstas tienen la capa media muy rica en fibras de elastina, que alternan con capas finas de células del músculo liso, mientras que en las musculares la media está compuesta predominantemente por células de músculo liso con la elastina limitando en las membranas interna y externa.
La matriz extracelular es abundante en las arterias que poseen músculo liso, como las grandes y las medianas.
Los diferentes tipos de células que componen la pared vascular están organizados en capas concéntricas, con el endotelio tapizando la luz del vaso y descansando sobre la lámina elástica interna, que constituye los límites de la íntima de la arteria. En condiciones normales, la cantidad de matriz y de células entre el endotelio y la lámina elástica interna es escasa. La formación de lesiones vasculares invariablemente está asociada con la acumulación de células mesenquimáticas y sus productos en la íntima, que compromete así la luz del vaso y contribuye a la retención de moléculas aterogénicas. Como resultado de esto, la hiperplasia de la íntima es determinante en el desarrollo de un amplio rango de condiciones clínicas que están asociadas con el incremento en la morbimortalidad cardiovascular.
Simultáneamente con la expansión de las células preexistentes en la íntima, la hipótesis inicial sostiene que la modulación del fenotipo de las células del músculo liso del tipo contráctil al sintético (desdiferenciación) es importante en su migración a la íntima.
Trabajos recientes en la remodelación luego de implantes venosos en condiciones dislipidémicas señalan que la hiperplasia de la íntima puede originarse en las células del músculo liso de la media y/o los fibroblastos vasculares escasamente diferenciados o aun de fuentes no vasculares. (19, 28)
MATRIZ EXTRACELULAR
La matriz extracelular está en todos los tejidos y ocupa el volumen del espacio extracelular en la capa media, donde es más abundante que las células que la rodean y determina así las propiedades físicas del tejido. Está compuesta por macromoléculas que resultan de la unión de una gran variedad de proteínas y polisacáridos; la diferente concentración de cada uno de ellos y la forma en que se organizan da lugar a una gran diversidad para adaptarse al requerimiento funcional de cada tejido en particular. (9, 32) Muchos de estos cambios tienen que ver con la expresión genética y casi todos son mediados por receptores llamados integrinas. La matriz extracelular cumple una función especial en el desarrollo embriológico, la curación de heridas y el cáncer mediante sus propiedades quimiotácticas, opsónicas y adherentes.
Los elementos de la matriz son secretados localmente y ensamblados dentro de una red organizada en estrecho contacto con las células que la producen (Figura 2). (30)
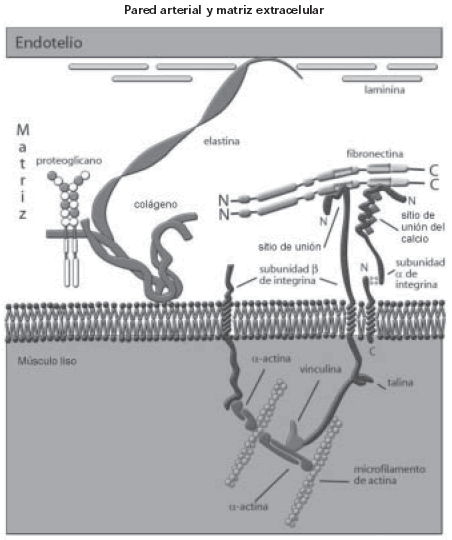
Fig. 2. Esquema de la relación entre el endotelio, la matriz extracelular y el músculo liso; la relación es a expensas de las fibras de elastina. Por otro lado, tal como ocurre en el músculo cardíaco, la relación entre las células y la matriz está dada por las integrinas. (Modificado de Scott F. Gilbert. Biología del Desarrollo. 7a ed. Editorial Médica Panamericana; 2003. Cap 6, p. 182.)
Las dos clases más importantes de macromoléculas extracelulares que forman la matriz son:
1. Sustancia fundamental: está constituida por glicoproteínas que forman cadenas lineales de polisacáridos, compuestos por unidades de disacáridos que se repiten, conocidos como glicosaminas por tener el grupo amina-azúcar unido en forma covalente a un centro proteico, unión de la que resultan los proteoglicanos, que se agrupan en cinco grandes familias, de acuerdo con su residuo de azúcar, el tipo de unión entre esos residuos y el número o la localización de los grupos sulfatados.
2. Proteínas fibrosas: se pueden clasificar de acuerdo con sus propiedades en dos tipos:
a) Estructurales, como el colágeno y la elastina.
b) Adhesivas, como la fibronectina y la laminina.
Los miembros de ambas clases tienen una gran variedad de formas y tamaños.
Los proteoglicanos: tienen menos del 10% en proteínas y el resto son hidratos de carbono; la variedad en el centro proteico genera una gran diversidad. (33) Los más frecuentes en las arterias son el condroitín sulfato (versicán, biglicán, perlecán), el heparán sulfato (agrin, decorin, perlecán) y el dermatán sulfato. Tienen alta densidad de cargas negativas que atraen cationes como el sodio, que son activos osmóticamente y hacen que una gran cantidad de líquido pase a la matriz. Se forman así geles hidratados que ocupan un gran espacio, que resisten fuerzas compresivas y permiten la rápida difusión de nutrientes, metabolitos y hormonas entre la sangre y la célula.
Los colágenos: son proteínas fibrosas secretadas por las células del tejido conectivo, como los fibroblastos (músculo liso en los vasos). La molécula de colágeno es larga y gruesa en una estructura de polipéptidos en forma de triple hélice conocidos como cadena á, de las cuales hay por lo menos 25 tipos que se enrollan entre sí. A diferencia de las fibras de los proteoglicanos que resisten fuerzas compresivas, las fibrillas de colágeno forman estructuras que resisten las fuerzas de tensión. Además de la responsabilidad en la organización espacial de la matriz, establecen conexiones con otras moléculas de ella.
Al menos cinco tipos diferentes de colágeno están presentes en los vasos sanguíneos, aunque es probable que existan más. Los más importantes en mantener la estructura de los vasos sanguíneos son los tipos I y III, que forman largas fibrillas. El tipo IV, sin embargo, también es un componente estructural importante que forma una red de moléculas en las membranas basales de las células endoteliales y del músculo liso junto con microfibrillas que usualmente están presentes entre las largas fibras del colágeno intersticial. La función del tipo V no se conoce bien, pero parece que conecta fibras grandes del colágeno intersticial localizándose dentro de esas fibras o sobre la superficie de éstas.
Del colágeno tipo VIII no se pudo establecer con precisión su estructura y tampoco sus posibles funciones.
La síntesis del colágeno por el músculo liso en los vasos resulta de un cambio en las propiedades de éste, que al pasar de las características contráctiles al fenotipo secretor comienza a sintetizar grandes cantidades de proteínas de la matriz extracelular. (33, 34)
La elastina: una vez secretadas, estas fibras están profusamente entrelazadas y forman una extensa red de fibras y cuerdas. Son muy ricas en prolina y lisina y tienen la propiedad de ser cinco veces más extensibles que una banda de goma de igual diámetro.
La fibra elástica está cubierta, además de la elastina, por una envoltura de microfibrillas compuestas por unas glicoproteínas llamadas fibrilinas que son imprescindibles para su integridad y cuyo defecto genético produce, debido a la alteración en el ensamblado de la elastina, el síndrome de Marfan. (35-37)
Las fibronectinas: son proteínas adhesivas extracelulares que ayudan a las células a fijarse en la matriz. Son glicoproteínas de gran tamaño divididas en dos subunidades unidas por puentes de azufre, dobladas a su vez en módulos con forma de vara funcionalmente distintos. Uno de estos módulos se une al colágeno, otro al heparán y otros tienen receptores específicos para varios tipos de células. (38)
La laminina: ubicada entre las proteínas fibrosas adhesivas, resulta de la organización de la matriz extracelular, especialmente en ciertos lugares, como debajo de los epitelios. Su función no es sólo estructural, sino que cumple el papel de filtro, determina la polaridad de la célula, influye en el metabolismo celular, organiza las proteínas de las membranas plasmáticas adyacentes, induce la diferenciación celular y sirve como sendero para su migración. (30)
RECEPTORES DE LA MATRIZ EXTRACELULAR
La arquitectura global de un tejido que contiene células adherentes está determinada por los mecanismos de adhesión en los que intervienen interacciones intercelulares y entre las células y la matriz que las rodea.
Si bien algunos proteoglicanos actúan como correceptores, las integrinas, proteínas que forman parte de la familia de las moléculas de adhesión, son las más importantes e indispensables junto con los factores de crecimiento en la señalización celular para una respuesta óptima. (39)
Las integrinas se agrupan en los sitios de contacto de las células con la matriz y pueden activar muchas vías de señalización intracelular, incluido el fosfolípido inositol.
Las integrinas se expanden sobre diversas células y la mayoría de las células expresan varias integrinas, lo cual les permite unirse a varias moléculas de la matriz; la presencia de subunidades, al menos 8 para las β y 17 para las á, da lugar a una gran cantidad de combinaciones con la presencia de una gran variedad de integrinas. (40)
Las integrinas β2 que median principalmente las conexiones célula-célula en lugar de célula-matriz serían importantes en las células endoteliales; los ligandos, referidos a veces como contrarreceptores, son miembros de una superfamilia de las inmunoglobulinas que forman también parte de las moléculas de adhesión. Algunas de las integrinas β2, por ejemplo, les permiten a los glóbulos blancos fijarse y atravesar la capa endotelial de los vasos sanguíneos en los sitios de infección.
Para poder actuar como integradoras, las integrinas deben interactuar con el citoesqueleto, tanto en la relación célula-matriz como en la relación célula- célula conectándose en la mayor parte de ellas con los filamentos de actina.
En biología vascular son especialmente importantes las α2bβ3 que están en las plaquetas y los megacariocitos y les corresponde un importante papel en la retracción del coágulo; la integrina conocida como ávâ3 está ampliamente distribuida y con una densidad variable en diversas células vasculares y cuya acción tiene que ver con la angiogénesis, la hiperplasia de la íntima luego de la lesión arterial y la cicatrización de heridas.
En las plaquetas, la alteración de la conformación de la membrana activa la integrina α2bβ3 y promueve su unión con el fibrinógeno. En los linfocitos T se activa una integrina α1β2 que se une a la célula blanco (antígeno y/o virus). Por otro lado, algunos eventos celulares, como la fosforilación del residuo de serina intracelular de la integrina, la activan durante la mitosis, y otro tanto ocurre con la fosforilación de la tirosina en la misma zona en algunos tipos de células cancerosas. (41, 42)
PROTEÓLISIS Y PROTEASAS
Para que ocurra la remodelación en la pared de la arteria es fundamental el proceso de proteólisis de la matriz en la región pericelular del músculo liso y de esta manera favorecer su proliferación y migración. La proteólisis es imprescindible para la migración, en tanto que su necesidad para la proliferación resulta menos obvia. (43-47)
La adhesión de las células a la matriz vía moléculas de integrina genera un estrés dentro de ella, conocido como tensegrity (del inglés, tensional integrity: integridad tensional). (48) En el sistema cardiovascular, la tensegrity media el control del comportamiento de la célula a través de las fuerzas mecánicas.
Las señales emergentes de los receptores de factores de crecimiento, cadherinas e integrinas, parecen tener una importancia significativa, al determinar que las proteasas de los leucocitos generen en los casos patológicos la cascada proteolítica pericelular. (49-51)
En el caso del músculo liso, la pérdida de contacto llevaría a la apoptosis por la falta de tensigrity, generando una cascada de caspasas, aparentemente activadas por la simple separación de la fibronectina, que se considera un factor de supervivencia y la alteración de la relación con ella dispararía la muerte celular. (32)
Esta apoptosis de las células se conoce como anoïkis, palabra tomada del griego y que significaría la desaparición de los desamparados. (48, 50) Es probable que las señales de supervivencia en anoïkis sean ampliamente reguladas por el citoesqueleto.
En condiciones fisiológicas, anoïkis funciona en la homeostasis de los tejidos y las células durante el desarrollo, la renovación y la regresión. (52-55)
Las endopeptidasas se clasifican de acuerdo con su mecanismo catalítico en proteasas de serina, cisteína, aspártico o metaloproteinasas.
En la remodelación de la matriz en general y de la pared vascular en particular son importantes las metaloproteinasas. (56-58)
Existen cinco superfamilias de metaloproteinasas, clasificadas de acuerdo con la secuencia de los péptidos que la forman y de ellos, la superfamilia metzicina es clave en la remodelación vascular. Estas enzimas se distinguen por tener una molécula de Zn2+ en el sitio catalítico, atrapado en un complejo de histidinas. (59-61)
La gran familia metzicina se subdivide a su vez en cuatro familias multigénicas, de las cuales en el sistema vascular son importantes las adamalisinas (ADAM) y las metaloproteinasas (MMP) de la matriz que tienen, salvo excepciones, el aminoácido serina en algún lugar de la cadena peptídica. (59, 62)
La expresión de las metaloproteinasas es prominente en los macrófagos, pero también están presentes en el músculo liso vascular y en las células endoteliales (Tabla 2).
Tabla 2. Metaloproteinasas en el sistema vascular (16)

Su estructura es parecida y está organizada en dominios o regiones modulares con una secuencia Nterminal (predominio), que es eliminada después de su síntesis en el retículo sarcoplasmático. (56)
Las metaloproteinasas en condiciones fisiológicas están presentes en el desarrollo embriológico y la morfogénesis. (56) Por ser inducibles, su transcripción y secreción están estrictamente controladas, ya que su acción es irreversible, por lo que deben ser activadas una vez secretadas por otras metaloproteinasas o por proteasas de serina (urokinase-type plasminogen activator). (57, 61)
Algunos estudios plantean un mecanismo de retroalimentación entre las MMP y especies reactivas del oxígeno, al señalar que el óxido nítrico ejercería su acción vía modulación de las metaloproteinasas. (16) Un concepto emergente sugiere que la variación en la expresión y la actividad de las MMP contribuye a la heterogenicidad en la presentación e historia natural de la aterosclerosis.
Una vez secretadas, las MMP son reguladas a través de su inactivación proteolítica o inhibidas por otras proteínas conocidas como proteínas inhibidoras de las metaloproteinasas (TIMP).
Las TIMP son una familia de proteínas secretadas que inhiben reversiblemente las MMP con una estequiometría 1:1. Las TIMP se clasifican con un número secuencial como 1, 2, 3, 4 halladas hasta ahora con diferente capacidad de inhibición.
Además de su acción inhibidora de las metaloproteinasas, las TIMP pueden producir la muerte celular por supresión de las señales mitogénicas. (47)
Existen otras estructuras proteicas fuera de las TIMP, con capacidad inhibidora endógena de las MMP, entre ellas las ∝2-macroglobulinas, que por su abundancia en el plasma representan el inhibidor más importante presente en el líquido intersticial, ya que el resto de las TIMP están localizadas en el área pericelular. (47)
El otro grupo de enzimas proteolíticas que procesan y desenganchan proteínas de la membrana celular, activando o desactivando sustratos proteicos con cambios sustanciales en sus propiedades funcionales, son las adamalisinas (ADAM). Se trata de una familia de enzimas con anclaje en las membranas, que tienen múltiples módulos; uno de ellos es similar al sitio catalítico de las metaloproteinasas y otro, conocido como disintegrina, tiene una secuencia similar a los venenos de serpiente conocidos como disintegrinas (de ahí su nombre) con características adhesivas propias.
De las halladas hasta hoy, las ADAM 17 y 19 tienen funciones esenciales en el desarrollo del corazón en conejos y la 10 y la 15 parecen intervenir en la angiogénesis y la vascularización.
CONCLUSIONES
En los sistemas biológicos, frente a situaciones de cambio, los tejidos tienen la opción de la remodelación. Una de las vías utilizadas en estas situaciones recurre a mecanismos útiles durante el período embrionario, que en el caso de la pared arterial generan un cambio en el fenotipo del músculo liso y un desequilibrio entre las metaloproteinasas y sus inhibidores.
En el sistema arterial, los cambios producidos por la remodelación tienen diferentes características según la arteria afectada, de modo que no se establece un patrón único para todo el sistema.
En todos los casos hay un aumento de la íntima con modificaciones de la pared arterial que pueden ser predominantemente obstructiva o expansiva de acuerdo con la región y la causa.
Los mecanismos mediante los cuales se lleva a cabo la remodelación son complejos por los múltiples componentes de la matriz y la gran variedad y especificidad de las integrinas en su función integradora.
Las alteraciones en la relación célula-célula y célula- matriz parecen ser determinantes, especialmente la relación músculo liso-fibronectina.
La presencia de las metaloproteinasas, su papel esencial en las modificaciones de la matriz, así como su dependencia del cinc, convierten su inhibición en una opción terapéutica interesante.
Agradecimiento
Los autores agradecen la inestimable colaboración del Prof. Dr. Ricardo Gelpi en las correcciones y sugerencias del texto y el aporte de los elementos correspondientes a la Figura 1.
BIBLIOGRAFÍA
1. Glagov S, Weisenberg E, Zarins CK, Stankunavicius R, Kolettis GJ. Compensatory enlargement of human atherosclerotic coronary arteries. N Engl J Med 1987;316:1371-5. [ Links ]
2. Pasterkamp G, de Kleijn DP, Borst C. Arterial remodeling in atherosclerosis, restenosis and after alteration of blood flow: potential mechanisms and clinical implications. Cardiovasc Res 2000; 45:843-52. [ Links ]
3. Azzari FA, Guzman LA, Kuschnir P, Tercelan A, Padilla LT(h), Cura F y col. El remodelado arterial en la angina inestable. Rev Argent Cardiol 2002;70:159-67. [ Links ]
4. Farb A, Kolodgie FD, Hwang JY, Burke AP, Tefera K, Weber DK, et al. Extracellular matrix changes in stented human coronary arteries. Circulation 2004;110:940-7. [ Links ]
5. Falk E, Shah PK, Fuster V. Coronary plaque disruption. Circulation 1995;92:657-71. [ Links ]
6. Gibbons GH, Dzau VJ. The emerging concept of vascular remodeling. N Engl J Med 1994;330:1431-8. [ Links ]
7. Wexberg P, Gyongyosi M, Sperker W, Kiss K, Yang P, Hassan A, et al. Pre-existing arterial remodeling is associated with in-hospital and late adverse cardiac events after coronary interventions in patients with stable angina pectoris. J Am Coll Cardiol 2000;36:1860-9. [ Links ]
8. Wight TN, Merrilees MJ. Proteoglycans in atherosclerosis and restenosis: key roles for versican. Circ Res 2004;94:1158-67. [ Links ]
9. Chung IM, Gold HK, Schwartz SM, Ikari Y, Reidy MA, Wight TN. Enhanced extracellular matrix accumulation in restenosis of coronary arteries after stent deployment. J Am Coll Cardiol 2002;40: 2072-81. [ Links ]
10. Ramzy D, Rao V, Brahm J, Miriuka S, Delgado D, Ross HJ. Cardiac allograft vasculopathy: a review. Can J Surg 2005;48:319-27. [ Links ]
11. Galis ZS, Sukhova GK, Lark MW, Libby P. Increased expression of matrix metalloproteinases and matrix degrading activity in vulnerable regions of human atherosclerotic plaques. J Clin Invest 1994; 94:2493-503. [ Links ]
12. Watanabe N, Ikeda U. Matrix metalloproteinases and atherosclerosis. Curr Atheroscler Rep 2004;6:112-20. [ Links ]
13. Kaski JC. Atheromatous plaque location and arterial remodelling. Eur Heart J 2003;24:291-3. [ Links ]
14. Newby AC. Dual role of matrix metalloproteinases (matrixins) in intimal thickening and atherosclerotic plaque rupture. Physiol Rev 2005;85:1-31. [ Links ]
15. Ward MR, Pasterkamp G, Yeung AC, Borst C. Arterial remodeling. Mechanisms and clinical implications. Circulation 2000;102:1186-91. [ Links ]
16. Galis ZS, Khatri JJ. Matrix metalloproteinases in vascular remodeling and atherogenesis: the good, the bad, and the ugly. Circ Res 2002;90:251-62. [ Links ]
17. Korshunov VA, Berk BC. Strain-dependent vascular remodeling: the "Glagov phenomenon" is genetically determined. Circulation 2004;110:220-6. [ Links ]
18. Lee E, Grodzinsky AJ, Libby P, Clinton SK, Lark MW, Lee RT. Human vascular smooth muscle cell-monocyte interactions and metalloproteinase secretion in culture. Arterioscler Thromb Vasc Biol 1995;15:2284-9. [ Links ]
19. Zalewski A, Shi Y, Johnson AG. Diverse origin of intimal cells: smooth muscle cells, myofibroblasts, fibroblasts, and beyond? Circ Res 2002;91:652-5. [ Links ]
20. Achenbach S, Ropers D, Hoffmann U, MacNeill B, Baum U, Pohle K, et al. Assessment of coronary remodeling in stenotic and nonstenotic coronary atherosclerotic lesions by multidetector spiral computed tomography. J Am Coll Cardiol 2004;43:842-7. [ Links ]
21. Weissman NJ. Vascular remodeling: do we really need yet another study? J Am Coll Cardiol 2003;42:811-3. [ Links ]
22. Fassa AA, Wagatsuma K, Higano ST, Mathew V, Barsness GW, Lennon RJ, et al. Intravascular ultrasound-guided treatment for angiographically indeterminate left main coronary artery disease: a long-term follow-up study. J Am Coll Cardiol 2005;45:204-11. [ Links ]
23. Ye S, Watts GF, Mandalia S, Humphries SE, Henney AM. Preliminary report: genetic variation in the human stromelysin promoter is associated with progression of coronary atherosclerosis. Br Heart J 1995;73:209-15. [ Links ]
24. Uzui H, Harpf A, Liu M, Doherty TM, Shukla A, Chai NN, et al. Increased expression of membrane type 3-matrix metalloproteinase in human atherosclerotic plaque: role of activated macrophages and inflammatory cytokines. Circulation 2002;106:3024-30. [ Links ]
25. Nakamura M, Nishikawa H, Mukai S, Setsuda M, Nakajima K, Tamada H, et al. Impact of coronary artery remodeling on clinical presentation of coronary artery disease: an intravascular ultrasound study. J Am Coll Cardiol 2001;37:63-9. [ Links ]
26. Schwartz SM, Heimark RL, Majesky MW. Developmental mechanisms underlying pathology of arteries. Physiol Rev 1990; 70:1177-209. [ Links ]
27. Varnava A. Coronary artery remodelling. Heart 1998;79:109-10. [ Links ]
28. Lauffenburger DA, Horwitz AF. Cell migration: a physically integrated molecular process. Cell 1996;84:359-69. [ Links ]
29. Bishop JE. Regulation of cardiovascular collagen deposition by mechanical forces. Molecular Medicine Today 1998; February: 69-75. [ Links ]
30. Carey DJ. Control of growth and differentiation of vascular cells by extracellular matrix proteins. Annu Rev Physiol 1991;53:161-77. [ Links ]
31. Iozzo RV. Basement membrane proteoglycans: from cellar to ceiling. Nat Rev Mol Cell Biol 2005;6:646-56. [ Links ]
32. Newby AC. Matrix metalloproteinases regulate migration, proliferation, and death of vascular smooth muscle cells by degrading matrix and non-matrix substrates. Cardiovasc Res 2006;69:614-24. [ Links ]
33. Wight TN. Cell biology of arterial proteoglycans. Arteriosclerosis 1989;9:1-20. [ Links ]
34. Mayne R. Collagenous proteins of blood vessels. Arteriosclerosis 1986;6:585-93. [ Links ]
35. Li DY, Brooke B, Davis EC, Mecham RP, Sorensen LK, Boak BB, et al. Elastin is an essential determinant of arterial morphogenesis. Nature 1998;393:276-80. [ Links ]
36. Pasterkamp G, Galis ZS, de Kleijn DP. Expansive arterial remodeling: location, location, location. Arterioscler Thromb Vasc Biol 2004;24:650-7. [ Links ]
37. Bunton TE, Biery NJ, Myers L, Gayraud B, Ramirez F, Dietz HC. Phenotypic alteration of vascular smooth muscle cells precedes elastolysis in a mouse model of Marfan syndrome. Circ Res 2001; 88:37-43. [ Links ]
38. Riessen R, Isner JM, Blessing E, Loushin C, Nikol S, Wight TN. Regional differences in the distribution of the proteoglycans biglycan and decorin in the extracellular matrix of atherosclerotic and restenotic human coronary arteries. Am J Pathol 1994;144:962-74. [ Links ]
39. Byzova TV, Rabbani R, D'Souza SE, Plow EF. Role of integrin alpha(v)beta3 in vascular biology. Thromb Haemost 1998;80:726-34. [ Links ]
40. Carman CV, Springer TA. Integrin avidity regulation: are changes in affinity and conformation underemphasized? Curr Opin Cell Biol 2003;15:547-56. [ Links ]
41. Frenette PS, Wagner DD. Adhesion molecules- Part 1. N Engl J Med 1996;334:1526-9. [ Links ]
42. Ruoslahti E. Integrins. J Clin Invest 1991;87:1-5. [ Links ]
43. Shi Y, Patel S, Niculescu R, Chung W, Desrochers P, Zalewski A. Role of matrix metalloproteinases and their tissue inhibitors in the regulation of coronary cell migration. Arterioscler Thromb Vasc Biol 1999;19:1150-5. [ Links ]
44. Bendeck MP. Targeting pericellular proteolysis in vascular disease. Circ Res 2002;91:861-2. [ Links ]
45. Johnson C, Galis ZS. Matrix metalloproteinase-2 and -9 differentially regulate smooth muscle cell migration and cell-mediated collagen organization. Arterioscler Thromb Vasc Biol 2004;24:54-60. [ Links ]
46. Werb Z. ECM and cell surface proteolysis: regulating cellular ecology. Cell 1997;91:439-42. [ Links ]
47. Baker AH, Edwards DR, Murphy G. Metalloproteinase inhibitors: biological actions and therapeutic opportunities. J Cell Sci 2002; 115:3719-27. [ Links ]
48. Michel JB. Anoikis in the cardiovascular system: known and unknown extracellular mediators. Arterioscler Thromb Vasc Biol 2003;23:2146-54. [ Links ]
49. Frisch SM, Screaton RA. Anoikis mechanisms. Curr Opin Cell Biol 2001;13:555-62. [ Links ]
50. Silvestre JS, Mallat Z, Tamarat R, Duriez M, Tedgui A, Levy BI. Regulation of matrix metalloproteinase activity in ischemic tissue by interleukin-10: role in ischemia-induced angiogenesis. Circ Res 2001;89:259-64. [ Links ]
51. Parks WC, Wilson CL, Lopez-Boado YS. Matrix metalloproteinases as modulators of inflammation and innate immunity. Nat Rev Immunol 2004;4:617-29. [ Links ]
52. Harper E, Bloch KJ, Gross J. The zymogen of tadpole collagenase. Biochemistry. 1971;10:3035-41. [ Links ]
53. Sternlicht MD, Werb Z. How matrix metalloproteinases regulate cell behavior. Annu Rev Cell Dev Biol 2001;17:463-516. [ Links ]
54. Yong VW. Metalloproteinases: mediators of pathology and regeneration in the CNS. Nat Rev Neurosci 2005;6:931-44. [ Links ]
55. Nagase H, Woessner JF Jr. Matrix metalloproteinases. J Biol Chem 1999;274:21491-4. [ Links ]
56. Kuzuya M, Iguchi A. Role of matrix metalloproteinases in vascular remodeling. J Atheroscler Thromb 2003;10:275-82. [ Links ]
57. Lijnen HR. Metalloproteinases in development and progression of vascular disease. Pathophysiol Haemost Thromb 2003-2004; 33:275-81. [ Links ]
58. Lee MH, Murphy G. Matrix metalloproteinases at a glance. J Cell Sci 2004;117:4015-6. [ Links ]
59. Stetler-Stevenson WG. Matrix metalloproteinases in angiogenesis: a moving target for therapeutic intervention. J Clin Invest 1999; 103:1237-41. [ Links ]
60. Tronc F, Mallat Z, Lehoux S, Wassef M, Esposito B, Tedgui A. Role of matrix metalloproteinases in blood flow-induced arterial enlargement: interaction with NO. Arterioscler Thromb Vasc Biol 2000; 20:E120-6. [ Links ]
61. Kenagy RD, Vergel S, Mattsson E, Bendeck M, Reidy MA, Clowes AW. The role of plasminogen, plasminogen activators, and matrix metalloproteinases in primate arterial smooth muscle cell migration. Arterioscler Thromb Vasc Biol 1996;16:1373-82. [ Links ]
62. Leontovich AA, Zhang J, Shimokawa K, Nagase H, Sarras MP Jr. A novel hydra matrix metalloproteinase (HMMP) functions in extracellular matrix degradation, morphogenesis and the maintenance of differentiated cells in the foot process. Development 2000;127:907-20. [ Links ]














