Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de cardiología
versión On-line ISSN 1850-3748
Rev. argent. cardiol. v.75 n.4 Buenos Aires jul./ago. 2007
Resultados alejados del implante miocárdico de células madre en la miocardiopatía chagásica
Jorge C. TraininiMTSAC, 1, José L. BarisaniMTSAC, Noemí LagoMTSAC, Javier Bordone, Jorge Mouras, Andrés Ruiz2, Osvaldo MasoliMTSAC, 3, Rubén Carrizo Páez4, Salvador Chada, Alejandra ChristenMTSAC, Adelina Riarte5
Servicio de Cardiocirugía, Hospital Interzonal Presidente Perón, Avellaneda, Provincia de Buenos Aires. Hospital Universitario
MTSAC Miembro Titular de la Sociedad Argentina de Cardiología
1 Jefe del Servicio de Cirugía Cardíaca del Hospital Interzonal Presidente Perón, Avellaneda, Provincia de Buenos Aires. Hospital Universitario; Fellow, American College of Surgeons; Miembro Titular de la Société Française de Chirurgie Thoracique et Cardio-Vasculaire; Fellow, Heart and Lung Transplantation Association, Miembro de la Academia Argentina de Cirugía
2 Director del Instituto Fatala Chabén, Buenos Aires
3 Hospital Argerich, Buenos Aires
4 Director Provincial de Lucha contra el Chagas. Hospital Rawson, San Juan
5 Instituto Fatala Chabén, Buenos Aires
Dirección para separatas: Dr. Jorge C. Trainini Hospital Presidente Perón Servicio de Cardiocirugía Anatole France 773 (1870) Avellaneda Provincia de Buenos Aires jctrainini@hotmail.com jctrainini@yahoo.es
Recibido: 28/03/2007
Aceptado: 17/05/2007
RESUMEN
Objetivo
La presente investigación clínica persigue evaluar la seguridad y la factibilidad del cardioimplante de células mononucleares de médula ósea, así como analizar los cambios clínicos y de la función ventricular, en pacientes portadores de insuficiencia cardíaca secundaria a miocardiopatía dilatada de origen chagásico sometidos a este procedimiento.
Material y métodos
La muestra comprende 5 pacientes consecutivos (3 masculinos) con una edad promedio de 55,8 ± 8,1 años, que presentaban insuficiencia cardíaca secundaria a miocardiopatía chagásica. Los datos preoperatorios promedio de estos pacientes indicaban una clase funcional (NYHA) de 2,6 ± 0,5, mientras que la fracción del ventrículo izquierdo correspondía al 27,6% ± 5,9%, el diámetro diastólico ventricular izquierdo era de 62,9 ± 6,2 mm y el diámetro sistólico del ventrículo izquierdo era de 49,7 ± 7,6 mm. La suspensión celular obtenida de células mononucleares de la médula ósea contenía 10,6 ± 7 ml con un conteo de 1,43 ± 0,6 (E+08) células con una viabilidad mayor del 95%. Correspondían a la fracción CD34+, 5,07 ± 9,51 (E+06) y a la CD133+, 5,11 ± 4,3 (E+06). La suspensión se inyectó por pulsos en cuatro pacientes por vía intracoronaria y en el quinto por vía transepicárdica en el transcurso de una cirugía (reemplazo valvular mitral, revascularización y colocación de matriz bioartificial degradable).
Resultados
A los 17,2 ± 8,8 meses de seguimiento promedio, 4 enfermos se hallaban vivos y en clase funcional I (p < 0,005). Un paciente falleció de muerte súbita a los 17 meses de seguimiento. En este tiempo de evolución no se observaron efectos adversos en ninguno de los pacientes referidos al implante celular. En relación con la fracción de eyección, se notó un incremento a 36,6% ± 2,3% (p < 0,05). Los datos obtenidos en la medición de los diámetros sistólico y diastólico del ventrículo izquierdo no mostraron cambios estadísticos significativos.
Conclusiones
Este trabajo representa la segunda comunicación mundial sobre el uso de stem cells en cardiopatía de Chagas-Mazza. El procedimiento resultó factible y seguro y se asoció con mejoría de la capacidad funcional y de la función ventricular en el seguimiento. Estos hallazgos provisorios deberán ser corroborados por estudios clínicos controlados más amplios.
Palabras clave: Enfermedad de Chagas; Insuficiencia cardíaca congestiva; Células madre
Abreviaturas
IC Insuficiencia cardíaca
SUMMARY
Late Results in Myocardial Implantation of Stem Cells in Chagasic Myocardial Disease
Objective
The present clinical study is aimed at assessing the safety and feasibility of cardio implantation of mononuclear bone marrow cells, as well as analyzing the clinical and ventricular function changes in patients with cardiac failure secondary to dilated myocardial disease of chagasic origin that underwent this procedure.
Material and Methods
The sample included 5 consecutive patients (3 male), mean age 55, 8 ± 8, 1 years that showed cardiac failure secondary to chagasic myocardial disease. Average pre-surgery data in these patients were 2, 6 ± 0, 5 functional class (NYHA), whereas the left ventricle fraction corresponded to 27, 6% ± 5, 9%, the left ventricle diastolic diameter was 49, 7 ± 7, 6 mm. The cellular suspension obtained from mononuclear bone marrow cells contained 10, 6 ± 7 ml with 1, 43 ± 0, 6 (E+08) cell counting with a viability higher than 95%. Corresponding to CD34+, 5, 07 ± 9, 51 (E+06) fraction and CD133+, 5, 11 ± 4, 3 (E+06). Suspension was intracoronary injected in pulses to four patients and transepicardially to the fifth during the course of a surgery (mitral valve replacement, revascularization and degradable bioartificial matrix).
Results
At 17,2 ± 8,8 average months follow up, 4 patients were alive and with functional class I (p < 0,005). One patient died of sudden death after 17 months of follow up. During this evolution time period no adverse events were observed in none of the patients referred for cellular implantation. In regards to the ejection fraction, a 36,6% ± 2,3% (p < 0,05) increase was observed. Data obtained from the assessment of the left ventricle systolic and diastolic diameters did not show significant statistical changes.
Conclusions
This study represents the second world communication on the use of stem cells in Chagas-Mazza heart disease. The procedure resulted feasible and safe and was associated to improvement of the functional capacity and ventricular function during follow up. These conditional results should be corroborated by broader controlled clinical trials.
Key words: Chagas Disease; Heart Failure; Congestive; Stem cells
INTRODUCCIÓN
El tratamiento médico de la insuficiencia cardíaca (IC) ha mejorado sustancialmente el pronóstico en las últimas décadas. Sin embargo, en muchas de las personas que la padecen, la disfunción ventricular avanzará y los síntomas limitarán progresivamente la calidad de vida, con frecuentes internaciones por descompensación y el ingreso al período refractario de la enfermedad. La posibilidad de regeneración miocárdica en estos casos podría detener la evolución y mejorar los síntomas y la función ventricular.
Son pocos los enfermos que pueden tener el beneficio del trasplante cardíaco. Una posibilidad en estos casos es ofrecerle al paciente un tratamiento alternativo, que incluye revascularización miocárdica, técnicas de corrección de la insuficiencia mitral y/o reducción ventricular, asistencia biológica o asistencia mecánica prolongada. (1) Últimamente se ha agregado el implante de células o cardiomioplastia celular con el fin de promover la regeneración cardíaca y de esta forma actuar directamente sobre la masa cardíaca insuficiente. (2-4)
El miocardio adulto es incapaz de reparar en forma efectiva su lesión después de un infarto, debido a la escasez de células madre residentes. (5) Por esta razón, se han diseñado distintas estrategias de trasplante celular para el tratamiento de la IC con el fin de reemplazar las células perdidas con otras células que puedan realizar el trabajo cardíaco. Para lograr la regeneración miocárdica se ha ensayado el trasplante de diferentes tipos de células, como mioblastos autólogos, células madre derivadas de la estroma de la médula ósea, células progenitoras circulantes en la sangre, células del músculo liso, células del endotelio vascular y células madre del embrión. (6)
La experiencia clínica con cardioimplante celular autólogo en la enfermedad de Chagas es escasa y se remite principalmente a las miocardiopatías de etiología coronaria o idiopática. (7)
El objetivo de la presente investigación es evaluar la seguridad y la factibilidad del cardioimplante de células mononucleares de médula ósea, así como analizar los cambios clínicos y de la función ventricular, en pacientes portadores de IC secundaria a miocardiopatía dilatada de origen chagásico. Para asegurar este fin se elaboró este estudio piloto, que incluye los primeros 5 pacientes, para luego valorar la posibilidad de un protocolo más ambicioso.
MATERIAL Y MÉTODOS
Selección de pacientes
En la Tabla 1 se resume el protocolo utilizado en nuestro hospital para el trasplante de stem cells de médula ósea en pacientes con miocardiopatía dilatada de origen no coronario e IC avanzada. Los pacientes deben encontrarse en esta condición a pesar del cumplimiento estricto del tratamiento médico optimizado y estable durante al menos 4 semanas con diuréticos, digoxina, betabloqueantes, inhibidores de la enzima convertidora de la angiotensina o antagonistas de la angiotensina y espironolactona. En el caso de realizarse en un paciente portador de cardiopatía de origen chagásico avanzada, la enfermedad deberá estar acreditada por análisis serológicos.
Tabla 1. Selección de pacientes para implante intracoronario de stem cells autólogas en miocardiopatía dilatada no isquémica (Hospital Presidente Perón, Buenos Aires, Argentina)

Durante los dos meses previos al implante, los enfermos recibieron tratamiento parasiticida con benznidazol. Asimismo, sus hábitats fueron desparasitados con fumigación y sometidos a controles periódicos con el fin de evitar la reinfección luego del implante celular. Este protocolo tuvo aprobación del Comité de Ética de la Institución. Los pacientes incluidos recibieron extensa información y dieron su consentimiento.
Estudios preoperatorios y posoperatorios
Los pacientes se evaluaron mediante ecocardiograma Doppler, ventriculografía isotópica, cinecoronariografía y ventriculografía izquierda. Se realizó perfusión miocárdica en cámara SPECT gatillado con MIBI Tc 99m (reposo/dipiridamol) y eco estrés con dobutamina para establecer la viabilidad miocárdica. La motilidad parietal segmentaria se examinó en condiciones basales, a través de ecógrafos SONOS 2500 y SONOS 5500 (Hewlett Packard; Andover, Massachusetts, USA) con colorcinesis y armónicas de fusión, respectivamente. El puntaje (score) de motilidad parietal se dispuso según las normas de la American Heart Association (segmentos cardíacos = 17). (8) Los resultados de los estudios fueron analizados por dos especialistas diferentes tomando como segmentos no viables solamente aquellos en los que ambas evaluaciones coincidían. La evaluación posoperatoria fue realizada por los mismos operadores. Para este trabajo se analizaron comparativamente los datos clínicos, ecocardiográficos y la fracción de eyección radioisotópica preoperatorios y en el seguimiento alejado.
Población
Desde diciembre de 2001, sesenta y ocho pacientes fueron implantados con técnicas de regeneración. La etiología tratada fue aterosclerótica en 50 pacientes, miocardiopatía dilatada idiopática en 12, enfermedad de Chagas en 5 y miocardiopatía por lupus en el restante. El abordaje utilizado fue epicárdico en 40 pacientes e intracoronario en 28. (9-15)
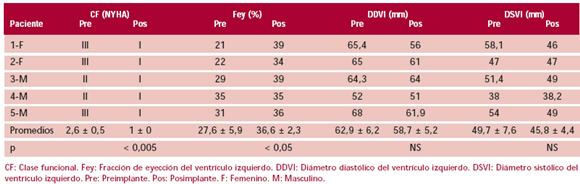
La muestra analizada para este estudio comprende 5 pacientes consecutivos (3 masculinos), edad promedio de 55,8 ± 8,1 años, que presentaban IC secundaria a miocardiopatía chagásica. Todos ellos tenían tres reacciones serológicas po sitivas para enfermedad de Chagas. Dos tenían colocados marcapasos definitivos. Los datos preoperatorios promedio de estos pacientes indicaban una clase funcional (NYHA) de 2,6 ± 0,5 en promedio, mientras que la fracción del ventrículo izquierdo correspondía al 27,6% ± 5,9%, el diámetro diastólico ventricular izquierdo era de 62,9 ± 6,2 mm y el diámetro sistólico del ventrículo izquierdo era de 49,7 ± 7,6 mm (Tabla 2).
Tabla 2. Evaluación preimplante y posimplante a los 17,2 ± 8,8 meses de seguimiento
Preparación celular
Las células progenitoras de la médula ósea se obtuvieron mediante la aspiración de 100 ml de médula ósea por punción de la cresta ilíaca realizada 4 horas antes del implante bajo anestesia local con lidocaína al 2%. En ese lapso, la muestra se filtró con el fin de eliminar detritos, como fragmentos grasos. A continuación se centrifugó mediante un gradiente de Ficoll Hystopaque. La fracción mononuclear obtenida se diluyó y se centrifugó nuevamente con solución salina. Una porción mínima fue separada para prueba de viabilidad y citometría de flujo.
El resto se resuspendió en solución de suero autólogo y se inyectó por pulsos en cuatro pacientes por vía intracoronaria y al quinto en el transcurso de cirugía cardíaca, por vía transepicárdica. La suspensión celular obtenida de células mononucleares de la médula ósea contenía (valores promedio) 10,6 ± 7 ml con un conteo de 1,43 ± 0,6 (E+08) de células con una viabilidad mayor del 95%. Correspondían a la fracción CD34+, 5,07 ± 9,51 (E+06) y a la CD133+, 5,11 ± 4,3 (E+06).
Estadística
Los resultados se evaluaron como valores promedio ± desviación estándar. La comparación de datos preoperatorios y posoperatorios se realizó con la prueba de la t, con una p < 0,05 como límite de significación.
RESULTADOS
En cuatro pacientes, la solución con células madre se inyectó por pulsos por vía percutánea intracoronaria (descendente anterior, circunfleja y coronaria derecha) a través de un catéter guía, con oclusión de la arteria por medio de un catéter-balón hasta los 3 minutos, con dependencia de la tolerancia (síntomas, caída tensional, supradesnivel del segmento ST, arritmias). El tiempo de isquemia inducida total fue de 18,4 ± 3 minutos promedio en estos pacientes. La tolerancia fue excelente y no hubo complicaciones relacionadas con el procedimiento. En otro paciente, la solución con células madre se aplicó durante una cirugía cardíaca mediante 28 inyecciones transepicárdicas en la cara anterior, la lateral y el ápex del ventrículo izquierdo. A este paciente se le realizó además reemplazo valvular mitral con prótesis mecánica bivalva, revascularización de la arteria descendente anterior mediante anastomosis mamaria y colocación de una matriz bioartificial degradable. No hubo complicaciones ni óbitos hospitalarios en estos 5 enfermos.
A los 17,2 ± 8,8 meses de seguimiento promedio, 4 enfermos se hallaban vivos y en clase funcional I. Un paciente falleció a los 17 meses debido a muerte súbita. En este tiempo de evolución no se observaron efectos adversos en ninguno de los pacientes vinculados con el implante celular. Los estudios realizados en el control posoperatorio fueron los mismos que los llevados a cabo en el preoperatorio.
En relación con la fracción de eyección, mostró un incremento de 27,6% ± 5,9% en el preimplante a 36,6% ± 2,3% (p < 0,05); por su parte, la clase funcional pasó de 2,6 ± 0,5 a 1 ± 0 (p < 0,005). Los datos obtenidos en la medición de los diámetros sistólico y diastólico del ventrículo izquierdo no mostraron cambios estadísticos significativos (Tabla 2). Si hacemos un análisis más homogéneo y a esta serie pequeña, inadecuada para un consideración definitiva, le quitamos el paciente tratado por vía quirúrgica, hallamos en el estudio de la fracción de eyección una p = 0,07. Consideramos que el escaso número de pacientes implica que en esta situación debemos caracterizarla como una tendencia hacia la significación.
DISCUSIÓN
Diversos aspectos nos llevaron a establecer la posibilidad de regenerar tejido cardíaco en las miocardiopatías dilatadas, entre ellas la enfermedad de Chagas-Mazza. Y ellos fueron forjados a través del conocimiento que se fue adquiriendo con el desarro llo de la técnica en la patología aterosclerótica y la interpretación de los resultados obtenidos. Estas etapas pueden ser ordenadas de la siguiente manera:
1. Observación de la viabilidad con mioblastos en un período de seguimiento a tres años
Si tomamos en cuenta en nuestro primer estudio clínico los segmentos comprometidos en cinco pacientes tratados con mioblastos y los dividimos en infarto transmural, infarto no transmural, isquémicos y normales, hallamos que sobre 68 segmentos pasibles de estudio a los 33 ± 6,05 meses hubo un claro retroceso de los segmentos con infarto transmural y un incremento en los segmentos no transmurales e isquémicos. Los segmentos con compromiso transmural retrocedieron de 15 a 3, a lo cual le corresponde un 80% de eficacia (p < 0,005). El análisis de los segmentos no transmurales debe ser exhaustivo. Si bien éstos globalmente aumentaron de 7 a 10, aquellos segmentos no transmurales registrados originariamente en el preoperatorio descendieron de 7 a 2, un 72%. Se puede explicar que el aumento global de estos segmentos no transmurales correspondió a segmentos incorporados tanto por el avance de la enfermedad como a expensas de los transmurales, en claro retroceso del tejido fibrótico. (9)
Con estos resultados discernimos que la enfermedad de Chagas-Mazza era pasible de tratamiento, ya que se caracteriza por fibrosis miocárdica difusa e infiltrados compuestos de linfocitos, células plasmáticas y macrófagos, que indican un proceso activo continuo de pérdida de miocitos y activación del colágeno. Debido a esta disposición diseminada en focos inflamatorios es factible lograr mejores resultados que con las escaras de tamaño considerable y ya constituidas que ofrece el modelo aterosclerótico luego de producido el infarto.
Además, en la enfermedad de Chagas-Mazza se produce una cantidad elevada de citocinas debido al foco persistente de inflamación. Estos factores ayudarían a la atracción celular y la fijación de las células inyectadas hacia dichos focos, como asimismo en la diferenciación futura.
2. La introducción de las células madre de la médula ósea permitió trabajar con la vía de implante por vía intracoronaria por cateterismo
Esta circunstancia se halla en relación con el diámetro celular. Los 30 micrones de los mioblastos pueden precipitar por vía intracoronaria pequeños infartos, situación de la que las células de la médula ósea permanecen exentas al tener sólo la mitad, unos 15 micrones. (15)
3. La experiencia con células madre de la médula ósea mostró una mejor perspectiva de regeneración en aquellos segmentos de infarto no transmural respecto de los transmurales
El análisis segmentario del corazón nos muestra que de los 74 segmentos tratados con implante de stem cells en 13 pacientes que superaron el año de seguimiento se recuperaron 43 de ellos, es decir un 58% (p < 0,0001). De 8,2 ± 3,1 segmentos no viables por paciente se redujeron a 3,4 ± 2. Los segmentos se dividieron por su viabilidad en necrosis transmurales y no transmurales. Del total de 74 segmentos no viables en estos pacientes, 54 presentaban compromiso transmural y 20 no transmural. En los primeros, la recuperación alcanzó al 46% de ellos, mientras que en los no transmurales esta cifra se incrementó al 90%. Esta observación implica una posible concepción terapéutica tanto en lo que hace a la utilización precoz del cardioimplante celular en el curso de infartos completos/ subcompletos, como a su uso en la miocardiopatía dilatada idiopática y en la enfermedad de Chagas-Mazza. La interpretación es que en los miocardios atigrados, con mosaico de zonas viables y no viables, la posibilidad de recuperación sería mayor que en el modelo necrótico, constituido por dilatación extensa y escaras fibrosas extensas. (13)
Definir las indicaciones de un procedimiento relativamente nuevo, para el que aún no se han fijado los límites de sus resultados, siempre es conflictivo. Esto es más difícil al no haberse aclarado totalmente cuestiones éticas, técnicas y clínicas. Aún persiste el interrogante sobre cuál es el mejor tipo de célula para cada caso, cuál es la vía de abordaje ideal y si los procedimientos se deben asociar o repetir.
Sin dudas, el escenario ideal para la demostración de resultados es la cardiopatía isquémica crónica con amplias zonas de fibrosis miocárdica y disfunción ventricular sintomática. De hecho, la mayor parte de los estudios clínicos se realizaron en este tipo de enfermos. En estos casos, si se asocian áreas isquémicas o viables y las coronarias tienen lechos aceptables para ser revascularizadas, los dos procedimientos se podrían combinar.
Tal vez el mayor interrogante lo presenten las miocardiopatías dilatadas no isquémicas como la enfermedad de Chagas-Mazza, con daño difuso del miocardio y pérdida progresiva y más o menos uniforme de cardiomiocitos. La escasa experiencia en estas patologías obliga a la prudencia en la selección de pacientes y, en consecuencia, a escoger sólo a los que se presentan sintomáticos a pesar del tratamiento médico optimizado, completo e individualizado y que presenten dificultades para ser trasplantados en un tiempo razonable.
En la Argentina y buena parte de Latinoamérica, la enfermedad de Chagas-Mazza sigue siendo un flagelo, por lo que pensar que tal vez este tipo de terapia pueda tener aplicación resulta esperanzador. La persistencia del parásito en el organismo, las arritmias ventriculares graves y los trastornos de conducción que suelen asociarse con esta cardiopatía constituyen problemas que seguramente limitarán y dificultarán su implementación.
Desde el punto de vista experimental, en ratones chagásicos implantados con células de la médula se observó reducción de los infiltrados inflamatorios y desaparición de la fibrosis intersticial característicos de la afección. (16)
En la fase clínica, en Brasil, se inyectó por cateterismo a 28 pacientes en clase funcional III-IV. Aunque esta experiencia fue comunicada con sólo dos meses de seguimiento, los pacientes mejoraron los índices de clase funcional, la caminata de seis minutos y la calidad de vida. El número de latidos prematuros se incrementó, pero sin que se hallara aumento de episodios de taquicardia ventricular. (17)
Si bien la experiencia de nuestro hospital se inició al mismo tiempo, nuestra estrategia se basó en realizar un estudio inicial pequeño y vigilar su seguimiento por un lapso más prolongado. El estudio demostró seguridad, sin aparición de efectos adversos atribuibles al procedimiento. En nuestra muestra, la única paciente fallecida a los 17 meses se hallaba en clase funcional I y la causa fue muerte súbita. Vivía en un área endémica, a pesar de que su domicilio estuvo en vigilancia epidemiológica. Si bien este óbito se produjo por arritmia ventricular, en los controles periódicos estos pacientes no refirieron nuevos trastornos del ritmo ni aumento en los episodios de taquicardia ventricular. De todas formas, este aspecto de la enfermedad de Chagas-Mazza constituye un desafío vigente para estas posibilidades de terapia con células de la médula ósea.
Los pacientes incorporados a esta experiencia contaban con función ventricular y capacidad funcional disminuidas. En cuanto a los resultados, éstos mostraron una franca mejoría de la clase funcional a un seguimiento apreciable de 17,2 ± 8,8 meses. De 2,6 ± 0,5 a 1 ± 0 (p < 0,005). Este efecto se corroboró con un aumento de la fracción de eyección, la cual se incrementó de 27,6% ± 5,9% en el preimplante a 36,6% ± 2,3% (p < 0,05). Los diámetros ventriculares, en cambio, mostraron índices de mejoría discretos. A pesar de hallarse en fases de capacidad funcional comprometida (tres pacientes en clase funcional III), estos pacientes mostraron persistencia de su recuperación luego del tratamiento.
Es importante destacar que el implante en enfermedades del corazón no ateroscleróticas adolece de la comprobación fundamental que dan los radioisótopos. A pesar de haberlos utilizado tanto en el preoperatorio como en el seguimiento, son de difícil interpretación, ya que no tienen áreas geográficas extensas y constituidas de destrucción muscular (Tabla 3, Figura 1). Esto obliga a evaluaciones funcionales de la capacidad cardíaca, las cuales pueden ser aleatorias y, por lo tanto, menos fidedignas. Lo trascendente quizás sea lograr la comprobación de cambios en la viabilidad de los segmentos comprometidos. Posiblemente deban utilizarse escalas de score adecuadas a cambios mínimos en lugar de las actuales, que establecen la viabilidad de segmentos demasiados amplios para las variaciones que puedan introducir las células progenitoras.
Tabla 3. Paciente con cardiopatía de Chagas-Mazza. Evolución de los segmentos con control por SPECT luego del implante de stem cells
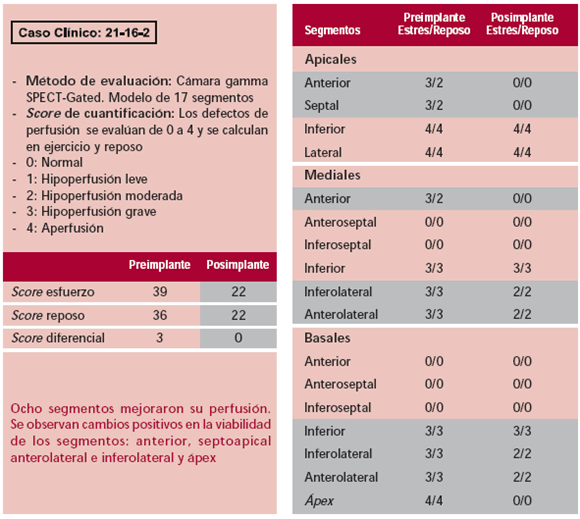
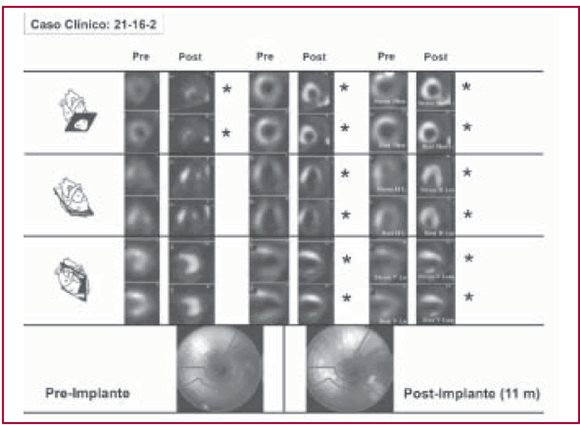
Fig. 1. SPECT correspondiente a la paciente de la Tabla 3.
Otro interrogante por dilucidar es si las células madre o troncales pueden transdiferenciarse o si actúan por fusión celular. Sin embargo, aunque no llegue a demostrarse una transdiferenciación, esta situación no excluye su beneficio, el cual se ha observado clínicamente. Por otro lado, respecto de la fusión celular, ésta puede ser un mecanismo de reparación celular como existe en el músculo esquelético.
Un punto de confusión está dado en la creencia de que las células madre de la médula ósea son únicamente hematopoyéticas. En este aspecto, las células AC133 o CD34 también son células madre hematopoyéticas pero no exclusivas, ya que es factible encontrar en ellas a las endoteliales y también a las mesenquimáticas.
En lo que hace a la situación clínica, creemos que la experiencia acumulada en este último lustro ha demostrado algunos aspectos que avizoran una imagen a la espera de ser develada. Debemos contentarnos con lo parcial y lo provisional, a pesar de la tendencia que tiene el hombre en su reclamo de unidad y coherencia, en la visualización de un mundo que presenta la diversidad como rasgo fundamental.
Si puede demostrarse la efectividad de la regeneración miocárdica, mediante la miogénesis y la angiogénesis, como prometen las recientes experiencias, seguramente las indicaciones del cardioimplante celular se ampliarán y podrá emplearse en etapas más precoces de las cardiopatías. Sin duda, el tiempo y el esfuerzo de investigación básica y clínica determinarán si existe posibilidad de ubicar a la terapia celular dentro del arsenal terapéutico y preventivo en patologías que llevan a la IC, entre ellas la enfermedad de Chagas-Mazza. (14) Mientras tanto, adherimos al Consensus Task Force- Stem Cells cuando expresa "Sería una tragedia para el tratamiento de pacientes con miocardiopatía... y para los costos de salud si la eficacia de este tratamiento no fuese explorada completamente". (18)
La miocardiopatía dilatada no isquémica es otro desafío que enfrenta esta técnica. No hay, en este aspecto, una experiencia tan manifiesta como en la patología necrótico-isquémica. Además, la evaluación es más engorrosa, al disminuir la eficacia de los estudios de viabilidad miocárdica en estas patologías. Deben ser monitorizadas con pruebas de función ventricular y capacidad funcional, que convierten a los resultados en propensos al riesgo de la aleatoriedad y complican la interpretación del potencial terapéutico utilizado.
La eficiencia de esta técnica en la enfermedad de Chagas deberá ser demostrada con estrategias que incluyen el compromiso no sólo de médicos, sino también de aquellos derivados de aspectos multidisciplinarios y económicos. Por tratarse de una enfermedad profundamente social, se deberá agregar el apoyo de las administraciones sanitarias a través de protocolos protegidos económicamente. La corroboración de estos hallazgos con estudios clínicos controlados debe indicarnos la posibilidad de mejorar la calidad de vida y la supervivencia en estos pacientes. El bajo costo de esta estrategia en nuestra experiencia y el hecho de que no haya riesgo de episodios de rechazo inmunológico, de que sea una terapéutica menos agresiva y de que tenga la factibilidad de ser utilizada en forma masiva quizás puedan servir para paliar esta "enfermedad de los pobres". El compromiso social del médico no debe hallarse exento de estas implicaciones en el ejercicio de su arte.
CONCLUSIONES
Hay pocas comunicaciones sobre el uso de células madre en la enfermedad de Chagas-Mazza. Este trabajo representa el segundo en fase clínica sobre este mal endémico de América publicado en la literatura internacional.
Nuestros pacientes toleraron bien el procedimiento, que resultó seguro y factible. Hallamos una franca y sostenida mejoría de la clase funcional en el seguimiento alejado. Esto se asoció con un aumento de la fracción de eyección del ventrículo izquierdo con discreta mejoría de los diámetros ventriculares. Obviamente, el pequeño número de casos hace que sólo podamos hablar de tendencia en los resultados. Se requiere un estudio controlado y a mayor escala, que contemple un análisis de costos, para consolidar esta técnica como una alternativa para los enfermos con IC de origen chagásico.
BIBLIOGRAFÍA
1. Trainini JC. El concepto de estructura "culpable" en la insuficiencia cardíaca. Rev Argent Cardiol 2001;69:128-35. [ Links ]
2. Nadal-Ginard B. Generation of new cardiomyocytes in the adult heart: Prospects of myocardial regeneration as an alternative to cardiac transplantation. Rev Esp Cardiol 2001;54:543-50. [ Links ]
3. Chachques JC, Shafy A, Duarte F, Cattadori B, Goussef N, Shen L, et al. From dynamic to cellular cardiomyoplasty. J Card Surg 2002;17:194-200. [ Links ]
4. Menasche P, Hagege AA, Scorsin M, Pouzet B, Desnos M, Duboc D, et al. Myoblast transplantation for heart failure. Lancet 2001;357: 279-80. [ Links ]
5. Quaini F, Urbanek K, Beltrami AP, Finato N, Beltrami CA, Nadal- Ginard B, et al. Chimerism of the transplanted heart. N Engl J Med 2002;346:5-15. [ Links ]
6. Rajnoch C, Chachques JC, Berrebi A, Bruneval P, Benoit MO, Carpentier A. Cellular therapy reverses myocardial dysfunction. J Thorac Cardiovasc Surg 2001;121:871-8. [ Links ]
7. Chachques JC, Acar C, Herreros J, Trainini JC, Prosper F, D'Attellis N, et al. Cellular cardiomyoplasty: clinical application. Ann Thorac Surg 2004;77:1121-30. [ Links ]
8. Cerqueira MD, Weissman NJ, Dilsizian V, Jacobs AK, Kaul S, Laskey WK, et al; American Heart Association Writing Group on Myocardial Segmentation and Registration for Cardiac Imaging. Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart: a statement for healthcare professionals from the Cardiac Imaging Committee of the Council on Clinical Cardiology of the American Heart Association. Circulation 2002;105:539-42. [ Links ]
9. Trainini JC, Lago N, Masoli O, Mouras J, Guevara E, Barisani JL y col. Implante cardíaco de mioblastos. Informe a tres años de seguimiento. Rev Argent Cardiol 2006;74:304-7. [ Links ]
10. Trainini JC, Lago N, de Paz J, Cichero D, Giordano R, Mouras J, et al. Myoblast transplantation for myocardial repair: a clinical case. J Heart Lung Transplant 2004;23:503-5. [ Links ]
11. Lago N, Trainini JC, Genovese JC, Barisani JL, Mouras J, Guevara E y col. Tratamiento de la disfunción ventricular posinfarto mediante el cardioimplante de mioblastos autólogos. Rev Argent Cardiol 2004;72:124-30. [ Links ]
12. Chachques JC, Herreros J, Trainini JC, Prosper F, Lajos P, Salanson-Lajos C, et al. Clinical Cellular Cardiomyoplasty. En: Cardiac Bioassist 2002. Ed Shaker Verlag; 2003. Chapter 3. p. 49-56. [ Links ]
13. Trainini JC, Lago N, Klein G, Mouras J, Masoli O, Barisani JL y col. Cardiomioplastia celular con médula ósea autóloga en pacientes con miocardiopatía isquémica. Rev Argent Cardiol 2004;72:418-25. [ Links ]
14. Trainini JC, Lago N, Masoli O, Bordone J, Mouras J, Christen A, et al. Bone marrow stem cells implant in myocardium segments. Société Française de Chirurgie Thoracique et Cardio-Vasculaire, Journees d'Automne. Paris, 2006. p. 44. [ Links ]
15. Trainini JC, Chachques JC, Herreros J, Lago N, Christen AI. Implante clínico de células madre. En: Chachques JC, Herreros J, Trainini JC, editores. Regeneración Cardíaca. Buenos Aires: Magister- Eos Ed; 2005. p. 109-26 [ Links ]
16. Soares MB, Lima RS, Rocha LL, Takyia CM, Pontes-de-Carvalho L, de Carvalho AC, et al. Transplanted bone marrow cells repair heart tissue and reduce myocarditis in chronic chagasic mice. Am J Pathol 2004;164:441-7. [ Links ]
17. Vilas-Boas F, Feitosa GS, Soares MB, Mota A, Pinho-Filho JA, Almeida AJ, et al. Early results of bone marrow cell transplantation to the myocardium of patients with heart failure due to Chagas disease. Arq Bras Cardiol 2006;87:159-66. [ Links ]
18. Bartunek J, Dimmeler S, Drexler H, Fernandez-Aviles F, Galinanes M, Janssens S, et al; task force of the European Society of Cardiology. The consensus of the task force of the European Society of Cardiology concerning the clinical investigation of the use of autologous adult stem cells for repair of the heart. Eur Heart J 2006;27:1338-40. [ Links ]














