Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de cardiología
versión On-line ISSN 1850-3748
Rev. argent. cardiol. v.75 n.6 Buenos Aires nov./dic. 2007
Evaluación de los niveles plasmáticos de células progenitoras en pacientes con enfermedad coronaria crónica
Juan GagliardiMTSAC, Emilse Bermejo, Verónica Galán, Javier Marino, María Lazzari, Carlos Bertolasi*
Grupo DIC Hospital General de Agudos Dr. Cosme Argerich, División Cardiología Clínica del Sol Instituto de Investigaciones Hematológicas. Academia Nacional de Medicina
MTSAC Miembro Titular de la Sociedad Argentina de Cardiología
* Socio Miembro Honorario Nacional de la Sociedad Argentina de Cardiología
Dirección para separatas: Dr. Juan Gagliardi Rivera Indarte 364 - 4° B (1406) Buenos Aires, Argentina Tel. 4637-3505 e-mail: jgagliardi@fibertel.com.ar
Recibido: 23/02/2007
Aceptado: 21/09/2007
RESUMEN
Introducción
El ejercicio físico es útil para los pacientes con enfermedad coronaria y es un estímulo para el desarrollo de circulación colateral. Ésta podría estar determinada por un aumento en la producción y circulación de células progenitoras.
Objetivo
Evaluar el efecto del ejercicio físico programado sobre la producción y el número circulante de células progenitoras en pacientes coronarios crónicos estables.
Material y métodos
Estudio prospectivo, controlado, aleatorizado y abierto con la inclusión de 18 pacientes (8 en grupo ejercicio y 10 en grupo control) con enfermedad coronaria estable, < 75 años, que no hubieran participado en grupos de ejercicio programado en los últimos 3 meses. La determinación de las células progenitoras se realizó por citometría de flujo utilizando marcaciones con anticuerpos monoclonales CD45-FITC, CD34-FITC y CD133/1-PE.
Resultados
En el grupo control, el nivel de CD45 no tuvo variación significativa (0,724 ± 0,256 versus 0,765 ± 0,216 [media ± EE cada 100.000 eventos]), mientras que en el grupo ejercicio el nivel de CD45(+)/CD133(+) se incrementó de 0,497 ± 0,161 a 2,265 ± 1,003 luego de un mes de actividad física programada sin alcanzar significación estadística. Al analizar los niveles de CD34 se observó que en el grupo control se incrementaron de 0,196 ± 0,086 a 0,235 ± 0,063 (p = NS). En el grupo ejercicio, la variación fue mucho mayor: 0,220 ± 0,078 a 0,844 ± 0,172 (p = 0,0046; p = 0,0092 versus el grupo control).
Conclusión
El ejercicio físico programado en pacientes coronarios promueve un incremento de las células progenitoras circulantes. Su estímulo persistente podría ser la base para un mayor desarrollo de circulación colateral.
Palabras clave: Coronariopatía; Angina de pecho; Células madre; Ejercicio
Abreviaturas
CP Células progenitoras
CPE Células progenitoras endoteliales
FC Frecuencia cardíaca
FITC Isotiocianato de fluoresceína
FRC Factores de riesgo coronario de crecimiento endotelial vascular)
HTA Hipertensión arterial
NO Óxido nítrico
PE Ficoeritrina
VEGF Vascular endothelial growth factor (factor de crecimiento endotelial vascular)
SUMMARY
Assessment of Plasmatic Levels of Endothelial Progenitor Cells in Patients with Chronic Coronary Disease
Background
Exercise is useful for patients with coronary artery disease, and it works as a stimulus for the development of collateral circulation, which could be the result of an increase in the production and circulation of endothelial progenitor cells.
Objective
The objective of this study was to assess the effect of programmed exercise on the production and number of circulating endothelial progenitor cells in patients with chronic and stable coronary disease.
Material and Methods
We conducted a prospective, randomized, controlled and open study that included 18 patients (8 in the exercise group and 10 in the control group) with demonstrated chronic stable angina, < 75 years. Patients eligible should not have participated in programmed exercise groups within the last 3 months.
Progenitor cells were determined by flow cytometry using marked monoclonal antibodies CD45-FITC, CD34-FITC y CD133/1-PE.
Results
After 1 month of programmed physical activity, CD45 level did not show any significant change in the control group (0.724±0.256 vs 0.765±0.216 [mean ± SE each 100,000 events]), whereas it increased from basal levels of 0.497±0.161 to 2.265±1.003 in the exercise group, though this change was not statistically significant.
Analyzing CD34 levels, an increase from 0.196±0.086 to 0.235±0.063 was seen in the control group (p = NS). This increase was greater in the exercise group: 0.220±0.078 to 0.844±0.172 (p=0.0046; p=0.0092 vs control group).
Conclusions
In patients with coronary artery disease, programmed exercise promotes an increase in the level of circulating progenitor cells. Its persistent stimulus could be the basis of a greater development of collateral circulation.
Key words: Coronary Disease; Angina Pectoris; Stem Cells; Exercise
INTRODUCCIÓN
Una de las vías posibles para morigerar el estrés oxidativo vascular sería el incremento de la producción de óxido nítrico (NO) a través de la actividad de la sintetasa endotelial (eNOS) y la superóxido dismutasa extracelular. El ejercicio físico, a través del estrés de rozamiento (shear stress) podría favorecer dicho mecanismo. (1, 2) Por otro lado, el ejercicio físico programado con la administración previa de hepa rina ha demostrado un posible efecto favorable con incremento del doble producto y de los niveles de ejercicio alcanzados. (3-9)
Uno de los mecanismos de acción propuestos es su efecto favorecedor de la angiogénesis a través de un aumento de los niveles y/o vida media del VEGF (vascular endothelial growth factor [factor de crecimiento endotelial vascular]) y de otros posibles factores. Por un lado, la isquemia constituye uno de los principales estímulos para su producción y para la amplificación local de sus efectos. Por otro, su alta afinidad por la heparina determinaría una unión que impide su degradación y prolonga su vida media.
Si bien algunos autores ya están utilizando la inyección local de VEGF para estimular la angiogénesis, la utilización del estímulo isquémico podría ser un mecanismo útil para facilitar un aumento endógeno del VEGF. El ejercicio físico programado ha demostrado que es muy útil para los pacientes con enfermedad coronaria crónica y en ocasiones pareciera que es un estímulo para el desarrollo de circulación colateral.
Por otra parte, la función vascular no sólo depende de las células que residen dentro de la pared vascular, sino que también parece estar modulada por células circulantes derivadas de la médula ósea. Se ha establecido que un grupo especial de estas células madre (las células progenitoras endoteliales [CP]) mejora la angiogénesis, promueve la reparación vascular, mejora la función endotelial, inhibe la aterosclerosis e incrementa la función ventricular luego del infarto.
Además, recientemente se ha establecido que el ejercicio físico intenso aumenta la producción y el número de CP en pacientes con enfermedad coronaria, probablemente por un efecto antiapoptótico parcialmente dependiente del NO y que podría potenciar los efectos beneficiosos del ejercicio en estos pacientes. (10) De esta forma, el ejercicio físico programado podría determinar un aumento en la producción y circulación de CP.
El objetivo de este trabajo fue el de evaluar el efecto del ejercicio físico programado sobre la producción y el número circulante de CP.
MATERIAL Y MÉTODOS
Se realizó un estudio prospectivo, controlado, aleatorizado y abierto, en el que se enrolaron 18 pacientes con angina crónica estable, < 75 años, con enfermedad coronaria demostrada y que no hubieran participado en grupos de ejercicio programado en los últimos 3 meses.
Los criterios de exclusión incluyeron: imposibilidad física para realizar ejercicio, enfermedades extracardíacas que comprometan la sobrevida; miocardiopatías o valvulopatías asociadas, arritmia ventricular grave, insuficiencia cardíaca, HTA no controlada, angor CF III-IV pese al tratamiento y prueba ergométrica con criterios de alto riesgo.
En todos los pacientes se realizó una evaluación clínica, análisis de laboratorio y la determinación de CP en forma basal y al finalizar el período de estudio.
Los pacientes se aleatorizaron a:
Grupo ejercicio: 8 pacientes que realizaron un plan de ejercicio programado de tres sesiones semanales durante 4 semanas.
Grupo control: 10 pacientes que continuaron con sus controles habituales.
Metodología de las determinaciones
La determinación de las células progenitoras endoteliales se realizó en el Instituto de Hematología de la Academia Nacional de Medicina.
Los estudios se efectuaron en sangre entera con anticuerpos monoclonales disponibles comercialmente (Miltenyi Biotec Inc, CA, USA).
Para eliminar las uniones inespecíficas se utilizó un bloqueante comercial, FcR, que contiene IgG humana (Miltenyi Biotec Inc, CA, USA).
Los leucocitos se marcaron por inmunoflourescencia directa con CD45-FITC, isotipo IgG2a. El anticuerpo purificado está conjugado con isotiocianato de fluoresceína (FITC).
El anticuerpo monoclonal CD34-FITC marca una glicoproteína de cadena simple, expresada en las células hematopoyéticas humanas, las células endoteliales vasculares, los fibroblastos embrionarios y en algunas células de tejido nervioso fetal y adulto.
El anticuerpo CD133/1-PE (clon AC133) reconoce el epítope llamado epítope 1 para distinguirlo de otros como el AC141 y 293C3. En el sistema hematopoyético, la expresión de CD133 está restringida a un subgrupo de células progenitoras CD34+ en el hígado humano fetal, la médula ósea y en la sangre del cordón y periférica. Este monoclonal reconoce un antígeno de superficie con un peso molecular de 117 kD y está conjugado con ficoeritrina (PE).
Los isotipos IgG1-PE y IgG1-FITC tienen una especificidad irrelevante; se utilizaron como control negativo de las marcaciones.
Las muestras de sangre se recogieron por venopuntura en tubos que contenían ácido etilendiaminotetraacético tripotásico (K3EDTA) y se conservaron a temperatura ambiente hasta su procesamiento.
Las muestras se incubaron con solución de lisis durante 20 minutos a temperatura ambiente (2 ml de sangre anticoagulada con 14 ml de líquido de lisis). Terminada la incubación, las muestras se centrifugaron (300 × g por 10 min), se retiró el sobrenadante y el botón de células se resuspendió en PBS. El procedimiento se repitió dos veces para obtener una población purificada de células libre de eritrocitos.
Se incubaron 60 ml de células con 20 ml de FcR a temperatura ambiente durante 15 minutos. Luego se lavaron y resuspendieron en 4 alícuotas de 100 ml cada una:
Alícuota 1: Mouse IgG1-FITC + Mouse IgG1-PE (como controles negativos)
Alícuota 2: CD45-FITC + Mouse IgG1-PE
Alícuota 3: CD45-FITC + CD133-PE
Alícuota 4: CD34-FITC + CD133-PE
Todas las alícuotas se incubaron en oscuridad durante 40 minutos, posteriormente se diluyeron con 450 ml de Isoflow y se pasaron por el citómetro.
Las muestras se analizaron por citometría de flujo (FACScan-Becton Dickinson), sistema equipado con un láser de argón de 488 nm y como software se utilizó CellQuest.
En la alícuota 2 se usó CD45-FITC/anti-IgG-PE para efectuar compensación y delimitar la región CD45+, que luego es utilizada para el resto de las adquisiciones. De esta forma quedan excluidos eritrocitos, plaquetas y restos celulares (debris).
Lo informado proviene del cuadrante de doble positividad y es bajo porque de todas las mononucleares (CD45+) sólo se tienen en cuenta y se informan aquellas que expresan CD133+ (alícuota 3). Esta doble marcación es de suma utilidad en la medición de células progenitoras.
La alícuota 4 se eligió para informar el porcentaje de expresión en el cuadrante de doble positividad, y mide CD34+ y CD133+, consideradas CP.
La cantidad de CP se expresa como media ± error estándar (EE) cada 100.000 eventos. Los eventos representan el pasaje de las células por el láser del equipo y con las regiones apropiadas se encuentra la positividad de los monoclonales usados (Figura 1).
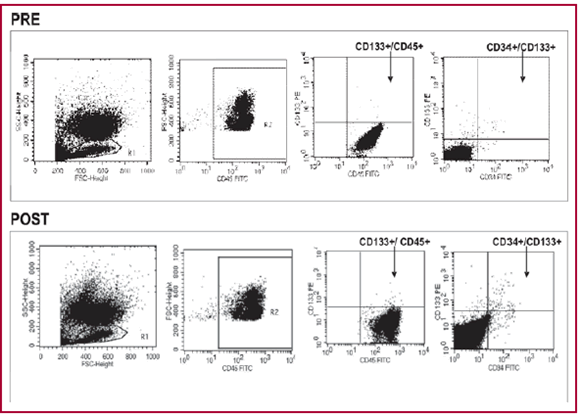
Fig. 1. Citometría de flujo previa (PRE) y luego de 1 mes de ejercicio programado.
Plan de rehabilitación cardiovascular
Los ejercicios se realizaron en tres sesiones semanales en un centro de rehabilitación. Durante este período se continuó la medicación antiisquémica habitual.
Se trabajó al 80% de la FC de trabajo y el plan de trabajo en el centro consistió en calistenia o bicicleta sin carga, bicicleta con carga con intensidad regulada para mantener una FC ± 5 latidos de la FC de trabajo y gimnasia o actividad recreativa.
Análisis estadístico
El punto final primario de este estudio fue la variación en los niveles circulantes de CP con el ejercicio.
Sobre la base de los estudios previos en los que se observó un incremento del 78% de células progenitoras endoteliales con el ejercicio, (10) 4 pacientes por grupo serían suficientes para demostrar diferencias estadísticamente significativas, tomando como base un incremento promedio por paciente en el número de CP de 17 ± 15. Estimamos que 8 pacientes por grupo (presumiendo un incremento promedio por paciente en el número de CP de 17 ± 20 y una diferencia intergrupos de 20 ± 12) eran suficientes para establecer diferencias significativas con un poder del 90% y un nivel de significación de p < 0,05.
El análisis de las variables discretas se realizó por el método de chi cuadrado y la prueba exacta de Fisher. El análisis de las variables continuas para las comparaciones intragrupos se efectuó con la prueba de la t para datos apareados y para las comparaciones intergrupos, con la prueba de la t o la de Kruskall-Wallis para datos no apareados o el análisis de la varianza (ANOVA). Se consideró significativa una p < 0,05.
RESULTADOS
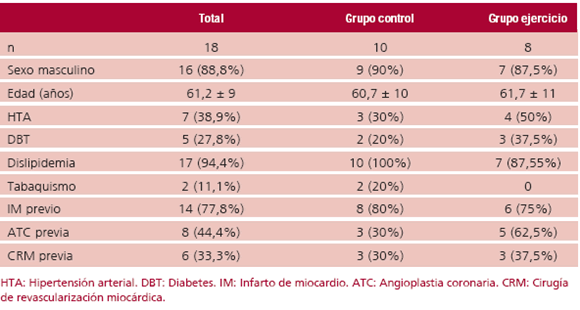
Se incluyeron en el estudio 18 pacientes (16 hombres [88,8%]), 8 en el grupo ejercicio y 10 en el grupo control. No hubo diferencias en las características basales y en los antecedentes de los pacientes asignados a cada grupo (Tabla 1). Casi todos los pacientes tenían antecedentes de dislipidemia, el 28% diabetes y el 39% hipertensión arterial. El 79% tenía antecedente de haber padecido un infarto de miocardio, el 44% angioplastia y el 33% cirugía de revascularización.
Tabla 1. Características de los pacientes incluidos
Los pacientes del grupo ejercicio mostraron una variación en el rendimiento físico medido por ergometría con un incremento en el tiempo máximo de 600 ± 158 segundos a 720 ± 228 segundos (p = 0,028) y la carga máxima desarrollada de 107,7 ± 34 watts a 132,5 ± 39,9 watts (p = 0,01). No hubo variación significativa en el doble producto máximo.
No se observaron diferencias en los niveles de CP de acuerdo con la presencia de factores de riesgo coronario, como diabetes o hipertensi ón arterial.
En el grupo control, el nivel de CD45+/CD133+ no tuvo variaci ón significativa (0,724 ± 0,256 versus 0,765 ± 0,216), mientras que en el grupo ejercicio el nivel de CD45 se incrementó de un basal de 0,497 ± 0,161 a 2,265 ± 1,003 luego de 1 mes de actividad física programada, sin alcanzar significación estadística (Figura 2).
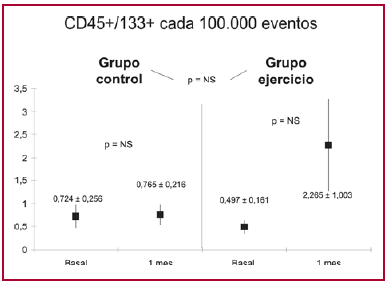
Fig. 2. Niveles de CP CD45+/133+ en el grupo control y grupo ejercicio, basal y al mes.
Al analizar los niveles de CD34+/CD133+ se observó que en el grupo control se incrementó de 0,196 ± 0,086 a 0,235 ± 0,063 (p = ns). En el grupo ejercicio, el incremento fue mucho mayor: 0,220 ± 0,078 a 0,844 ± 0,172 (p = 0,0046; p = 0,0092 versus el grupo control) (Figura 3; Tabla 2).
No se observaron variaciones cl ínicas significativas ni complicaciones durante la realización del estudio.
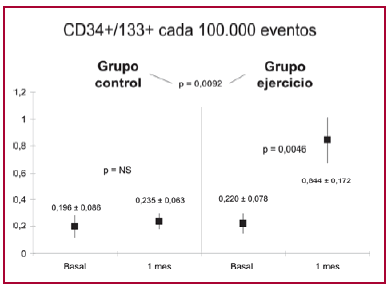
Fig. 3. Niveles de CPE CD34+/133+ en el grupo control y grupo ejercicio, basal y al mes.
Tabla 2. Variación de los niveles plasmáticos de células progenitoras

DISCUSIÓN
De acuerdo con estos resultados, observamos que el ejercicio físico programado promueve un incremento en el nivel de CP circulantes, evaluado por la presencia de células con marcadores de superficie CD34.
Se creía que la diferenciación de las células mesodérmicas en angioblastos y la subsiguiente diferenciación endotelial ocurría exclusivamente durante el desarrollo embrionario. Este dogma fue superado en 1997 cuando Asahara y colaboradores (11) publicaron que un porcentaje de células progenitoras hematopoyéticas CD34+ de adultos podían diferenciarse ex vivo en un fenotipo endotelial. Estas células, que fueron denominadas CPE (células progenitoras endoteliales), mostraron expresión de varios marcadores endoteliales y se incorporaron en neovasos en sitios de isquemia.
El grupo de Rafii en 1994 (12) también demostró la existencia de células progenitoras endoteliales derivadas de la médula ósea en el adulto.
Las CPE contribuyen a la neovascularización luego de la isquemia, la angiogénesis tumoral y la recuperación de la superficie endotelial después de la lesión, mientras que la infusión de CPE derivadas de la médula ósea o circulantes aumentan la neovascularización. (13)
Sin embargo, la definición de CPE es muy amplia. Las células con expresión de marcadores de superficie endoteliales y características funcionales de células endoteliales pueden surgir de células hematopoyéticas que expresan los marcadores CD34 o CD133, pero también a partir de los monocitos. (13)
Existe consenso en considerar CPE a las células con marcadores de superficie CD34 y VEGF Receptor2 (VEGFR2 o KDR en humanos) positivos. También un grupo inmaduro de CPE expresan además CD133 (como típicamente lo hacen los angioblastos inmaduros) y una subpoblación con CD34 negativo y CD133 y VEGFR2 positivos se ubica preferentemente en sitios de isquemia, aunque también se observan en placas inestables de pacientes con síndromes coronarios agudos. (14, 15)
El número de CPE circulantes en sujetos normales es relativamente baja (entre el 0,01% y el 0,0001% de las células mononucleares) (16) y una variedad de condiciones o factores pueden influir en este número. Pueden incrementarse por diferentes estímulos: trauma vascular, entrenamiento físico, (10) citocinas (17) y drogas. (18) A su vez, la movilización de precursores de la médula ósea depende de la activación de las metaloproteasas que actúan para liberar CPE de la estroma a la circulación y, en este sentido, el VEGF y G-CSF son los principales factores. (11, 17)
Varios autores han estudiado la relación entre el nivel de CPE y la presencia de factores de riesgo coronario (FRC). Hill y colaboradores (19) observaron una relación inversa entre el número de CPE circulantes y los FRC medidos por Score de Framingham en individuos sin antecedentes coronarios.
Los pacientes diabéticos mostraron un número menor de CPE circulantes, (20, 21) con una correlación inversa con los niveles de HbA1c. A su vez, las CPE aisladas de los pacientes diabéticos o con la presencia de otros FRC tuvieron una respuesta migratoria menor respecto de los controles. (21, 22) En nuestro estudio no observamos diferencias en los niveles de CP circulantes, probablemente por el escaso número de pacientes con diabetes y porque el estudio no fue diseñado para evaluar dicha diferencia.
También el tabaquismo se correlacionó en forma inversa con el número de CPE circulantes. (23) El tabaquismo podría afectar el entorno de la médula ósea y, por lo tanto, afectar la movilización de las CPE. También el cambio en los niveles de CPE podría estar relacionado con el hecho de que los tabaquistas tienen disfunción endotelial.
En la enfermedad coronaria se observó un número menor de CPE circulantes respecto de los controles. (20) Aunque los pacientes con angina inestable tienen niveles mayores que los pacientes con angina estable, (24) en éstos los niveles aumentados de CPE se asociaron con una reducción del riesgo de eventos. (25)
Si bien en los procesos isquémicos agudos (17) o por la cirugía de revascularización miocárdica el número de CPE aumenta, parecería que la presencia de múltiples factores de riesgo lo reduce, (26) lo cual implica que el proceso de reparación luego de la lesión requiere incrementos importantes de estas células.
En este marco, el ejercicio físico programado podría ser un estímulo constante para el incremento progresivo de las CPE circulantes.
Laufs y colaboradores, (10) en 19 pacientes con enfermedad coronaria que realizaron un programa de ejercicio supervisado de 4 semanas, demostraron un incremento significativo (78% ± 34%) de las CPE circulantes con una reducción concomitante de la apoptosis de CPE (41% ± 11%).
En el estudio de Rehman y colaboradores, (27) el ejercicio en sujetos sanos incrementó cerca de cuatro veces el nivel de CPE circulantes en sangre periférica. Es posible que aun en ausencia de angiogénesis la movilización de CPE pudiera contribuir a la reparación endotelial mediante el alojamiento en áreas de disfunción endotelial y la diferenciación en nuevas células endoteliales o la secreción de factores de crecimiento vasculoprotectores.
En nuestro estudio, el incremento de las células CD34 en el grupo ejercicio fue del 327% ± 257%, mucho mayor que en el grupo control (163% ± 216%). Es probable que el escaso número de pacientes haya influido en una gran variación individual, como se observa por la amplia desviación estándar.
El ejercicio físico diario durante 4 semanas en pacientes con enfermedad arterial periférica produjo un incremento del 310% en los niveles de VEGF y del 40% en el número de CPE circulantes. Por el contrario, en pacientes con enfermedad coronaria estable o enfermedad arterial periférica revascularizados no se observó incremento en los niveles de VEGF o CPE pero se detectó una mejoría en la integración de las CPE a las estructuras vasculares. (28) De esta forma, la isquemia sintomática sería necesaria para la liberación de CPE.
No hemos evaluado los niveles de VEGF en nuestros pacientes, pero es de esperar un incremento similar al observado en otros estudios.
Tanto el ejercicio isquémico como el subisquémico llevan a una mejoría en la incorporación de las CPE a las estructuras vasculares. Y la mejora en la capacidad de incorporación de las CPE a las estructuras vasculares también podría ser una explicación para la mejoría observada con este tipo de ejercicio y la falta de incrementos más significativos en sangre periférica. (28)
A su vez, el entrenamiento físico produce una mejoría en la función endotelial (10, 27) y, como en nuestro estudio, es bien tolerado y rara vez se observan complicaciones.
Kuwamoto y colaboradores (29, 30) demostraron en un modelo en animal que el trasplante intramiocárdico de CPE autólogas en la zona isquémica produce un incremento en la densidad de los capilares, un desarrollo mayor de circulación colateral y mejoría en la función ventricular izquierda evaluada por ecocardiografía.
También se ha mencionado que la utilización previa de heparina (5-9) podría ser útil para el desarrollo de circulación colateral. Probablemente su incorporación al arsenal terapéutico y/o la del de factor granulocítico estimulante, que aumenten la oferta medular de células, podrían ser muy útiles.
El tratamiento para promover el desarrollo de circulación colateral sería meritorio en términos de calidad de vida y atenuación de las secuelas deletéreas de la enfermedad coronaria. Por lo tanto, el ejercicio físico programado a través de un incremento persistente de los niveles de CPE circulantes podría ser la base para un mayor desarrollo de circulación colateral.
Agradecimiento
Agradecemos a la Dra. María Laura Zea y su equipo de Laboratorio de Clínica del Sol por su colaboración para el desarrollo del estudio.
BIBLIOGRAFÍA
1. Kojda G, Cheng YC, Burchfield J, Harrison DG. Dysfunctional regulation of endothelial nitric oxid synthase (eNOS) expression in response to exercise in mice lacking one eNOS gene. Circulation 2001; 103:2839-44. [ Links ]
2. Fukai T, Siegfried MR, Ushio-Fukai M, Cheng Y, Kojda G, Harrison DG. Regulation of the vascular extracellular superoxide dismutase by nitric oxide and exercise training. J Clin Invest 2000;105:1631-9. [ Links ]
3. Fujita M, Sasayama S, Asanoi H, Nakajima H, Sakai O, Ohno A. Improvement of treadmil capacity and collateral circulation as a result of exercise with heparin pretreatment in patients with effort angina. Circulation 1988;77:1022-9. [ Links ]
4. Sasayama S, Fujita M. Recent insights into coronary collateral circulation. Circulation 1992;85:1197-204. [ Links ]
5. Quyyumi AA, Diodati JG, Lakatos E, Bonow RO, Epstein SE. Angiogenic effects of low molecular weight heparin in patients with stable coronary artery disease: a pilot study. J Am Coll Cardiol 1993; 22:635-41. [ Links ]
6. Carroll SM, White FC, Roth DM, Bloor CM. Heparin accelerates coronary collateral development in a porcine model of coronary artery occlusion. Circulation 1993;88:198-207. [ Links ]
7. Melandri G, Semprini F, Cervi V, Candiotti N, Palazzini E, Branzi A, et al. Benefit of adding low molecular weight heparin to the conventional treatment of stable angina pectoris. Circulation 1993; 88:2517-23. [ Links ]
8. Fujita M, Sasayama S, Kato K, Takaori S. Prospective, randomized, placebo-controlled, double-blind, multicenter study of exercise with enoxaparin pretreatment for stable-effort angina. Am Heart J 1995;129:535-41. [ Links ]
9. Gagliardi JA, Prado NG, Marino JC, Lederer S, Ramos AO, Bertolasi CA. Exercise training and heparin pretreatment in patients with coronary artery disease. Am Heart J 1996;132:946-51. [ Links ]
10. Laufs U, Werner N, Link A, Endres M, Wassmann S, Jurgens K, et al. Physical training increases endothelial progenitor cells, inhibits neointima formation, and enhances angiogenesis. Circulation 2004;109:220-6. [ Links ]
11. Asahara T, Murohara T, Sullivan A, Silver M, van der Zee R, Li T, et al. Isolation of putative progenitor endotelial cells for angiogenesis. Science 1997;275:964-7. [ Links ]
12. Rafii S, Shapiro F, Rimarachin J, Nachman RL, Ferris B, Weksler B, et al. Isolation and characterization of human bone marrow microvascular endothelial cells: hematopoietic progenitor cell adhesion. Blood 1994;84:10-9. [ Links ]
13. Urbich C, Dimmeler S. Endothelial progenitor cells: characterization and role in vascular biology. Circ Res 2004;95:343-53. [ Links ]
14. Werner N, Nickenig G. Clinical and therapeutical implications of EPC biology in atherosclerosis. J Cell Mol Med 2006;10:318-32. [ Links ]
15. Francis S. Endothelial progenitor cells and coronary artery disease. Heart 2004;90:591-2. [ Links ]
16. Blann AD, Pretorius A. Circulating endothelial cells and endothelial progenitor cells: two sides of the same coin, or two different coins? Atherosclerosis 2006;188:12-8. [ Links ]
17. Shintani S, Murohara T, Ikeda H, Ueno T, Honma T, Katoh A, et al. Mobilization of endothelial progenitor cells in patients with acute myocardial infarction. Circulation 2001;103:2776-9. [ Links ]
18. Vasa M, Fichtlscherer S, Adler K, Aicher A, Martin H, Zeiher AM, et al. Increase in Circulating Endothelial Progenitor Cells by Statin Therapy in Patients With Stable Coronary Artery Disease. Circulation 2001;103:2885-90. [ Links ]
19. Hill JM, Zalos G, Halcox JP, Schenke WH, Waclawiw MA, Quyyumi AA, et al. Circulating endothelial progenitor cells, vascular function, and cardiovascular risk. N Engl J Med 2003;348:593-600. [ Links ]
20. Eizawa T, Ikeda U, Murakami Y, Matsui K, Yoshioka T, Takahashi M, et al. Decrease in circulating endothelial progenitor cells in patients with stable coronary artery disease. Heart 2004;90:685-6. [ Links ]
21. Tepper OM, Galiano RD, Capla JM, Kalka C, Gagne PJ, Jacobowitz GR, et al. Human endothelial progenitor cells from type II diabetics exhibit impaired proliferation, adhesion, and incorporation into vascular structures. Circulation 2002;106:2781-6. [ Links ]
22. Vasa M, Fichtlscherer S, Aicher A, Adler K, Urbich C, Martin H, et al. Number and migratory activity of circulating endothelial progenitor cells inversely correlate with risk factors for coronary artery disease. Circ Res 2001;89:E1-7. [ Links ]
23. Kondo T, Hayashi M, Takeshita K, Numaguchi Y, Kobayashi K, Iino S, et al. Smoking cessation rapidly increases circulating progenitor cells in peripheral blood in chronic smokers. Arterioscler Thromb Vasc Biol 2004;24:1442-7. [ Links ]
24. George J, Goldstein E, Abashidze S, Deutsch V, Shmilovich H, Finkelstein A, et al. Circulating endothelial progenitor cells in patients with unstable angina: association with systemic inflammation. Eur Heart J 2004;25:1003-8. [ Links ]
25. Werner N, Kosiol S, Schiegl T, Ahlers P, Walenta K, Link A, et al. Circulating endothelial progenitor cells and cardiovascular outcomes. N Engl J Med 2005;353:999-1007. [ Links ]
26. Walter DH, Rittig K, Bahlmann FH, Kirchmair R, Silver M, Murayama T, et al. Statin therapy accelerates reendothelialization: a novel effect involving mobilization and incorporation of bone marrow-derived endothelial progenitor cells. Circulation 2002; 105: 3017-24. [ Links ]
27. Rehman J, Li J, Parvathaneni L, Karlsson G, Panchal VR, Temm CJ, et al. Exercise acutely increases circulating endothelial progenitor cells and monocyte-/macrophage-derived angiogenic cells. J Am Coll Cardiol 2004;43:2314-8. [ Links ]
28. Sandri M, Adams V, Gielen S, Linke A, Lenk, Krankel N, et al. Effects of exercise and ischemia on mobilization and functional activation of blood-derived progenitor cells in patients with ischemic syndromes. Results of 3 randomized studies. Circulation 2005;111:3391-9. [ Links ]
29. Kawamoto A, Tkebuchava T, Yamaguchi J, Nishimura H, Yoon YS, Milliken C, et al. Intramyocardial transplantation of autologous endothelial progenitor cells for therapeutic neovascularization of myocardial ischemia. Circulation 2003;107:461-8. [ Links ]
30. Kawamoto A, Iwasaki H, Kusano K, Murayama T, Oyamada A, Silver M, et al. CD34-positive cells exhibit increased potency and safety for therapeutic neovascularization after myocardial infarction compared with total mononuclear cells. Circulation 2006;114:2163-9. [ Links ]














