Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de cardiología
versión On-line ISSN 1850-3748
Rev. argent. cardiol. v.75 n.6 Buenos Aires nov./dic. 2007
Respuesta hipotensora al tratamiento agudo con péptido natriurético auricular: su relación con la expresión y la actividad de la óxido nítrico sintetasa cardíaca en ratas espontáneamente hipertensas
Rosana Elesgaray, Carolina Caniffi, Andrea Fellet, Ana M. Balaszczuk, Cristina T. Arranz, María A. Costa†
Premio XXXIV Congreso Argentino de Cardiología
Cátedra de Fisiología, Facultad de Farmacia y Bioquímica, UBA. IQUIMEFA-CONICET
Este trabajo ha sido financiado por la Universidad de Buenos Aires: Subsidio UBACYT: B040 (2004-2007) y CONICET: PIP5206 (2005-2006) y el IQUIMEFA-CONICET
† Para optar a Miembro Titular de la Sociedad Argentina de Cardiología
Dirección para separatas: Dra. María A. Costa Cátedra de Fisiología, Facultad de Farmacia y Bioquímica, UBA Junín 956 -Piso 7 (1113) Buenos Aires. Argentina Tel. 4964-8280/8279 int. 308 Fax: 4964-8280/8279 int. 309 e-mail: mcosta@ffyb.uba.ar
Recibido: 06/09/2007
Aceptado: 19/09/2007
RESUMEN
Introducción
El péptido natriurético auricular (ANP) y el óxido nítrico (NO) aumentan la diuresis y la natriuresis y disminuyen el tono vascular. Previamente demostramos que el NO está involucrado en el efecto hipotensor del ANP en ratas normotensas.
Objetivo
Estudiar el efecto del ANP sobre la presión arterial media (PAM) y el sistema del NO en ratas espontáneamente hipertensas (SHR) y Wistar Kyoto (WKY) y la participación de la isoforma inducible de la NO-sintasa (iNOS).
Material y métodos
Protocolo 1: los animales fueron infundidos con solución salina (0,05 ml/min) o con ANP (0,2 µg/kg/min) durante 1 hora. Se determinaron: PAM y nitritos y nitratos urinarios (NOx). Se extrajo el corazón y se determinaron la actividad, con L-[U14C]-arginina, y la expresión (Western blot) de iNOS y NOS endotelial (eNOS). Protocolo 2: luego del agregado de ANP (1 µM), cANP(4-23) (agonista NPR-C,1µM) o aminoguanidina (inhibidor de iNOS, 1 µM) se determinó la actividad de la NOS en la aurícula derecha y en el ventrículo izquierdo de SHR y WKY.
Resultados
La infusión con ANP disminuyó la PAM y aumentó los NOx en ambos grupos. La actividad NOS fue mayor en SHR y se incrementó con la infusión de ANP. Se observaron niveles proteicos mayores para eNOS e iNOS en SHR, que no se modificaron con ANP. La actividad basal de iNOS fue mayor en SHR. En la aurícula, el ANP sólo interactuaría con el NPR-C para activar la NOS y en el ventrículo también participarían los receptores NPR-A/B. El desarrollo y/o el mantenimiento de la hipertensión en este modelo experimental involucraría alteraciones en la interacción entre ambos sistemas, ANP y NO.
Palabras clave: Óxido nítrico sintetasa; Factor natriurético auricular; Presión arterial; Corazón; Aurícula derecha; Ventrículo izquierdo; Receptores de factor natriurético auricular
Abreviaturas
AG Aminoguanidina
ANOVA Análisis de la varianza de una variable
ANP Péptido natriurético auricular
cANP(4-23) Péptido natriurético auricular truncado
cGMP Guanilil-monofosfato cíclico
EEM Error estándar de la media
eNOS Óxido nítrico sintetasa endotelial
Gi1-2 G inhibidora tipo 1-2 WKY Ratas Wistar Kyoto
iNOS Óxido nítrico sintetasa inducible
NO Óxido nítrico
NOS Óxido nítrico sintetasa
NPR-A Receptor natriurético tipo A
NPR-B Receptor natriurético tipo B
NPR-C Receptor natriurético tipo C
nNOS Óxido nítrico sintetasa neuronal
SHR Ratas espontáneamente hipertensas
SUMMARY
Hypotensive Response to Acute Treatment with Atrial Natriuretic Peptide: Its Relationship with Cardiac Nitric Oxide Synthase Expression and Activity in Spontaneously Hypertensive Rats
Background
Atrial natriuretic peptide (ANP) and nitric oxide (NO) increase diuresis and natriuresis and reduce vascular tone. We have previously demonstrated that NO is involved in ANP hypotensive effect in normotensive rats.
Objective
To assess the effect of ANP on mean blood pressure (MBP) and on NO system in spontaneously hypertensive rats (SHR) and Wistar Kyoto (WKY), and the role of the inducible isoform of nitric oxide synthase (iNOS).
Material and Methods
Protocol 1: animals were instilled with saline solution (0.05 ml/min) or with ANP (0.2 µg/kg/min) for an hour. MBP and urinary nitrites and nitrates (NOx) were assessed. The heart was extracted and iNOS and endothelial iNOS (eNOS) activity (with L-[U14C]-arginine) and expression (Western blot) were determined. Protocol 2: after adding ANP (1 µM), cANP(4-23) (NPR-C agonist, 1µM) or aminoguanidine (iNOS inhibitor, 1 µM) NOS activity in the right atrium and left ventricle of SHR and WKY was determined.
Results
Instillation with ANP reduced MBP and increased NOx in both groups. NOS activity was greater in SHR, and increased with the instillation of ANP. In SHR, greater eNOS and iNOS protein levels were observed, which were not modified by ANP. iNOS basal activity was greater in SHR. In the atrium, ANP interacts only with NPR-C in order to activate NOS, and NPR-A/B receptors would also take part in the ventricle. In this experimental model, the development and maintenance of hypertension could involve alterations in the interaction between both systems, ANP and NO.
Key words: Nitric Oxide Synthase; Atrial Natriuretic Factor; Blood Pressure; Heart; Heart Atria; Heart Ventricle; Receptors; Atrial Natriuretic Factor
INTRODUCCIÓN
La hipertensión arterial (HTA) es una patología altamente prevaleciente en la sociedad moderna y, no obstante los notables avances en el conocimiento de sus mecanismos, el impacto logrado sobre su control es universalmente escaso.
La HTA esencial, o HTA de causa no determinada, es responsable de más del 90% de los casos de HTA vistos en la práctica médica.
Las ratas espontáneamente hipertensas (SHR) constituyen un modelo experimental de hipertensión genética adecuado para estudiar la hipertensión esencial en el hombre, ya que reproducen muchas de las características de ésta. Como ocurre en la hipertensión esencial, la hipertensión en SHR generalmente está asociada con complicaciones de diversos órganos, como el corazón y el riñón, entre otros. (1-3) Numerosos factores fisiopatológicos se han considerado partícipes en la génesis de este tipo de HTA: el incremento en la actividad del sistema nervioso simpático, la sobreproducción de hormonas ahorradoras de sodio y vasoconstrictoras, el aumento en la ingesta de sodio, entre otros. En los últimos años han adquirido relevancia el sistema del óxido nítrico (NO) y el péptido natriurético auricular (ANP), factores estrechamente relacionados con la regulación del tono vascular y el manejo renal del Na+. (4-6)
El ANP es un péptido producido principalmente en las aurículas y los ventrículos, que se libera en respuesta a la distensión de la pared cardíaca. (7-9)
Se han descripto tres tipos de receptores natriuréticos, con los que interactúa el ANP con diferente afinidad: NPR-A y NPR-B, acoplados a la enzima guanilato ciclasa, y NPR-C, inicialmente considerado un receptor de clearance o depuración. (10, 11) El conocimiento de la relación "péptidos natriuréticos-receptor- aumento del GMPc-acción", nos lleva de inmediato a pensar en su relación con el sistema del NO.
El NO es un gas lipófilo e hidrosoluble que se forma a partir de L-arginina mediante una reacción catalizada por la enzima óxido nítrico sintetasa (NOS). Tres isoformas de la NOS, endotelial (eNOS), neuronal (nNOS) e inducible (iNOS), se han identificado en el sistema cardiovascular y renal. (12-14) Se han descripto resultados contradictorios acerca de la actividad y la expresión de las diferentes isoformas de la NOS en este modelo genético de hipertensión. Algunos autores observaron un aumento de la actividad de la eNOS en la aorta torácica e incremento de la expresión de la iNOS y de la eNOS en el riñón y la aorta de ratas SHR (12) y otros comunicaron resultados diferentes para la expresión de eNOS e iNOS en la aorta y el ventrículo de SHR, de acuerdo con la edad del animal en estudio. (14, 15)
En trabajos previos demostramos que el efecto hipotensor del ANP estaría mediado, al menos en parte, por la activación del sistema del NO en animales normotensos. (16) Continuando con el estudio de la interacción entre ambos sistemas, comprobamos que la administración de ANP aumenta la actividad de la NOS cardíaca y renal. (17)
En estudios realizados en aurícula aislada de ratas normotensas mostramos que la estimulación de la NOS inducida por el ANP estaría mediada por su unión al receptor NPR-C acoplado a la proteína Gi. En el ventrículo, en la aorta y en el riñón de animales normotensos, la activación de la NOS inducida por el péptido involucraría a los receptores NPR-A y/o NPRB, con aumento de cGMP intracitoplasmático. (18)
Si bien existen estudios que vinculan la fisiopatología de la hipertensión arterial con deficiencias en la vía NO/cGMP, así como alteraciones en la vía ANP/cGMP, (19, 20) no existen resultados en la bibliografía que muestren el papel del NO y/o del ANP y de su interrelación en la fisiopatología de la hipertensión en el modelo experimental de HTA utilizado en este trabajo.
Por lo expuesto anteriormente, el objetivo del presente trabajo fue estudiar el efecto de la infusión aguda de ANP sobre la presión arterial media (PAM), como también sobre la expresión de la NOS cardíaca y la actividad del sistema del NO en ratas adultas espontáneamente hipertensas.
MATERIAL Y MÉTODOS
Animales
Se trabajó con ratas macho SHR y WKY de 16 semanas, cuyo peso corporal oscilaba entre 250 y 300 g. Los animales fueron mantenidos en un ambiente con temperatura y humedad controladas, con ciclos automáticos de luz y oscuridad de 12/12 horas y alimentados con una dieta estándar (Nutrimentos Purina) y agua ad libitum hasta el día en que se realizaron los experimentos.
Los animales utilizados en los experimentos fueron tratados de acuerdo con los lineamientos de la American Heart Association sobre el uso de animales de investigación.
Diseño experimental
Protocolo 1: efecto de la infusión aguda de ANP sobre la presión arterial media y el sistema del óxido nítrico
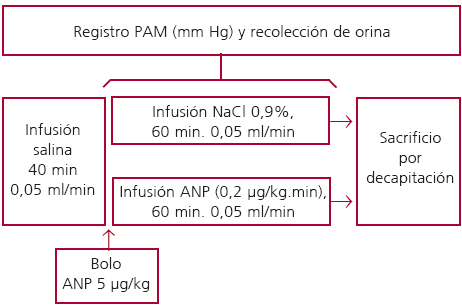
Las ratas fueron anestesiadas con uretano (1 g kg-1 peso corporal, i.p.). Luego de realizarles una traqueotomía se les introdujeron catéteres de polietileno en la vena y la arteria femoral para la infusión de drogas y para el registro de la presión arterial media (PAM), respectivamente. Además, se les canuló la vejiga para la recolección de orina.
Luego de la cirugía, los animales fueron infundidos con solución de NaCl 0,9% (0,05 ml/min) durante 40 minutos para estabilizar parámetros hemodinámicos y renales. Luego de este período, un grupo de animales WKY y SHR continuó con la infusión de solución salina, mientras que otro grupo recibió un bolo de ANP (5 µg/kg) seguido de una infusión de péptido (0,2 µg/kg/min) durante 1 hora. Se monitorizó la PAM y se recolectó orina durante el período experimental.
La concentración urinaria de nitritos y nitratos (NOx), productos finales del metabolismo del NO, se determinó mediante la técnica descripta por Verdon y colaboradores. (21)
Al finalizar el período experimental, los animales fueron sacrificados por decapitación y se les extrajeron la aurícula derecha y el ventrículo izquierdo para determinar la actividad y la expresión de la NOS.
Esquema del diseño experimental del protocolo 1
Determinación de la actividad de la NOS en el corazón
En cortes (2-3 mm) de aurícula derecha y de ventrículo izquierdo se determinó la actividad de la NOS utilizando [14C] L-arginina como sustrato, según la técnica descripta en trabajos previos. (22, 23) La actividad de la NOS se expresó como pmol de [14C] L-citrulina/g tejido · min.
Determinación de la expresión de la NOS en el corazón Técnica de Western blot. Muestras de aurícula derecha y de ventrículo izquierdo, con una concentración proteica de 0,10 mg proteína/línea, fueron separadas por electroforesis en gel de SDS-poliacrilamida 7,5%, transferidos a una membrana de nitrocelulosa y luego incubados con anticuerpos policlonales de conejo anti-NOS (dilución 1/500) y se empleó como anticuerpo secundario anticuerpo anticonejo (dilución 1/5.000).
Las muestras fueron reveladas por quimioluminiscencia con reactivo ECL por 2-4 min. La cuantificación de las bandas se realizó por análisis digital de las imágenes, con empleo de un escáner Hewlett-Packard y un software Totallab analyzer.
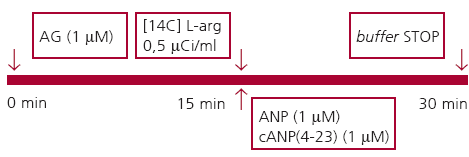
Protocolo 2: efecto del ANP sobre la actividad de la NOS en la aurícula y el ventrículo aislados
Las ratas WKY y SHR fueron sacrificadas por decapitación y se les extrajeron la aurícula derecha y el ventrículo izquierdo, para determinar la actividad de la NOS con la técnica descripta anteriormente luego del agregado de diferentes agonistas y/o antagonistas, según esquema:
1. Basal: actividad basal de la NOS.
2. AG: aminoguanidina 1 ìM, inhibidor de la iNOS.
3. ANP, 1 ìM.
4. AG, 1 mM + ANP, 1 ìM.
5. cANP(4-23), ìM, agonista NPR-C.
6. AG, 1 mM, + cANP(4-23), 1 ìM.
Esquema del diseño experimental del protocolo 2
Análisis estadístico
Los resultados se expresan como media ± EEM. Los datos se analizaron con análisis de la varianza para una variable (ANOVA) seguido de la prueba a posteriori para comparaciones múltiples de Bonferroni. Se consideraron significativos los valores de p < 0,01.
RESULTADOS
Efecto de la infusión aguda de ANP sobre la presión arterial media y el sistema del óxido nítrico
La Figura 1 (paneles A y B) muestra el efecto de la infusión del ANP sobre la PAM y la excreción urinaria de NOx en WKY y SHR. El tratamiento con ANP disminuyó la PAM tanto en los animales hipertensos como en sus controles normotensos y esta caída fue similar en ambos grupos (WKY: -12,8% ± 1,6% versus SHR: -14,1% ± 1,7%; ns). La infusión de ANP aumentó la excreción de NOx en ambos grupos; este incremento no mostró diferencias entre ambos grupos (WKY: 43,4% ± 4,5% versus SHR: 50,3% ± 5,6%; ns).

Fig. 1. Cambios en la presión arterial media (A) y en la excreción de nitritos y nitratos (NOx) (B) inducidos por la infusión de ANP en ratas WKY (n = 8) y SHR (n = 8). * p < 0,01 versus NaCl.
En la Figura 2 se puede observar que la actividad basal de la NOS, tanto en la aurícula derecha como en el ventrículo izquierdo, fue mayor en las ratas SHR que en las WKY. El ANP aumentó dicha actividad en la aurícula y en el ventrículo en ambos grupos de animales.
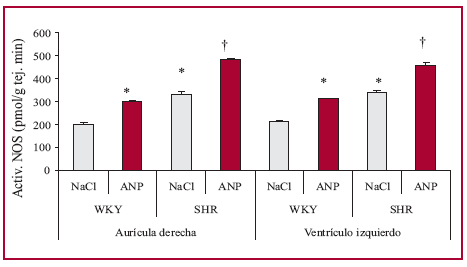
Fig. 2. Cambios en la actividad de la NOS inducidos por la infusión de ANP en la aurícula derecha y el ventrículo izquierdo de ratas WKY (n = 8) y SHR (n = 8). * p < 0,01 versus NaCl WKY; † p < 0,01 versus NaCl SHR.
La Figura 3 muestra que tanto la aurícula derecha como el ventrículo izquierdo de WKY y SHR presentan reactividad positiva con los anticuerpos antieNOS e iNOS. No se observó reactividad contra el anticuerpo para la isoforma neuronal. Los niveles proteicos basales para ambas isoformas fueron mayores en las ratas SHR, comparados con las WKY, en ambos tejidos estudiados. El ANP no modificó la expresión de ninguna de las isoformas de la enzima en el corazón de ninguno de los grupos de animales.
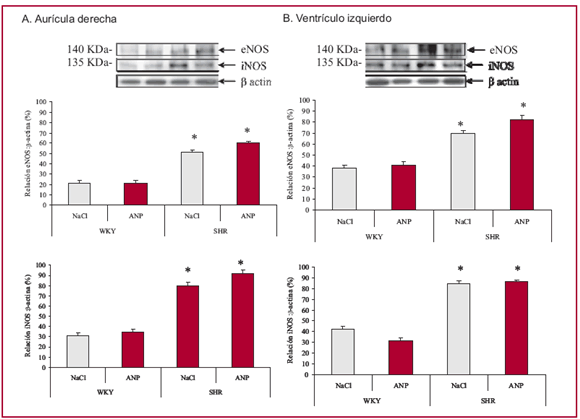
Fig. 3. Efectos sobre la expresión de la NOS inducidos por la infusión de ANP en la aurícula derecha (A) y en el ventrículo izquierdo (B) de ratas WKY (n = 6) y SHR (n = 6); * p < 0,01 versus WKY. Análisis de Western blot de la aurícula derecha y el ventrículo izquierdo, representativos de los dos grupos experimentales, para el anticuerpo anti-eNOS y anti-iNOS. Todos los experimentos se realizaron por triplicado. Cada banda fue normalizada con la expresión del marcador â-actina corrido en el mismo gel.
Efecto del ANP sobre la actividad de la NOS en la aurícula y el ventrículo aislados
En los estudios realizados en el órgano aislado observamos que la actividad basal de la NOS fue mayor en los animales SHR que en los WKY, tanto en la aurícula como en el ventrículo (aurícula derecha: 345,6 ± 11,2 versus 235 ± 9,8; p < 0,01; ventrículo izquierdo: 351,9 ± 12,3 versus 228,5 ± 6,9; p < 0,01). Como se muestra en la Tabla 1, ambos péptidos, ANP y cANP(4- 23), agonista específico del receptor NPR-C, aumentaron la actividad de la NOS en la aurícula y en el ventrículo provenientes tanto de ratas SHR como WKY. Estos hallazgos nos permiten sugerir que la estimulación de la NOS vía ANP observada in vivo no dependería de los cambios hemodinámicos inducidos por el péptido.
Tabla 1. Efecto del ANP y el cANP(4-23) (agonista NPR-C) sobre la actividad de la NOS en la aurícula y en el ventrículo aislados de ratas SHR (n = 8) y WKY(n = 8)

En la aurícula, el incremento de la actividad de la NOS fue similar para ambos péptidos, sin que se observaran diferencias entre ambos grupos de animales. En el ventrículo, en cambio, el incremento de actividad inducida por el ANP fue mayor que el observado con el agonista específico del receptor NPR-C en ambos grupos de animales. Además, la estimulación de la enzima inducida por el ANP fue menor en los ventrículos de SHR que en los de WKY. Sin embargo, esta diferencia entre grupos no se observó en la estimulación de la NOS ventricular inducida por el cANP(4-23) (Tabla 1). La inhibici ón de la iNOS, en la aurícula y en el ventrículo, disminuyó la actividad basal de la enzima, caída que fue mayor en los tejidos de SHR que de WKY (Tabla 2).
Tabla 2. Efecto del bloqueo de la iNOS con aminoguanidina sobre la actividad basal de la NOS y sobre la actividad de la enzima inducida por ANP o cANP(4-23) en la aurícula y en el ventrículo aislados de ratas SHR (n = 8) y WKY (n = 8)
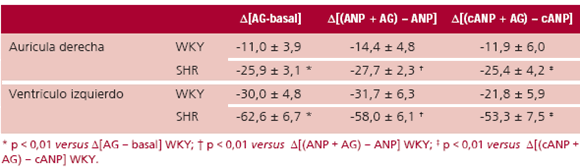
La actividad de la NOS inducida por ambos p éptidos disminuyó parcialmente cuando se inhibió la enzima inducible. Sin embargo, el grado de caída de dicha actividad fue similar al observado con respecto a la actividad basal cuando los tejidos fueron tratados con AG (Tabla 2).
DISCUSIÓN
Nuestros resultados muestran que la infusión aguda de ANP induce una disminución en la PAM, asociada con un incremento en la excreción de NOx. Esto indicaría que el sistema del NO podría relacionarse con los efectos hipotensores del ANP en este modelo de hipertensión.
Las ratas hipertensas presentan mayor actividad basal de la NOS cardíaca en comparación con las WKY. De acuerdo con nuestros resultados, el aumento de la actividad de la NOS no sólo comprometería a la NOS constitutiva, sino que en este modelo también participaría la isoforma inducible, ya que su bloqueo disminuyó significativamente la actividad basal de la enzima. Las isoformas endotelial e inducible de la NOS se expresan en la aurícula derecha y en el ventrículo izquierdo y son más abundantes en los animales SHR. Nuestros resultados se correlacionan con los hallazgos de numerosos autores, que muestran aumento de la expresión de ambas isoformas en la aorta y en el riñón de ratas SHR. (12, 13, 24-26)
De acuerdo con nuestros resultados, el ANP aumenta la actividad de la NOS cardíaca; este incremento es menor en las SHR que en las WKY. Sin embargo, en este modelo de hipertensión, el aumento de actividad observado no estaría asociado con un incremento en la expresión proteica de ninguna de las isoformas de la NOS estudiadas. Este hecho indica que el ANP ejercería un efecto modulador positivo sobre la actividad de la NOS, sin modificar los niveles proteicos de la enzima.
En trabajos previos demostramos que, en aurículas de ratas normotensas, la activación de la NOS inducida por el ANP involucraría al receptor NPR-C. En el riñón y en la arteria mostramos que además participarían los receptores natriuréticos NPR-A y/o B mediando los mecanismos diuréticos, natriuréticos y vasculares del ANP. También demostramos que el ANP interactuaría con el receptor NPR-C acoplado a la vía de la proteína Gi activando la NOS Ca2+ dependiente. (18)
En el presente trabajo, tanto el ANP como el agonista específico del receptor NPR-C indujeron un aumento en la actividad de la NOS en todos los tejidos estudiados, en SHR y en WKY. En el ventrículo, el ANP indujo un aumento mayor de la actividad de la enzima que el provocado por el agonista del receptor NPR. Estos resultados indican que, en este tejido, el aumento de la actividad de la NOS inducido por el ANP no sólo involucraría al NPR-C, sino también a los receptores NPR-A y/o NPR-B.
En la aurícula, donde el ANP sólo interactuaría con el NPR-C para activar la NOS, el aumento de la actividad de la NOS inducida por el péptido fue similar en SHR y en WKY. Además, no se encontraron diferencias en la actividad de la NOS inducida por el agonista específico del receptor NPR-C entre ambos grupos de animales, en ninguno de los tejidos estudiados. Existen evidencias que muestran una expresión mayor del receptor natriurético tipo C en el riñón y en el corazón de ratas SHR y un aumento en la expresión de proteína Gi en este modelo. (27, 28) Teniendo en cuenta estos hallazgos y nuestros resultados, la activación de la NOS inducida por el péptido, vía NPR-C asociado con la Gi1-2, no se encontraría alterada en el modelo de ratas espontáneamente hipertensas. Por el contrario, la vía que involucra NPR-A y/o NPR-B, y el consecuente aumento de los niveles de cGMP, se encontraría afectada en este modelo. Este hecho, si bien se contrapone con los resultados de Tremblay y colaboradores, que muestran un aumento de la expresión de NPR-A en el riñón de SHR, podría explicarse por una disminución en la actividad guanilato ciclasa particulada descripta por Lee y colaboradores en este modelo de hipertensión. (20, 29)
Por otra parte, el hecho de que el bloqueo de la iNOS no afecte significativamente la actividad de NOS inducida por el agonista del receptor NPR-C en ninguno de los tejidos estudiados, indicaría que esta isoforma no es estimulada por el ANP vía receptores NPR-C.
Nuestros resultados permiten demostrar que los efectos a nivel cardíaco del ANP estarían mediados, al menos en parte, por su interacción con el sistema del NO en este modelo de hipertensión genética, tal como lo observamos previamente en animales normotensos.
En el presente trabajo mostramos que los animales SHR presentan un aumento en la actividad de la NOS sin modificar la expresión de ninguna de sus isoformas. Este incremento dependería en parte de la actividad de la isoforma inducible de la NOS. No obstante, el ANP exógeno induciría una respuesta menor del sistema del NO en los animales hipertensos. La alteración de la interacción entre ambos sistemas, ANP y NO, podría estar involucrada en el desarrollo y/o el mantenimiento de la hipertensión arterial en este modelo de hipertensión experimental.
Perspectivas
En pacientes con deterioro cardíaco acentuado, los niveles endógenos de péptidos natriuréticos se encuentran aumentados y el organismo se torna resistente a sus efectos vasodilatadores, diuréticos y natriuréticos. Sin embargo, la infusión exógena de péptidos natriuréticos supera, al menos temporariamente, esa resistencia.
El ANP es un factor hipotensor y natriurético que permite mantener la homeostasis hidrosalina y la presión arterial. Este importante mecanismo fisiológico aún no ha encontrado un lugar en los tratamientos farmacológicos de la hipertensión arterial y patologías del equilibrio hidrosalino. Dilucidar los mecanismos moleculares en modelos de hipertensión arterial y su relación con otros sistemas reguladores, como el sistema del NO, contribuiría al desarrollo de nuevas estrategias terapéuticas.
BIBLIOGRAFÍA
1. Kimura K, Drozdova G, Hirata Y, Matsuoka H, Ishii M, Sugimoto T, et al. Effects of chronic administration of atrial natriuretic polypeptide on glomerular lesions in spontaneously hypertensive rats. Jpn Heart J 1990;31:227-36. [ Links ]
2. Skov K, Mulvany MJ. Structure of renal afferent arterioles in the pathogenesis of hypertension. Acta Physiol Scand 2004;181:397-405. [ Links ]
3. Pravenec M, Zidek V, Landa V, Simakova M, Mlejnek P, Kazdova L, et al. Genetic analysis of "metabolic syndrome" in the spontaneously hypertensive rat. Physiol Res 2004;53:S15-22. [ Links ]
4. Carretero OA, Scicli AG. Local hormonal factors (intracrine, auto crine, and paracrine) in hypertension. Hypertension 1991;18:I58-69. [ Links ]
5. Moncada S, Palmer RM, Higgs EA. Nitric oxide: physiology, pathophysiology, and pharmacology. Pharmacol Rev 1991;43:109-42. [ Links ]
6. Wilkins MR, Redondo J, Brown LA. The natriuretic peptide family. Lancet 1997;349:1307-10. [ Links ]
7. Kone BC. Molecular biology of natriuretic peptides and nitric oxide synthases. Cardiovasc Res 2001;51:429-41. [ Links ]
8. Lin X, Hanze J, Heese F, Sodmann R, Lang RE. Gene expression of natriuretic peptide receptors in myocardial cells. Circ Res 1995;77: 750-8. [ Links ]
9. Murthy KS, Teng B, Jin J, Makhlouf GM. G protein-dependent activation of smooth muscle eNOS via natriuretic peptide clearance receptor. Am J Physiol 1998;275:C1409-16. [ Links ]
10. Ahluwalia A, MacAllister RJ, Hobbs AJ. Vascular actions of natriuretic peptides. Cyclic GMP-dependent and -independent mechanisms. Basic Res Cardiol 2004;99:83-9. [ Links ]
11. D'Souza SP, Davis M, Baxter GF. Autocrine and paracrine actions of natriuretic peptides in the heart. Pharmacol Ther 2004;101:113-29. [ Links ]
12. Vaziri ND, Ni Z, Oveisi F. Upregulation of renal and vascular nitric oxide synthase in young spontaneously hypertensive rats. Hypertension 1998;31:1248-54. [ Links ]
13. Cheng PY, Chen JJ, Yen MH. The expression of heme oxygenase- 1 and inducible nitric oxide synthase in aorta during the development of hypertension in spontaneously hypertensive rats. Am J Hypertens 2004;17:1127-34. [ Links ]
14. Piech A, Dessy C, Havaux X, Feron O, Balligand JL. Differential regulation of nitric oxide synthases and their allosteric regulators in heart and vessels of hypertensive rats. Cardiovasc Res 2003;57: 456-67. [ Links ]
15. Chou TC, Yen MH, Li CY, Ding YA. Alterations of nitric oxide synthase expression with aging and hypertension in rats. Hypertension 1998;31:643-8. [ Links ]
16. Costa MD, Bosc LV, Majowicz MP, Vidal NA, Balaszczuk AM, Arranz CT. Atrial natriuretic peptide modifies arterial blood pressure through nitric oxide pathway in rats. Hypertension 2000; 35:1119-23. [ Links ]
17. de los Angeles Costa M, Elesgaray R, Loria A, Balaszczuk AM, Arranz C. Atrial natriuretic peptide influence on nitric oxide system in kidney and heart. Regul Pept 2004;118:151-7. [ Links ]
18. Elesgaray R, Costa MA, Caimi M, Balaszczuk AM, Arranz CT. Participación del receptor NPR-C en la activación de la sintetasa de óxido nítrico inducida por el péptido natriurético auricular en el corazón, la arteria aorta y el riñón. Rev Argent Cardiol 2005;73:102-6. [ Links ]
19. Woodard GE, Zhao J, Rosado JA, Brown J. A-type natriuretic peptide receptor in the spontaneously hypertensive rat kidney. Peptides 2002;23:1637-47. [ Links ]
20. Lee J, Kang DG, Kook H, Kim IK, Oh BS. Differentially-altered vascular guanylate cyclase isoforms in experimental hypertensive rats. J Korean Med Sci 1999;14:386-92. [ Links ]
21. Verdon CP, Burton BA, Prior RL. Sample pretreatment with nitrate reductase and glucose-6-phosphate dehydrogenase quantitatively reduces nitrate while avoiding interference by NADP+ when the Griess reaction is used to assay for nitrite. Anal Biochem 1995;224:502-8. [ Links ]
22. Costa MA, Loria A, Elesgaray R, Balaszczuk AM, Arranz C. Role of nitric oxide pathway in hypotensive and renal effects of furosemide during extracellular volume expansion. J Hypertens 2004;22:1-9. [ Links ]
23. Costa MA, Elesgaray R, Loria A, Balaszczuk AM, Arranz C. Vascular and renal effects of dopamine during extracellular volume expansion: role of nitric oxide pathway. Life Science 2006;28:1543-9. [ Links ]
24. Crabos M, Coste P, Paccalin M, Tariosse L, Daret D, Besse P, et al. Reduced basal NO-mediated dilation and decreased endothelial NOsynthase expression in coronary vessels of spontaneously hypertensive rats. J Mol Cell Cardiol 1997;29:55-65. [ Links ]
25. Vapaatalo H, Mervaala E, Nurminen ML. Role of endothelium and nitric oxide in experimental hypertension. Physiol Res 2000;49:1-10. [ Links ]
26. Wu CC, Hong HJ, Chou TC, Ding YA, Yen MH. Evidence for inducible nitric oxide synthase in spontaneously hypertensive rats. Biochem Biophys Res Commun 1996;228:459-66. [ Links ]
27. Martin ER, Lewicki JA, Scarborough RM, Ballermann BJ. Expression and regulation of ANP receptor subtypes in rat renal glomeruli and papillae. Am J Physiol 1989;257:F649-57. [ Links ]
28. Marcil J, Thibault C, Anand-Srivastava MB. Enhanced expression of Gi-protein precedes the development of blood pressure in spontaneously hypertensive rats. J Mol Cell Cardiol 1997;29:1009-22. [ Links ]
29. Tremblay J, Huot C, Willenbrock RC, Bayard F, Gossard F, Fujio N, et al. Increased cyclic guanosine monophosphate production and overexpression of atrial natriuretic peptide A-receptor mRNA in spontaneously hypertensive rats. J Clin Invest 1993; 92:2499-508. [ Links ]














