Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista argentina de cardiología
On-line version ISSN 1850-3748
Rev. argent. cardiol. vol.76 no.2 Buenos Aires Mar./Apr. 2008
Mismatch paciente-prótesis aórtica. Comparación alejada por eco-Doppler transtorácico versus el estimado en el preoperatorio
Edgardo D. Castro†, 1, 2, Mónica Cavazzi3, Andrea Curcio3, Corina Baltrucowicz3, Roxana Venditti3, Pablo Guidobono3, Daniel Dinano4, Gabriel Converso5, Sergio Chekerdemian6
Hospital Churruca Visca, Servicio de Cardiología, Sección de Ecocardiografia. Ciudad Autónoma de Buenos Aires, Argentina
† Para optar a Miembro Titular de la Sociedad Argentina de Cardiología
1 Jefe de la Sección de Ecocardiografía del Hospital Churruca Visca
2 Staff de Ecocardiografia del Instituto Sacre Coeur
3 Staff de Ecocardiografia del Hospital Churruca Visca
4 Staff del Servicio de Cardiología del Hospital Churruca Visca
5 Asesor en Investigación Clínica
6 Jefe de Cardiología del Hospital Churruca Visca
Dirección para separatas: Dr. Edgardo D. Castro Fray J. Santa María de Oro 2652, 1º C (1425) Buenos Aires, Argentina e-mail: edcastro63@arnet.com.ar
Recibido: 18/09/2007
Aceptado: 21/01/2008
RESUMEN
Introducción
El mismatch paciente-prótesis (MPP) aórtica se asocia con peor evolución posoperatoria. La utilización del área del orificio aórtico efectivo (AOE) para cada tipo de prótesis, indexado por la superficie corporal (SC) en el momento quirúrgico, puede permitir la elección de un tamaño de prótesis adecuado para cada paciente y así evitar el MPP.
Objetivo
Comparar la estimación de MPP por las AOE tabuladas con la diagnosticada en el posoperatorio alejado por eco-Doppler.
Material y métodos
Se analizaron retrospectivamente 57 pacientes, 43 hombres, con prótesis aórtica, operados más de 6 meses antes del estudio. Se calculó la SC del parte quirúrgico y el AOE indexada tabulada, el AOE posquirúrgica con eco-Doppler transtorácico por la ecuación de continuidad y se comparó el MPP prequirúrgico y posquirúrgico. Se consideró MPP aórtico un AOE indexada < 0,75 cm2/m2.
Resultados
Se observó una prevalencia de MPP preoperatorio del 29,8% y posoperatorio del 54,4% (p = 0,029), con el 31% de MMP grave. La prevalencia de sobrepeso en la muestra estudiada fue del 80%.
Conclusiones
En este grupo de pacientes con alta prevalencia de sobrepeso, la estimación del AOE preoperatoria indexada por SC de cada tipo de prótesis para predecir el MPP posoperatorio mostró diferencias significativas entre el diagnóstico del MPP estimado en el preoperatorio y el calculado por eco-Doppler en el posoperatorio. En futuros estudios es necesaria la inclusión de un grupo poblacional mayor, así como la revisión del método de cálculo del área valvular (p. ej., del tracto de salida del ventrículo izquierdo).
Palabras clave: Válvula aórtica; Ecocardiografia; Prótesis valvular
Abreviaturas
AOE Área del orificio efectivo
AOG Área del orificio geométrica
DE Desviación estándar
IMC Índice de masa corporal
MPP Mismatch paciente-prótesis
SC Superficie corporal
TSVI Tracto de salida del ventrículo izquierdo
VI Ventrículo izquierdo
SUMMARY
Comparison between Patient-Aortic Valve Prosthesis Mismatch Determined by Transthoracic Echo-Doppler at Late Follow-up versus Preoperative Estimation
Background
Patient-aortic valve prosthesis mismatch (PPM) is associated with poor postoperative outcomes. Determination of aortic effective orifice area (EOA) indexed for body surface area (BSA) is useful to select suitable type and size of heart valve prosthesis in order to prevent patient-prosthesis mismatch.
Objective
The objective of this study was to compare the PPM estimated by indexed EOA with PPM determined by echo-Doppler at late follow-up.
Material and Methods
Fifty seven patients (43 men) who had undergone an aortic valve replacement in the previous 6 months were retrospectively assessed. After calculating BSA from the surgical report, indexed EOA, postoperative EOA (determined by the continuity equation with transthoracic echo-Doppler), preoperative and postoperative PPM were compared. An indexed EOA < 0.75 cm2/m2 was considered aortic PPM.
Results
The prevalence of preoperative and postoperative PPM was 29.8% and 54.4%, respectively (p=0.029); 31% of MMP was severe. The prevalence of overweight in this sample was 80%.
Conclusions
In this group of patients with a high prevalence of overweight, the estimation of preoperative EOA indexed for BSA in order to predict postoperative PPM according to the type of prosthesis, showed significantly differences between preoperative PPM and postoperative PPM calculated by echo-Doppler. Further studies should not only include a larger sample, but should also check the method used for calculating valvular area (for example, in the left ventricular outflow tract).
Key words: Aortic Valve; Echocardiography; Heart Valve Prosthesis
INTRODUCCIÓN
El concepto de mismatch paciente-prótesis (MPP) fue descripto por Rahimtoola en 1978, (1) quien lo definió como el área del orificio valvular protésico inadecuado por la superficie corporal (SC) del paciente, es decir, menor que el de la válvula nativa. El MPP genera gradientes transvalvulares elevados por obstrucción al tracto de salida del ventrículo izquierdo (VI). (2, 3) El MPP se ha observado con más frecuencia en pacientes con raíz aórtica pequeña, de mayor edad, (4) especialmente mujeres, en los cuales también están asociadas la enfermedad coronaria grave y la función ventricular deteriorada. (5)
En cuanto al impacto clínico, en una serie de estudios se demostró menor regresión de la masa ventricular, mayor frecuencia de eventos cardíacos y menor sobrevida luego del reemplazo valvular. Sin embargo, en otros estudios se observó en el seguimiento posoperatorio un impacto mínimo o nulo. (6-8)
Se han propuesto diferentes métodos para predecir el MPP, uno de los cuales es el cálculo del área del orificio efectivo (AOE) indexada por la SC del paciente en el momento de la cirugía, con empleo de los valores de AOE tabulados documentados en la literatura, para cada tipo y tamaño de prótesis. (6, 9, 10)
Estos valores de referencia son un dato crucial, pero a pesar de ello existen discrepancias, por lo que algunos autores utilizan en sus instituciones las medidas de AOE determinadas por eco-Doppler cardíaco. (6) Otros investigadores se basaron en los valores in vitro e in vivo dados por las empresas que producen las prótesis. (8, 11) Sin embargo, éstos parecen poco confiables a la hora de decidir qué tamaño y tipo de válvula colocar en cada paciente en particular, según su SC, su actividad física y su función ventricular. (6, 12)
La estimación del AOE preoperatoria sobre tablas de valores de referencia publicados para cada tipo de prótesis y la alta prevalencia de mismatch calculado por eco-Doppler en algunas series nos lleva a plantear la hipótesis de que existen diferencias entre ambos métodos no atribuibles a la variabilidad del mismatch. El objetivo de nuestro trabajo fue comparar las AOE estimadas en el preoperatorio versus la calculada por eco-Doppler transtorácico en el posoperatorio alejado y, a través de estas áreas, comparar los porcentajes de mismatch diagnosticados por ambos métodos.
MATERIAL Y MÉTODOS
Población y diseño
Se estudiaron 57 pacientes (43 hombres y 14 mujeres) que concurrieron al servicio de ecocardiografía para la realización de un eco-Doppler transtorácico de control desde julio de 2006 a julio de 2007. Del parte quirúrgico se revisaron las siguientes variables: peso, altura, tipo, marca y tamaño de la prótesis implantada. Se calculó la SC por la fórmula de Dubois (13) y el índice de masa corporal (IMC) en el momento de la cirugía y se tomaron las mismas mediciones antropométricas antes del estudio. Un ecografista con experiencia realizó las mediciones del tracto de salida del ventrículo izquierdo (TSVI) en el eje largo paraesternal lo más cercano posible al anillo y de las velocidades de flujo con Doppler pulsado con un volumen de muestra de 5 mm inmediatamente por debajo de la válvula, previo a la aceleración de flujo o ensanchamiento de la señal espectral, para tratar de asegurar que ambos parámetros se tomaran en el mismo lugar. (14) Con el Doppler continuo, a través de la prótesis desde la vista apical de 5 cámaras, se estimaron los gradientes máximo y medio. Las AOE se calcularon por la ecuación de continuidad con empleo de las integrales velocidad- tiempo del TSVI y del flujo transprotésico, así como el área del TSVI. Se indexaron los valores por la SC en el momento del estudio. Se promediaron tres determinaciones del eco bidimensional y Doppler en los pacientes con ritmo sinusal y por lo menos cinco en aquellos con fibrilación auricular.
Sobre la base del tipo, la marca y el tamaño de prótesis implantada se diagnosticó la presencia de MPP preoperatorio cuando el AOE tabulada (Tabla 1) indexada por la SC prequirúrgica fue menor de 0,75 cm2/m2, ya que este valor se ha relacionado con la supervivencia a largo plazo. (7, 10, 15) Se comparó con la prevalencia de MPP actual de acuerdo con los valores adquiridos en el eco-Doppler de control. Se consideró sobrepeso un IMC > 25.
Tabla 1. Áreas de orificios efectivos aórticos determinadas por eco-Doppler en los diferentes modelos y tamaños de prótesis obtenidos de la literatura (9, 10)

Se utilizó un equipo Esaote My Lab 50 y Hewlet Packard image Point Hx con transductor de 2 a 4 mHz, con segunda armónica.
Fórmulas utilizadas
SC = (peso kg0,425) × (altura0,725) × 0,007184 (7) = m2 IMC = peso / altura2
Ecuación de continuidad : AOE = aTSVI × VTI TSVI / VTI AO = cm2/m2
Área del TSVI: ![]() × r2 = cm2
× r2 = cm2
Método estadístico
Las variables cualitativas se expresan como porcentajes y las comparaciones se realizaron con las pruebas de chi cuadrado o exacta de Fisher según correspondiera. Las variables continuas con distribución normal se expresaron como medias ± desviación estándar y se compararon mediante la prueba de la t de Student o la prueba de rangos de Wilcoxon para distribuciones no paramétricas. Se utilizó la correlación de Pearson para evaluar asociación lineal entre el gradiente y los grados de MPP. Se estableció un nivel de significación de p < 0,05 para dos colas. Los cálculos se realizaron con el software Statistix 7,1 y Epinfo 3,4.1 para Windows.
RESULTADOS
Los datos de la población se resumen en la Tabla 2. La mayoría eran de sexo masculino (75,4%) y más jóvenes que las mujeres (62,8 [ 9,8] versus 74,3 [ 6,5] años [ DE], respectivamente). Si bien la comparación no era parte del objetivo del estudio, los hombres tenían mayor peso y superficie corporal pero un índice de masa corporal y una prevalencia de sobrepeso similares a los de las mujeres (peso [ DE] 85,5 [ 14,6)] versus 67,9 [ 11,5] kg, SC 1,97 [ 0,17] versus 1,66 [ 0,13], p < 0,01; IMC 29,1 [ 4,6] versus 28,6 [ 5,1], p = 0,7; sobrepeso 83,7% versus 71,4%, p = 0,31, respectivamente). Se observó un alto porcentaje de pacientes con sobrepeso y obesidad, quienes no mostraron mayores gradientes medios que los no obesos (p > 0,20). Sin embargo, la tasa de mismatch fue mayor entre los obesos (60% versus 27%, p = 0,047). Las AOE indexadas prequirúrgica y posquirúrgica fueron similares en ambos sexos, aunque levemente menores en los hombres. La mayoría de las prótesis eran mecánicas (77,2%) y se habían implantado más de 6 meses antes de la realización del estudio. Predominaron las prótesis St Jude y número 21.
Tabla 2. Características de la población

Las valvulopatías prequirúrgicas fueron: 63,2% estenosis aórtica pura, 26,3% insuficiencia y 10,5% enfermedad aórtica. El 73,7% de las cirugías fueron no combinadas. El 66,7% de los pacientes se hallaban en clase funcional I-II y el 29,8% se encontraban asintomáticos. En esta muestra se observó un porcentaje elevado (31,55%) de mismatch grave (AOE < 0,65 cm2/m2) y el 22,85% de MPP leve a moderado (AOE 0,65-0,85 cm2/m2); sin embargo, sólo el 15,7% tenían más de 45 mm Hg de gradiente máximo y se halló una correlación lineal baja (r: 0,35; p < 0,007) entre el grado de MPP y el gradiente transprotésico. Cuando se comparó la prevalencia de MPP preoperatorio y posoperatorio (Tabla 4) en todo el grupo se obtuvo una diferencia estadísticamente significativa (p = 0,029). No se encontraron diferencias con respecto al MPP cuando se analizaron los subgrupos según sexo.
DISCUSIÓN
Dada la implicación clínica otorgada al MPP por distintos estudios, hoy en día parece necesario tratar de prevenirlo en el momento de la cirugía, para lo cual se utilizan valores de AOE de referencia basados en trabajos con un número importante de pacientes. Dado que no hallamos guías de instituciones nacionales o extranjeras que aportaran datos consensuados, nos basamos en valores de dos trabajos representativos de la literatura actualmente disponible. (3, 18) La utilización del AOE determinada por la ecuación de continuidad se basa en que es menos dependiente del flujo (16) y en que no depende sólo de las características de la prótesis, sino también de las propiedades del ventrículo izquierdo y del tracto de salida. No obstante, se encuentran discrepancias en los resultados obtenidos con su utilización en diferentes trabajos. (6) Las AOE pueden diferir en la misma prótesis a causa de variaciones biológicas verdaderas, como la alteración de la vena contracta por la geometría subvalvular, errores de medición y de sobrestimación o subestimación, que pueden ocurrir cuando los prerrequisitos del principio de continuidad no se cumplen. Por ejemplo, se pueden cometer errores de medición del área del tracto de salida ventricular izquierdo, así como en las velocidades Doppler (Tabla 3). También es conocido que el concepto de AOE es funcional, a diferencia del AOG que es una medida estática derivada del diámetro interno de la prótesis. (17) Por esto, la utilización del AOG ha demostrado que no posee precisión diagnóstica debido a que no tiene en cuenta factores que se presentan in vivo, como el tejido circundante, las técnicas de sutura o la posición de la prótesis, por lo que no refleja la complejidad de la hemodinámica valvular.
Tabla 3. Principales causas de variación del AOE del mismo tamaño valvular por la ecuación de continuidad (16)

En nuestro estudio observacional de una muestra retrospectiva de pacientes con reemplazo valvular aórtico por diferentes patologías, la utilización de los valores de referencia del AOE indexados para diagnosticar MPP mostró diferencias en el diagnóstico de mismatch prequirúrgico y posquirúrgico. Si bien el poder del estudio se halla limitado por el tamaño de la muestra, y teniendo en cuenta el valor predictivo positivo del AOE del 64% para el diagnóstico de MPP publicado en la literatura, (6) este resultado pone en relieve las dificultades que pueden encontrarse para predecir el MPP y la posibilidad de elección de una prótesis adecuada para el paciente en el estadio preoperatorio. Sin duda, como lo citara previamente Rubio y colaboradores, (18) la presencia de sobrepeso es una variable que confunde al momento de diagnosticar MPP. Así, en coincidencia, por la probable sobrestimación causada por el sobrepeso, la presencia de MMP de grado severo no se asociaría con gradientes transprotésicos elevados ni deterioro de la clase funcional. Ya se ha establecido una relación curvilínea entre el gradiente medio transvalvular y las AOE (r = 0,79), con aumentos significativos del gradiente con AOE por debajo de 0,85 cm2. (3) Sin embargo, cuando observamos el grado de MPP y los gradientes en nuestro estudio, hallamos una débil correlación entre ambas. Esta variable, sobrepeso, explicaría también la diferencia con la literatura, donde la prevalencia de MPP leve a moderado (AOE indexado 0,65- 0,85 cm2/m2) varía entre el 20% y el 70% y el severo (AOE indexado < 0,65 cm2/m2), del 2% al 11% de los reemplazos valvulares. (3) En este estudio no hubo diferencias significativas en el peso y la superficie corporal prequirúrgicos y posquirúrgicos de los pacientes (Tabla 4).
Tabla 4. Medidas antropométricas y prevalencia de mismatch

Una posible explicación de lo observado con respecto al MPP prequirúrgico y posquirúrgico podría ser que los valores de referencia de las AOE se han establecido en poblaciones que pueden diferir de las nuestras desde el punto de vista antropométrico. También cabe considerar la posibilidad de diferencias en las técnicas quirúrgicas empleadas entre los diferentes centros que determinaron los valores de referencia publicados. El gradiente posoperatorio está determinado de manera principal por el diámetro interno de la prótesis, pero existen variables adicionales como, por ejemplo, en las válvulas mecánicas, la forma y el tipo de las valvas, los ángulos de apertura y cierre, así como la orientación de la válvula que puede causar diferentes patrones de flujo. (19-21) En las bioprótesis, el AOE puede depender del gasto cardíaco y la función ventricular, así como de la flexibilidad de los stents, el grado de descalcificación de la raíz aórtica y la distensibilidad de los tejidos circundantes. Por esto se ha mencionado que existe una variación del AOE en prótesis del mismo tamaño. Por ejemplo, en una válvula mecánica bivalva Carbomedics número 23 oscila entre 1,63 y 1,8 cm. (2, 9, 10) A su vez, las AOE tienden a ser menores que las AOG, (16) aproximadamente un 10% a 15%. (9) Las AOG, a pesar de ser una medida fija para cada tamaño de prótesis, ha demostrado escaso valor predictivo para morbimortalidad posoperatoria por no tener en cuenta la funcionalidad hemodinámica de la prótesis, como ya se mencionó.
Las diferencias en el diagnóstico de MPP plantea el interrogante de si deberíamos revisar los valores de referencia de AOE para nuestra población y/o el método para su determinación. Con respecto a esto creemos que sería importante evaluar el posible impacto del procedimiento de medición del área del tracto de salida del ventrículo izquierdo. (22, 23) En presencia de una prótesis aparecen mayores dificultades en su valoración por ecografía por la existencia de reverberaciones producidas por el material no biológico y, muchas veces, de calcio remanente en la raíz aórtica. Según la literatura, la forma del TSVI en sístole es circular. (14) Sin embargo, en caso de que no se cumpliera esta condición, estaríamos frente a un error de cálculo que nos alejaría del valor real.
Para ejemplificar esto, en algunos casos examinamos la hipótesis planteada, la cual será objeto de un futuro estudio de investigación. En la Figura 1 puede apreciarse la forma elíptica del tracto de salida, y como el eje anteroposterior pasa por el diámetro menor, se subestimaría el área aórtica efectiva calculada por la ecuación de continuidad con la utilización de la fórmula de la superficie del círculo para la estimación del área del tracto de salida del ventrículo izquierdo.
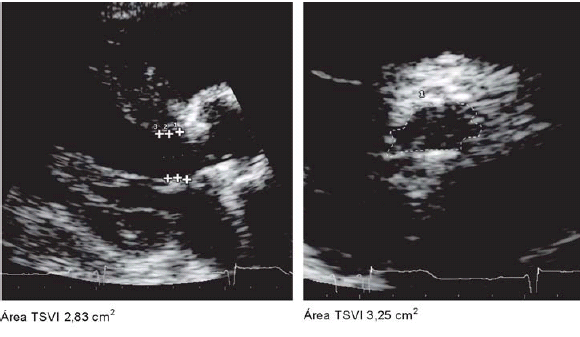
Fig. 1. Área del TSVI por planimetría en el eje corto (B) versus el área estimada a partir del diámetro en eje largo (A) por la fórmula del círculo
Esta hipótesis también estaría sustentada por los bajos gradientes medidos a pesar del alto porcentaje de mismatch grave encontrado en pacientes sin deterioro significativo de la función ventricular.
Limitaciones
Cabe mencionar que el presente es un estudio retrospectivo y que el tamaño de la muestra es pequeño, con un porcentaje bajo de mujeres y prevalencia alta de sobrepeso. Dado el escaso número de prótesis de cada tipo, marca y tamaño, no fue posible establecer una relación de éstas con el MPP.
Hay que destacar que la sensibilidad y la especificidad del método comunicadas para el diagnóstico de MPP oscila entre el 54% y el 71% y el 67% y el 83%, respectivamente, con un valor predictivo positivo del 64% al 67%. Esta exactitud diagnóstica es otro factor para considerar en el resultado de este estudio.
CONCLUSIÓN
En este grupo de pacientes con alta prevalencia de sobrepeso y mismatch paciente-prótesis aórtica, la aplicación de los valores de referencia de los orificios aórticos efectivos disponibles en la literatura, indexados por la superficie corporal del paciente en el momento prequirúrgico, y el cálculo del AOE medida por eco-Doppler transtorácico en el posoperatorio alejado, mostró diferencias significativas para el diagnóstico de MPP prequirúrgico y posquirúrgico. En futuros estudios es necesaria la inclusión de un grupo poblacional mayor que confirme estos hallazgos, así como la revisión del método de cálculo del área valvular, por ejemplo, el área del tracto de salida del ventrículo izquierdo.
Agradecimientos
Agradecemos la colaboración del Licenciado en Enfermería Javier Quiroga.
Declaración de conflicto de intereses
Ninguno de los autores presenta conflicto de intereses.
BIBLIOGRAFÍA
1. Rahimtoola SH. The problem of valve prosthesis-patient mismatch. Circulation 1978;58:20-4. [ Links ]
2. Dumesnil JG, Honos GN, Lemieux M, Beauchemin J. Validation and applications of indexed aortic prosthetic valve areas calculated by Doppler echocardiography. J Am Coll Cardiol 1990;16:637-43. [ Links ]
3. Pibarot P, Dumesnil JG. Prosthesis-patient mismatch: definition, clinical impact, and prevention. Heart 2006;92:1022-9. [ Links ]
4. Roscitano A, Benedetto U, Sciangula A, Merico E, Barberi F, Bianchini R, et al. Indexed effective orifice area after mechanical aortic valve replacement does not affect left ventricular mass regression in elderly. Eur J Cardiothorac Surg 2006;29:139-43. [ Links ]
5. Taggart DP. Prosthesis patient mismatch in aortic valve replacement: possible but pertinent? Eur Heart J 2006;27:644-6. [ Links ]
6. Bleiziffer S, Eichinger WB, Hettich I, Guenzinger R, Ruzicka D, Bauernschmitt R, et al. Prediction of valve prosthesis-patient mismatch prior to aortic valve replacement: which is the best method? Heart 2007;93:615-20. [ Links ]
7. Pibarot P, Dumesnil JG, Cartier PC, Métras J, Lemieux MD. Patientprosthesis mismatch can be predicted at the time of operation. Ann Thorac Surg 2001;71:S265-8. [ Links ]
8. Blackstone EH, Cosgrove DM, Jamieson WR, Birkmeyer NJ, Lemmer JH Jr, Miller DC, et al. Prosthesis size and long-term survival after aortic valve replacement. J Thorac Cardiovasc Surg 2003; 126:783-96. [ Links ]
9. Pibarot P, Dumesnil JG. Hemodynamic and clinical impact of prosthesis-patient mismatch in the aortic valve position and its prevention. J Am Coll Cardiol 2000;36:1131-41. [ Links ]
10. Borracci R, Rubio M. Nomograma para determinar el tipo y tamaño mínimo de prótesis valvular que previene el mismatch aórtico. Rev Argent Cardiol 2005;73:96-101. [ Links ]
11. Koch CG, Khandwala F, Estafanous FG, Loop FD, Blackstone EH. Impact of prosthesis-patient size on functional recovery after aortic valve replacement. Circulation 2005;111:3221-9. [ Links ]
12. Moon MR, Pasque MK, Munfakh NA, Melby SJ, Lawton JS, Moazami N, et al. Prosthesis-patient mismatch after aortic valve replacement: impact of age and body size on late survival. Ann Thorac Surg 2006;81:481-8. [ Links ]
13. Dubois EF. Metabolism in Health and Disease. Philadelphia: Lea & Febiger; 1936. [ Links ]
14. Piñeiro D, Bustamante Labarta M, Guevara M, Migliore R, Roisinblit J. Ecocardiografía para la toma de decisiones clínicas. Buenos Aires: Editorial Médica Panamericana; 2005. p. 529-68. [ Links ]
15. Rao V, Jamieson WR, Ivanov J, Armstrong S, David TE. Prosthesispatient mismatch affects survival after aortic valve replacement. Circulation 2000;102:III5-9. [ Links ]
16. Bech-Hanssen O, Caidahl K, Wallentin I, Ask P, Wranne B. Assessment of effective orifice area of prosthetic aortic valves with Doppler echocardiography: an in vivo and in vitro study. J Thorac Cardiovasc Surg 2001;122:287-95. [ Links ]
17. Pibarot P, Dumesnil JG. Prevention of valve prosthesis patient mismatch before aortic valve replacement: does it matter and is it feasible? Heart 2007;93:549-51. [ Links ]
18. Rubio M, Borracci R. El ajuste en base al peso ideal en pacientes con sobrepeso y reemplazo valvular aórtico. Rev Argent Cardiol 2005;73:90-5. [ Links ]
19. Christakis GT, Buth KJ, Goldman BS, Fremes SE, Rao V, Cohen G, et al. Inaccurate and misleading valve sizing: a proposed standard for valve size nomenclature. Ann Thorac Surg 1998;66:1198-203. [ Links ]
20. Sievers HH. Prosthetic aortic valve replacement. J Thorac Cardiovasc Surg 2005;129:961-5. [ Links ]
21. Chambers JB, Oo L, Narracott A, Lawford PM, Blauth CI. Nominal size in six bileaflet mechanical aortic valves: a comparison of orifice size and biologic equivalence. J Thorac Cardiovasc Surg 2003;125: 1388-93. [ Links ]
22. Ruel M, Al-Faleh H, Kulik A, Chan KL, Mesana TG, Burwash IG. Prosthesis-patient mismatch after aortic valve replacement predominantly affects patients with preexisting left ventricular dysfunction: effect on survival, freedom from heart failure, and left ventricular mass regression. J Thorac Cardiovasc Surg 2006;131: 1036-44. [ Links ]
23. Kulik A, Burwash IG, Kapila V, Mesana TG, Ruel M. Long-term outcomes after valve replacement for low-gradient aortic stenosis: impact of prosthesis-patient mismatch. Circulation 2006;114:I553-8. [ Links ]














